γ-聚谷氨酸对鸡肉肌原纤维蛋白功能特性的影响
白登荣 - 董 唯 齐昕宇 - 尚永彪,2,3 -,2,3
(1. 西南大学食品科学学院,重庆 400715;2. 农业部农产品贮藏保鲜质量安全评估实验室〔重庆〕,重庆 400715;3. 重庆市特色食品工程技术研究中心,重庆 400715) (1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Ministry of AgriculturePreservation Quality and Safety Assessment Laboratory〔Chongqing〕, Chongqing 400715, China; 3. Chongqing Specialty Food Engineering Research Center, Chongqing 400715, China)
γ-聚谷氨酸对鸡肉肌原纤维蛋白功能特性的影响
白登荣1BAIDeng-rong1董 唯1DONGWei1齐昕宇1QIXin-yu1尚永彪1,2,3SHANGYong-biao1,2,3
(1. 西南大学食品科学学院,重庆 400715;2. 农业部农产品贮藏保鲜质量安全评估实验室〔重庆〕,重庆 400715;3. 重庆市特色食品工程技术研究中心,重庆 400715) (1.CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China; 2.MinistryofAgriculturePreservationQualityandSafetyAssessmentLaboratory〔Chongqing〕,Chongqing400715,China; 3.ChongqingSpecialtyFoodEngineeringResearchCenter,Chongqing400715,China)
将不同浓度的γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)添加到鸡肉肌原纤维蛋白(myofibrillar protein,MP)中,研究γ-PGA对鸡肉MP功能特性的影响。结果表明:随着γ-PGA浓度的增大,MP表面疏水性呈先减小后增大的趋势,且在γ-PGA浓度为0.6‰时达到最小值;溶解度、乳化性、凝胶硬度、弹性和保水性呈先增大后减小的趋势,且在γ-PGA浓度为0.6‰时分别达到最大值,而γ-PGA对凝胶白度值影响较小。流变学性质变化表明,γ-PGA对MP凝胶的形成有一定的促进作用。通过SDS-PAGE研究发现,γ-PGA与MP之间存在交联作用。
γ-聚谷氨酸;鸡肉;肌原纤维蛋白;功能特性
鸡肉是中国第二大肉类消费品[1],因其具有“一高三低”的营养特点而深受消费者的青睐[2]。肌原纤维蛋白是肌肉中重要的盐溶性蛋白,其功能特性与肉制品的乳化性、硬度、黏弹性、保水性等质构和感官品质密切相关[3]。鸡肉是西式肉制品加工中常用的原料,然而在实际生产加工过程中发现其肉糜制品凝胶特性较差,严重影响了鸡肉制品的深加工水平[4-5]。目前,对于改善肉糜制品凝胶特性的研究较多,如加入添加剂[6-7]或优化凝胶制备的工艺[8-9],这些方法或技术虽然对肉糜制品凝胶特性有一定的改善作用,但也存在成本高、可操作性差[10]、作用效果不理想及营养损失严重等问题。
γ-聚谷氨酸(γ-Polyglutamic acid,γ-PGA)是由L-谷氨酸(L-Glu)和D-谷氨酸(D-Glu)单体通过γ-酰胺键连接而成的阴离子多肽型聚合物[11-12]。目前,在中国γ-PGA虽尚未被批准作为食品添加剂,但很多学者在食品领域还是做了较多的研究。如γ-PGA能够促进小肠对矿物质的吸收、降解谷氨酸单体以被人体吸收利用,目前日本已将其列入促进矿物质吸收的保健成分表中[13];在淀粉类食品中添加γ-PGA可以防止淀粉老化,改善组织结构、维持外形[14];在果汁和饮料中,低浓度的γ-PGA 可以缩短高强度甜味剂(如阿斯巴甜)的甜味持续时间,改善味觉平衡[15];在沙拉酱和冰淇凌等食品中,添加γ-PGA可以提高产品的乳化稳定性[16]。此外,γ-PGA还可以遮掩KCl的苦味,将γ-PGA与一定量的KCl复合,可以制成含钠量低的美味食盐[17]。通过γ-PGA改变食品的生理、物理特性以及味觉的功能已得到广泛研究,但目前关于γ-PGA对肉制品品质影响的研究还鲜有报道,不同浓度γ-PGA下对蛋白质功能性质的影响及其机理仍不明确。本试验拟研究不同浓度γ-PGA对肌原纤维蛋白(myofibrillar protein,MP)的功能特性的影响,以期为γ-PGA在肉制品生产中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
冷冻鸡胸肉:购买于北碚永辉超市,剔除可见脂肪及结缔组织后真空包装(每袋约200 g),于-18 ℃冷冻储藏备用。使用前取一定量的鸡胸肉放入4 ℃冰箱解冻10~12 h,加入冰水斩拌成肉糜后用于肌原纤维蛋白的提取。
γ-PGA:食品级,分子量为700 kD,pH值5.0~7.0,南京轩凯生物科技有限公司;
Na2HPO4、NaH2PO4、牛血清蛋白、CuSO4、尿素、KCl、NaCl、EDTA:分析纯,成都市科龙化工试剂厂;
酒石酸钾钠:分析纯,宁波大川精细化工有限公司;
SDS、BIOSHARP、溴酚蓝:分析纯,北京鼎国生物技术有限责任公司;
大豆油:食品级,益海嘉里食品有限公司。
1.2 仪器与设备
酸度计:PHS-4C+型,成都世纪方舟科技有限公司;
内切式匀浆机:XHF-D型,宁波新芝生物科技股份有限公司;
台式高速离心机:5810型,德国Eppendorf公司;
色差仪:UltraScan PRO型,美国HunterLab公司;
质构仪:CT-3型,美国Brookfield公司;
流变仪:HR-1型,美国TA公司;
电泳槽:Mini-PROTEAN®型,美国BIO-RAD公司。
1.3 试验方法
1.3.1 MP的提取 参照文献[18]。
1.3.2 MP溶解度的测定 参照文献[19]。
1.3.3 MP乳化性的测定 取一定量的MP添加到4 ℃磷酸盐缓冲溶液(0.6 mol/L NaCl、0.05 mol/L Na2HPO4、pH 6.5)中,在4 ℃下2 800 r/min匀浆24 s,调节蛋白质质量浓度为1 mg/mL,加入不同浓度(0‰,0.3‰,0.6‰,0.9‰,1.2‰)的γ-PGA混匀后,调节pH为6.5,在4 ℃下反应1 h后,参照文献[20]的方法进行乳化性的测定,并以相同条件下不同浓度(0.2‰,0.4‰,0.6‰,0.8‰,1.0‰,1.2‰)γ-PGA的乳化性为对照。
1.3.4 MP表面疏水性的测定 参照文献[21]。
1.3.5 MP热诱导凝胶的制备 将一定量的MP添加到4 ℃的磷酸盐缓冲溶液(0.6 mol/L NaCl、0.05 mol/L Na2HPO4、pH 6.5)中,在4 ℃下2 800 r/min匀浆24 s,调节蛋白质溶液质量浓度为40 mg/mL,加入不同浓度(0‰,0.3‰,0.6‰,0.9‰,1.2‰)的γ-PGA混匀后,调节pH为6.5,4 ℃反应1 h,然后取7 mL样液于10 mL的离心管中,先40 ℃ 水浴加热0.5 h,再80 ℃水浴加热0.5 h,形成凝胶后迅速冷却,然后将其置于4 ℃冰箱12 h后,待测。
1.3.6 凝胶硬度和弹性的测定 将凝胶样品在室温下平衡30 min后,使用质构仪对其凝胶硬度和弹性进行测定。探头类型:TA5,其他测定参数参照文献[22]。
1.3.7 凝胶保水性的测定 参照文献[23]。
1.3.8 凝胶白度值的测定 参照文献[18]。
1.3.9 MP流变学性质的测定 取一定量的MP于4 ℃磷酸盐缓冲液(0.6 mol/L NaCl、0.05 mol/L Na2HPO4、pH 6.5)中,于2 800 r/min匀浆30 s,调节蛋白质质量浓度为40 mg/mL,然后加入不同浓度(0‰,0.3‰,0.6‰,0.9‰,1.2‰)的γ-PGA混匀后,调节pH为6.5,4 ℃反应1 h。流变仪具体参数设置参照文献[24]。
1.3.10 肌原纤维蛋白SDS-PAGE 取一定量的MP用0.6 mol/L NaCl(pH 6.5)溶液调节蛋白质质量浓度为2 mg/mL,加入不同浓度(0‰,0.3‰,0.6‰,0.9‰,1.2‰)的γ-PGA混匀后,调节pH为6.5,在4 ℃下反应1 h后进行电泳样品的制备。具体操作参照文献[25]。
1.3.11 数据处理 所有试验设置3个平行样,结果取平均值。所得数据用Excel 2016和Origin 8.0软件处理,用SPSS Statistics 17.0软件对数据进行显著性(P<0.05)分析。
2 结果与分析
2.1 γ-PGA对MP溶解度的影响
为消除了因加入γ-PGA而引起的pH值的变化,本试验控制了体系γ-PGA的pH值为5.0~7.0,以考察γ-PGA的其他性质对蛋白质功能特性的影响。由图1可知,随着γ-PGA 浓度的增大,MP溶解度呈先增大后减小的趋势。添加γ-PGA后各处理组的溶解度均显著大于对照组(P<0.05),且在γ-PGA浓度0.6‰时,MP溶解度最大,与对照组相比,溶解度增大了6.36%,可能是γ-PGA对体系中的极性和非极性残基的电荷平衡产生了影响,添加γ-PGA后蛋白质分子表面所带的负电荷数目增多,在静电斥力作用下蛋白质与水分子之间的结合力增强,从而使蛋白质溶解度提高。γ-PGA 浓度在0.6‰~0.9‰时,MP的溶解度明显减小(P<0.05),当γ-PGA浓度进一步增大时,较0.9‰的蛋白样品相比溶解度变化不明显(P>0.05),可能是γ-PGA浓度过高时,γ-PGA侧链上存在大量活性较高的游离羧基与蛋白质的亲水基团发生竞争,疏水相互作用促使蛋白质周围的水分子发生重排,蛋白质—水之间的结合力减小,从而使蛋白质产生凝聚,溶解度有所降低[26]。
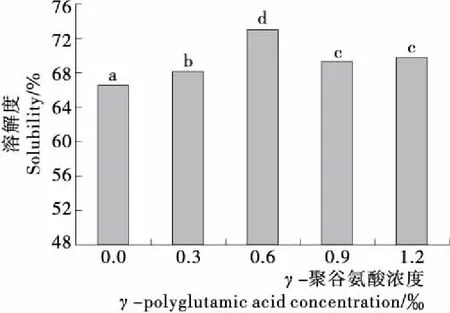
不同字母表示差异显著(P<0.05)图1 γ-PGA对MP溶解度的影响Figure 1 Effect of γ-polyglutamic acid on solubility of myofibrillar protein
2.2 γ-PGA对MP乳化性的影响
由图2可知,随着γ-PGA浓度的增大,MP的乳化活性(EAI)和乳化稳定性(ESI)均呈先增大后减小的趋势。在γ-PGA浓度<0.6‰时,EAI值和ESI值随着γ-PGA浓度的增大显著增大(P<0.05);在γ-PGA浓度为0.6‰时EAI值和ESI值分别达到最大值,即乳化效果最好,与对照组相比,EAI值和ESI值分别增加了24.48%,10.06%;在γ-PGA 浓度>0.6‰时,EAI值和ESI值有所减小,与γ-PGA浓度为0.6‰时相比差异显著(P<0.05)。有研究[27]表明,蛋白质的乳化能力与其溶解度有关,蛋白质溶解度越高,溶液中能参与乳化的蛋白质分子就越多,因此乳化能力就越好。随着γ-PGA浓度的增加,蛋白质溶解度逐渐增大,分布在油水界面的蛋白质浓度相对较高,乳化油滴界面膜的厚度及强度增大,油滴稳定性增加,从而使蛋白质的乳化性增大。此外,乳化液是一种热力学不稳定状态,在乳化过程中部分蛋白质之间相互靠近形成胶束,进而提高蛋白质的乳化性,随着γ-PGA 浓度的增大,体系中—COO—数量相对增多,静电斥力增强,双电层和溶液界面膜的厚度增加,同时有利于胶束的形成,因此蛋白质乳化性得到提高,然而当γ-PGA浓度过高时会增加蛋白从油水界面向水相体系的通过量,压缩胶状分散体的离散双电层,破坏静电复合物的形成,油滴之间易产生聚集,从而导致蛋白质的乳化性能有所降低[28]。通过与图3比较可知,蛋白质乳化性的提高并不是γ-PGA乳化性与蛋白质乳化性的简单叠加,而是通过γ-PGA对蛋白质乳化性的增效作用来实现的。
2.3 γ-PGA对MP表面疏水性的影响
由图4可知,随着γ-PGA浓度的增大,MP表面疏水性呈先减小后增大的趋势。在γ-PGA浓度为0.6‰时,表面疏水性达到最小值,与对照组相比,表面疏水性减小了8.27%。有研究[29]发现,蛋白质的表面疏水性与溶解度及α-螺旋结构含量呈负相关关系,蛋白质的溶解度取决于蛋白质分子的亲水性和疏水性的平衡。一方面,当在0‰~0.6‰时,蛋白质的溶解度随γ-PGA浓度增大而逐渐增大,此时蛋白质分子表面存在的疏水性残基逐渐减小,表面疏水性降低。另一方面,γ-PGA中α-螺旋含量较高,一定浓度的γ-PGA使体系中α-螺旋结构含量增多,从而使分子内部暴露的疏水位点减小,蛋白质的表面疏水性逐渐降低[29]。当γ-PGA浓度较高时,MP溶解度降低,疏水基团在蛋白内部暴露程度增大,MP表面疏水性也随之增大。
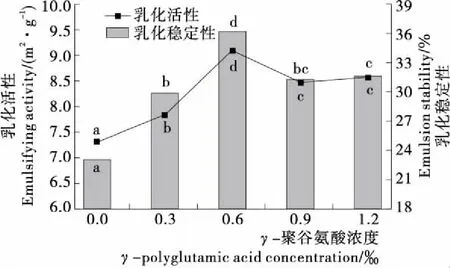
不同字母表示差异显著(P<0.05)图2 γ-PGA对MP乳化性的影响Figure 2 Effects of γ-polyglutamic acid on emulsifying of myofibrillar protein
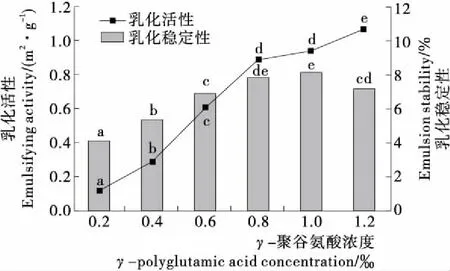
不同字母表示差异显著(P<0.05)图3 不同浓度γ-PGA乳化性的变化
Figure 3 Changes of emulsifying properties ofγ-polyglut-amic acid at different concentrations
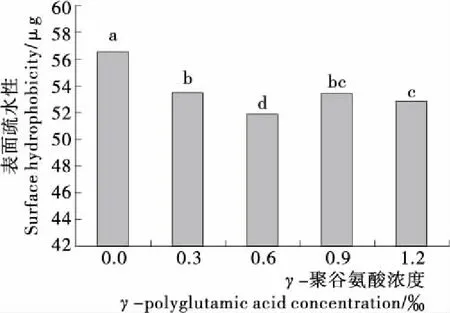
不同字母表示差异显著(P<0.05)图4 γ-PGA对MP表面疏水性的影响Figure 4 Effect of γ-polyglutamic acid on surface hydrophobicity of myofibrillar protein
2.4 γ-PGA对MP凝胶硬度和弹性的影响
MP热诱导凝胶的硬度和弹性可以反映蛋白质形成凝胶的能力,蛋白质凝胶的形成主要受内部因素(如化学作用力、官能团等)和外部因素(如离子强度、温度、pH等)的影响,这些因素的改变都会导致蛋白质的二、三、四级结构发生改变,最终对蛋白质的凝胶特性产生影响[30]。由图5可知,MP凝胶硬度和弹性随着γ-PGA浓度的增大呈先增大后减小的趋势。在γ-PGA浓度为0.6‰时,凝胶硬度和弹性达到最大值,与对照组相比,凝胶硬度和弹性分别增加了61.11%,13.10%,可能是一定浓度的γ-PGA水溶液在加热过程中产生多肽链的随机断裂,在内源酶的催化作用下,暴露出的Glu残基与蛋白质中的Lys残基发生交联,形成的三维网络结构变得更加有序,从而使凝胶硬度和弹性逐渐提高[31]。在γ-PGA浓度0.9‰~1.2‰时,凝胶硬度和弹性有所减小,但与对照组相比,仍呈显著(P<0.05)增加的趋势。过高浓度的γ-PGA反而会使凝胶硬度和弹性有所降低,可能是此时底物浓度已经饱和,过高浓度的γ-PGA和蛋白质分子之间发生过度交联,破坏了凝胶网络结构的均一性。
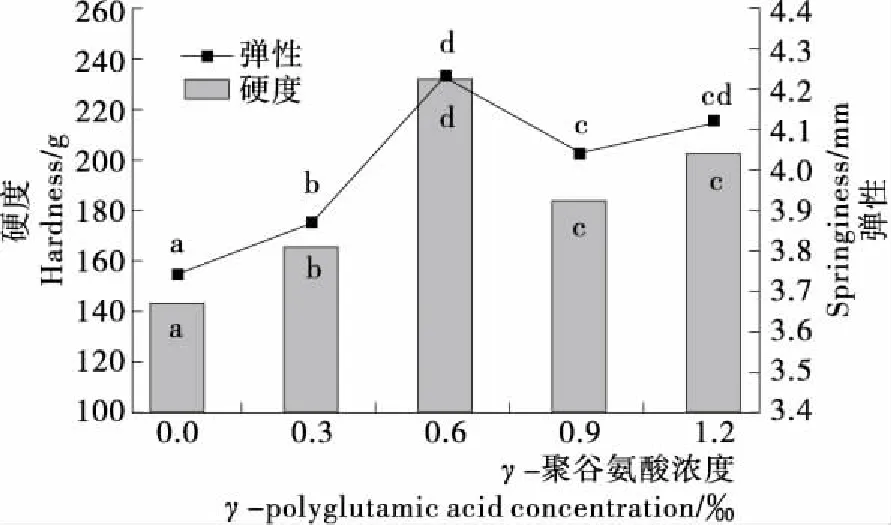
不同字母表示差异显著(P<0.05)图5 γ-PGA对MP凝胶硬度和弹性的影响
Figure 5 Effect ofγ-polyglutamic acid on the hardness and springinessof myofibrillar protein gelatin
2.5 γ-PGA对MP凝胶保水性的影响
由图6可知,MP凝胶保水性随着γ-PGA浓度的增大呈先增大后减小的趋势。在γ-PGA浓度为0.6‰时,凝胶保水性最好,与对照组相比提高了8.18%。有研究[32]表明,肉制品中的水分主要依靠蛋白质之间的静电相互作用、毛细管张力和氢键来维持。一定浓度的γ-PGA能够提高凝胶保水性,可能是添加γ-PGA后MP分子表面所带的负电荷数目增多,静电斥力作用使蛋白质分子间的作用力减弱,而蛋白质与水分子之间的作用力增强。此外,MP凝胶的形成主要是由蛋白质分子间的相互作用产生的,肌球蛋白是MP的主要成分,在离子强度较高时,肌球蛋白会以单分子状态存在,在热诱导凝胶形成过程中,一定浓度的γ-PGA使MP充分伸展,不易聚集,蛋白质颗粒较小,加热过程中γ-PGA可与肌球蛋白之间最大程度地发生交联或聚合,并形成有序的三维网状结构,使凝胶孔洞更加均匀,网络结构更加紧密,从而将更多的水分包埋或被结合在凝胶结构中[33]。随着γ-PGA浓度的进一步增大,凝胶保水性有所降低,可能是较高浓度的γ-PGA与蛋白质之间过度交联,造成凝胶网络结构混乱无序,蛋白质与水分子之间的相互作用减弱,从而使凝胶保水性能下降。
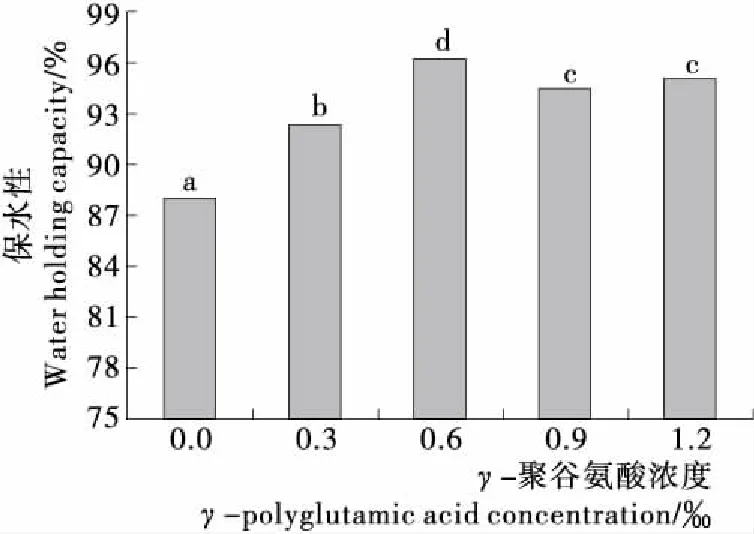
不同字母表示差异显著(P<0.05)图6 γ-PGA对MP凝胶保水性的影响Figure 6 Effect of γ-polyglutamic acid on water holding capacity of myofibrillar protein gelatin
2.6 γ-PGA对MP凝胶白度值的影响
由图7可知,随着γ-PGA浓度的增大,凝胶白度值呈逐渐减小的趋势。在γ-PGA浓度<0.6‰时,与对照组相比,凝胶白度值变化较小(P>0.05);在γ-PGA浓度>0.6‰时,凝胶白度值随着γ-PGA浓度的增大呈明显(P<0.05)的减小趋势,且在γ-PGA浓度为1.2‰时,凝胶白度值达到最小值,与对照组相比,白度值仅降低了1.09%。γ-PGA对凝胶白度值的影响可能有3个方面的原因:① 随着γ-PGA浓度的增大,在凝胶制备过程中Maillard反应的速率加快,生成的有色物质影响凝胶白度值的提高;② 随着γ-PGA浓度的增大,蛋白质浓度增加,其与蛋白质之间的交联作用增强,凝胶微观结构变得更加致密,从而影响光的折射率;③ 一定浓度的γ-PGA使凝胶的保水性提高,凝胶样品表面的游离水减少,从而降低了与白度值正相关的L*值[34]76。Soottawat等[33]报道称凝胶白度值的变化与保水性有关,高的水分含量会导致凝胶白度值降低,与本试验的研究结果基本一致。总体来看,γ-PGA对凝胶白度值的影响并不大,可能也与γ-PGA自身的颜色有关。

不同字母表示差异显著(P<0.05)图7 γ-PGA对MP凝胶白度值的影响Figure 7 Effect of γ-polyglutamic acid on whiteness of myofibrillar protein gelatin
2.7 γ-PGA对MP流变学性质的影响
存储模量(Storage modulus,G')可以反映蛋白质在加热过程中形成弹性凝胶网络结构的能力。由图8可知,γ-PGA对蛋白质G′值的影响可分为3个阶段:第一阶段是随着温度的升高,G′值缓慢增大,在41~43 ℃时分别出现了第1个峰值,此时MP的黏度达到最大,主要是因为肌球蛋白结构发生变化,三维网状结构初步形成,对照组在43.07 ℃时G′达最大值(1 082.09 Pa),而添加了γ-PGA的试样在此温度之前就出现了峰值,且其峰值明显高于对照组;第二阶段是G′值随着温度的升高逐渐减小,在48~50 ℃时达到第2个峰值,在此阶段蛋白质开始变性,已形成的三维网络结构被破坏,导致凝胶弱化[35],加入γ-PGA样品其G′的最小值显著大于对照组的,而且其转变温度低于对照组的;第三阶段是G′值随着温度的升高快速增大,且在71~77 ℃时达到第3个峰值,此阶段MP的弹性达到最大,主要是受疏水相互作用和二硫键的影响,变性的MP最终形成了不可逆的三维网状结构凝胶,对照组在77.02 ℃时G′达最大值(19 798.7 Pa),而γ-PGA浓度为0.6‰的样品在71.18 ℃时G′达最大值(127 332 Pa),γ-PGA浓度为1.2‰的样品在72.11 ℃时G′达最大值(104 558 Pa),与对照组相比,加入γ-PGA的样品G′值增大速度较快,G′值发生转变的温度比对照组低,且其G′最大值也显著高于对照组的,表明γ-PGA可以降低蛋白质形成凝胶的热变性温度,提高凝胶的形成能力。此后,随着温度的继续升高,加入γ-PGA的样品其G′值平缓下降,而对照组的G′值下降趋势明显。在80 ℃时,γ-PGA浓度为0.6‰ 的样品其G′值(113 261.6 Pa)明显大于其他样品的,与γ-PGA对MP凝胶硬度和弹性的影响结果基本一致。

图8 γ-PGA对MP存储模量(G′)的影响Figure 8 Effect of γ-polyglutamic acid on storage modulus (G′) of myofibrillar protein
2.8 γ-PGA对肌原纤维蛋白SDS-PAGE图谱的影响
MP是一个复杂的蛋白集合体系,在蛋白溶液样品中加入不同浓度的γ-PGA后,其电泳条带的变化会有所不同。由图9可知,与对照组的蛋白样品图谱相比,添加一定浓度γ-PGA后的蛋白样品其MHC(分子质量为200 kD)条带和Actin(分子质量为43 kD)条带都明显减弱。随着γ-PGA浓度的增大,MHC、Actin条带及肌球蛋白轻链(分子质量为17~20 kD)条带都逐渐减弱,可能是在鸡肉蛋白质中内源酶的催化作用下,因样品缓冲液中含有SDS和β-巯基乙醇等还原剂,γ-PGA经高温降解后产生的Glu残基与蛋白质中的Lys残基发生交联反应、形成大分子聚合物,说明此聚合物并不是通过二硫键和氢键形成的,而是由共价键形成的。当γ-PGA浓度进一步增大时,MHC、Actin条带并未随着γ-PGA浓度的进一步增大而继续减弱,可能是此时底物浓度已经达到饱和状态。此外,在凝胶顶部存在着一些颜色很深的条带,可能是γ-PGA的分子量很高,其在高温条件下降解后产生了一些分子量超过200 kD的高分子物质,这些物质在进行凝胶电泳时无法进入到浓缩胶和分离胶中,从而聚积在凝胶顶部[36]。刘文娟[34]81-82在研究γ-PGA对带鱼蛋白质凝胶特性的影响时发现,γ-PGA的添加可以使MHC条带减弱,CPI条带显著增强,与本试验的研究结果基本一致。
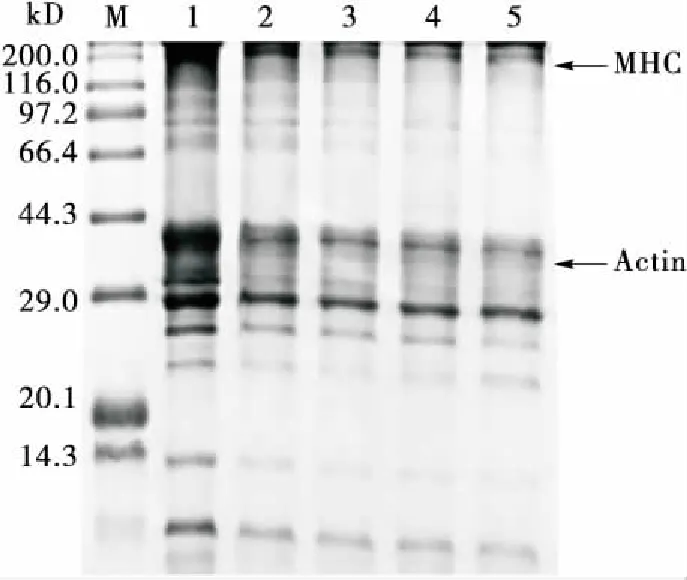
M. 标准蛋白(marker) 1~5.γ-PGA浓度分别为0‰,0.3‰,0.6‰,0.9‰,1.2‰ MHC. 肌球蛋白重链 Actin. 肌动蛋白
图9γ-PGA对肌原纤维蛋白SDS-PAGE图谱的影响
Figure 9 Effects ofγ-polyglutamic acid on the SDS-PAGE pattern of myofibrillar protein
3 结论
不同γ-PGA浓度对鸡肉MP功能特性的影响不同。随着γ-PGA浓度的增大,MP的溶解度、乳化性、凝胶硬度、弹性及保水性呈先增大后减小的趋势,表面疏水性呈先减小后增大的趋势,而γ-PGA对凝胶白度值影响较小;流变学性质变化表明,γ-PGA对MP凝胶的形成有一定的促进作用;SDS-PAGE结果表明,γ-PGA与MP能够发生交联反应、形成大分子物质。γ-PGA对鸡肉MP的功能特性有一定的积极作用,今后在研究过程中可考虑将γ-PGA和TGase等品质改良剂复合使用,为功能性(如低盐、低脂)肉制品及新产品的开发提供了一定的理论依据。
[1] 施海东. 论我国肉鸡行业发展[J]. 家禽科学, 2017(1): 4-10.
[2] 张海峰, 白杰, 张英. 宰后处理方式对鸡肉品质及加工性能的影响[J]. 肉类研究, 2009, 23(8): 32-36.
[3] 倪学文, 严文莉, 汪芳丽, 等. 魔芋胶对鸡肉和猪肉混合肉糜凝胶特性的影响[J]. 食品工业科技, 2015, 36(8): 305-308.
[4] 马力量. 超高压及亲水胶体对鸡肉凝胶品质的影响[D]. 合肥: 合肥工业大学, 2007: 7-10.
[5] 赵春青, 彭增起. 鸡肉盐溶蛋白质凝胶特性及其影响因素的研究[D]. 保定: 河北农业大学, 2002: 1-4.
[6] 唐学燕, 李博, 顾小红, 等. 魔芋葡甘露聚糖对肌肉蛋白质性质的影响[J]. 食品与机械, 2000(4): 25-26.
[7] 贾娜, 韩齐, 芦嘉莹, 等. 复配食用胶对肌原纤维蛋白功能特性的影响[J]. 中国食品学报, 2014(10): 141-148.
[8] 王希希, 林超, 李向红, 等. 工艺条件对蛋清鲢鱼鱼糜凝胶特性的影响[J]. 食品与机械, 2016, 32(12): 22-25.
[9] 董建国, 李茂华, 潘润淑, 等. 超高压和转谷氨酰胺酶联合处理对碎牛肉重组特性的影响[J]. 食品与机械, 2014, 30(2): 184-187.
[10] BAJOVIC B, BOLUMAR T, HEINZ V. Quality considera-tions with high pressure processing of fresh and value added meat products[J]. Meat Science, 2012, 92(3): 280-289.
[11] ISHWAR Bajaj, REKHA Singhal. Poly(glutamic acid)-An emerging biopolymer of commercial interest [J]. Bioreso-urce Technology, 2011, 102(10): 5 551-5 561.
[12] ADETORO Ogunleye, ADITYA Bhat, VICTOR U, et al. Poly-γ-glutamic acid: production, properties and applications[J]. Microbiology, 2015, 161: 1-17.
[13] HO G H, HO T I, HSIEH K H, et al. Gamma-Polyglutamic acid produced by Bacillus subtilis (natto): structural characteristics, chemical properties and biological functionalities[J]. Journal of the Chinese Chemical Society, 2006, 53(6): 1 363-1 384.
[14] KONNO A, TAGUCHI T, YAMAGUCHI T. Bakery prod-ucts andnoodles containing polyglutamic acid: United State, 4888193[P]. 1989-12-19.
[15] SATO S, KOYAMA M. Inhibitor for sweet aftertaste of high-intensity sweetener: Japanese, 118741[P]. 2010-11-25.
[16] WANG T L, KAO T H, INBARAJ B S, et al. Inhibition effect of poly(γ-glutamic acid) on lead-induced toxicity in mice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(23): 12 562-12 567.
[17] SATO S, SATOKAWA H, IWASAKI T, et al. Taste improver: United State, 146491[P]. 2009-11-30.
[18] 白登荣, 温佳佳, 贺雪华, 等.γ-聚谷氨酸对鸡肉糜凝胶特性的影响[J]. 食品科学, 2017, 38(15): 158-164.
[19] AGYARE K K, XIONG You-ling, ADDO K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1 131-1 137.
[20] AGYARE K K, ADDO K, XIONG You-ling. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[21] CHELH L, GATELLIER P, SANTE-LHOUTELLIER V. Technical note: A simplied procedure for myobril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[22] 徐谓, 李洪军, 徐明悦, 等. 亚麻籽胶对猪、兔肉混合肉糜凝胶特性的影响[J]. 食品工业科技, 2015, 36(24): 296-300.
[23] SALVADOR P, TOLDRA M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcinehaemoglo- bin[J]. Food Hydrocolloids, 2009, 23(7): 1 654-1 659.
[24] WESTPHALEN A D, BRIGGS J L, LONERGAN S M. Influence of muscle type on rheological properties of porcine myofibrillar protein during heat-induced gelation[J]. Meat Science, 2006, 72(4): 697-703.
[25] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of Bacteriophage T4[J]. Nature, 1970, 227(5 259): 680-685.
[26] THAWORNCHINSOMBUT S. Biochemical and gelation properties of fish protein isolate prepared under various pH and ionic strength conditions[D]. United States: Oregon State University, 2004: 8-10.
[27] ZORBA O, KURT S, GENCCELEP H. The effects of different levels of skim milk powder and whey powder on apparent yield stress and density of different meat emulsions[J]. Food Hydrocolloids, 2005, 19(1): 149-155.
[28] WAGNER J R, GUEGUEN J. Surface functional properties of native, acid- treated and reduced soy glycinin: 2. emulsifying properties[J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2 181-2 187.
[29] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[30] 杨明. 马铃薯淀粉及转谷氨酰胺酶对鲤鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨: 东北农业大学, 2014: 3-4.
[31] GOTO A, KUNIOKA M. Biosynthesis and hydrolysis of poly(glutamic acid) from bacillus subtilis IFO3335[J]. Biosci Biotechnol Biochem, 1992, 56(7): 1 031-1 035.
[32] 吴烨, 许柯, 徐幸莲, 等. 低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响[J]. 食品科学, 2010, 31(9): 6-11.
[33] SOOTTAWAT B, WONNOP V, SUTTIRAK P. Suwari gel properties as affected by transglutaminase activator and inhibitors[J]. Food Chemistry, 2004, 85(1): 91-99.
[34] 刘文娟. 凝胶增强剂对带鱼肌肉蛋白质热凝胶形成的影响及机理研究[D]. 杭州: 浙江大学, 2015.
[35] 付湘晋, 许时婴, 王璋. 酸碱处理对鲢鱼肌原纤维蛋白热变性, 聚集, 胶凝性质的影响[J]. 食品科学, 2008, 29(6): 100-103.
[36] 魏晓明, 郭晓娜, 朱科学, 等. 谷氨酰胺转氨酶对荞麦面条品质的影响[J]. 食品与机械, 2016, 32(3): 188-192.
Effectsofγ-polyglutamicacidonfunctionalpropertiesofchickenmyofibrillarprotein
Different concentration ofγ-polyglutamic acid were added to chicken myofibrillar protein, and the effects ofγ-polyglutamic acid on the function of chicken myofibrillar protein were studied. The study found that with the increase of the concentration ofγ-polyglutamic acid, surface hydrophobicity of myofibrillar protein first decreases and then increases, and reached the minimum when the concentration ofγ-polyglutamic acid was 0.6‰; the solubility, emulsification, the gelatin of hardness, springiness and water holding capacity were first increases and then decreases, and respectively reached the maximum when the concentration ofγ-polyglutamic acid was 0.6‰, butγ-polyglutamic acid on gelatin whiteness had little effect. The change of rheological properties indicated thatγ-PGA had a certain effect on the formation of myofibrillar protein gelatin. SDS-PAGE studies indicated that the cross-linking reaction betweenγ-polyglutamic acid and myofibrillar protein.
γ-polyglutamic acid; chicken; myofibrillar protein; functional properties
四川省科技支撑计划(编号:2016NZ0003-05)
白登荣,男,西南大学在读硕士研究生。
尚永彪(1964—),男,西南大学教授,博士。
E-mail:shangyb64@sina.com
2017—04—06
10.13652/j.issn.1003-5788.2017.09.008

