添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能、血浆指标和乳中褪黑素含量的影响
陈俊宏 赵 芳 魏凯敏 谭世新 杨开伦*
(1.新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐 830052;2.新疆天山畜牧生物工程股份有限公司,昌吉 831100)
添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能、血浆指标和乳中褪黑素含量的影响
陈俊宏1赵 芳1魏凯敏1谭世新2杨开伦1*
(1.新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐 830052;2.新疆天山畜牧生物工程股份有限公司,昌吉 831100)
本研究旨在探究在饲粮中添喂色氨酸(Trp)、过瘤胃色氨酸(RPTrp)对奶牛泌乳性能、血浆指标和乳中褪黑素(MLT)含量的影响。选取30头3~5岁、2~3胎次、泌乳天数为(180±46) d的健康荷斯坦奶牛,随机分为3组,分别为对照组、试验Ⅰ组和试验Ⅱ组,每组10头。对照组饲喂全混合日粮,试验Ⅰ、Ⅱ组在对照组基础上分别添喂100 g/(d·头)色氨酸和220 g/(d·头)过瘤胃色氨酸(L-色氨酸含量≥45%)。预试期7 d,正试期60 d。结果表明:1)试验Ⅰ、Ⅱ组产奶量相比于对照组分别提高了11.78%(P<0.05)和17.19%(P<0.01);试验Ⅰ、Ⅱ组乳糖产量极显著高于对照组(P<0.01)。2)试验Ⅰ、Ⅱ组在14:00和22:00血浆中生长激素(GH)含量极显著高于对照组(P<0.01);14:00时,试验Ⅱ组血浆色氨酸含量极显著高于对照组(P<0.01),各组血浆褪黑素含量无显著差异(P>0.05);22:00时试验Ⅱ组血浆色氨酸含量极显著高于对照组(P<0.01),试验Ⅱ组血浆褪黑素含量显著高于对照组(P<0.05);试验Ⅰ组在14:00和22:00血浆色氨酸、5-羟色胺(5-HT)和褪黑素的含量与对照组均无显著差异(P>0.05)。3)05:00时试验Ⅱ组乳中褪黑素含量极显著高于对照组(P<0.01);18:00时各组乳中褪黑素含量无显著差异(P>0.05)。4)试验Ⅰ组血浆总抗氧化能力(T-AOC)极显著高于对照组(P<0.01);试验Ⅱ组血浆谷胱甘肽过氧化物酶(GSH-Px)活性极显著高于对照组(P<0.01);试验Ⅰ、Ⅱ组血浆超氧化物歧化酶(SOD)活性极显著高于对照组(P<0.01);试验Ⅱ组血浆丙二醛(MDA)含量极显著低于对照组(P<0.01)。结果提示,添喂色氨酸[100 g/(d·头)]、过瘤胃色氨酸[220 g/(d·头)]能够提高泌乳期奶牛产奶量、血浆GH含量及抗氧化能力,其中以添喂过瘤胃色氨酸效果较好;添喂过瘤胃色氨酸[220 g/(d·头)]可提高血浆色氨酸含量及夜间血浆褪黑素含量,从而提高夜间奶牛乳中褪黑素含量。
色氨酸;过瘤胃色氨酸;奶牛;泌乳性能;褪黑素
褪黑素(melatonin,MLT)是由哺乳动物松果体分泌的一种吲哚类神经内分泌激素[1],研究发现,褪黑素在治疗失眠、稳定生物节律、提高免疫力,以及抗氧化、抗衰老、抗癌等方面都具有一定的生物学作用[2-3]。但由于人工合成的褪黑素可能导致机体内分泌紊乱等副作用,其安全性还有待验证,多数国家和地区把人工合成的褪黑素归为药物[4]。因此生产富含天然褪黑素的乳品既具有生物学意义也具有经济价值。色氨酸(tryptophan,Trp)作为动物体内一种功能性必需氨基酸,同时也是褪黑素的前体物质,在机体内经过羟基化、脱羧、N-乙酰化和甲基化,最终形成褪黑素[5]。Esteban等[6]研究发现,给大鼠口服色氨酸可显著提高脑内5-羟色氨酸、5-羟色胺(5-HT)和血浆褪黑素含量。Eriksson等[7]研究发现,奶牛血清褪黑素含量与乳中褪黑素含量呈正相关,在夜间牛乳中褪黑素含量会随血浆褪黑素含量的升高而升高。以上研究表明,通过给奶牛添喂色氨酸,可以提高血浆色氨酸含量,从而促进褪黑素的合成。但由于色氨酸在反刍动物瘤胃内会被大量降解,故直接给反刍动物添喂色氨酸不能达到理想的目的[8]。而通过添喂过瘤胃色氨酸(rumen-protected tryptophan,RPTrp),可有效地避免色氨酸在瘤胃内被降解[9],增加血液中色氨酸的含量及褪黑素的合成量,从而提高乳中褪黑素的含量。因此本试验以泌乳期荷斯坦奶牛为研究对象,研究添喂色氨酸、过瘤胃色氨酸对泌乳期荷斯坦奶牛血浆及乳中褪黑素含量的影响,并探究添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能、血浆激素含量及抗氧化指标的影响。
1 材料与方法
1.1试验时间与地点
试验于2016年10—12月在新疆维吾尔自治区昌吉市阿什里乡天山畜牧生物工程股份有限公司良繁场进行。
1.2试验动物及试验设计
试验选取30头3~5岁、2~3胎次、泌乳天数为(180±46) d的健康荷斯坦奶牛,随机分成3组,分别为对照组、试验Ⅰ和Ⅱ组,每组10头牛。对照组饲喂全混合日粮(TMR),试验Ⅰ、Ⅱ组在对照组基础上分别添喂100 g/(d·头)色氨酸(购自希杰印度尼西亚有限公司,纯度≥98%)和220 g/(d·头)过瘤胃色氨酸(购自北京亚禾营养高新技术有限公司,色氨酸含量≥45%,过瘤胃率≥85%)。2种添加物均等量分为2份,分别于每天11:00和19:00添喂。预试期7 d,正试期60 d。在预试期注意观察奶牛的健康状况,乳房炎发病情况及奶牛对添加剂的采食情况。正试期时,添加色氨酸和过瘤胃色氨酸时与少量TMR均匀混合后进行单槽饲喂,每天记录各组奶牛产奶量。于试验第1、30、60天进行乳样和血浆样的采集。
1.3饲养管理
试验期间,对照组与试验组试验动物均在同一圈舍饲养。每天11:00和19:00,定时饲喂TMR,试验动物自由采食,自由饮水,在圈舍自由活动,每天定时清粪,保持圈舍的清洁。TMR组成及营养水平见表1。
1)每千克预混料含有One kg of premix contained the following:Cu 3 230 mg,Zn 5 950 mg,Mn 4 850,I 120 mg,Se 150 mg,Co 90 mg,VA 804 800 IU,VD3188 800 IU,VE 4 600 IU,烟酸 nicotinic acid 800 mg。
2)泌乳净能为计算值,其他营养水平为实测值。NELwas a calculated value, while the other nutrient levels were measured values.
1.4样品的采集
试验期间每天进行3次机械挤奶,记录各组奶牛24 h产奶量,正试期第1、30、60天05:00和18:00采集乳样,分装于6个5 mL Eppendorf管中(每管4 mL),标记后-20 ℃保存待测。
在正试期第1、30、60天分别于14:00和22:00采集血浆样。在奶牛采食期间保定,通过尾静脉采集血样,每头牛采血15 mL,分装于5 mL的肝素钠抗凝管中,在3 500 r/min离心15 min,用移液枪吸取血浆,分装于2 mL Eppendorf管中(每管1.5 mL),标记后-20 ℃保存待测。
1.5样品的测定及方法
TMR干物质(dry matter,DM)的含量采用常规饲料分析方法进行测定[10];钙(calcium,Ca)含量采用邻甲酚酞比色法进行测定[11];磷(phosphorus,P)含量采用定磷法进行测定;中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量采用纤维分析仪(ANKOM公司,美国)进行测定;粗蛋白质(crude protein,CP)含量采用快速定氮仪(Elementar公司,德国),并严格按照仪器的操作方法进行测定。
乳脂、乳蛋白和乳糖产量采用乳成分分析仪(MilkoScan FT+)(丹麦福斯有限公司)进行分析。乳中褪黑素及血浆中5-HT、褪黑素、促卵泡素(FSH)、促黄体素(LH)、生长激素(GH)、催乳素(PRL)含量采用酶联免疫吸附测定法测定,血浆中丙二醛(MDA)含量,过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及总抗氧化能力(T-AOC)采用比色法测定,样品均送至北京华英生物技术研究所测定。血浆中色氨酸含量测定参考谢占武等[12]的比色法进行。
1.6数据统计分析
试验数据采用SAS 8.0中Mixed混合模型统计,固定效应有试验处理、时间及二者之间的交互作用。方差结构采用复合对称性协方差(CS),数据采用最小二乘平均值表示,P<0.05为差异显著,P<0.01为差异极显著,采用LS-means进行多重比较。
2 结果与分析
2.1添喂色氨酸、过瘤胃色氨酸对奶牛产奶量、乳成分的影响
由表2可知,试验Ⅰ、Ⅱ组产奶量与对照组相比分别提高了11.78%(P<0.05)和17.19%(P<0.01),试验Ⅰ组与Ⅱ组相比差异不显著(P>0.05),时间对产奶量无显著影响(P>0.05),组别与时间对产奶量也无显著的互作效应(P>0.05)。试验Ⅰ、Ⅱ组的乳脂率、乳脂产量、乳蛋白率、乳蛋白产量和乳糖率与对照组相比,差异均不显著(P>0.05)。试验Ⅰ、Ⅱ组的乳糖产量与对照组相比分别提高了14.66%(P<0.01)和17.96%(P<0.01)。各组间的乳尿素氮含量差异均不显著(P>0.05)。时间对乳蛋白率和乳蛋白产量有极显著影响(P<0.01),对其余乳成分无显著影响(P>0.05),组别与时间对乳成分也无显著的互作效应(P>0.05)。
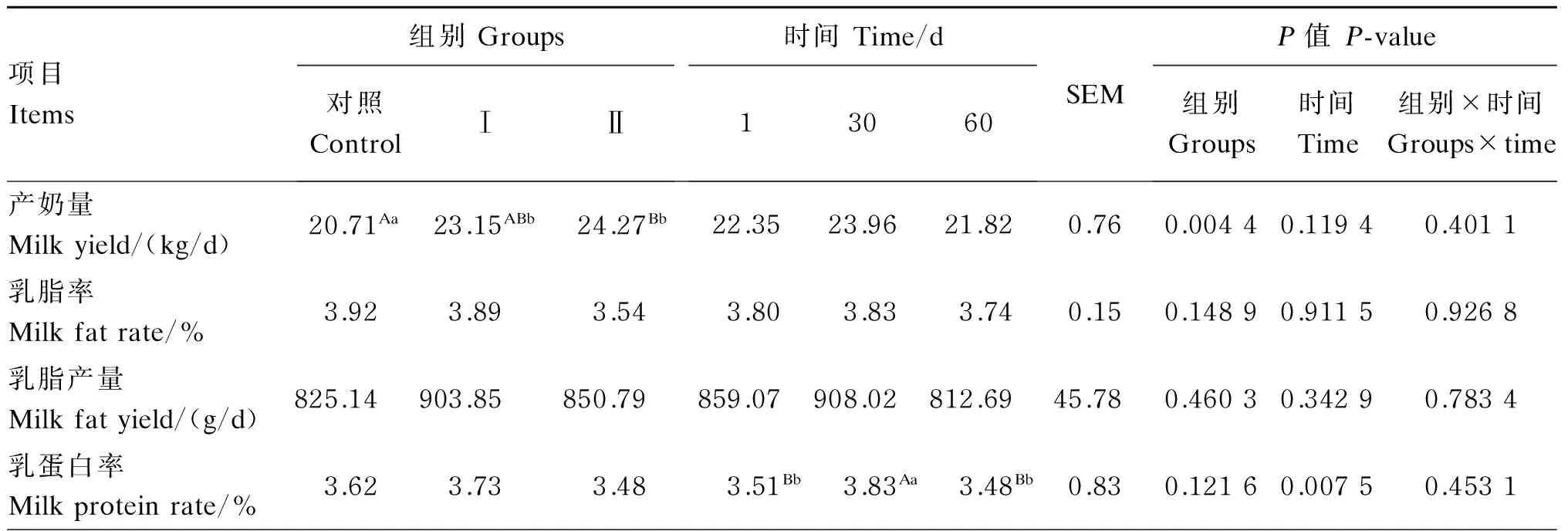
表2 添喂色氨酸、过瘤胃色氨酸对奶牛产奶量、乳成分的影响
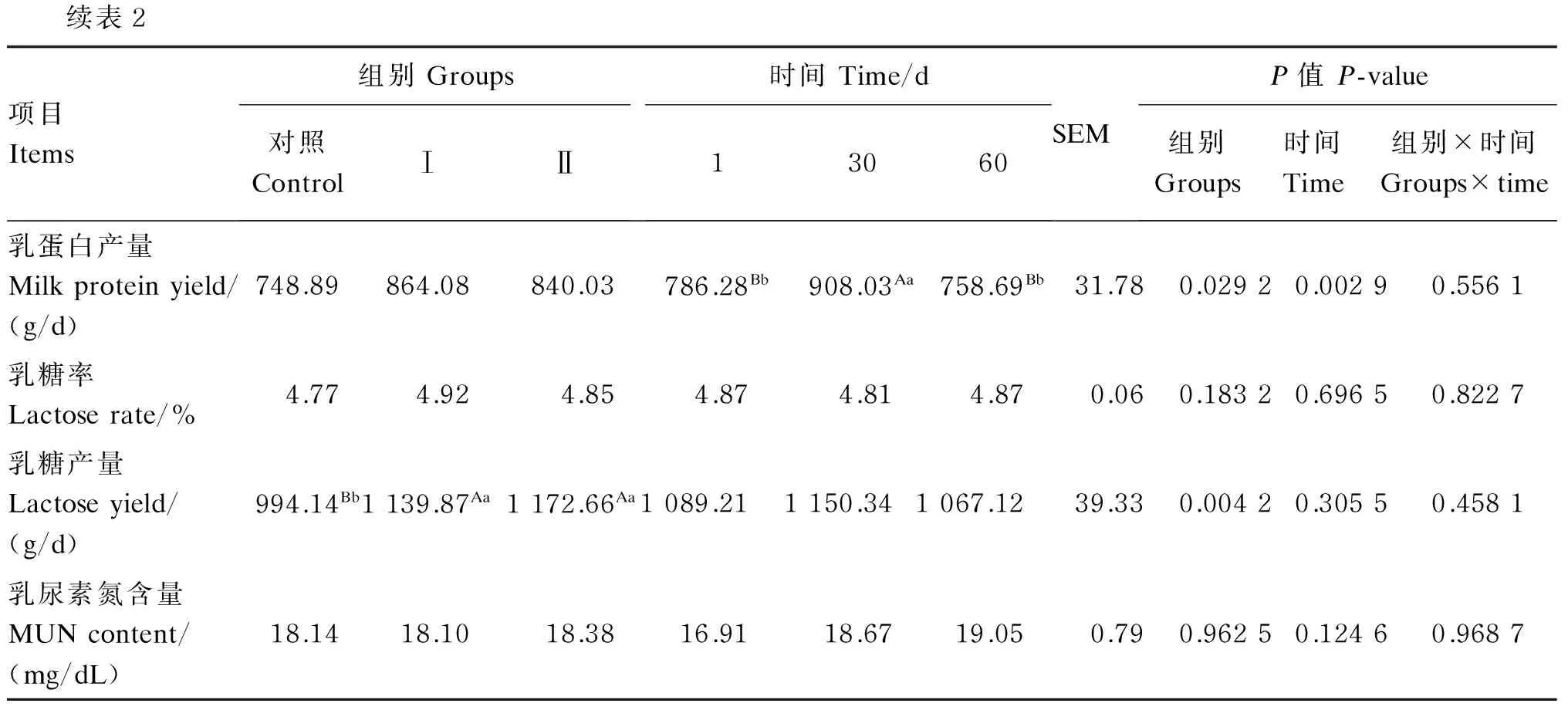
续表2项目Items组别Groups对照ControlⅠⅡ时间Time/d13060SEMP值P-value组别Groups时间Time组别×时间Groups×time乳蛋白产量Milkproteinyield/(g/d)748.89864.08840.03786.28Bb908.03Aa758.69Bb31.780.02920.00290.5561乳糖率Lactoserate/%4.774.924.854.874.814.870.060.18320.69650.8227乳糖产量Lactoseyield/(g/d)994.14Bb1139.87Aa1172.66Aa1089.211150.341067.1239.330.00420.30550.4581乳尿素氮含量MUNcontent/(mg/dL)18.1418.1018.3816.9118.6719.050.790.96250.12460.9687
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.2添喂色氨酸、过瘤胃色氨酸对奶牛血浆激素含量的影响
由表3可知,试验Ⅰ、Ⅱ组血浆PRL含量高于对照组,但各组间差异不显著(P>0.05)。试验Ⅰ、Ⅱ组血浆GH含量与对照组相比分别提高了11.05%(P<0.01)和14.15%(P<0.01),试验Ⅰ组与Ⅱ组相比差异不显著(P>0.05)。各组间血清FSH、LH含量均差异不显著(P>0.05)。时间对血浆GH和FSH含量有极显著影响(P<0.01),对PRL和LH含量无显著影响(P>0.05)。组别与时间对血浆PRL、GH、FSH和LH含量无显著的互作效应(P>0.05)。
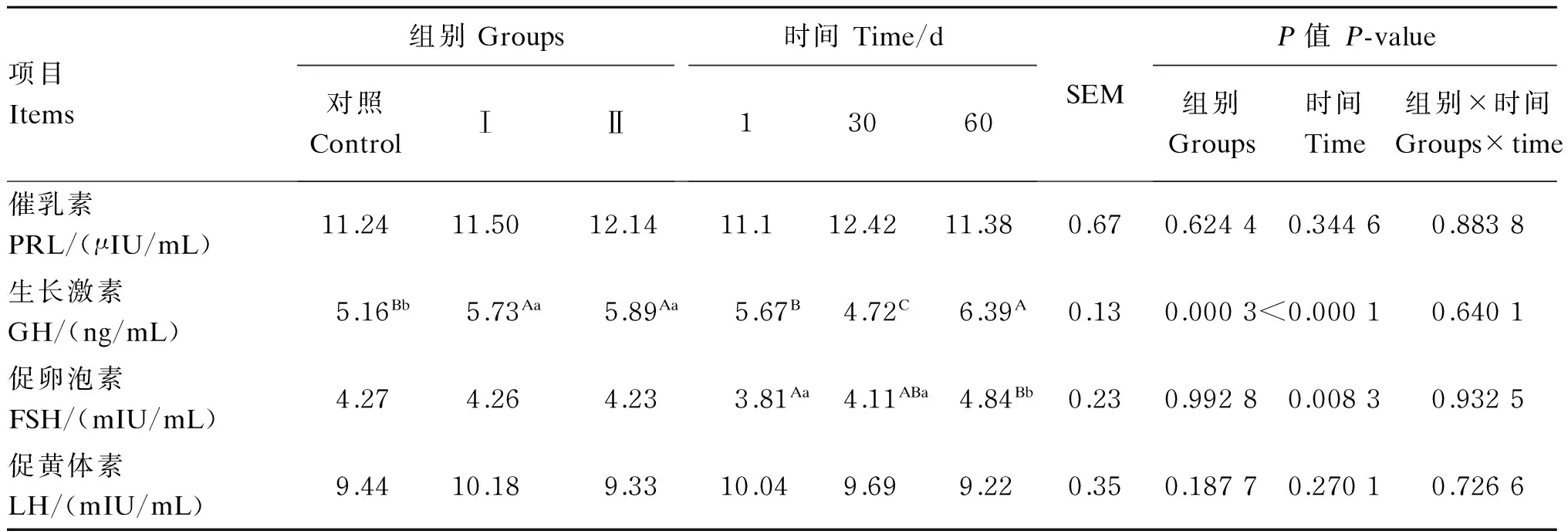
表3 添喂色氨酸、过瘤胃色氨酸对奶牛血浆激素含量的影响
采样时间为22:00。
Blood samples were collected at 22:00.
2.3添喂色氨酸、过瘤胃色氨酸对奶牛血浆色氨酸、5-HT、褪黑素含量的影响
由表4可知,在14:00时,试验Ⅰ组血浆色氨酸含量与对照组差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比分别提高了29.58%(P<0.01)和31.59%(P<0.01),时间对血浆色氨酸含量有极显著影响(P<0.01),组别与时间对血浆色氨酸含量也有极显著的互作效应(P<0.01)。各组的血浆5-HT含量差异不显著(P>0.05),时间对血浆5-HT含量无显著影响(P>0.05),组别与时间也无显著交互效应(P>0.05)。各组血浆褪黑素含量差异不显著(P>0.05),时间对血浆褪黑素含量有极显著影响(P<0.01),但组别与时间无显著的互作效应(P>0.05)。
在22:00时,试验Ⅰ组血浆色氨酸含量与对照组相比差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比分别提高了29.63%(P<0.01)和32.06%(P<0.01),时间对血浆色氨酸含量有极显著的影响(P<0.01),组别与时间也有极显著的互作效应(P<0.01)。各组血浆5-HT含量差异不显著(P>0.05)。试验Ⅰ组血浆褪黑素含量与对照组相比差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比分别提高了7.87%(P<0.05)和6.51%(P<0.05)。时间对5-HT含量和褪黑素含量有极显著的影响(P<0.01),但组别与时间均无显著的互作效应(P>0.05)。
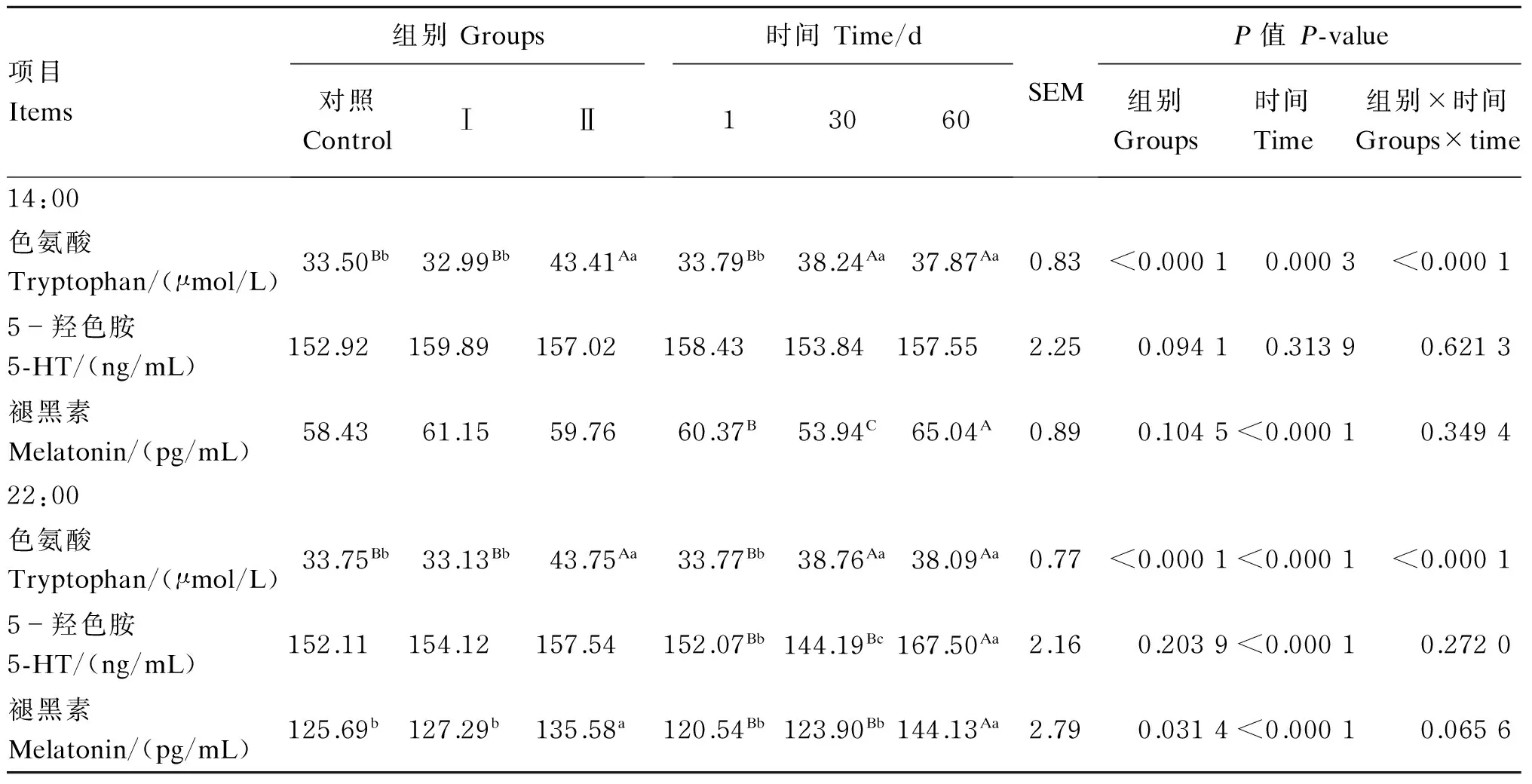
表4 添喂色氨酸、过瘤胃色氨酸对奶牛血浆色氨酸、5-HT、褪黑素含量的影响
2.4添喂色氨酸、过瘤胃色氨酸对奶牛乳中褪黑素含量的影响
由表5可知,在05:00时,试验Ⅰ组的乳中褪黑素含量与对照组差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比分别提高了6.69%(P<0.01)和17.06%(P<0.01),时间对牛乳中褪黑素含量有极显著的影响(P<0.01),组别与时间也有极显著的互作效应(P<0.01)。
在18:00时,各组的乳中褪黑素含量差异不显著(P>0.05),时间对乳中褪黑素含量有极显著影响(P<0.01),组别与时间也有极显著的互作效应(P<0.01)。
2.5添喂色氨酸、过瘤胃色氨酸对奶牛血浆抗氧化指标的影响
由表6可知,试验Ⅰ组的血浆T-AOC与对照组、试验Ⅱ组相比极显著提高(P<0.01),试验Ⅱ组与对照组相比差异不显著(P>0.05),时间对T-AOC有极显著的影响(P<0.01),组别与时间也有极显著的互作效应(P<0.01)。试验Ⅰ组的血浆GSH-Px活性与对照组相比差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比,分别提高了5.43%(P<0.01)和6.14%(P<0.01),时间对血浆GSH-Px活性有极显著影响(P<0.01),但组别与时间无显著的交互效应(P>0.05)。试验Ⅰ、Ⅱ组的血浆SOD活性与对照组相比均有所提高,差异极显著(P<0.01),时间组别与时间对血浆SOD活性有显著的交互效应(P<0.05),时间对血浆SOD活性无显著影响(P>0.05)。各组的血浆CAT活性差异不显著(P>0.05),时间对CAT活性有极显著影响(P<0.01),但组别与时间无显著的交互效应(P>0.05)。试验Ⅰ组的血浆MDA含量与对照组相比差异不显著(P>0.05),试验Ⅱ组与对照组、试验Ⅰ组相比,分别降低了16.05(P<0.01)和8.11%(P<0.01),时间对血浆MDA含量无显著的影响(P>0.05),组别与时间对血浆MDA含量也无显著的交互效应(P>0.05)。
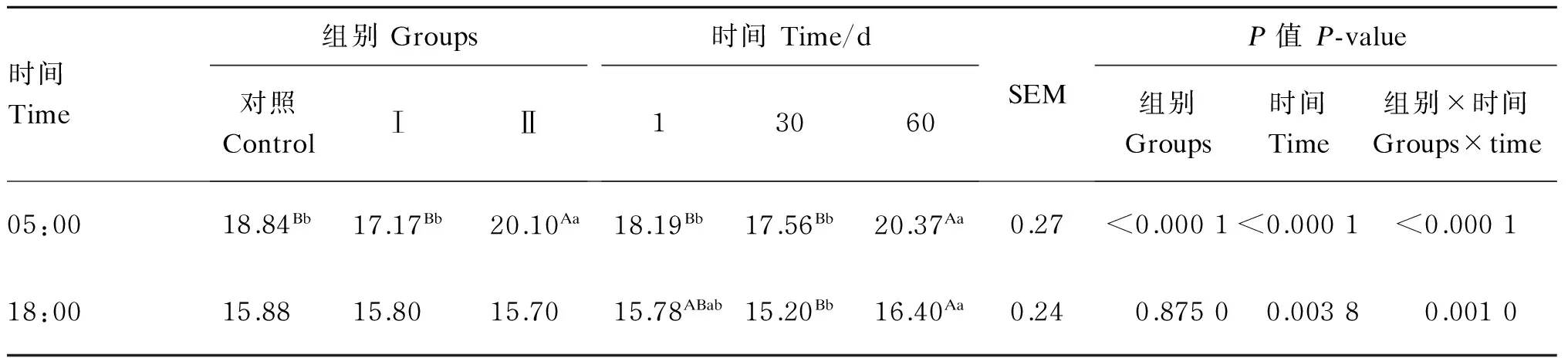
表5 添喂色氨酸、过瘤胃色氨酸对奶牛乳中褪黑素含量的影响
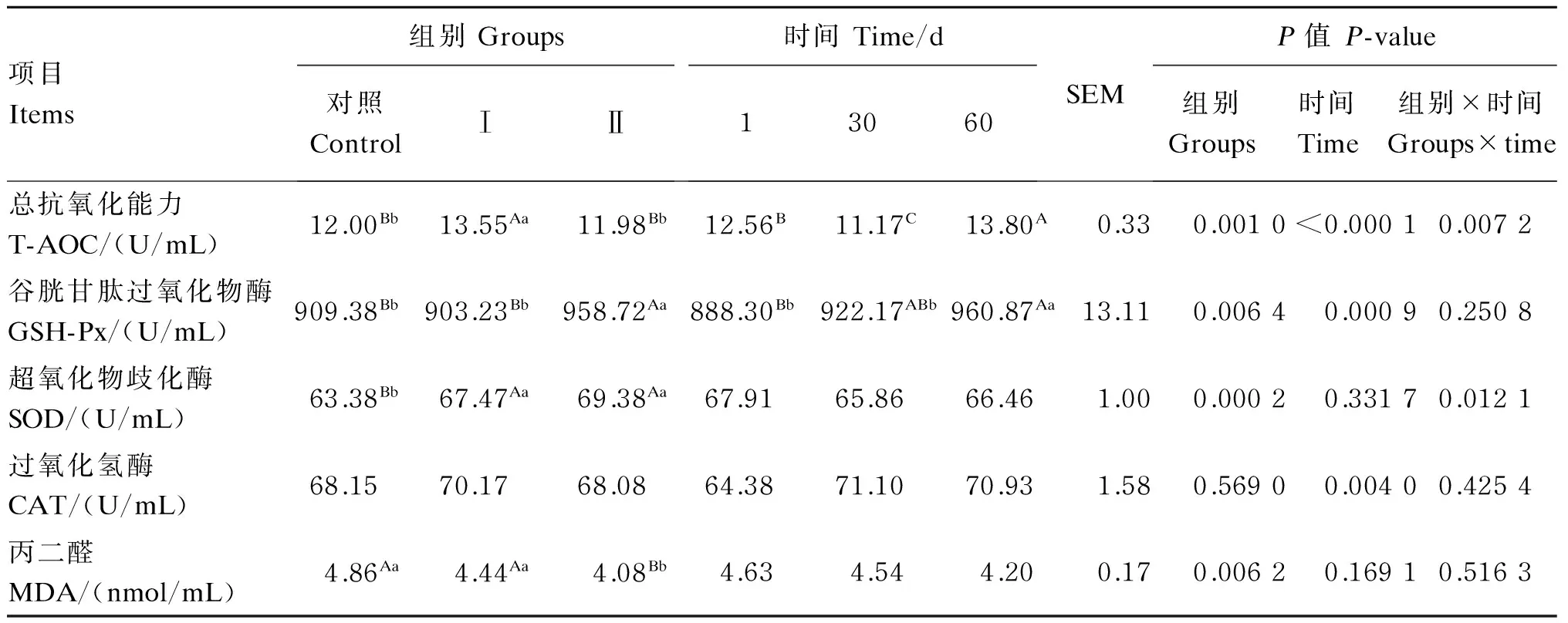
表6 添喂色氨酸、过瘤胃色氨酸对奶牛血浆抗氧化指标的影响
采样时间为22:00。
Samples were collected at 22:00.
3 讨 论
3.1添喂色氨酸、过瘤胃色氨酸对奶牛泌乳性能的影响
色氨酸作为动物体内一种功能性必需氨基酸,不但参与动物体蛋白质的合成,还是一种具有代谢活性的氨基酸,其代谢产物5-HT、褪黑素、烟酰胺腺嘌呤二核苷酸、烟酰胺腺嘌呤二核苷酸磷酸和烟酸等还参与动物的采食、生长、繁殖、泌乳和抗氧化等方面的调节[13]。刘君等[14]选用20只3月龄断奶杂交肉羊,分别添喂0、1、2和4 g/(d·头)的过瘤胃色氨酸(L-色氨酸含量33.3%),结果表明,添喂4 g/(d·头)的过瘤胃色氨酸能显著提高氮沉积和日增重,降低尿氮的排出量。Hui等[15]在给内蒙古绒山羊添喂0、2、4和6 g/(d·头)过瘤胃色氨酸后,提高了氮保留率和日增重,并显著增加了羊绒生长速度。Kollmann等[16]选取了12头泌乳瑞士褐牛,在饲粮中添喂过瘤胃色氨酸500 g/(d·头)(L-色氨酸含量25%),结果显示,在有效色氨酸补喂量为125 g/(d·头)时,显著提高了奶牛血浆色氨酸含量及产奶量。本试验在综合以上试验结果的基础上,设置的过瘤胃色氨酸添喂量为220 g/(d·头)(过瘤胃色氨酸产品中色氨酸含量按45%计),有效L-色氨酸含量为100 g/(d·头),因此,色氨酸组的补喂量也设定为100 g/(d·头)。
本试验中添喂色氨酸、过瘤胃色氨酸后产奶量分别提高了14.77%和17.19%,与前人研究结果一致。可能是由于本试验奶牛处于妊娠后期,胎儿生长发育很快,需消耗大量的营养物质,以满足胎儿生长发育的需要,所以这一时期的奶牛存在缺乏色氨酸的情况。而添喂过瘤胃色氨酸后,增加了小肠色氨酸的供应量,改善了妊娠后期奶牛色氨酸的缺乏,提高了产奶量。此外,添喂过瘤胃色氨酸可以使血液游离色氨酸含量升高,使通过血脑屏障的色氨酸增多,从而提高脑内5-HT含量,促进PRL、GH等激素的分泌,作用于乳腺组织,从而促进乳汁的分泌[17]。大量的研究表明,色氨酸的代谢产物烟酸具有提高体内烟酰胺腺嘌呤二核苷酸、烟酰胺腺嘌呤二核苷酸磷酸含量,提高瘤胃微生物蛋白的产量和促进营养物质的利用等多种生物学作用,从而提高产奶量[18]。本试验中,添喂色氨酸后产奶量也有所升高可能是因为添喂色氨酸后瘤胃内游离色氨酸增多,微生物蛋白合成量增加,增加了小肠微生物蛋白的供给,从而提高了产奶量。
本试验结果表明,添喂色氨酸、过瘤胃色氨酸对乳脂率、乳蛋白率和乳糖率无显著的影响,而乳脂产量、乳蛋白产量和乳糖产量有所增加。可能是由于动物为了维持机体自身需要会动员机体储备,因此乳中的乳脂率、乳蛋白率和乳糖率可能不受色氨酸添加量的影响。而乳脂产量、乳蛋白产量和乳糖产量的增加可能是产奶量增加的结果,并非色氨酸的作用。
乳尿素氮是评价奶牛对饲料中蛋白质利用率、蛋白质和能量摄入平衡的重要指标。Leonardi等[19]分别在2个不同蛋白质水平(16%和18%)的饲粮中添加0.07%的蛋氨酸,发现在同一蛋白质水平下添加蛋氨酸对乳尿素氮含量无显著影响。Bach等[20]的研究也表明,奶牛饲喂相同蛋白质水平而氨基酸组成不同的饲粮,乳尿素氮含量没有显著差异。本试验中,各组间乳尿素氮含量平均值为18.21 mg/dL,各组间无显著差异,与上述研究结果一致,表明在同一蛋白质水平饲粮中,添加色氨酸、过瘤胃色氨酸对奶牛乳尿素氮含量无显著影响。
3.2添喂色氨酸、过瘤胃色氨酸对奶牛血浆激素含量的影响
PRL和糖皮质激素主要发挥启动泌乳的生乳作用[21],胰岛素和GH主要在营养调控方面发挥维持泌乳的作用[22]。大量的研究表明,色氨酸可提高动物的机体PRL和GH含量。Charney等[23]研究发现,在给健康的人静脉注射色氨酸后,受试者血液PRL和GH含量显著升高。Kasuya等[17]的研究发现,对牛通过静脉注射色氨酸后,脑脊液5-HT和血浆GH含量均显著升高。本试验结果表明,添喂色氨酸、过瘤胃色氨酸可使奶牛血浆PRL和GH含量升高,与前人研究结果一致,这主要是由于色氨酸作为5-HT的前体物质,可使脑内5-HT含量上升,5-HT作为中枢神经系统一种重要的神经递质,可以作用于下丘脑和垂体促进PRL和GH的释放。此外,Kasuya等[24]的研究表明,褪黑素可以通过作用于下丘脑促进GH的分泌。色氨酸作为褪黑素的前体物质,在体内通过经过羟基化、脱羧、乙酰化和甲基化最终形成褪黑素,从而促进GH的分泌。
在正常生理条件下,FSH和LH具有协同作用,刺激卵泡的发育、成熟和排卵。本试验中,添喂色氨酸、过瘤胃色氨酸对奶牛血浆FSH和LH含量无显著影响,这可能是因为试验奶牛处于妊娠期,体内FSH和LH含量较为稳定。而有关色氨酸对动物繁殖性能的影响值得进一步研究。
3.3添喂色氨酸、过瘤胃色氨酸对奶牛血浆色氨酸、5-HT、褪黑素含量的影响
血浆游离氨基酸含量在一定程度上能够反映动物体内氨基酸的代谢情况,饲粮中的氨基酸到达动物小肠被吸收后,血浆中的游离氨基酸含量就会上升,血浆游离氨基酸含量与到达小肠的氨基酸量呈正相关,所以血浆游离氨基酸含量可以直接反映动物吸收氨基酸的量[25]。Ma等[26]的研究表明,在辽宁绒山羊饲粮中添加4 g/(d·头)过瘤胃色氨酸(L-色氨酸含量33%)可显著升高血浆色氨酸含量。Kollmann等[16]的研究表明,在给奶牛添喂500 g/(d·头)的过瘤胃色氨酸(L-色氨酸含量25%)后,显著提高了白天及夜间的血浆色氨酸含量,且夜间血浆色氨酸含量提高更为显著,呈现夜间高白天低的趋势,表现出明显的昼夜节律性。本试验中,添喂过瘤胃色氨酸后,14:00与22:00血浆色氨酸含量与对照组相比分别提高了29.58%和29.63%,与上述研究结果一致。
5-HT是一种中枢神经系统的神经递质,是由色氨酸在色氨酸羟化酶和脱羧酶的作用下在5-HT神经元合成[27]。本试验结果表明,添喂色氨酸、过瘤胃色氨酸对血浆5-HT含量无显著影响,且白天与夜间5-HT含量也没有明显的昼夜节律性。Kollmann等[16]的研究也表明,给奶牛添喂过瘤胃色氨酸,对其血浆5-HT含量没有显著影响。与本试验结果一致。这可能是由于5-HT无法通过血脑屏障,所以外周系统中的5-HT含量与脑部5-HT含量是相对独立的。大量的研究表明,提升动物的血浆色氨酸含量,可以增加脑内5-HT的合成量,从而使大脑活动受抑制,减轻动物应激,促进睡眠,有利于降低动物的维持需要,从而提高饲料转化效率[28-29]。而血浆色氨酸含量是否对血浆5-HT含量有影响,还有待进一步研究。
色氨酸作为褪黑素的前体物质,在机体内经过羟化、脱羧、乙酰化和甲基化最终形成褪黑素。Esteban等[6]研究发现,给大鼠口服色氨酸可显著提高脑内5-羟色氨酸、5-HT和血浆褪黑素含量。Kollmann等[16]研究发现,给瑞士褐牛添喂500 g/(d·头)过瘤胃色氨(L-色氨酸含量25%)酸后,夜间血浆褪黑素含量显著上升,而白天则没有变化。本试验结果表明,14:00和22:00血浆褪黑素含量变化幅度较小,这与血浆色氨酸含量无显著变化的结果一致,说明色氨酸在瘤胃内被降解,到达小肠被动物机体吸收和利用的量非常有限。添喂过瘤胃色氨酸对14:00血浆褪黑素含量没有影响,在22:00时血浆褪黑素含量与对照组相比显著升高,且具有明显的白天低夜间高的昼夜节律,与前人研究结果一致。由于色氨酸在通过血脑屏障时与血液中的酪氨酸、缬氨酸、亮氨酸和苯丙氨酸等大分子中性氨基酸(large neutral amino acids,LNAA)发生竞争性吸收,添喂过瘤胃色氨酸可以提高血浆游离色氨酸含量,提高色氨酸与LNAA比值,增加进入脑部的游离色氨酸的量,从而促进5-HT以及褪黑素的合成[30]。
3.4添喂色氨酸、过瘤胃色氨酸对奶牛乳中褪黑素含量的影响
本试验中,奶牛乳中褪黑素含量在15.70~20.10 pg/mL,且在05:00时各组间褪黑素含量均高于18:00时,与血浆褪黑素含量变化趋势相同。任皓威等[31]检测奶牛乳中褪黑素含量发现,白天为7~12 pg/mL,夜间为15~26 pg/mL,与本试验的结果相近。Castro等[32]研究光照周期对奶牛血浆和乳中褪黑素含量的影响发现,在夜间乳中褪黑素含量会随血浆褪黑素的含量升高而升高,但有时间延迟。Kollmann等[16]研究表明,给奶牛添喂过瘤胃色氨酸可提高夜间奶牛血浆和乳中褪黑素含量,但对白天血浆和乳中褪黑素含量没有显著影响。本试验中,添喂色氨酸对牛乳中褪黑素含量无显著影响,这也与其对血浆褪黑素含量无显著影响结果一致。添喂过瘤胃色氨酸对18:00时奶牛乳中褪黑素含量无显著影响,这也与其在14:00时血浆褪黑素含量无显著变化的结果一致。添喂过瘤胃色氨酸可显著提高05:00时牛乳中褪黑素含量,与22:00时血浆褪黑素含量显著升高结果一致,表明牛乳中褪黑素的含量与血浆褪黑素含量呈正相关。本试验结果表明添喂过瘤胃色氨酸可以提高血浆褪黑素含量从而提高牛乳中褪黑素含量,且乳中褪黑素含量会随血浆褪黑素含量的变化而变化,具有相似的昼夜节律。
3.5添喂色氨酸、过瘤胃色氨酸对奶牛血浆抗氧化指标的影响
本试验中,添喂过瘤胃色氨酸使血浆GSH-Px和SOD活性显著增加,MDA含量显著降低。魏宗友等[33]研究表明,随着饲粮中色氨酸含量的升高,扬州鹅血清中SOD活性和T-AOC显著增加。马玉娥等[34]研究发现,在饲粮中添加0.18%的色氨酸,黄羽肉鸡血清中SOD活性、谷胱甘肽(GSH)含量和GSH-Px活性显著升高。与本试验研究结果一致。由于色氨酸分子结构中的氨基可与氧化剂结合,阻碍氧化反应的发生,从而降低血清中MDA的含量,提高机体的抗氧化能力[35]。此外色氨酸在体内可以合成褪黑素,Ozturk等[36]研究表明,给小鼠注射褪黑素10 mg/d,7 d后SOD活性显著升高。Özturk等[37]研究发现,褪黑素可以改善小鼠由中毒性肝炎引发的GSH-Px活性和GSH含量下降。本试验结果表明,添喂过瘤胃色氨酸可以提高夜间血浆褪黑素含量,提高机体的抗氧化能力。
4 结 论
① 添喂色氨酸[100 g/(d·头)]、过瘤胃色氨酸[220 g/(d·头)]能够提高泌乳期奶牛血浆GH含量、产奶量及抗氧化能力,其中以添喂过瘤胃色氨酸效果较好。
② 添喂过瘤胃色氨酸[220 g/(d·头)]可提高血浆色氨酸含量及夜间血浆褪黑素含量,从而提高夜间奶牛乳中褪黑素含量。
[1] PÉVET P,BOTHOREL B,SLOTTEN H,et al.The chronobiotic properties of melatonin[J].Cell and Tissue Research,2002,309(1):183-191.
[2] JAN J E,REITER R J,WASDELL M B,et al.The role of the thalamus in sleep,pineal melatonin production,and circadian rhythm sleep disorders[J].Journal of Pineal Research,2009,46(1):1-7.
[3] REITER R J,TAN D X,FUENTES-BROTO L.Melatonin:a multitasking molecule[J].Progress in Brain Research,2010,181(6):127-151.
[4] 张微,赵广永,张晓明,等.天然高褪黑素牛奶生产技术[J].动物营养学报,2016,28(3):635-640.
[5] 白苗苗,刘红南,吴信,等.饲粮中色氨酸对畜禽的免疫调节作用[J].动物营养学报,2016,28(2):361-368.
[6] ESTEBAN S,NICOLAUS C,GARMUNDI A,et al.Effect of orally administeredL-tryptophan on serotonin,melatonin,and the innate immune response in the rat[J].Molecular and Cellular Biochemistry,2004,267(1):39-46.
[7] ERIKSSON L,VALTONEN M,LAITINEN J T,et al.Diurnal rhythm of melatonin in bovine milk:pharmacokinetics of exogenous melatonin in lactating cows and goats[J].Acta Veterinaria Scandinavica,1998,39(3):301-310.
[8] ONODERA R.Methionine and lysine metabolism in the rumen and the possible effects of their metabolites on the nutrition and physiology of ruminants[J].Amino Acids,1993,5(2):217-232.
[9] 孔凡德,刘建新,吴跃明.瘤胃保护性氨基酸及其对奶牛生产性能的影响[J].中国奶牛,2001(1):30-32.
[10] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007:48-93.
[11] 傅启高,雒秋江.用邻-甲酚酞比色法测定饲料中钙含量的研究[J].动物营养学报,1996,8(3):25-30.
[12] 谢占武,邓上奇,刘瑞凝,等.健康牛、羊血清及牛奶中游离色氨酸的微量测定[J].中国预防兽医学报,1991(6):27-30.
[13] 李华伟,祝倩,吴灵英,等.色氨酸的生理功能及其在畜禽饲粮中的应用[J].动物营养学报,2016,28(3):659-664.
[14] 刘君,耿忠诚,马慧,等.瘤胃保护性色氨酸对肉羊氮代谢及生长性能的影响[J].饲料与畜牧:新饲料,2010,46(1):18-21.
[15] HUI M,WEI Z,ZHU X P,et al.Effects of rumen-protected tryptophan on growth performance,fibre characteristics,nutrient utilization and plasma essential amino acids in Cashmere goats during the cashmere slow growth period[J].Livestock Science,2010,131(2/3):227-233.
[16] KOLLMANN M T,LOCHER M,HIRCHE F,et al.Effects of tryptophan supplementation on plasma tryptophan and related hormone levels in heifers and dairy cows[J].Domestic Animal Endocrinology,2008,34(1):14-24.
[17] KASUYA E,YAYOU K,HASHIZUME T,et al.A possible role of central serotonin inL-tryptophan-induced GH secretion in cattle[J].Animal Science Journal,2010,81(3):345-351.
[18] 吴妙宗,蔡辉益.动物色氨酸与烟酸互作关系研究进展[J].动物营养学报,2002,14(2):5-8.
[19] LEONARDI C,STEVENSON M,ARMENTANO L E.Effect of two levels of crude protein and methionine supplementation on performance of dairy cows[J].Journal of Dairy Science,2003,86(12):4033-4042.
[20] BACH A,STERN M D.Measuring resistance to ruminal degradation and bioavailability of ruminally protected methionine[J].Animal Feed Science and Technology,2000,84(1/2):23-32.
[21] RHOADS M L,MEYER J P,KOLATH S J,et al.Growth hormone receptor,insulin-like growth factor (IGF)-1,and IGF-binding protein-2 expression in the reproductive tissues of early postpartum dairy cows[J].Journal of Dairy Science,2008,91(5):1802-1813.
[22] FORSYTH I A,WALLIS M.Growth Hormone and prolactin molecular and functional evolution[J].Journal of Mammary Gland Biology and Neoplasia,2002,7(3):291-312.
[23] CHARNEY D S,HENINGER G R,REINHARD R F,Jr,et al.The effect of intravenousL-tryptophan on prolactin and growth hormone and mood in healthy subjects[J].Psychopharmacology,1982,77(3):217-222.
[24] KASUYA E,KUSHIBIKI S,SUTOH M,et al.Effect of melatonin injected into the third ventricle on growth hormone secretion in Holstein steers[J].Journal of Veterinary Medical Science,2006,68(10):1075-1080.
[25] GIBB D J,KLOPFENSTEIN T J,BRITTON R A,et al.Plasma amino acid response to graded levels of escape protein[J].Journal of Animal Science,1992,70(9):2885-2892.
[26] MA H,CHENG J,ZHU X,et al.Effects of rumen-protected tryptophan on performance,nutrient utilization and plasma tryptophan in cashmeregoats[J].African Journal of Biotechnology,2011,10(30):5806-5811.
[27] CHAN J S,SNOEREN E M,CUPPEN E,et al.The serotonin transporter plays an important role in male sexual behavior:a study in serotonin transporter knockout rats[J].Journal of Sexual Medicine,2011,8(1):97-108.
[28] SARWAR G,BOTTING H G.Liquid concentrates are lower in bioavailable tryptophan than powdered infant formulas,and tryptophan supplementation of formulas increases brain tryptophan and serotonin in rats[J].Journal of Nutrition,1999,129(9):1692-1697.
[29] MONTI J M,JANTOS H.The roles of dopamine and serotonin,and of their receptors,in regulating sleep and waking[J].Progress in Brain Research,2008,172:625-646.
[30] SHEN Y B,COFFEY M T,KIM S W.Effects of short term supplementation ofL-tryptophan and reducing large neutral amino acid along withL-tryptophan supplementation on growth and stress response in pigs[J].Animal Feed Science and Technology,2015,207:245-252.
[31] 任皓威,王丹,刘鹏,等.光照调整对于牛乳中褪黑素质量浓度的影响及其检测[J].中国乳品工业,2011,39(4):55-57.
[32] CASTRO N,SPENGLER M,VANESSA L,et al.Diurnal pattern of melatonin in blood and milk of dairy cows[J].Milchwissenschaft-Milk Science International,2011,6(4):352-353.
[33] 魏宗友,王洪荣,潘晓花,等.饲喂方式和饲粮色氨酸水平对扬州鹅免疫功能及抗氧化指标的影响[J].动物营养学报,2012,24(12):2356-2365.
[34] 马玉娥,占秀安,朱巧明,等.饲粮色氨酸水平对黄羽肉种鸡生产性能、抗氧化功能及血清生化指标的影响[J].动物营养学报,2011,23(12):2177-2182.
[36] ÖZTURK G,COKUN S,ERBAD,et al.The effect of melatonin on liver superoxide dismutase activity,serum nitrate and thyroid hormone levels[J].The Japanese Journal of Physiology,2000,50(1):149-153.
[37] PASHKOV A N,POPOV S S,SEMENIKHINA A V,et al.Glutathione system and activity of NADPH-generating enzymes in the liver of intact rats and animals with toxic hepatitis receiving melatonin[J].Bulletin of Experimental Biology and Medicine,2005,139(5):565-568.
*Corresponding author, professor, E-mail: yangkailun2002@aliyun.com
EffectsofTryptophanandRumen-ProtectedTryptophanSupplementationsonLactationPerformance,PlasmaIndexesandMilkMelatoninContentofDairyCows
CHEN Junhong1ZHAO Fang1WEI Kaimin1TAN Shixin2YANG Kailun1*
(1.XinjiangKeyLaboratoryofMeat&MilkProductionHerbivoreNutrition,CollegeofAnimalScience,XinjiangAgriculturalUniversity,Urumqi830052,China; 2.XinjiangTianshanAnimalHusbandryBio-EngineeringCo.,Ltd.,Changji831100,China)
This study was conducted to investigate the effects of tryptophan (Trp) and rumen-protected tryptophan (RPTrp) supplementations in diet on lactation performance, plasma indexes and milk melatonin (MLT) content of dairy cows. Thirty healthy Holstein dairy cows at 3 to 5 years of age, 2 to 3 parities, (180±46) d of lactation days were selected and randomly divided into 3 groups, which were control group, trial groups Ⅰ and Ⅱ. Cows in control group was fed a total mixed ration (TMR), and trial groups Ⅰ and Ⅱ were supplemented with 100 g/(d·head) Trp and 220 g/(d·head) RPTrp [L-tryptophan content was over 45%] based on control group, respectively. The pre-trial lasted for 7 days, and the trial lasted for 60 days. The results showed as follows: 1) Compared with control group, milk yield in trial groups Ⅰ and Ⅱ was increased by 11.78% (P<0.05) and 17.19% (P<0.01), respectively; lactose yield in trial groups Ⅰ and Ⅱ was significantly increased (P<0.01). 2) Compared with control group, plasma growth hormone (GH) content at 14:00 and 22:00 in trial groups Ⅰ and Ⅱ was significantly increased(P<0.01); at 14:00, plasma Trp content in trial group Ⅱ was significantly increased (P<0.01), but there was no significantly difference of plasma MLT content among groups (P>0.05); at 22:00, plasma Trp (P<0.01) and MLT contents (P<0.05) in trial group Ⅱ were significantly increased; in trial group Ⅰ, plasma Trp, 5-hydroxytryptamine (5-HT) and MLT contents were not significantly changed both at 14:00 and 22:00 (P>0.05). 3) Compared with control group, at 05:00, milk MLT content in trial group Ⅱ was significantly increased (P<0.01); at 18:00, there was no significant difference of milk MLT content among groups (P>0.05). 4) Compared with control group, plasma total antioxidant capacity (T-AOC) in trial group Ⅰ was significantly increased(P<0.05); plasma glutathione peroxidase (GSH-Px) activity in trial group Ⅱ was significantly increased(P<0.01); plasma superoxide dismutase (SOD) activity in trial groups Ⅰ and Ⅱ was significantly increased (P<0.01); plasma malondialdehyde (MDA) in trial group Ⅱ was significantly reduced (P<0.01). In conclusion, supplementation of Trp [100 g/(d·head)] and RPTrp [220 g/(d·head),] increases milk yield, plasma GH content and antioxidant capacity of Holstein dairy cows, and RPTrp shows better effect; supplement of RPTrp [220 g/(d·head)] elevated plasma Trp content and plasma MLT contents at night of dairy cows, and hence increase MLT content in milk at the night.[ChineseJournalofAnimalNutrition,2017,29(11):3921-3931]
tryptophan; rumen-protected tryptophan; dairy cow; lactation performance; melatonin
10.3969/j.issn.1006-267x.2017.11.012
S823
A
1006-267X(2017)11-3921-11
2017-05-03
新疆维吾尔自治区“十三五”重点学科
陈俊宏(1991—),男,甘肃张掖人,硕士研究生,研究方向为草食动物营养代谢。E-mail: 63793760@qq.com
*通信作者:杨开伦,教授,博士生导师,E-mail: yangkailun2002@aliyun.com
(责任编辑 王智航)

