菲对秀丽隐杆线虫、中杆属和拟丽突属线虫毒性效应研究①
张言诚,石金礼,曾四满,张 振,李伟明,李辉信,胡 锋,徐 莉
(南京农业大学资源与环境科学学院,南京 210095)
菲对秀丽隐杆线虫、中杆属和拟丽突属线虫毒性效应研究①
张言诚,石金礼,曾四满,张 振,李伟明,李辉信,胡 锋,徐 莉*
(南京农业大学资源与环境科学学院,南京 210095)
采用悉生培养系统,研究不同浓度菲对秀丽隐杆线虫、拟丽突属与中杆属线虫的毒性效应,以及3种线虫对菲的去除作用。结果表明:①随着菲浓度的增加,3种线虫存活率逐渐降低。秀丽隐杆线虫在不添加菲的处理中,48 h内出现繁殖,而在添加菲的处理中,即使在最低浓度5 mg/L下,繁殖现象也会消失。中杆属与拟丽突属线虫由于世代时间较长,在本试验周期内均未出现繁殖现象。②暴露24 h时,比较不同浓度菲处理下线虫的相对死亡率,得到3种线虫的耐性依次为中杆属线虫≥秀丽隐杆线虫≥拟丽突属线虫,且随菲浓度的增加,秀丽隐杆线虫耐性水平逐渐降低;暴露48 h时中杆属线虫耐性依旧高于拟丽突属,而72 h时中杆属与拟丽突属线虫的耐性趋于一致。③3种线虫受菲胁迫后均失去头部正常摆动能力,且秀丽隐杆线虫与拟丽突属线虫体长随菲浓度的增加而逐渐降低。④不同种类线虫的添加均能促进菲的去除,不同线虫之间无显著差异。因此,菲会显著抑制3种线虫的存活率和生长发育,抑制秀丽隐杆线虫的繁殖。线虫的存活率受线虫种类、暴露时间、菲浓度及其交互作用的影响显著,其中中杆属线虫对菲的综合耐性最强,3种线虫均能促进溶液中菲的去除。
菲;秀丽隐杆线虫;中杆属;拟丽突属;生物毒性
多环芳烃(polycyclic aromatic hydrocarbons,简称PAHs),是指由两个或两个以上苯环以线状、角状或簇状排列的稠环化合物[1],是一类广泛存在于环境中具有致癌、致畸、致突变性的持久性有机污染物。PAHs大多来源于物质的不完全燃烧、汽车尾气、化工厂排放等[2-4]。菲是典型的三环PAHs,其分布广泛,甚至在我国西藏冰川中也有检出[5],此外,它具有较高的水溶性及生物可利用性,因此研究菲的生物毒性效应具有重要的科学意义[6]。
线虫是土壤中数量最多、种类最丰富的多细胞动物,线虫群落结构对不同土壤耕作方式、耕作年限等干扰具有重要的响应与指示意义[7-8],也是土壤污染的重要指示生物[9-10]。目前研究最多的是秀丽隐杆线虫(Caenorhabditis elegans),它的基因组已经完全被测定,由于其某些生化途径与人类相似[11],常被作为分子生物学与发育生物学研究的模式线虫,也被用于评价污染物的毒性效应[12-14]。而目前,学者对于其他种类线虫,特别是土著线虫在污染条件下的毒性效应研究较少。
Bongers 和Bongers[15]将土著线虫根据其不同的生活史对策划分为5类,分别以cp(colonizerspersisters)-(1-5)来表示,随着cp值的增加,线虫的世代时间增加、繁殖率降低、对环境胁迫的耐受性降低,线虫的生活史对策出现由r对策到K对策的转变。Louati等[9]研究表明,土壤中添加PAHs后,Oncholaimus campylocercoides与Neochromadora peocilosoma两种线虫丰度明显下降,而Spirinia parasitifera丰度增加成为优势种,可见不同土著线虫对污染物的耐性不同。因此,本试验通过构建悉生培养系统,以两种常见土著线虫,分别是cp值为1的中杆属与cp值为2的拟丽突属线虫为受体,并以模式线虫——秀丽隐杆线虫作为比较,探究不同线虫对不同浓度菲的毒性响应特征。
除PAHs对线虫的毒性效应研究外,一些研究发现线虫有助于环境中PAHs污染物的去除。井永苹等[16]发现添加食细菌线虫,可以强化土壤菲降解菌的数量和活性,从而促进土壤菲的去除。此外,研究表明线虫可以影响土壤养分循环,促进植物生长,改变土壤微生物群落,间接强化对PAHs的去除[17]。然而对于线虫能否直接参与PAHs的去除,还少有研究涉及。为此,本文还将探讨不同食细菌线虫对菲的去除效果。
1 材料与方法
1.1 试验药剂
PAHs:菲购自德国Fluka公司,纯度≥97%。
溶液与培养基:线虫培养基(NGM):3 g NaCl,2.5 g蛋白胨,17 g琼脂,25 ml 1 mol/L K2HPO4-KH2PO4缓冲液(pH 6.0),975 ml蒸馏水,灭菌后加入分别抽滤除菌的1 ml胆固醇(5 mg/ml溶于乙醇),1 ml MgSO4(1 mol/L)以及1 ml CaCl2(1 mol/L)。LB培养基:10.0 g蛋白胨,5.0 g酵母浸出物,5.0 g NaCl 加蒸馏水至1 L,调节pH至7.5后灭菌。K溶液(K-medium):3 g NaCl,2.36 g KCL加蒸馏水至1 L,灭菌。M9缓冲液(M9-buffer):6 g Na2HPO4,3 g KH2PO4,5 g NaCl,0.25 g MgSO4,加蒸馏水至1 L后灭菌。裂解液(bleaching mixture):1 ml 0.45 mol/L NaOH,1 ml 2% NaClO,加7 ml无菌水,混匀。化学药剂均购自南京寿德试验材料有限公司,均为分析纯。
1.2 试验动物
受试线虫:秀丽隐杆线虫,中杆属、拟丽突属线虫。其中中杆属与拟丽突属两种线虫筛选自清洁土壤,经纯化除菌后进行世代培养,繁殖周期分别约为7 d与10 d,而寿命分别约为35 d与80 d。秀丽隐杆线虫购自国际线虫中心(CGC),繁殖周期约为3.5 d,寿命约为30 d。这3种线虫均在本实验室完成多世代培养,线虫世代过程中均未接触过污染源。
1.3 试验方法
1.3.1 线虫同步化培养 3种线虫均在在表面涂有Escherichia coli OP50(大肠杆菌)菌液的NGM线虫培养基富集培养。20 ℃培养72 h后,用M9缓冲液将3种含大量孕期成虫的线虫冲洗至1.5 ml尖角离心管中,3 000 r/min离心3 min,若上层液体浑浊,则弃去上层液体,重新加入1 ml M9充分混匀并离心,直至上层液清澈,弃去上清液后,加入1 ml裂解液并不断颠倒离心管10 min,使线虫与裂解液充分接触,成虫虫体裂开,卵分离出。随后3 000 r/min离心1 min,弃去裂解液并重新加入1 ml M9缓冲液充分混匀后离心,弃去上层液,重复5次。将最后一次混匀后的线虫放入20 ℃培养箱培养12 h,此时线虫缺乏食物会进入Dauer幼虫阶段,且停止老化。随后将线虫接入NGM平板内,在20 ℃生长36 h,获得同步化线虫。
1.3.2 毒性效应测试 将1.3.1中同步化后的线虫进行毒性效应测试,选择秀丽隐杆线虫(C)、中杆属线虫(M)、拟丽突属线虫(A),设计0、5、10、20、30 mg/L 5个菲浓度处理,每个处理4个重复。
构建悉生培养体系,控制细胞培养板内为无菌环境,除添加线虫与大肠杆菌外,不存在其他生物。于12孔细胞培养板中,每孔加入3 ml的K溶液,同龄成虫20条,并添加10 μl OD值为0.1的大肠杆菌防止饥饿效应。将菲溶于丙酮,设置浓度为500、1 000、2 000、3 000 mg/L的菲储存溶液,后吸取30 μl加至孔中,使孔中菲的最终浓度分别为5、10、20、30 mg/L,并各加15 μl丙酮助溶。同时设置不添加丙酮的对照组CK,和仅添加丙酮的0 mg/L处理,以明确丙酮对线虫的毒性效应。在暴露0、24、48、72 h时记录各孔线虫存活数目,以对针尖刺激有反应为准,评价菲对线虫致死效应。记录20 s内线虫身体扭动频率,计数时微微晃动培养板,以线虫头部回到最左(右)为一个扭动周期。在暴露72 h时记录活体线虫的体长,作为菲对线虫亚致死效应。
1.3.3 线虫对菲去除的影响 选取上述毒性效应测试中5、10、20、30 mg/L 4个菲浓度下不同线虫培养72 h后的培养液,取1 ml与1 ml超声后的甲醇充分混合,过0.22 μm滤膜后进高效液相色谱仪检测菲含量变化。
液相色谱分析条件:Agilent-1200 高效液相色谱仪,Φ4.5mm×250 mm C18反向色谱柱(Waters PAH专用柱),柱温30 ℃,检测波长254 nm,流速1 ml/min,流动相为甲醇,样品进样量为10 μl。
1.4 数据处理
本研究试验数据均采用Microsoft Excel 2003 和SPSS 20.0软件进行统计分析,结果表示为平均值±标准差,采用单因子方差分析法进行统计处理(one-way ANOVA),Duncan 检验P<0.05表示差异显著;采用Pearson相关性分析线虫存活数与菲浓度的相关性(P < 0.05);采用多因素方差分析线虫种类、暴露时间、菲浓度以及它们的交互作用对线虫存活率的影响;运用Origin软件绘图。
2 结果与分析
2.1 不同浓度菲对线虫存活率的影响
由表1可看出,秀丽隐杆线虫在不添加菲的处理中,48 h内出现繁殖,而在添加菲处理后,即使在最低试验浓度下(5 mg/L),繁殖现象消失,说明菲能够显著抑制秀丽隐杆线虫的繁殖。而中杆属与拟丽突属线虫在试验周期内未见繁殖现象,这与它们的世代时间在7 ~ 10 d有关。
菲处理24 h与48 h后,在0 mg/L处理中,中杆属线虫存活率显著低于拟丽突属,而菲胁迫后,中杆属线虫存活率显著高于拟丽突属(P<0.05),说明在暴露24 h与48 h后,中杆属线虫对菲的耐性更强;暴露72 h后,中杆属与拟丽突属线虫存活率趋于一致。
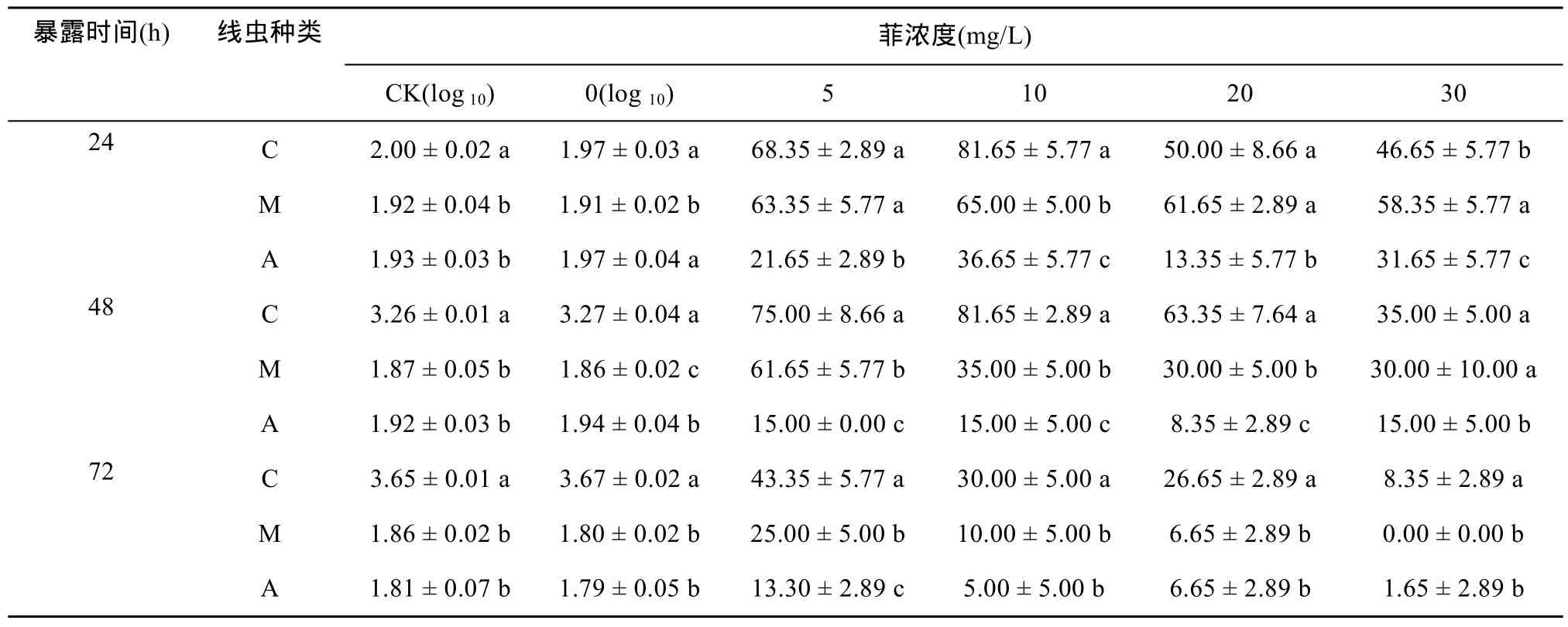
表1 不同暴露时间与菲浓度处理下3种线虫的存活率(%)Table 1 Survival rates of three nematodes under different phenanthrene treatments at different exposure time (%)
由于秀丽隐杆线虫在24 h后48 h内出现繁殖,为了便于比较,本文计算了不同线虫在处理24 h时的相对死亡率来表征不同线虫对菲的耐性,如图1所示。结果显示,当菲浓度为5 mg/L与10 mg/L 时,3种线虫对菲的耐性依次为M≈C>A;当菲浓度为20 mg/L时,为M>C>A;当菲浓度为30 mg/L时,为M>C≈A。可见,暴露各浓度菲处理下24 h后,中杆属线虫对菲的耐性最强,拟丽突属线虫对菲的耐性最弱,且秀丽隐杆线虫对菲的耐性水平随菲浓度的增加明显降低。
由表2可知,经过多因素方差分析,得到线虫的存活率与暴露时间、菲浓度以及线虫种类均在P<0.01水平具有显著的相关性,且不同因素对线虫存活率均在P<0.01水平具有显著的交互作用。
2.2 不同浓度菲对线虫体长和行为的影响
由图2可知,在CK与0 mg/L两个未添加菲的处理中,每种线虫的体长均未出现显著性差异,说明添加丙酮对3种线虫体长发育没有影响。
当菲浓度达到5 mg/L后,秀丽隐杆线虫、中杆属线虫、拟丽突属线虫体长分别降低20.9%、15.2%与11.8%。除中杆属线虫体长在20 mg/L菲处理时高于10 mg/L菲处理外,其余两种线虫体长均随着菲浓度的增加而逐渐降低。将线虫体长与菲浓度进行相关性分析可知,秀丽隐杆线虫与拟丽突属线虫体长随菲浓度的增加而逐渐降低(P<0.01),中杆属线虫体长与菲浓度无显著相关性(P>0.05)。
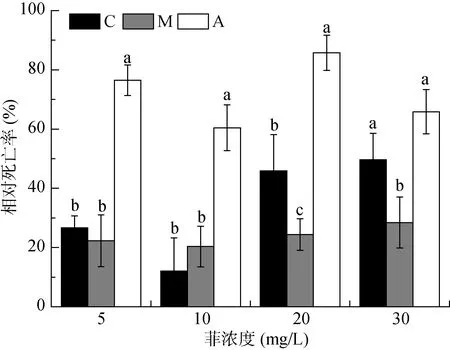
图1 处理24 h时不同菲浓度下线虫的相对死亡率Fig. 1 Relative mortalities of nematodes under different phenanthrene treatments after 24 h exposure

表2 线虫种类、暴露时间、菲浓度以及其交互作用对线虫存活率的影响Table 2 Influences of nematode species, exposure time, phenanthrene concentrations and their interactions on survival rates of nematodes
此外,3种线虫在未添加菲的处理中,直到处理72 h时都保持身体正常扭动,在添加菲的处理中,从24 h开始,绝大多数存活线虫只有头部微微颤动或身体间歇性弯曲,失去标准的扭动能力,说明菲的添加可显著抑制线虫的身体扭动行为。
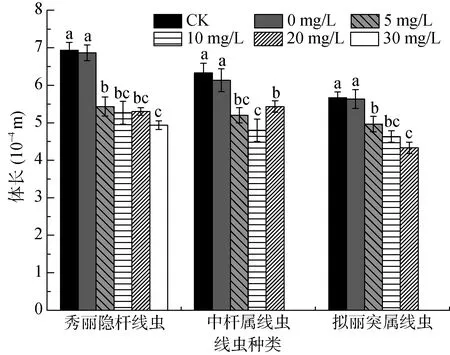
图2 处理72 h时菲对3种线虫体长的影响Fig. 2 Body lengths of three nematodes under different phenanthrene treatments after 72h exposure
2.3 不同线虫对菲浓度的影响
菲处理72 h后,CK处理中菲浓度略有降低,说明菲存在自然降解的过程。添加3种线虫的处理中,菲的浓度均低于对照组CK,说明食细菌线虫的添加能显著降低溶液中菲含量,且3种线虫对菲的去除效果无显著差异(图3)。经相关性分析,得到3种线虫存活率与其对菲的去除作用均无显著相关性(P>0.05)。图3还显示,线虫种类、菲处理浓度以及其交互作用对菲的去除率均无显著影响(P>0.05)。
3 讨论
本研究结果发现,随着菲浓度的增加,3种线虫存活率均逐渐降低,具有明显的浓度相关性。Daresta等[18]研究发现,秀丽隐杆线虫存活率随PAHs混合污染浓度的增加而下降,与本试验研究结果一致;Sese等[12]研究发现,当添加菲浓度为8 mg/L时,秀丽隐杆线虫繁殖现象基本消失,本试验也发现最低菲胁迫浓度5 mg/L时可完全阻止秀丽隐杆线虫的繁殖行为,与前人研究结果相近;同时,王赢利等[19]研究发现,高浓度十溴联苯(30 mg/kg)会显著抑制秀丽隐杆线虫的繁殖和生殖能力,并发现了线虫生殖部位的细胞凋亡现象,而本研究中菲对秀丽隐杆线虫的繁殖抑制也可能是线虫生殖部位的细胞受到破坏。
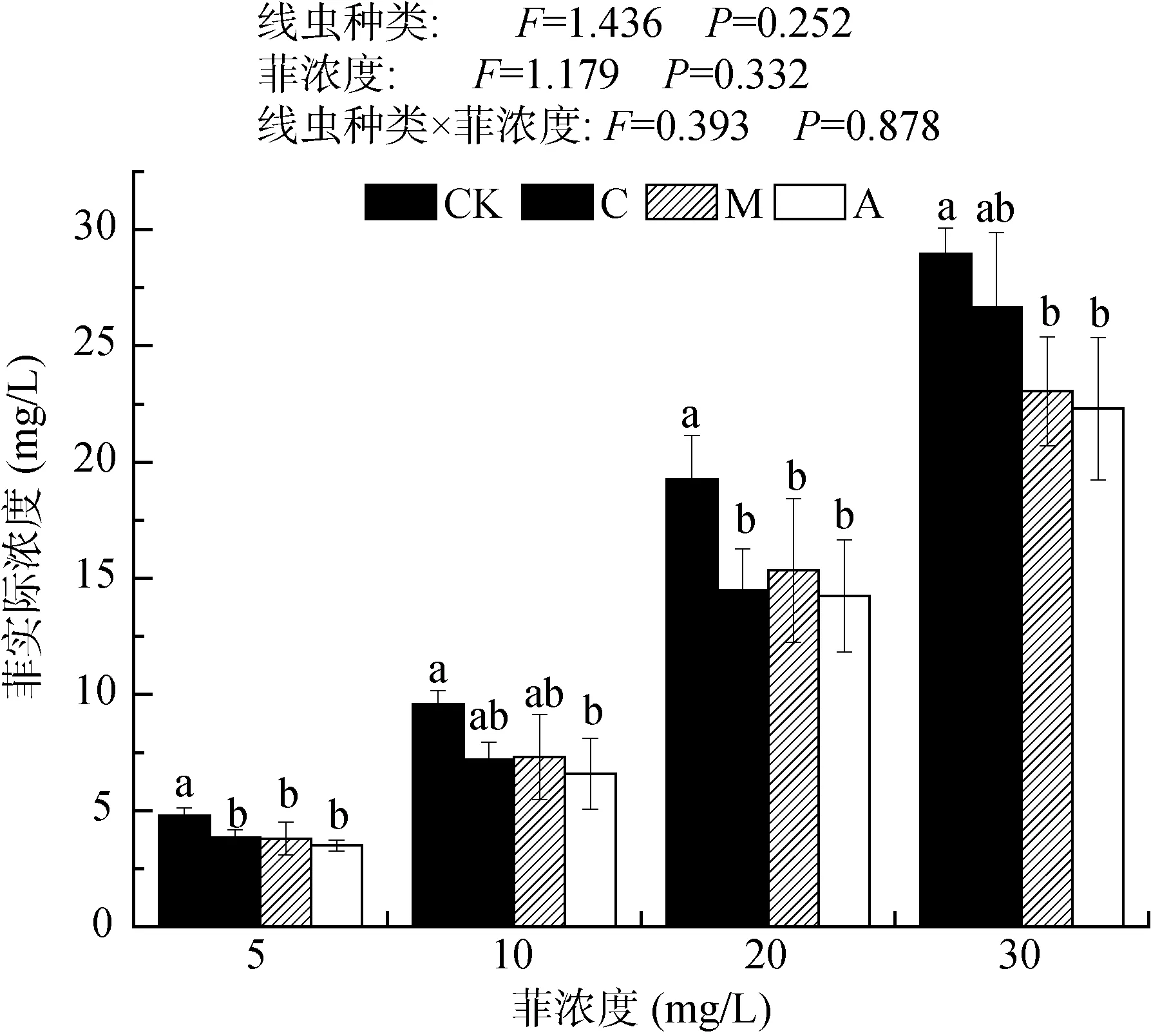
图3 处理72 h时不同线虫体系下菲的浓度变化Fig. 3 Phenanthrene concentrations under different nematode treatments after 72h exposure
本研究中除中杆属线虫外,秀丽隐杆线虫与拟丽突属线虫体长均与菲浓度显著相关。田慧敏等[20]的研究也发现,随着苯并[a]芘(Benzo(a)pyrene,BaP)浓度的增加,秀丽隐杆线虫虫体发育迟缓数越多,发育迟缓程度也越严重;另外,利用线虫运动轨迹研究,发现BaP能够显著抑制秀丽隐杆线虫的正常行为。本试验也发现菲胁迫下3种线虫的正常头部扭动受到显著抑制,这可能与菲具有体外神经毒性[21],能够导致神经元与肌肉细胞不能正常结合有关[22]。
3种线虫对菲的耐性受到暴露时间、菲浓度以及它们交互作用的显著影响。研究结果发现中杆属线虫的耐性显著高于与拟丽突属线虫,两者在处理72 h时耐性趋于一致,这与拟丽突属线虫的cp值为2,而中杆属线虫cp值为1有关,因为高cp值的线虫,在生活史对策上趋向于K对策,即繁殖世代长、繁殖率低、对环境胁迫更加敏感[23-24]。为去除秀丽隐杆线虫在48 h内繁殖的影响,对比处理24 h时各浓度菲胁迫下3种线虫的相对死亡率可知,中杆属线虫对菲的耐性最强,拟丽突属线虫最差,也是与中杆属线虫cp值较低,抗胁迫性较高有关。秀丽隐杆线虫对菲的耐性在低浓度菲(5、10 mg/L)胁迫下,与中杆属线虫相当,在高浓度菲(30 mg/L)处理下,与拟丽突属线虫一致,说明秀丽隐杆线虫的耐性对菲浓度的变化最为敏感。因此利用秀丽隐杆线虫作为土壤健康指示生物,评价土壤PAHs污染状况具有明显的应用优势[12,18]。
Zhou等[25-27]发现土壤中包括线虫在内的一些小型动物群,对土壤中有机污染物有一定的吸收与富集作用,能促进土壤中有机污染物的去除。食细菌线虫也被发现有促进PAHs消减的作用,但多是有关间接机制的报道,比如促进土壤微生物活性,促进植物生长,从而促进修复。本试验采用悉生培养系统,利用水溶液培养,将线虫与菲直接接触,且排除菲降解菌等因素的干扰,结果显示,各个菲浓度处理下,3种线虫的存在均可显著促进溶液中菲含量的降低,说明线虫可能存在对菲的直接去除作用。其中机制可能是线虫容易吸收积累菲于体内,降低了溶液中菲的浓度[28];也可能是线虫可以分泌某些降解酶类,从而代谢菲,使其含量降低[29]。不同线虫对菲的去除效果与线虫种类、菲处理浓度以及其间的交互作用均无显著相关性,且与3种线虫存活率无显著相关性。而线虫对污染物的去除究竟是线虫活体(残体)对菲的吸收积累,还是线虫自身及其分泌物对菲的代谢,其具体途径与效果,还需要进一步研究。
4 结论
菲会显著抑制秀丽隐杆线虫、中杆属线虫与拟丽突属线虫的存活率和生长发育,并抑制秀丽隐杆线虫的繁殖。线虫的存活率受线虫种类、暴露时间、菲浓度及其交互作用的影响显著,其中中杆属线虫对菲的综合耐性最强,秀丽隐杆线虫的耐性对菲浓度的变化最为敏感。3种线虫均能不同程度地降低溶液中菲的浓度。
[1] 王连生. 有机污染物化学[M]. 北京: 高等教育出版社,2004
[2] Amodio M, Caselli M, de Gennaro G, et al. Particulate PAHs in two urban areas of southern Italy: Impact of the sources, meteorological and background conditions on air quality[J]. Environment Research, 2009, 109(7): 812-820
[3] Amodio M, Andriani E, Caselli M, et al. Characterization of particulate matter in the Apulia Region (south of Italy):Features and critical episodes[J]. Journal of Atmospheric Chemistry, 2010, 63(3): 203-220
[4] Augusto S, Maguas C, Matos J, et al. Lichens as an integrating tool for monitoring PAH atmospheric deposition: A comparison with soil, air and pine needles[J].Environmental Pollutant, 2010, 158(2): 483-489
[5] Li Q L, Wang N L,Wu X B, et al. Source and distribution of polycyclic aromatic hydrocarbons of different glaciers over the Tibetan Plateau[J]. Science China-Earth Sciences,2011, 54(8): 1189-1198
[6] Gottfried A, Singhal N, Elliot R, et al. The role of salicylate and biosurfactant in inducing phenanthrene degradation in batch soil slurries[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1563-1571
[7] 毛妙, 王磊, 席运官, 等. 有机种植业土壤线虫群落特征的调查研究[J]. 土壤, 2016, 48(3): 492-502
[8] 王明伟, 刘雨迪, 陈小云, 等. 旱地红壤线虫群落对不同耕作年限的响应及指示意义[J]. 土壤学报, 2016, 53(2):510-522
[9] Louati H, Ben Said O, Soltani A, et al. Responses of a free-living benthic marine nematode community to bioremediation of PAH mixture[J]. Environmental Science and Pollution Research, 2015, 22(20): 15307-15318
[10] Moreno M, Vezzulli L, Marin V, et al. The use of meiofauna diversity as an indicator of pollution in harbours[J]. Ices Journal of Marine Science, 2008, 65(8):1428-1435
[11] Tejeda-Benitez L, Olivero-Verbel J. Caenorhabditis elegans, a biological model for research in toxicology[J].Reviews of Environmental Contamination and Toxicology,2016, 237: 1-35
[12] Sese B T, Grant A R, Reid B J. Toxicity of polycyclic aromatic hydrocarbons to the nematode Caenorhabditis elegans[J]. Journal of Toxicology and Environmental Health-Part A-Current Issues, 2009, 72(19): 1168-1180
[13] Swain S, Wren J F, Sturzenbaum S R, et al. Linking toxicant physiological mode of action with induced gene expression changes in Caenorhabditis elegans[J]. BMC System Biology, 2010, 4: 32
[14] Nelson G A, Jones T A, Chesnut A, et al. Radiationinduced gene expression in the nematode Caenorhabditis elegans[J]. Journal of Radiation Research, 2002, 43:S199-S203
[15] Bongers T, Bongers M. Functional diversity of nematodes[J]. Applied Soil Ecology, 1998, 10(3): 239-251
[16] 井永苹, 赵莉, 陈小云, 等. 土壤食细菌线虫对菲降解的影响[J]. 土壤, 2010, 42(3): 372-377
[17] 陈小云, 刘满强, 胡锋, 等. 根际微型土壤动物-原生动物和线虫的生态功能[J]. 生态学报, 2007, 27(8):3132-3143
[18] Daresta B E, Liuzzi V C, de Gennaro G, et al. Evaluation of the toxicity of PAH mixtures and organic extract from apulian particulate matter by the model system “Caenorhabditis elegans”[J]. Fresenius Environmental Bulletin,2010, 19(9B): 2002-2005
[19] 王赢利, 陈建松, 阳宇翔, 等. 十溴联苯醚对秀丽隐杆线虫毒性研究[J]. 土壤学报, 2015, 52(5): 1116-1123
[20] 田慧敏. 苯并(a)芘对线虫发育和行为的影响及其分子机制[D]. 福建厦门: 厦门大学, 2008
[21] Iyer P, Martin J E, Irvin T R. Role of biotransformation in the in vitro preimplantation embryotoxicity of Naphthalene[J]. Toxicology, 1991, 66(3): 257-270
[22] Loria P M, Hodgkin J, Hobert O. A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans[J]. Journal of Neuroscience,2004, 24(9): 2191-2201
[23] Bongers T. The Maturity index, the evolution of nematode life history life history traits, adaptive radiation and cp-scaling[J]. Plant and Soil, 1998, 212(1): 13-22
[24] 闫小梅, 虞丽, 李根, 等. 两种土著食细菌线虫对五种细菌的取食偏好及相关机制[J]. 土壤, 2016, 48(1): 82-87
[25] Zhou J H, Li X C, Jiang Y, et al. Combined effects of bacterial-feeding nematodes and prometryne on the soil microbial activity[J]. Journal of Hazardous Materials, 2011,192(3): 1243-1249
[26] Zhou J H, Sun X W, Jiao J G, et al. Dynamic changes of bacterial community under the influence of bacterialfeeding nematodes grazing in prometryne contaminated soil[J]. Applied Soil Ecology, 2013, 64: 70-76
[27] Zhou J H, Hu F, Jiao J G, et al. Effects of bacterial-feeding nematodes and prometryne-degrading bacteria on the dissipation of prometryne in contaminated soil[J]. Journal of Soils and Sediments, 2012, 12(4): 576-585
[28] 丁哲利, 朱骏杰, 赵和平, 等. 珍珠岩对蚯蚓同步处理污泥-狐尾藻的研究[J]. 环境科学学报, 2014, 34(5):1256-1261
[29] Kojima K, Kamijyo A, Masumori M, et al. Cellulase activities of pine-wood nematode isolates with different virulences[J]. Journal of the Japanese Forestry Society,1994, 76: 258-262
Toxic Effects of Phenanthrene on Caenorhabditis elegans,Mesorhabditis sp. and Acrobeloides sp.
ZHANG Yancheng, SHI Jinli, ZENG Siman, ZHANG Zhen, LI Weiming, LI Huixin, HU Feng, XU Li*
(College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China)
A gnotobiotic microcosm experiment was conducted to study the toxic effects of phenanthrene (PHE) on three nematodes—Caenorhabditis elegans, Mesorhabditis sp. and Acrobeloides sp., also the possibility of PHE depletion by the nematodes were examined. The results showed that the survival rates of these three nematodes decreased gradually with PHE concentration increased. Without PHE exposure, Caenorhabditis elegans could reproduce within 48 hours and 5 mg/L PHE could inhibit the reproduction of Caenorhabditis elegans. While no reproductive patterns was observed with the Mesorhabditis sp. and Acrobeloides sp. due to their longer generation time. After comparing the relative mortality at 24h exposure, the tolerance order of those nematode was Mesorhabditis sp. ≥Caenorhabditis elegans≥Acrobeloides sp., and the tolerance of Caenorhabditis elegans reduced gradually with the increased PHE concentration. After 48h exposure, Mesorhabditis sp. still had a higher tolerance than Acrobeloides sp., while after 72h exposure, both of them showed similar tolerance to PHE. All nematodes lost the head swing ability after PHE exposure, and the body length of Caenorhabditis elegans and Acrobeloides sp. reduced gradually with the increase of PHE concentration. All nematodes could help to facilitate the depletion of PHE, and no significant difference was found among three nematodes. In conclusion, PHE could restrain the survival, growth and activity of these nematodes, and inhibit the reproduction of the Caenorhabditis elegans. The survival rates of the nematodes were significantly influenced by nematode species, exposure time, PHE concentrations and their interactions. Mesorhabditis sp. showed the highest resistance to PHE pollution. All the three nematodes could contribute to the depletion of phenanthrene in solution.
Phenanthrene; Caenorhabditis elegans; Mesorhabditis sp.; Acrobeloides sp.; Biological toxicity
X171.5
A
10.13758/j.cnki.tr.2017.05.012
国家自然科学基金项目(41371469,41101292),公益性行业(农业)科研专项项目(201503121),江苏省有机固体废弃物资源化协同创新中心和江苏省优势学科项目资助。
* 通讯作者(xuli602@njau.edu.cn)
张言诚(1990—),男,江苏南京人,硕士研究生,主要从事PAHs污染土壤生态修复方面的研究。E-mail: 2013103032@njau.edu.cn

