氯菊酯微生物手性降解的研究
李森+田晶+李朝阳+李巧玲+罗湘南+张春晓+李劭彤

摘要:通过对河北省石家庄市的黄土进行取样、筛选、分离,得到1株以氯菊酯为唯一碳源的细菌,命名为 PM-A,经鉴定为萎蔫短小杆菌(Curtobacterium flaccumfaciens)。此菌对氯菊酯有良好的降解能力,采用一级动力学模拟,半衰期为1.41 d。进一步考察对各异构体的降解情况,顺式体和反式体降解差异不明显,对顺式体的1对对映体(1R-cis 和1S-cis)降解不存在对映体选择性,对反式体的1对对映体(1R-trans和1S-trans)降解存在明显的对映体选择性。
关键词:氯菊酯;萎蔫短小杆菌;手性;降解;对映体;对映体选择性
中图分类号: X172;X592 文献标志码: A 文章编号:1002-1302(2017)20-0282-03
手性农药的不同对映体往往具有不同的生物活性和生理毒性,其在环境中的消解和归趋也有较大的差别,对环境样品中手性农药的分析和检测往往显示不同的对映体比值[1-2]。土壤是农药残留的主要场所,土壤微生物代谢也是手性农药降解和产生对映体差异的主要原因,目前关于环境样品中手性农药的分析检测及降解特征有较多的研究[3-6],但在微生物水平考察手性农药对映体差异的报道较少[7-8]。
拟除虫菊酯是一类重要的农用杀虫剂,在卫生杀虫领域也有广泛的应用。菊酯的结构较为复杂,一般含2~3个手性中心,因此有4~8个对映异构体,氯菊酯(permethrin)是拟除虫菊酯的重要品种,化学式为C21H20Cl2O3,化学名为3-苯氧基苄基-2,2-二甲基-3-(2,2-二氯二烯基)-1-环丙烷羧酸酯,结构式如图1所示。氯菊酯含有2个手性中心,有1个顺式体和1个反式体,顺式体和反式体又各含有2个对映异构体,因此共有4个对映体,分别为1R-cis、1S-cis、1R-trans、1S-trans,氯菊酯各异构体的生物活性和降解行为均有较大差异[7]。本研究通过对河北省石家庄市的黄土进行筛选和纯化,得到1株氯菊酯的优势降解菌,该菌株以氯菊酯为唯一碳源,且对氯菊酯具有良好的降解能力。在此基础上进一步研究氯菊酯各异构体的手性测定方法,考察该菌株对各异构体的降解差异,结果有助于阐释菊酯农药在环境中的对映体选择性行为,也能为菊酯农药的生物修复提供依据。
1 材料与方法
1.1 仪器与试剂
安捷伦1200型高效液相色谱仪(带G1314B紫外检测器),购自安捷伦科技有限公司;可见分光光度计(spectrunm 722型),购自上海美析仪器有限公司;ZWY-240型恒温摇床,购自上海智诚分析仪器制造有限公司;SPX-250B生化培养箱,购自上海贺德实验设备有限公司。石家庄黄土,采自河北科技大学新校区,pH值7.68,有机质含量2.26%;99%氯菊酯,购自上海市农药研究所有限公司;正己烷、乙酸乙酯、异丙醇等均为分析纯,均购自天津大茂化学试剂厂,重蒸后过0.45 μm有机滤膜备用;其他化学试剂和生物试剂均购自河北石家庄天时生物技术有限公司。富集培养基:10 g蛋白胨、1 g NaCl、1 g KH2PO4、1 000 mL水 (pH值7.0~72);普通培养基:3 g牛肉膏、10 g蛋白胨、5 g NaCl、1 000 mL水(pH值 7.0~72);基础培养基:1.00 g NH4NO3、0.50 g MgSO4·7H2O、0.50 g (NH4)2SO4、0.50 g KH2PO4、0.50 g NaCl、1.50 g K2HPO4、0.05 g酵母浸粉、1 000 mL水(pH值7.0~7.2),固体培养基在此基础上加入2 %琼脂粉。
1.2 色譜柱和色谱条件
非手性高效液相色谱(HPLC)的色谱柱为正相硅胶柱(购自辽宁大连依利特分析仪器有限公司,250 mm × 4.6 mm),流动相为正己烷 ∶ 异丙醇(体积比为100 ∶ 0.08)。手性HPLC色谱柱为Chiralcel OJ-H(购自日本大赛璐工业株式会社,250 mm × 4.6 mm),流动相为正己烷 ∶ 异丙醇(体积比为100 ∶ 2)。非手性和手性HPLC的检测波长均为 230 nm,流速为 1.0 mL/min,进样量为20 μL。
1.3 氯菊酯降解菌的筛选
向250 mL三角瓶中加入100 mL富集培养基,在高压蒸汽锅中灭菌15 min,自然冷却后加入10 mL氯菊酯(100 mg/L)和10 g石家庄黄土,在摇床(温度30 ℃、转速180 r/min)中培养7 d。此后按10 %的接种量转接到下一批含氯菊酯(质量浓度依次为100、200、300、400、500 mg/L)的富集培养基中,相同条件下各培养7 d,然后按10 %的接种量转接到含有500 mg/L氯菊酯的基础培养基中,并培养14 d,此后以10倍梯度稀释获得7个梯度,并分别进行涂布划线,直至出现单菌落并保存,得到1株优势菌株,命名为PM-A。
1.4 菌种鉴定
在牛肉膏蛋白胨培养基上接种少量预先稀释的菌液,并均匀涂布,待菌落长出后,采用革兰氏染色以及芽孢染色后镜检。另外进行葡萄糖发酵试验、甲基红试验等生理生化鉴定[9]。提取菌株的DNA,进行扩增后送往生工生物工程(上海)股份有限公司进行测序,将16S rDNA的序列结果与GenBank数据库中核酸的数据进行同源性对比[10]。
1.5 菌株降解试验
以PM-A菌株作为菌种进行菌液配制,将配制好的菌液(D600 nm ≈ 0.5)接种到含有100 mL无菌液体基础培养基的三角瓶中(接种量为1%),加入氯菊酯使培养基中氯菊酯的浓度达到10 mg/L。对照组除不加菌种外,其余条件均相同。将三角瓶置于摇床(温度30 ℃、转速180 r/min)中,分别在培养0、2、4、6、8 d取样,并用液相色谱进行总量和手性测定。endprint
1.6 样品提取和前处理
吸取5 mL培养液,加入等体积的正己烷和乙酸乙酯的混合液(体积比为5 ∶ 1),利用超声波辅助振荡10 min后萃取,吸取上清液,以上操作重复3次后,使用无水硫酸钠脱水,用高纯氮气吹干,正己烷定容至1 mL,过0.45 μm有机滤膜,用液相色谱进行测试分析。
1.7 氯菊酯异构体和对映体的测定方法
氯菊酯含1个顺式异构体(cis-PM)和1个反式异构体(trans-PM),在非手性硅胶柱上即可得到基线分离。cis-PM、trans-PM各含有2个对映体,分别为1R-cis和1S-cis、1R-trans和1S-trans,在手性Chiralcel-OJ-H柱上,4个对映体可以得到基线分离,笔者所在课题组前期的研究结果表明,顺反体对映体的具体流出顺序为1S-cis先于1R-cis出峰,1S-trans 先于1R-trans出峰[11]。预试验结果表明,同时测定4个对映体出峰时间较长,且容易受杂质干扰,尤其分析浓度较低的痕量样品时更为明显。因此,本研究采用分步测定方法,先用非手性硅胶柱分离测定氯菊酯的顺式体和反式体,剩余样品浓缩后用硅胶柱分离,待cis-PM、trans-PM出峰时,在色谱仪流动相出口端收集相应的流动相,吹干定容后,用手性色谱分别进行拆分,测定对映体的浓度比值ER(enantiomer ratio),根据顺式体、反式体的浓度及相应的ER值,即可得出各对映体的浓度。分步测定相对繁琐,但手性拆分前增加了顺式体和反式体净化步骤,可有效去除杂质干扰,提高测定准确度。
2 结果与分析
2.1 菌株鉴定结果
PM-A是以氯菊酯为唯一碳源生长的细菌,该菌属于革兰氏阳性菌,菌落较小,深黄色,边缘光滑,表面光滑,黏稠状,中间隆起;老细胞易退色,专性好氧。测序长度为1 485 bp,与萎蔫短小杆菌(Curtobacterium flaccumfaciens)rDNA序列的一致性达99%,初步鉴定为萎蔫短小杆菌。
2.2 氯菊酯总量、顺式体和反式体的降解特征
用对映异构体比例SR(stereoisomer ratio)表示顺式体和反式体浓度的比值,k表示降解速率常数,r2表示数据的回归平方和与总平方和之间的比值。由表1可知,PM-A对氯菊酯的降解符合一级动力学过程,半衰期为1.41 d。在8 d的培养过程中,氯菊酯浓度逐渐下降,在降解8 d时,降解率达到97.64%,前4 d的降解尤为显著,4 d降解率已达到9178%。分析其原因,可能是因为培养基中氯菊酯为唯一碳源,PM-A为了生存,只能利用氯菊酯作为碳源生长。在培养的前4 d,氯菊酯的量比较充足,PM-A可利用氯菊酯大量增殖和生长,故氯菊酯降解速率较快。随着培养时间的加长,氯菊酯浓度持续降低,不足以提供PM-A所需的碳源,此时培养基条件恶化,PM-A进入衰亡期,氯菊酯降解速率降低。8 d的降解过程中,SR值基本为0.70左右,与标准品SR值(0.71)相差不大,说明PM-A对氯菊酯的顺式体、反式体的降解没有选择性。笔者所在课题组前期已对氯菊酯在所选石家庄黄土中的降解情况进行过详细研究,在黄土中的降解半衰期为7.48 d,氯菊酯的反式体降解速度快于顺式体,半衰期分别为5.86、8.99 d[12]。其他研究报道也表明,氯菊酯在土壤和污泥中的降解速度一般均表现为反式体快于顺式体[5,13-14],而本研究中PM-A菌株则对cis-PM、trans-PM有着相近的降解速率,这可能是由于降解氯菊酯的微生物有很多种,而筛选得到的仅为其中1种,不同的微生物菌群有不同的降解特征,土壤中的降解应为各种微生物的综合代谢作用。
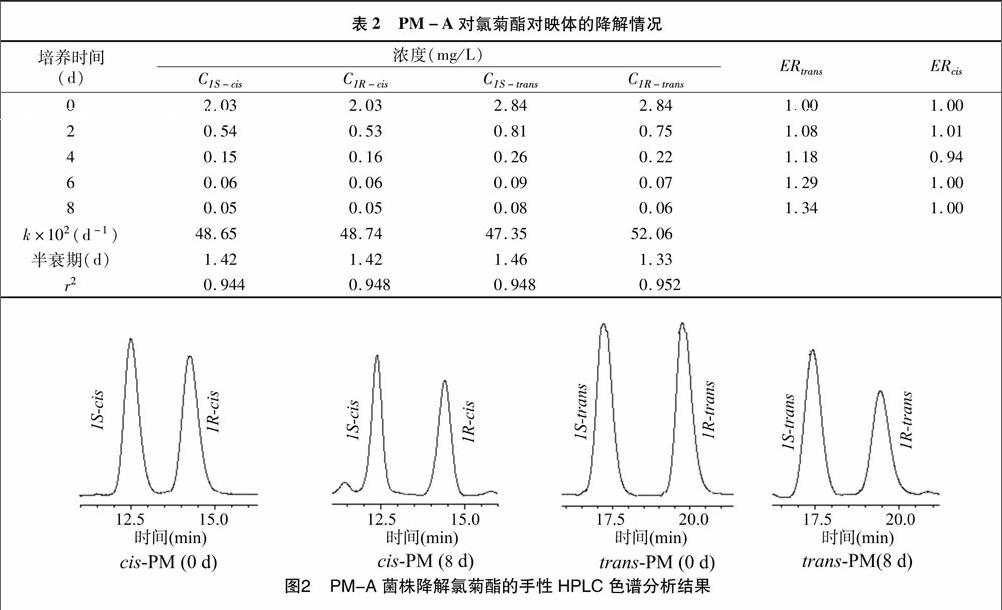
2.3 氯菊酯对映异构体的降解特征
为了更好地考察PM-A菌株對各对映体的降解差异,本试验测定了各对映体在不同时间的降解浓度,定义ER为先流出对映体与后流出对映体的浓度比值,由表2可知,cis-PM的1对对映体ER值始终在1.00左右,说明降解速率相同,没有选择性;而trans-PM的ER值则从降解0 d的1.00逐渐增大,到降解8 d时为1.34,说明1R-trans的降解速度明显快于 1S-trans ,2种异构体的半衰期分别为1.33、1.46 d。由图2可以看出,cis-PM的1对对映体1S-cis和1R-cis在降解0、8 d的ER值均接近1,而trans-PM的1对对映体1S-trans和1R-trans的ER值在降解8 d时明显高于1。前期的土壤试验结果表明,在土壤中cis-PM的1对对映体1S-cis和1R-cis的降解速率基本相近[12],本研究结果与之相一致;土壤中 trans-PM 的1对对映体存在降解差异,1S-trans的降解速度略快于1R-trans,半衰期分别为5.09、6.45 d[12],而本研究中PM-A对反式氯菊酯的降解特征与之相反。这可能因为土壤中的降解是各种微生物菌群协同作用的结果,同时手性农药的对映体选择性行为还受到具体环境条件的影响,因此出现单一菌株和土壤手性降解特征不一致的现象。
3 结论
本研究中优势菌株PM-A对氯菊酯作用的对映体差异仅体现在反式异构体中, 这与环境样品中反式体往往比顺式体具有更高的对映体选择性相一致,这可能与微生物体内降解酶的特定手性结构有关,具体的作用机制仍有待深入研究。同时,微生物的手性降解可以更有针对性地降解某一对映体。因此,采用适宜的微生物菌株可以大大提高环境污染中手性农药的生物修复效率和效果。
参考文献:
[1]刘维屏. 农药环境化学[M]. 北京:化学工业出版社,2006.
[2]Diao J,Xu P,Liu D,et al. Enantiomer-specific toxicity and bioaccumulation of alpha-cypermethrin to earthworm Eisenia fetida[J]. Journal of Hazardous Materials,2011,192(3):1072-1078.endprint
[3]Liu W P,Gan J Y,Schlenk D,et al. Enantioselectivity in environmental safety of current chiral insecticides[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(3):701-706.
[4]Müller T A,Kohler H P. Chirality of pollutants-effects on metabolism and fate[J]. Applied Microbiology and Biotechnology,2004,64(3):300-316.
[5]Garrison A W,Avants J K,Jones W J. Microbial transformation of triadimefon to triadimenol in soils:selective production rates of triadimenol stereoisomers affect exposure and risk[J]. Environmental Science & Technology,2011,45(6):2186-2193.
[6]程彪平,李來生,周仁丹,等. 两种β-环糊精单臂键合固定相液相色谱法拆分三唑类手性农药[J]. 高等学校化学学报,2015,36(5):872-880.
[7]Liu W,Gan J J,Lee S,et al. Isomer selectivity in aquatic toxicity and biodegradation of cypermethrin[J]. Journal of Agricultural and Food Chemistry,2004,52(20):6233-6238.
[8]Moreira I S,Ribeiro A R,Afonso C M,et al. Enantioselective biodegradation of fluoxetine by the bacterial strain Labrys portucalensis F11[J]. Chemosphere,2014,111(9):103-111.
[9]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:370-410.
[10]奥斯伯 F M,布伦特 R,金斯顿 R E,等. 精编分子生物学实验指南[M]. 5版. 金由辛,包慧中,赵丽云,等译. 北京:科学出版社,2001.
[11]Li Z Y,Luo X N,Li Q L,et al. Stereo and enantioselective separation and identification of synthetic pyrethroids,and photolytical isomerization analysis[J]. Bulletin of Environmental Contamination and Toxicology,2015,94(2):254-259.
[12]Li S,Li Z,Li Q,et al. Characterization of diastereo- and enantioselectivity in degradation of synthetic pyrethroids in soils[J]. Chirality,2016,28(1):72-77.
[13]Sakata S,Mikami N,Yamada H. Degradation of pyrethroid optical isomers in soils[J]. Journal of Pesticide Science,1992,17(3):169-180.
[14]Qin S,Gan J. Enantiomeric differences in permethrin degradation pathways in soil and sediment[J]. Journal of Agricultural and Food Chemistry,2006,54(24):9145-9151.endprint

