白木香结香树脂部内生真菌的分离及其结香菌筛选
黄秋伟+王丽萍+黄显雅+黄惠芳+李慧敏

摘要:采用平板培养法对白木香结香部位内生真菌进行分离,以沉香主要成分苄基丙酮作为结香菌的耐药指标,采用改进的菌块法进行耐药能力的筛选。结果表明,从结香部位分离出11株内生真菌,经形态学及分子初步鉴定归于3目4科5属,其中在数量上,镰刀菌属为优势种群,其次为木霉属。经苄基丙酮耐药筛选发现,镰刀菌属的G7耐药水平较高,对苄基丙酮的剂量变化不敏感,将其选作人工结香菌,效果有所显现,结香时间大为缩短。
关键词:白木香;内生真菌;苄基丙酮;人工结香
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2017)20-0285-05
白木香[ Aquilaria sinensis(Lour.) Gilg]为瑞香科(Thymelaeaceae)沉香属(Aquilaria)植物,别称土沉香、女儿香、莞香,为我国特有的珍贵药用树种,主产于海南、广东、广西等省(区)。其含黑色树脂的木质部称为沉香,系《中国药典》收载的品种,是目前紧缺的名贵药材和天然香料,具有行气止痛、温中止呕、纳气平喘之功效,主治胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等症状[1]。目前,由于白木香的野生资源少,生长周期较长,自然条件下沉香的形成最少也要10年以上的时间,而且并不是所有的白木香都能形成沉香,所以即使通过人工种植白木香,也很难解决天然沉香产量问题,不能满足市场需求。健康的白木香并不产生树脂,据目前研究表明,沉香形成机理是健康的白木香树干在受到损伤或者刺激情况下,其木质部细胞分泌出一种气味芬芳的防御性黑色树脂,而这种防御性机制的引发主要与白木香受损后的微生物浸染有很大关系。
内生真菌(Endophytic fungi)是指生活在健康植物的各种组织和器官内部的真菌,被感染的植物不表现明显的外在病症,可通过组织学方法,从表面严格消毒的植物组织中分离的方法,以及从植物组织内直接扩增微生物DNA 的方法来证明其内生性[2]。对药用植物内生真菌的研究表明,内生真菌与药用植物在长期的生活过程中,形成了互惠互利的共生关系,不但可以自身合成与宿主植物相类似活性成分,还具有促进宿主植物合成活性成分的能力。对于促进结香的内生真菌首先在一定程度上对沉香活性成分具有耐受性。沉香的成分比较复杂,主要成分有三大类:倍半萜、2-苯乙基色酮类物和芳香族化合物,苄基丙酮、对甲氧基苄基丙酮是沉香芳香族化合物的代表性成分。近年来,我国珍稀濒危药用植物内生真菌及其活性成分的研究成为了药物开发的热点,国内外从多种药用植物内生真菌中筛选出各种生理活性成分陸续见有报道,且发现有一些活性成分具有与宿主植物相同或相似的生理活性[3]。因此,当前国内外研究较多的是关于沉香内生真菌分离及其次生代谢产物活性成分,而对于促进结香的内生菌研究报道仍较少。本研究对已结香的沉香部分进行内生真菌的分离和鉴定,选用苄基丙酮作为试验条件对分离得到的内生真菌进行结香耐药性筛选,并通过人工结香试验,筛选出对白木香结香具有良好促进作用的菌株,为加快天然沉香的结香周期奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 白木香样品于2014年7月采自广西壮族自治区灵山县武利镇鱼良村当地一株树龄为100年白木香古树。因古树比较高大,根系深入地底,所以根部及叶片的组织样品难以取得,取材部位为茎部的天然结香树脂部分。白木香样品采集后于48 h内进行表面消毒。取样的树种经中国热带农业科学院热带作物品种资源研究所鉴定白木香。
1.1.2 主要仪器及试剂 徕卡DM2500型光学显微镜;DYY-6C双稳定时电泳仪;伯乐GEL DOCXR全自动凝胶成像仪;德国Biometra Tprofessional 96梯度PCR仪;LRH-250GB光照恒温培养箱;日本三洋MLS-3780高压蒸汽灭菌器;离心柱型真菌基因组DNA提取试剂盒,由北京鼎国昌盛生物技术有限责任公司生产;PCR产物纯化及回收试剂盒,由BIOMIGA公司生产;Taq PCR master mix试剂,由上海捷瑞生物工程有限公司生产;苄基丙酮试剂,由Sigma-aldrich公司生产;吐温80,由北京索莱宝科技有限公司生产。
1.1.3 所用培养基 白木香内生真菌分离培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,硫酸链霉素100 mg,氯霉素 100 mg,蒸馏水1 000 mL,pH值为7.0;纯化培养基(PDA培养基);白木香培养基:未结香白木香碎木块(7年树龄)100 g,琼脂15 g,蒸馏水1 000 mL,pH值为7.0;液体PDA培养基。
上述培养基所用的马铃薯与白木香均煮沸30 min后,4层纱布过滤,再补水至1 000 mL,灭菌条件为121 ℃,18 min,硫酸链霉素与氯霉素均在培养基冷却至50~60 ℃时加入。
1.2 试验方法
1.2.1 内生真菌的分离与纯化 内生真菌的分离采用组织块平板培养法[4-5],用于分离的白木香天然结香木块材料采用自来水冲洗1遍,并将腐烂的木质部去除,然后切割成 5 cm×5 cm的木块,依次用75%乙醇洗1 min,无菌水漂洗1次,5%次氯酸钠溶液漂洗5 min,无菌水漂洗4次。消毒后的材料置于无菌的干燥滤纸上吸干水分,用无菌手术刀刮去木块表面组织,并切成1 cm×1 cm的小块置于分离培养基上,采用三角形法,每个平板放置3个小块,以最后一次冲洗的无菌水0.1 mL涂板作为阴性对照,来检验表面消毒是否彻底。28 ℃恒温培养直到出现菌落,从菌落边缘挑取菌丝接种于纯化培养基上,经反复转接纯化后的菌株转接于PDA培养基的试管斜面,于4 ℃冰箱保存备用。
1.2.2 内生真菌的鉴定 形态学鉴定利用肉眼观察分离菌株在PDA培养基上的培养特征;采用真菌学插片培养法和水滴装片法,利用光学显微镜镜检观察,根据菌落形态特征(包括菌落大小、颜色、表面特征和质地等)和显微形态特征(包括菌丝和孢子等)参考文献[6]对白木香结香树脂部位的分离菌株进行初步鉴定。endprint
分子鉴定先采用液氮研磨,试剂盒提取方法制备真菌总DNA。真菌样品采取的是菌膜培养法,具体参考陈亮等的研究[7],从活化好的PDA平板中挑取1接种环菌丝,放入25 mL PDA液体培养基于26 ℃摇瓶培养24 h,充分混匀后,在静止培养5~7 d形成菌膜,然后挑取菌膜放入研钵,加入液氮并快速研磨成粉末,将粉末分成2份分装于2.5 mL离心管,一份于-80 ℃保存备用,一份用于DNA提取,提取操作按照试剂盒方法进行。PCR扩增采用真菌rDNA内转录间隔区(rDNA ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′,正向)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′,反向)扩增分离菌株的rDNA ITS区。PCR反应条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,循环35次;72 ℃温育10 min。PCR产物利用BIOMIGA公司生产的纯化回收试剂盒纯化,纯化后的产物由深圳华大基因科技有限公司进行核酸测序。测序结果通过NCBI的BLAST进行序列的同源性检索比对。
1.2.3 内生真菌的苄基丙酮耐受性筛选试验 初筛:将保存于试管斜面的菌种转接于新鲜的PDA培养基中,于26 ℃培养活化以作为供试菌。配制白木香培养基,待培养基冷却到50~60 ℃,往培养基里滴加0.10%(体积分数,下同)吐温80作为乳化剂,然后选取体积分数为0.08%加入沉香主要成分之一的苄基丙酮,快速混匀后倒平板。内生真菌对苄基丙酮具有耐受能力的初步筛选采用菌饼法,先用6 mm的打孔器在接有活化好的内生真菌的PDA平板上打出直径约为6 mm的圆形菌饼,然后用灭菌接种针各挑取1块圆形菌饼置于含苄基丙酮的白木香培养基平板中央,同时以置于不含苄基丙酮的白木香培养基作为对照,每个处理和对照均设置3次重复,置于26 ℃下恒温避光培养4 d后,观察真菌的生长状况,以菌圈直径(包括菌饼)作为耐受性指标,计算苄基丙酮对菌丝生长的抑制率,选取对苄基丙酮具有耐受性的菌株进行复筛,生长抑制率的计算公式如下:
菌丝生长抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-6 mm)×100%。
复筛:设置含苄基丙酮0.10%、0.12%、0.14% 3个体积分数梯度的白木香平板,并将具有耐受性的菌株转接于含药平板中,转接方法与初筛试验中菌饼转接法一致,置于 26 ℃ 下恒温避光培养7 d后,观察真菌的生长状况,以菌落长势及菌圈直径(包括菌饼)作为耐受能力指标,并通过菌丝生長抑制率浓度曲线,选取对苄基丙酮耐受能力较强的菌株作为结香菌。
所有的试验数据均采用SPSS 19.0统计软件进行统计,并计算对照组与处理组、处理组与处理组间的显著性差异。
1.2.4 结香菌人工结香的初步试验 将筛选出来的菌株转接到PDA平板上活化,挑取活化后的菌丝(连同培养基)转接到装有500 mL液体PDA培养基的1 L三角瓶中,于26 ℃、120 r/min 的条件下摇床培养7 d。液体培养物先后经慢速滤纸及0.45 μm微孔滤膜抽滤,收集滤液,得到菌体发酵液 4 ℃ 备用。选取7~8年树龄的白木香作为试验植株,在离地面50 cm处用电钻打孔,之后将含有发酵液的注射袋的注射头插入孔隙,吊带注射一段时间,观察孔隙口边缘是否漏液及注射袋是否胀袋,以判别液体是否成功注射入树体中。接菌注射3个月后,通过观察注射孔径位置是否变色,并取其部分材料进行燃烧试验,观察其燃烧状况,来初步判定结香状况。
2 结果与分析
2.1 白木香树脂部内生真菌的分离与鉴定结果
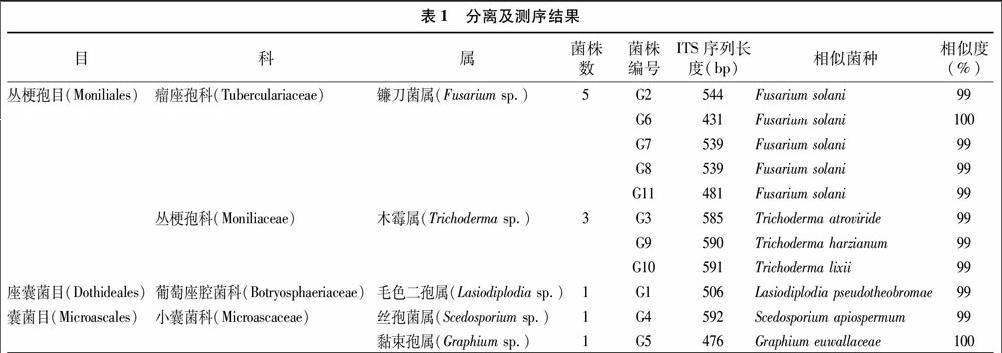
本次研究采用组织块平板分离法,经过多次分离纯化后,从白木香的树脂形成部位分离获得11株内生真菌,根据PDA平板上的分离次序、形态及培养特征依次进行菌株编号G1、G2,…,G11。经过显微形态观察及分子鉴定,将分离得到的内生真菌初步鉴定为3目4科5属,相关分离结果见表1。分离的5个菌属依次为镰刀菌属、木霉属、毛色二孢属、丝孢属、黏孢属。其中,镰刀菌属有5株,占分离菌株数的45%,为结香部位的优势菌群;木霉属有3株,占分离菌株数27%;其余属各有1株,各占分离菌株数的9%。在观察鉴定试验中,镰刀菌属与木霉属培养特征比较明显。镰刀菌属在PDA培养基培养前期产生大量的白色气生菌丝,并呈现棉絮状,培养后期不产生色素或者产生黄色、红色等色素,分生孢子梗主要单生,分生孢子呈镰刀形或卵圆形;木霉属在PDA培养基培养前期气生菌丝为白色,生长密集呈网丛状,培养后期菌丝转变为绿色或黄色,分生孢子梗呈二叉状或三叉状分枝,分生孢子球形。
2.2 内生真菌耐药菌的筛选
2.2.1 内生真菌苄基丙酮初筛结果 由表2可知,苄基丙酮对所分离的11株菌均产生了不同程度的抑制作用。从对比差异来看, 镰刀菌属的内生真菌有3株的对照组与处理组表现出极显著性差异;2株的对照组与处理组无明显差异,分别是G7与G8,说明这2株菌受苄基丙酮的影响较小,耐受能力较为明显。木霉属的内生真菌有2株表现出显著性差异,1株为极显著差异。其余3个属的内生真菌均表现极显著差异。从菌落生长抑制率效果来看,镰刀菌属的5株真菌所受抑制率各不相同,抑制率由小到大排列,依次为G7
2.2.2 内生真菌苄基丙酮复筛结果 将初筛得到的4株真菌再次进行复筛试验,由表3可知,各个菌的对照组与处理组生长情况相差明显,且总体趋势是随着苄基丙酮体积分数提高,抑制生长的效果越明显。在0.08%苄基丙酮处理中没有显著性差异镰刀菌属的G7、G8,在体积分数提高到0.10%后,与对照组相比也出现了极显著性差异。然而,镰刀菌各个体积分数处理间的菌落生长状况均没有明显差别;木霉属的各个体积分数处理间均表现出了显著性差异,甚至有些处理还出现了极显著性差异,说明这2株木霉属真菌对苄基丙酮变化量较敏感。此外,由图2可知,在0.10%、0.12%、014%培养条件下,木霉属的整体抑制率是低于镰刀菌属的,但从抑制率的增长态势分析,木霉属增长幅度波动性较大,尤其是体积分数0.14%时,与0.12%抑制率相比,增长幅度达到了约 15.00%,说明木霉属的G9、G10等2株真菌对于高浓度苄基丙酮耐受能力较低;镰刀菌属的增长幅度比较平缓,各个浓度的增长幅度基本维持在2.00%~5.00%,G7各个体积分数增长幅度较为均等,且抑制率水平较其他2株镰刀菌属真菌要低一些,说明该菌的苄基丙酮耐受能力水平较高,因此选用G7作为人工接菌结香的结香菌源。
2.3 人工结香试验初步结果
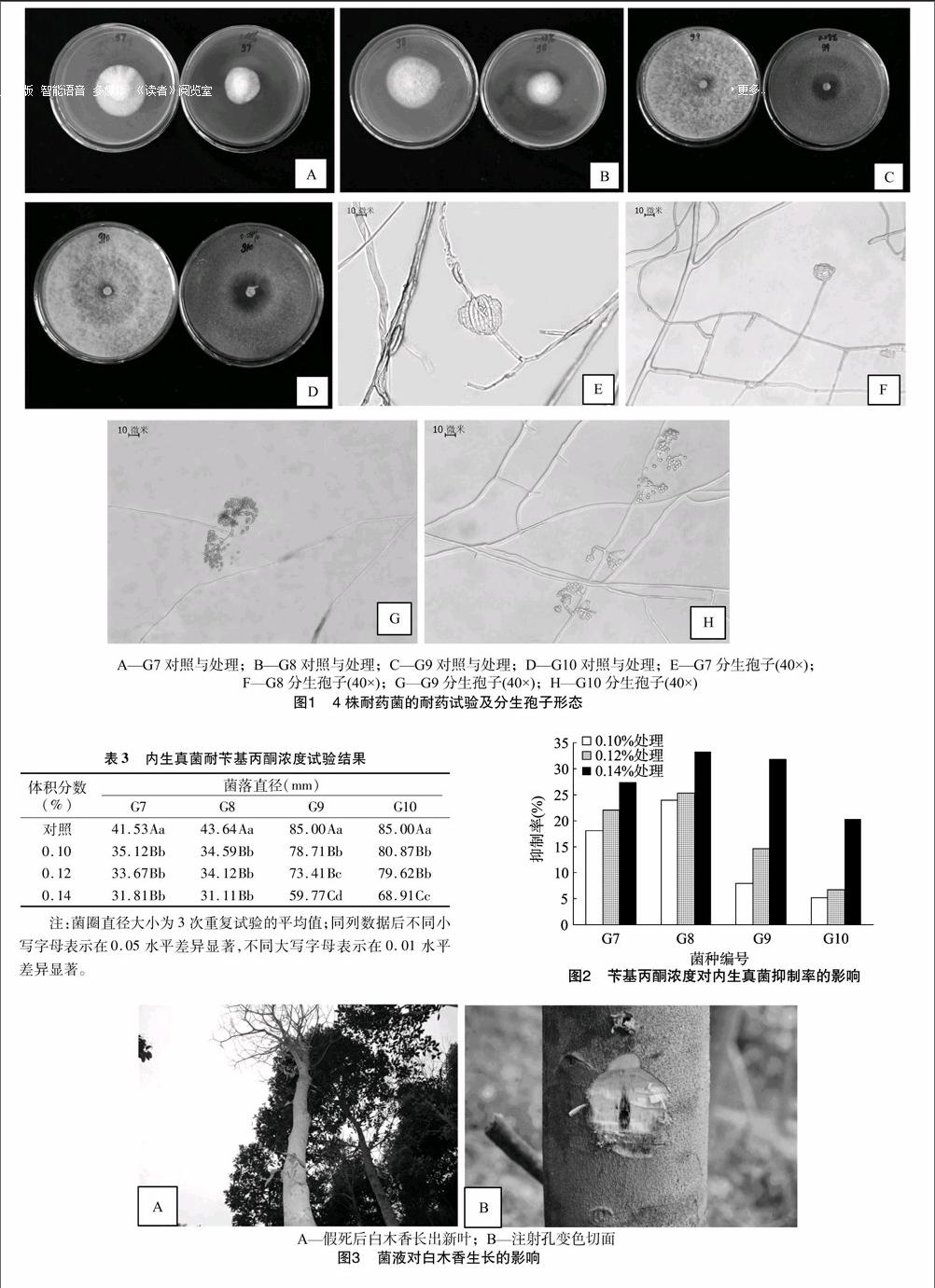
经发酵液注射过后的白木香树木,先出现掉叶枯枝的假死现象,后经过一段适应期长出新枝嫩叶。用砍刀将菌种发酵液注射孔及其周围的表皮去掉后,肉眼观察发现孔洞周围的木质部已经发黑变色,变色方向主要是向两端纵向延伸。变色部分的剖面面积约为1.0 cm×3.5 cm,通过旋转取样器深入取样,深入树干9.0 cm取出,发现取样器的顶端带有小部分白色木质组织,表明变色树脂的横向深度约为9.0 cm。将取出的黑色木块组织肉眼观察无腐化烂木现象,且经燃烧试验后无异味黑烟,而是白色带有淡香的烟气。初步认为,变色树脂部分为沉香,所筛选的耐药菌可以促进结香,图3为注射菌液后的白木香生长及切面状况。
3 讨论
内生真菌普遍存在于植物中,但不同的植物体内分离到的内生真菌种类和数量有差别,即使是同一种植物,也会因生境、品种和年龄等不同而分离出不同的内生真菌,加上不同的表面消毒程序和分离培养条件及污染控制,也会造成一定的差异。本试验从白木香的结香树脂部位分离得到11株真菌,显示内生真菌多样性较低。同时,在分离数量上,镰刀菌属为结香部位的优势属,这些结果与已报道的白木香内生真菌相比较,既有差异又有相似。张秀环等从树龄为7年的白木香健康部位和树脂形成部位共分离出42株内生真菌,其中健康部位15株,树脂形成部位27株,结香部位真菌分布优于健康组织,此外,该研究还发现枝顶孢霉属为健康部位优势菌属,青霉属为结香部位优势菌属[8]。王磊等对不同树龄白木香和不同的组织部位进行内生真菌的分离鉴定,共分离得到50株真菌,但不同树龄及组织得到的真菌数量各不相同,从树龄分布来看,5年树龄分离数量最多,30年树龄次之,10月树龄最少。他们还发现,在不同健康组织(根、茎、叶)和结香组织分离得到的真菌数量上,健康组织33株,结香部位17株,健康组织分布优于结香部位,而分离出来的镰刀菌全部位于结香树脂部位,是该部位的优势种群[9]。造成这种真菌数量种群差异性和结香种群优势专一性的原因可能是植物不同部位的微环境不同,如化学成分等内在因素,以及种植环境条件外在因素影响了内生真菌的浸染和多样性。
镰刀菌属[10](Fusarium Link)是重要的菌物类群,是人類发现的重要植物病原菌之一,自然界中兼寄生或腐生生活。该属真菌可侵染多科植物(茄科、豆科、禾本科、兰科、松科、锦葵科、藜科、葫芦科、十字花科、芸香科和百合科等)引起苗枯、穗腐、根腐、茎腐、穗轴腐烂、冠腐和植物种子、块茎的腐烂等症状[11]。此外,有些镰刀菌还可直接侵染动物和人类引起严重的疾病;有些可分解纤维素、降解有机物,有助于自然界的物质循环;有些可寄生在昆虫或其他真菌上,作为生防菌被利用;有的在一定培养条件下可产生激素,用于刺激动植物的生长发育[12]。此外,镰刀菌属一般的分类鉴定主要是以大小分生孢子形态、培养性状等形态学特征建立的形态学种,但由于该菌属会因为其分类性状易变且不稳定,造成种内分化和显著差异,这给实际鉴定带来许多困难。本次试验分离得到的5株镰刀菌,相似菌种为腐皮镰刀菌,但菌落在培养基上面的次生代谢产物(如色素有无及色泽)彼此不同,观察形态有些有共同特征(如菌落生长大小、孢子着生方式),也有些结构有明显差异(如孢子大小)和耐苄基丙酮能力的差异,这些可能都是由种内分化造成的。在耐药性筛选试验中,看似同种的5株镰刀菌,各自的耐苄基丙酮能力及抗药水平均有差异,导致这些差异的发生极有可能是由于种内分化,从而使菌体内的微结构及代谢功能发生改变。对于镰刀菌的结香效果,一些文献上也有所报道。例如,Tabata等利用包括三线镰孢(Fusarium trifosfrium)在内的5种镰刀菌进人工结香试验,发现通过接种能产生沉香[13]。Kazzaz等通过对印尼沉香树的调查研究发现,镰刀菌(F. laseritum)能促进白木香结香[14]。这些结果都与本次研究结果一致,说明镰刀菌对于开发白木香的结香技术有着重要作用,尤其是耐苄基丙酮药性的镰刀菌。
此外,由于沉香成分复杂,苄基丙酮只是其中的主要成分之一,有些真菌可能不耐苄基丙酮,但会对其他沉香成分有着协同促进作用。本试验分离得到1株毛色二孢属真菌,韩晓敏等研究发现的与其同属的可可毛色二孢菌类发酵液对白木香产生沉香主要成分-倍半萜有着诱导促进作用,而且发酵液产物成分里面也出现了与沉香倍半萜类相一致的成分[15]。因此,笔者认为分离出来的毛色二孢属也很有可能具备这一诱导作用,并产生倍半萜类化合物,但其本身对苄基丙酮耐受力较差。因此,还须对侵染结香的沉香组织进行物理提取及GC-MS检测,来分析其内在成分与天然结香的成分差异,以及多个菌属之间优化搭配,发挥协同作用来促进结香,提高结香品质。endprint
4 结论
本次研究从结香部位分离出11株内生真菌,并从中筛选出1株耐苄基丙酮内生菌,将该菌通过发酵培养后,对白木香进行人工的菌液注射侵染结香,一段时间后得到变色木质组织,经过初步验证,具备沉香的表观性质,且形成周期比自然形成时间要短很多,说明所选耐药菌对促进白木香结香、加快结香时间有良好的效果,因而耐苄基丙酮能力可以作为筛选人工结香菌的重要指标之一,且方法可行。
参考文献:
[1]戴好富,梅文莉. 海南药用植物现代研究[M]. 北京:中国科学技术出版社,2007:31-33.
[2]周雅琴,谭小明,陈晓梅,等. 药用植物沉香内生真菌的分离及抗菌活性研究[J]. 中国药学杂志,2011,46(9):649-651.
[3]文才艺,吴元华,田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志,2004,23(2):86-91.
[4]付建红,刘 鑫,李 娟. 天山花楸内生真菌的分离及其抗菌活性物质的初步研究[J]. 西北植物学报,2012,32(12):2537-2543.
[5]毕江涛,潘润霞,黄盼盼,等. 药用植物二色补血草内生真菌分离及其抑菌活性初步研究[J]. 西北植物学报,2012,32(12):2544-2550.
[6]魏景超遗. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:609-639.
[7]陈 亮,林永慧,何兴兵,等. 白腐真菌XX-3对苯胺蓝染料的脱色条件优化[J]. 湖北农业科学,2011,50(2):4178-4184.
[8]张秀环,梅文莉,陈 苹,等. 白木香内生真菌的分离鉴定及其抑菌活性[J]. 微生物学杂志,2009,29(3):6-10.
[9]王 磊,章卫民,潘清灵,等. 白木香内生真菌的分离及分子鉴定[J]. 菌物研究,2009,7(1):37-42.
[10]柳 凤,詹儒林,韦继光,等. 现代生物技术在镰刀菌分类学中的应用[J]. 中国农学通报,2012,28(30):166-170.
[11]Wingfield M J,Hammerbacher A A,Ganley A J,et al. Pitchcanker caused by Fusarium circinatum—a growing threat to pineplantations and forests worldwide[J]. Australasian Plant Pathology,2008(37):319-334.
[12]林清洪,黃志宏. 镰刀菌研究概述[J]. 亚热带植物通讯,1996,25(1):51-56.
[13]Tabata Y,Widjaja E,Mulyaningsih T,et al. Structural survey and artificial induction of aloeswood[J]. Wood Research,2003,90:11-12.
[14]Kazzaz M K,Fadly G B,Hassan M A,et al. Identification of some Fusarium spp. using molecular biologytechniques[J]. Egyptian Journal of Phytopathology,2008(36):57-69.
[15]韩晓敏,梁 良,张 争,等. 可可毛色二孢菌对白木香产生倍半萜诱导作用[J]. 中国中药杂志,2014,39(2):192-196.endprint

