耐低磷玉米自交系根系性状的主基因+多基因遗传分析
, , , , , , (.丹东农业科学院, 辽宁 凤城 809; .辽宁丹玉种业科技股份有限公司, 辽宁 凤城 809)
耐低磷玉米自交系根系性状的主基因+多基因遗传分析
鲁俊田1,任丽丽2,岳辉1,陈晓旭1,王作英1,陈丽1,丰光2
(1.丹东农业科学院, 辽宁 凤城 118109; 2.辽宁丹玉种业科技股份有限公司, 辽宁 凤城 118109)
目前对玉米自交系耐低磷能力评价缺乏统一的指标,为探明耐低磷玉米苗期根性状的遗传机制,为耐低磷玉米自交系的筛选及杂交种选育提供理论支撑,利用主基因+多基因遗传模型,研究了玉米自交系及其杂交和回交世代苗期根系性状的遗传机制。结果表明,总根长受加性-显性-上位多基因控制,在F2世代筛选效率最高,环境对其影响较大;根体积受2对加性-显性-上位性主基因+加性-显性多基因控制,主基因间存在互作效应,主基因显性效应为负效应,在B2世代筛选效率最高,受环境影响较小;根表面积的遗传受2对加性-显性-上位性主基因+多基因控制,主基因显性效应对根表面积起负向作用,主基因加性效应起正向作用,在F2代筛选效率最高,受环境影响较小。
玉米; 自交系; 根性状; 主基因+多基因模型
玉米是我国重要的粮食作物,然而在我国很多玉米主产区土壤中营养元素的缺乏已成为制约玉米高产优质的关键因素之一[1-2]。Tinker认为,地球磷资源枯竭是不可避免的,一旦磷矿资源枯竭,农业中磷供应的来路中断,其情形便不堪设想[3]。据统计,2005年底世界磷矿储量180亿t[4]。王永壮等认为,通常全磷含量在0.03%以下时,基本上属于缺磷土壤[5]。我国土壤中磷的含量及土壤溶液中磷的浓度很低,只有0.05 mg/kg[6],磷在土壤中易固定,流动性差,土壤全磷含量变动在0.02%~0.11%之间,其中99%以上为迟效磷[7-9],作物当季能利用的磷仅为1%,植物对磷素的利用效率低[10-11]。传统上通过施用磷肥作为克服磷缺乏的主要途径,但并不是解决问题的根本途径[12-13]。从长远看施用磷肥会使资源枯竭、环境污染给人类社会带来诸多问题。Smith研究证实,玉米品种间对磷素吸收利用存在差异[14]。因此,通过育种手段挖掘玉米资源中耐低磷自交系,培育耐低磷新品种是解决当前磷素缺乏的重要目标[15]。
研究表明,根系是作物吸收养分、最先感受养分胁迫的主要器官[16],磷素营养的吸收及其耐低磷能力与植物根系的分化与发育密切相关[17-18]。Johnson研究发现,根系构型的改变是作物适应低磷胁迫的反应,低磷条件下作物根构型的改变一般表现浅层根生长增加[19]。与低磷敏感自交系相比,耐低磷自交系根系发达,总根长方面优势明显,积累光合产物多[20-22]。耐低磷玉米自交系通过根系适应性反应提高植物对土壤磷的吸收能力,是吸收和利用土壤中有效磷素的机制之一[23]。探明耐低磷玉米苗期根性状的遗传性质使耐低磷玉米自交系及新品种的选择方法有据可依。
目前水稻、大豆、玉米耐低磷研究主要集中在磷素营养方面,在耐低磷玉米根系性状的主+多基因遗传分析方面报道很少。本试验应用植物数量性状主基因+多基因混合遗传模型分析方法,研究耐低磷玉米苗期根系性状的遗传特性,明确其遗传方式,旨在为玉米耐低磷育种实践提供参考。
1 材料与方法
1.1 供试材料
自交系T和S分别是本课题组多年在天然缺磷土壤上种植,通过生理、生化及表型性状筛选出的典型耐低磷(T)和低磷敏感自交系(S)。2011年丹东凤城市和海南杂交、自交和回交得P1(T)、P2(S)、F1、BC1(B1)、BC2(B2)及F2群体。
1.2 供试土壤
试验在丹东凤城大堡镇天然缺磷地块进行。地势平坦,地力均匀,田块为砂壤土,土壤有机质含量17.04 g/kg,碱解氮69.6 mg/kg,速效磷7.92 mg/kg,速效钾64.51 mg/kg,土壤pH值7.1,是典型的缺磷土壤。试验地未施有机肥,播种时施尿素150 kg/hm2,硫酸钾150 kg/hm2,大喇叭口期追施尿素150 kg/hm2。
1.3 试验设计
大田种植,试验采用随机区组设计,3次重复。P1、P2、F1设为4行区,B1、B2、F2设为12行区。小区行长6 m,行距0.6 m,株距0.3 m。2012年4月28日播种,选择在苗期F2群体出现低磷胁迫造成明显差异时用铁锹取样,保留完整根系,P1、P2、F1各取30株,B1、B2、F2各取180株。
1.4 根形态指标调查与方法
利用WinRHIZO Program(Regent Instruments Inc.,Canada)根系分析系统测定总根长、根表面积、根体积。
1.5 分析软件及方法
数据分析软件由南京农业大学章元明教授提供。各世代平均数的计算及次数分布的统计采用Microsoft Office Excel 2003。

2 结果与分析
2.1 各世代根系性状表现
由图1可见,低磷胁迫下,耐低磷亲本P1根表面积为330.64 cm2,敏感亲本(P2)根表面积为218.33 cm2,P1显著大于P2;F1为381.67 cm2,大于双亲并表现出一定的超亲遗传现象。B1、B2和F2世代表现基本相似,均介于双亲之间。

图1 根表面积差异表现
由图2可见,低磷胁迫下,耐低磷亲本(P1)总根长为1 378.57 cm,敏感亲本(P2)总根长为878.57 cm,P1显著大于P2;F1总根长为1 435.71 cm,表现与P1相近,两者差异不显著,F2接近P2;两回交世代总根长分别为823.60 cm和782.70 cm,二者表现基本相似,均小于双亲并接近敏感亲本。
由图3可见,低磷胁迫下,各世代根体积有明显差异。耐低磷亲本(P1)根体积为4.56 cm3,敏感亲本(P2)根体积为2.94 cm3,P1显著大于P2;F1根体积为2.94 cm3,大于P1,但两者差异不显著,F2世代和两回交世代表现基本相似,均介于双亲之间。
表2 各世代根性状遗传模型适应性检验

模型世代U12U22U32nW2Dn根表面积(E_1_0)P10.015(0.9069)0.000(0.9989)0.334(0.6360)0.03960.0863F10.211(0.6583)0.493(0.5838)1.181(0.3834)0.09330.1571P30.018(0.9531)0.030(0.9931)0.103(0.4480)0.08780.1088B10.417(0.3811)2.594(0.3068)3.486(0.0975)0.16040.0685B20.328(0.5693)1.460(0.4038)0.588(0.4986)0.15180.0739F20.835(0.3841)0.430(0.3961)0.073(0.4875)0.38340.0970总根长(C_0)P10.342(0.5420)0.1280(0.8069)0.409(0.5506)0.24090.2043F10.497(0.4807)0.010(0.9188)3.102(0.1499)∗0.11170.1452P20.003(0.9579)0.014(0.9042)0.070(0.7912)0.04730.0977B10.448(0.5033)0.534(0.4648)0.110(0.7402)0.18500.0708B20.556(0.4557)1.057(0.3038)0.418(0.5338)0.17520.0591F20.618(0.4317)0.557(0.4553)0.003(0.9529)0.20490.0823根体积(E_1_1)P10.223(0.6182)0.175(0.6766)0.051(0.6286)0.07100.1256F11.806(0.1786)1.400(0.1368)0.217(0.6228)0.19720.1801P22.591(0.1145)2.077(0.0785)0.817(0.3661)0.28810.7813∗B12.312(0.0788)4.658(0.0211)∗1.482(0.1151)0.5887∗0.6131∗B20.119(0.7204)0.315(0.5758)0.826(0.2632)0.14350.0822F20.626(0.4290)0.775(0.3787)0.210(0.6471)0.11420.0661
注:“*”表示在5%水平显著。

图2 总根系长度差异表现
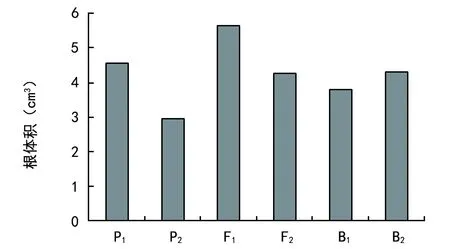
图3 根体积差异表现
2.2 各世代根系性状遗传模型
由表1可见,B_1_1、E_1_0和E_1_1模型下根表面积的AIC值较小,分别为7 205.54、7 209.33和7 215.48,对以上3模型做适应性检验结果显示,分别有9个、0个和5个统计量达到显著水平,E_1_0模型下统计量显著个数最少,固E_1_0模型即2对加性-显性-上位性主基因+多基因混合遗传模型作为根表面积遗传模型。
表1 各世代根性状遗传模型AIC值

模型AIC值表面积总根长根体积A_17239.848015.882884.45A_27241.188022.562814.79A_37248.158245.652718.31A_47242.368246.982826.18B_1_17205.547712.942732.52B_1_27238.287735.462672.52B_1_37241.227828.522758.00B_1_47241.777865.602702.57B_1_57244.217844.642782.83B_1_67242.677889.642684.64C_07241.877705.632617.35C_1--2650.87D_07240.518454.992589.01D_1-8565.77-D_2-8645.22-D_3-7820.332654.42D_4--2590.40E_1_07209.337822.152545.99E_1_17215.487848.272579.75E_1_27315.187964.242593.67E_1_37331.267941.402611.30E_1_47388.488216.332652.30E_1_57390.538348.992654.86E_1_67389.89--
表4 各世代根性状二阶参数估计

二阶参数估计值 根表面积 总根长 根体积 B1B2F2B1B2F2B1B2F2σ2p9452.6815544.6415464.5493281.09158267.15171684.203.557.495.80σ2mg5194.1310054.0910205.991.953.843.15σ2pg27.41483.732830.4455446.8465713.2876248.470.081.480.55σ2e4258.555490.554258.551.651.651.65h2mg(%)50.7164.6866.0056.3234.8464.32h2pg(%)0.293.1118.3059.4441.5244.413.1547.2610.81h2mg+h2pg(%)51.0067.7984.3059.4782.1075.13

同理可知,C_0模型下总根长的AIC值最小,为7 705.63,且选择统计量达到显著的个数(1个)为最少,C_0为总根长的最适模型即加性-显性-上位性多基因混合遗传模型;E_1_1模型下根体积的AIC值相对较小,为2 579.75,同时适应性检验统计量显著水平个数(4个)为各模型最少,固E_1_1模型为根体积遗传模型。
2.3 各世代根性状遗传参数估计
由表3和表4可知,根长受加性-显性-上位性多基因控制,在F2世代,多基因遗传率为44.41%,遗传效率最高,环境变异占表型变异平均为69.02%,环境对植物总根长的影响较大。
表3 各世代根性状一阶参数估计

一阶参数估计值根表面积总根长根体积m176.401309.193.02m2197.511368.692.46m3220.93726.563.46m474.26717.355.27m5213.14697.991.46m6173.15775.804.04da68.451.73db68.452.05ha-22.48-0.67hb-22.48-0.67i67.150.89jab-21.48-0.89jba-21.48-0.89l129.782.68
注:m为6世代平均值;d为主基因的加性效应;[d]为多基因的加性效应;[h]为多基因的显性效应;i为加性效应;j为互作效应;l为显性效应。
控制根体积的2对主基因存在加性、显性、加性×加性、显性×显性、加性×显性效应。群体均值m为3.29,2对主基因的加性效应值分别为1.73和2.05,显性效应和互作效应为-0.67和-0.89,均为负向作用。主基因显性效应的互作大于加性效应的互作。在B1、B2和F2世代中,主基因遗传率分别为54.93%、64.62%和54.31%,多基因遗传率分别为2.25%、19.76%和9.48%,其主基因+多基因的遗传率分别为57.18%、84.38%和63.79%,在B2世代遗传率较高,环境变异占表型变异的22.03%~46.48%,环境对低磷条件下根体积有一定的影响。
根表面积的遗传受2对加性-显性-上位性主基因+多基因控制,2对主基因存在加性、显性、加性×加性、显性×显性、加性×显性效应。2对主基因的加性效应(d)均为68.45,表明主基因对根表面积的遗传起正向效应。2主基因的显性效应(h)均为-22.48,表明主基因对根表面积的遗传起负向效应。主基因间互作效应中,加性×加性效应(i)为67.15,显性×显性(l)为129.78。主基因间加性×显性互作效应(j)均为-21.48。在B1、B2和F2世代,主基因遗传率分别为50.71%、64.68%和66.00%,多基因遗传率分别为0.29%、3.11%和18.30%,其主基因+多基因的遗传率分别为51.00%、67.79%和84.30%,所以在F2选择效率最高,各群体的遗传变异占表型变异的50.71%~66.00%,平均为60.46%。环境变异占表型变异的34.00%~49.29%,平均为39.54%,环境对低磷条件下根表面积的生长具有一定的影响。
3 讨 论
本研究中,玉米自交系的根系性状指标属于数量性状遗传体系,本研究利用主基因+多基因混合遗传模型,揭示玉米耐低磷主基因和多基因遗传效应大小,为进一步耐低磷育种提供理论依据。主基因+多基因混合遗传模型虽然能明确耐低磷特性的表型控制遗传机理,但尚不能定位有关基因,国内外对于耐低磷玉米自交系根系性状的研究多数集中在表型性状及营养利用上,而在基因遗传控制方面的研究未见报道,本研究为耐低磷玉米自交系的筛选和杂交种的选育提供理论参考。
章爱群等[26]认为,杂交、回交技术能改善作物品种的磷营养状况,继而选育耐低磷基因型作物品种。大多数研究表明,玉米根系与磷素吸收有很大的关系,陈俊意等[27]认为,玉米主根与磷素吸收呈现显著正相关。王庆仁等[28]认为,小麦、玉米、大豆等作物对磷的吸收利用主要取决于根系的生物学特性,本研究正是利用玉米根系这一主要性状对低磷胁迫下根系性状的遗传规律进行研究并得出明确的结论。
玉米根系数量性状是受多基因控制的,这些基因呈累加效应,研究表明大多数性状的遗传是受主基因+多基因控制,对于受主基因控制的性状,通过单交重组或简单回交转育的方法就可以实现改良,为了提高育种效率,还可以选用含有目的基因是主效基因的亲本进行轮回选择。主基因+多基因遗传六世代联合分离分析方法对于3对以上主基因的存在,则找不到合适的模型,给我们的启示是:如果需改良的性状遗传由多个主基因控制,则通过基因重组改良困难较大且实际意义也不是很大。
4 结 论
玉米自交系低磷环境下,根表面积受2对主基因控制+多基因混合控制,主基因间存在加性、显性及互作效应,在F2选择效率最高,环境对根表面积的影响较小。根体积受2对主基因控制+多基因混合控制,根体积遗传效率在B2世代较高,具有较好的筛选效果,环境对根表面积的影响较小。低磷环境下玉米自交系根体积和根表面积的遗传变异对根系的生长起主导作用,受环境影响相对较小,可作为耐低磷玉米自交系筛选指标与王庆仁[28]研究基本一致。
总根长受加性-显性-上位性多基因控制,在F2世代遗传效率最高,环境变异占表型变异平均为69.02%,总根长受环境影响远大于自身遗传变异效应,玉米自交系总根长的生长易受环境影响,所以早代选择可能具有一定的假象,如果以总根长做为筛选指标,应在F2代以后更高世代进行筛选。
[1]岳辉,曹敏建,于海秋,等.耐低磷玉米总根长的主基因+多基因遗传分析[J].沈阳农业大学学报,2014,45(5):604-607.
[2]于海秋,李兴涛,刘宇,等.耐低钾玉米总根长的主基因+多基因遗传分析[J].玉米科学,2011,19(4):27-30.
[3]Are N,Airfare J,Okada K,et al.Phosphorus uptake by pigeon pea and its role in cropping system of the India subcontinent[J].Science,1990,248:477-480.
[4]鲁如坤.磷在土壤中有效性的衰减[J].土壤学报,2000,37(3):323-328.
[5]岳辉,曹敏建,鲁俊田,等.耐低磷玉米自交系苗期总根长的主基因+多基因遗传分析[J].沈阳农业大学学报,2014,45(5):604-607.
[6]杜鹃,曾亚文,杨树明,等.云南粳稻耐低磷特性的主基因加多基因遗传分析[J].生态环境,2007,16(3):920-925.
[7]杜育梅,刘国道.植物利用磷素的有效性研究进展[J].华南热带农业大学学报,2007,1(2):42-45.
[8]杨珏,阮晓红.土壤磷素循环及其对土壤磷流失的影响[J].土壤与环境,2001,101(3):256-258.
[9]岳辉,曹敏建,于海秋,等.玉米低磷耐性性状的主基因+多基因遗传分析[J].玉米科学,2014,22(5):39-43.
[10]Bake D E,Jarrell A E.Phosphor us Uptake from Soils by Corn Hybrids Selected for High and Low Phosphorus Accumulation[J].Argon J,1970(62):103-106.
[11]马祥庆,梁霞.植物高效利用磷机制的研究进展[J].应用生态学报,2004,15(4):712-716.
[12]李晓臣.抗倒伏油菜根、茎解剖结构及木质素含量和木质素合成关键基因的表达研究[D].南京:南京农业大学2010:25-39.
[13]刘建中,李振声,李继云.利用植物自身潜力提高土壤中磷的生物有效性[J].生态农业研究,1994,2(1):16-23.
[14]Duff S M,Sarah G,Platoon W C.The role of acid phosphates in plant phosphorus metabolism[J].Physiological Plant arum,1994,90:791-800.
[15]Hassling M.Organic and inorganic in soil phosphates and acid phosphor ate activity in the rhizoid sphere of 80 years old Norway spruce (Piceaabies(L.)Karsr) trees[J].Biology and fertility of soil,1989,8(2):128-133.
[16]兰海,苏鹏,周树峰,等.玉米与四倍体大刍草杂交结实性的遗传分析[J].核农学报,2014,28(3):393-397.
[17]苏顺宗,徐刚,刘丹,等.两种磷水平下玉米苗期根系性状的QTL定位[J].玉米科学,2013,21(4):33-37.
[18]米国华,邢建平,陈范骏.玉米苗期根系生长与耐低磷的关系[J].植物营养与肥料学报,2004,10(5):468-472.
[19]Hageman C E,Garbage.A novel phytane with sequence similarity to purple acid phosphates is expressed in cotyledons of germination soybean seedlings[J].Plant Physiol 2001,126(4):1 598-1 698.
[20]袁硕,彭正萍,沙晓晴,等.玉米杂交种对缺磷反应的生理机制及基因型差异[J].中国农业科学,2010,43(1):51-58.
[21]丁广大,陈水森,石磊,等.植物耐低磷胁迫的遗传调控机理研究进展[J].植物营养与肥料学报,2013,19(3):733-744.
[22]林海建,张志明,高世斌,等.玉米耐低磷研究现状及磷高效育种策略的探讨[J].中国农学通报,2008,24(1):181-185.
[23]张吉海,高世斌,杨克诚,等.玉米耐低磷种质资源的筛选与鉴定[J].植物遗传资源学报,2008,9(3):335-339.
[24]盖钧镒,章元明,王建康.植物数量性状遗传体系[M].北京:科学出版社,2003:59-75.
[25]章元明,盖钧镒,王建康.利用回交B1和B2及F2群体鉴定数量性状两对主基因+多基因混合遗传模型[J].生物数学学报,2000,15(3):358-366.
[26]张爱群,贺立源,李德华.作物耐低磷营养性状遗传研究进展[J].山地农业生物学报,2007,27(2):162-169.
[27]陈俊意,徐莉.低磷土壤下玉米根系质量的混合遗传分析[J].西南师范大学学报(自然科学版),2009,34(1):64-66.
[28]王庆仁,李继云,李振声.植物高效利用土壤难溶态磷研究动态及展望[J].植物营养与肥料学报,1998,4(2):26-29.
Genetic Analysis of Root Characteristics with Mixed Model of Major Gene and Polygene in Tolerance to Low Phosphorus Inbred Lines
LUJuntian1,RENLili2,YUEHui1,CHENXiaoxu1,WANGZuoying1,CHENLi1,FENGGuang2
(1.Dandong Academy of Agricultural Science,Fengcheng Liaoning 118109,China;2.Liaoning Danyu Seed Science and Technology Co.,Ltd.,Fengcheng Liaoning 118109,China)
At present,evaluation the ability of maize inbred lines resistant to low phosphorus lack of unified indicators,in order to proven genetic mechanisms of resistance under low phosphorus corn seedling root traits,providing theory basis screen to low phosphorus tolerance maize inbred lines and hybrid breeding to the major gene and polygenic inheritance model was applied to study the genetic mechanisms of root characteristics at seedling stage.The results showed that the total root lengths were dominated by additive-dominant-epistemic gene and select the most efficiency in the F2,but the environment had a greater influence;Root volume was dominated by two pairs of additive-dominant-epistemic major gene+additive-dominant polygenic control, the interactions effects between major genetic and dominant effect genes for the negative effects,select the most efficiency in the B2,Root surface area was dominated by two pairs additive-dominant-epistemic major gene+dominant polygenic,the major dominant genes effect had a negative effect on the root surface area,had a positive role in the gene additive effect,and select the most efficiency in the F2,Root surface area and root volume had less affected by the environment.
corn; inbred lines; root characteristics; genetic analysis of major gene plus polygene
2017-01-12
辽宁省农业领域青年科技创新人才培养计划(2014009)。
鲁俊田(1985—),男,助理研究员,主要从事玉米育种研究;E-mail:lujuntian5211@126.com。
10.16590/j.cnki.1001-4705.2017.07.017
S 513
A
1001-4705(2017)07-0017-06

