远志汤有效成分对APP/PS1小鼠氧化损伤的保护作用机制研究*
董海影,丛欢,王俊苹,弓箭,柏青杨
(齐齐哈尔医学院病理学院,黑龙江 齐齐哈尔 161006)
远志汤有效成分对APP/PS1小鼠氧化损伤的保护作用机制研究*
董海影,丛欢,王俊苹,弓箭,柏青杨
(齐齐哈尔医学院病理学院,黑龙江 齐齐哈尔 161006)
目的通过观察远志汤有效成分即β-细辛醚+远志皂苷(TEN)对APP/PS1双转基因小鼠磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/糖原合成激酶3β(GSK-3β)信号通路的调控,探讨远志汤防治阿尔茨海默病(AD)的作用机制。方法将3月龄APP/PS1双转基因小鼠分为模型组、盐酸多奈哌齐组(0.33 mg/kg·d)、β-细辛醚+TEN低、中和高剂量组[18.5、37.0和74.0 mg/(kg·d)],选同月龄C57BL/6小鼠为空白对照组,采用Morris水迷宫法和新物体识别实验检测小鼠的学习记忆能力,采用分光光度法检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)、过氧化氢酶(CAT)活性,以及丙二醛(MDA)含量。采用Western blot检测GSK-3β、Akt,以及两者磷酸化蛋白表达。结果β-细辛醚协同TEN可增强APP/PS1双转基因小鼠的学习记忆功能,同时还能升高SOD、CAT和GSH-PX的活性,降低MDA含量,诱导Akt的蛋白表达,抑制GSK-3β的表达。结论远志汤有效成分即β-细辛醚+TEN可通过调控PI3K/Akt/GSK-3β信号通路,对APP/PS1双转基因小鼠氧化应激损伤发挥保护作用。
β-细辛醚;远志皂苷;APP/PS1双转基因小鼠;PI3K/Akt/GSK-3β信号通路
阿尔茨海默病(Alzheimer disease,AD)是由多方、多种和多层次因子共同引发而成,其中“自由基损伤”这一因素在AD发病机制的关键环节中起着至关重要的作用,在AD疾病发生的早期即已出现氧化应激,先于老年斑形成,以及神经元纤维缠结的出现[1-2]。AD的致病因素错综复杂,是多种神经递质和病理代谢产物相互协同促发而成,导致其靶向治疗药物开发困难。目前经由美国FDA批准,临床上广泛使用的,治疗AD的药物仅有几个,但几乎均为胆碱酯酶抑制剂,其远期疗效并不理想,也使临床治疗存在诸多困难[3]。因此,研究我国具有知识产权的抗AD创新药物和新方法是当前一项十分紧迫的研究任务。
临床上运用中医的“整体观念”与“辨证论治”防治AD,有效地缓解了疾病的进程,改善了患者的生活状态,有效地减轻了家庭和社会的负担[4]。中药复方多方位、多靶点和整体调控的优势,与AD多种致病因素互为因果的特点相互契合。其中石菖蒲-远志药是治疗AD方剂的基本结构,用药频率为34%[5]。
本论文就是在上述研究基础上,依托选自《政和圣济总录》的远志汤(由远志和石菖蒲按照1∶1配伍而成),观察石菖蒲的有效成分β-细辛醚(β-asarone)与远志的有效成分远志皂苷(Tenuigenin,TEN)协同作用于APP/PS1双转基因小鼠,分析β-细辛醚+TEN对APP/PS1双转基因小鼠磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(proteinkinase B,AKt)/糖原合成激酶 3β(Glycogen synthase kinase 3β,GSK-3β)通路的影响,从而进一步探讨远志汤对氧化应激损伤的保护作用和治疗AD的作用机制。
1 材料与方法
1.1 药物与试剂
β-细辛醚由天津一方科技有限公司提供(CAS:00011017-T9K),TEN由南京景竹生物科技有限公司提供(CAS:JZ20160327A),经HPLC测定,纯度均≥98%,盐酸多奈哌齐(donepezil hydrochloride tablets,DHT)由卫材(中国)药业有限公司提供(CAS:C14200012042),超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)均由南京建成生物工程研究提供(CAS:20150422、20150423、20150423和20150417),Akt和GSK-3β一抗均由美国Cell Signaling Technology公司提供(CAS:9315S、27C10)。
1.2 动物
APP/PS1双转基因小鼠(南京生物医药研究院,编号D000268),3月龄,50只,雄性;C57BL/6J小鼠,3月龄,10只,雄性。饲养于齐齐哈尔医学院实验动物中心SPF级饲养室。
1.3 分组和给药
将3月龄APP/PS1双转基因小鼠分为模型组、盐酸多奈哌齐组[0.33 mg/(kg·d)]和药物低、中和高剂量组 [18.5、37.0和 74.0 mg/(kg·d),均由β-细辛醚和TEN按照1∶1配制而成],选同月龄C57BL/6小鼠为空白对照组,空白对照组和模型组给予等体积的生理盐水(normal saline,NS)灌胃,1次/d,连续灌胃90 d。
1.4 Morris水迷宫检测
给药结束后进行Morris水迷宫行为测试。水迷宫为一直径150 cm,高60 cm的不锈钢圆形水池,水池侧壁上配备一长杆,上悬挂红外摄像头。水迷宫内设置一座底面为6 cm×10 cm,高为40 cm的有机玻璃平台。以水迷宫中心点为原点,在迷宫的侧壁上标明东、南、西、北4个方向的入水点。标明入水点后,将平台放在迷宫西南象限正中距池壁22 cm处,迷宫内注入水,水温控制在(22±1)℃,加入奶粉后,迷宫中上位水线高于安全平台1 cm,训练期环境保持安静与参照物不变。训练期间任选东、南、西、北4个方向的入水点,将小鼠面向迷宫壁放入池中,训练间隔为60 s。
1.4.1 定位航行实验 为期5 d,4次/d,选择迷宫侧壁的东向为入水点,摄像头记录小鼠的游泳轨迹图与逃避潜伏期,即小鼠找到水下平台的时间,设定逃避潜伏期的时限为2 min。
1.4.2 空间探索实验 定位航行实验结束后将水下平台撤除,在同一入水点将小鼠面向池壁放入水中,让小鼠在无平台情况下寻找记忆中的平台,记录在2 min内跨过原平台位置的次数。
1.4.3 新物体识别实验 检测箱为60 cm×40 cm×80 cm,由黑色聚酯塑料材质构成的封闭箱,箱左右内侧壁镶嵌LED灯条,顶部悬挂摄像头观察动物的活动情况及探索过程。实验检测过程分为适应期、熟悉期和测试期3个阶段。①适应期:为期3 d,每天将小鼠依次放入检测箱内,熟悉环境10 min;②熟悉期:第4天,将2个完全相同的正方体红色积木块放入检测箱内对称的位置处,两个积木距离箱侧壁与箱后壁的距离均为10 cm,将小鼠放入熟悉5 min;③测试期:间隔30 min后,将一个红色积木替换为大小相近的绿色圆柱形积木,将小鼠放入检测箱内,记录5 min内小鼠对新颖物体即绿色圆柱形积木(T novel,TN)和红色正方体即熟悉物体(T familiar,TF)的探索时间,以小鼠鼻尖距被识别物体的距离不超过2 cm或用鼻子接触到被识别物体为探究行为。应用认知指数(recognition index,RI)来评价动物的学习记忆能力,计算公式为RI=TN/(TN+TF)×100%。
1.5 SOD、CAT和GSH-PX活力检测以及MDA含量测定
Morris水迷宫检测与新物体识别实验结束后,小鼠禁食12 h。于第2天,快速断头取脑,借助组织钳沿着枕骨大孔,向左右分开颅骨,取出大脑,在冰盘上分离皮层和海马组织,匀浆,离心,获取上清液,用酶标法检测SOD,硫代巴比妥酸法检测MDA,分光光度法检测CAT,比色法检测GSH。
1.6 Western blot检测AKt、GSK-3β以及磷酸化蛋白水平
冰盘上分离海马组织,剪碎置于EP管中,加入组织裂解液,研磨裂解30 min,离心取上清,测定蛋白含量。检查和组装玻璃板,灌注分离胶液,制备胶板,取蛋白样品与上样缓冲液混合煮沸变性,电泳分离,转至聚偏二氟乙烯膜,加入5%脱脂牛奶封闭,加入一抗孵育过夜,辣根过氧化物酶标记二抗孵育,显影成像。扫描膜后应用Image J2x分析软件分析条带灰度,通过半定量比较分析Akt、p-Akt、GSK-3β和p-GSK-3β蛋白的表达水平。
1.7 统计学方法
采用SPSS16.0软件进行统计学分析,数据以均数±标准差(±s)表示,采用单因素方差分析,在方差分析有意义的基础上,再行SNK-q或LSD-t进行两两比较,P<0.05为差异具有统计学意义。
2 结果
2.1 β-细辛醚+TEN对APP/PS1双转基因小鼠学习记忆能力的影响
2.1.1 Morris水迷宫检测结果 第5天定位航行实验检测发现,与空白对照组相比,模型组在第3象限停留时间(residence time in the third quadrant,RTQ)、跨越隐匿平台的次数、逃逸潜伏期及入水朝向角度差异有统计学意义(P<0.05),模型组小鼠RTQ和跨越隐匿平台的次数减少,逃逸潜伏期延长,入水朝向角度增加;与模型组相比,盐酸多奈哌齐组和药物各剂量组的RTQ、跨越隐匿平台的次数、逃逸潜伏期及入水朝向角度差异有统计学意义(P<0.05),盐酸多奈哌齐组和药物各剂量组的RTQ和跨越隐匿平台的次数增加,逃逸潜伏期缩短,入水朝向角度减小。见表1和图1。
表1 β-细辛醚+TEN对各组小鼠空间学习记忆能力的影响 (n =10,±s)

表1 β-细辛醚+TEN对各组小鼠空间学习记忆能力的影响 (n =10,±s)
注:1)与空白对照组比较,P <0.05;2)与模型组比较,P <0.05
组别 RTQ/s 跨越隐匿平台的次数 入水朝向角度/(°) 逃避潜伏期(第5天)/s空白对照组 33.16±5.77 5.82±1.19 40.50±26.39 8.17±11.49模型组 14.61±4.851) 1.20±0.691) 67.52±34.961) 66.56±20.071)盐酸多奈哌齐组 29.08±8.302) 4.93±1.382) 45.25±27.452) 25.22±2.342)药物低剂量组 23.53±7.44 3.48±0.892) 47.73±20.162) 32.56±10.042)药物中剂量组 27.65±6.012) 4.62±0.932) 44.20±17.332) 22.14±8.302)药物高剂量组 30.85±7.932) 5.16±1.522) 42.09±15.752) 14.07±6.102)F值 39.91 80.924 8.095 57.224 P值 0.000 0.000 0.002 0.000
2.1.2 新物体识别实验检测结果 模型组与空白对照组比较,差异有统计学意义(P<0.05),模型组小鼠RI降低(q=6.222);盐酸多奈哌齐和药物各剂量组与模型组比较,差异有统计学意义(P<0.05),盐酸多奈哌齐组、药物各剂量组APP/PS1双转基因小鼠的RI升高(q=4.834、4.287、4.775和5.587)。见图2。

图1 各组小鼠定位航线实验轨迹图
2.2 各组小鼠SOD、CAT、GSH-PX活力和MDA含量的比较
模型组小鼠脑皮层与海马SOD、CAT、GSH-PX活力和MDA含量的影响与空白对照组比较,差异有统计学意义(P<0.05),模型组SOD、CAT和GSHPX活性降低,MDA含量增高;盐酸多奈哌齐和药物各剂量组与模型组比较,差异有统计学意义(P<0.05),盐酸多奈哌齐组和药物各剂量组SOD、CAT和GSHPX活性升高,同时MDA含量降低,且大体上呈现剂量依赖效应(见表2)。
2.3 β-细辛醚+TEN对PI3K/Akt/GSK-3β信号通路的影响
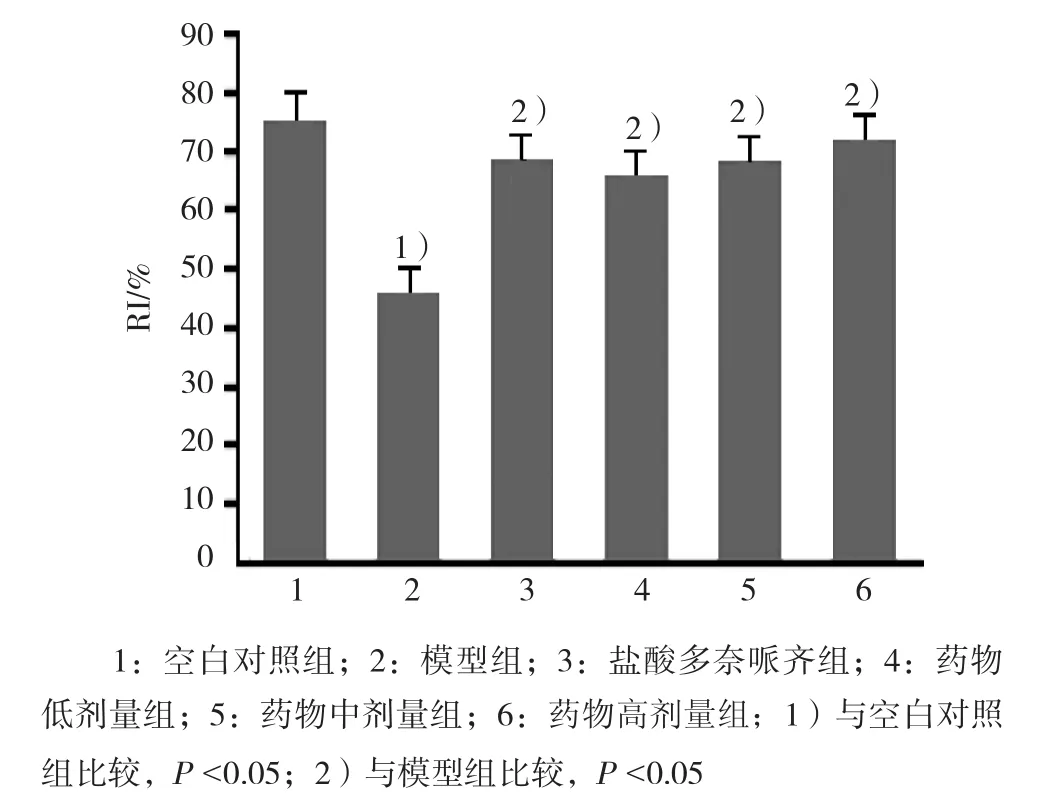
图2 β-细辛醚+TEN 对各组小鼠认知指数的影响 (n =10,±s)
表2 各组小鼠SOD、CAT、GSH-PX活力和MDA含量的比较 (n =10,±s)

表2 各组小鼠SOD、CAT、GSH-PX活力和MDA含量的比较 (n =10,±s)
注:1)与空白对照组比较,P <0.05;2)与模型组比较,P <0.05
组别 GSH-PX/(u/mg) MDA/(nmol/mg) SOD/(u/mg) CAT/(u/mg)空白对照组 609.69±45.59 7.75±1.36 33.59±3.08 30.89±2.81模型组 314.61±54.311) 15.17±4.771) 17.30±2.151) 13.12±1.081)盐酸多奈哌齐组 411.26±30.172) 10.12±2.66 23.19±4.482) 21.78±3.752)药物低剂量组 528.72±30.452) 8.00±1.942) 29.47±3.222) 25.17±2.492)药物中剂量组 579.82±38.752) 7.47±0.992) 30.77±2.93 2) 28.03±3.292)药物高剂量组 411.26±30.172) 10.12±2.66 23.19±4.482) 21.78±3.752)F值 68.734 17.440 75.477 96.048 P值 0.000 0.000 0.000 0.000
Western blot检测结果表明,与空白对照组比较,模型组即APP/PS1双转基因小鼠的p-Akt和p-GSK-3β的蛋白表达水平差异有统计学意义(P<0.05),模型组降低(q=13.330和12.806);而盐酸多奈哌齐和药物各剂量组与模型组比较,差异有统计学意义(P<0.05),盐酸多奈哌齐组和药物各剂量组p-Akt和p-GSK-3β的蛋白表达增加(q=16.278、11.023、12.433和 17.945;q=18.224、14.119、15.433和19.373),且大体上呈现剂量依赖效应(见图3)。

图3 β-细辛醚+TEN对各组小鼠Akt和GSK-3β磷酸化水平的影响 (n =10,±s)
3 讨论
AD是一种以进行性认知功能减退为特征的中枢神经系统退行性疾病。在65岁的老年人群当中发病率约10%,而在85岁以上的老年人群当中发病率可高达47%[6]。中国已经进入了老龄化社会,AD发病率出现了逐年增高的趋势,给社会和家庭增加了沉重的负担。
国内外医疗工作者对AD的研究已逾百年,提出了诸多假说,研发了多种药物,但迄今为止,发表机制尚不十分清楚,疗效显著的药物尚不十分明晰[7]。氧化应激学说的提出,为攻克AD探索出了一条新途径,氧化应激发生于AD疾病进展的早期,早于老年斑和神经元纤维缠结的出现[8]。
对抗活性氧簇(reactive oxygen species,ROS)的抗氧化防御体系包括酶系统,如SOD、GSH-PX和CAT,这些酶代表着机体的第一道抗氧化防御体系。其中SOD是体内天然存在的氧自由基清除剂,其活性的高低可以作为机体清除氧自由基能力的指标,而GSH-PX是机体内重要的抗氧化剂,能够清除自由基,发挥抗氧化作用,而MDA是体内的脂质代谢产物,是脂质过氧化的主要降解产物,其含量的高低可以作为机体细胞受自由基攻击程度的指标[9]。
PI3K的下游直接作用靶点为蛋白激酶Akt,PI3K/Akt信号途径下游调节氧化应激的靶基因是GSK-3β[10]。研究发现雌二醇可通过激活AD脑神经细胞中PI3K,进而诱导Akt发挥其神经保护作用[11]。通过美国FDA认证,已经应用于AD临床治疗的乙酰胆碱酯酶抑制剂类药物和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)阻滞剂类药物,均可以通过调控GSK-3丝氨酸9位磷酸化水平来抑制其活性,进而发挥拮抗AD的药理活性[12]。国内研究亦有报道[13],PI3K/Akt/GSK-3β通路与学习记忆功能密切相关。虽然实验研究结果与流行病学的大数据表明,抗氧化治疗能保护神经元,拮抗AD样症状,可是临床上将抗氧化剂维生素等用于治疗AD的疗效却差强人意,表明如果想要在抗氧化这一方向上攻克AD,需要寻找更加有效的抗氧化途径与策略,即需要激活内源性神经元的抗氧化防御系统等。
中医学认为“痰浊阻滞脑髓”是发病机制复杂AD形成过程中的关键环节。如元代医学家危达斋在其所著的《世医得效方》中就曾指出“痰迷心包,健忘失事”。《政和圣济总录》就这一症候收录了民间验方—由远志和石菖蒲配伍而成的远志汤[14]。《神农本草经》将具有祛痰开窍功效的远志和开窍豁痰效能的石菖蒲归为醒神益智的神药。远志和石菖蒲的主要药理活性成分分别为TEN和β-细辛醚。
本文主要采用Morris水迷宫和新物体识别实验检测远志汤有效成分,即TEN和β-细辛醚对各组小鼠的学习和记忆能力的影响。模型组小鼠表现出反应迟钝类似AD患者的行为学症状,RTQ与跨越隐匿平台的次数减少,逃逸潜伏期延长,入水朝向角度增大,认知指数亦降低。而TEN和β-细辛醚能增加模型组小鼠的RTQ与跨越隐匿平台的次数,缩短逃逸潜伏期,缩小入水朝向角度,提升认知指数,能改善APP/PS1小鼠的学习和空间记忆能力。说明经过β-细辛醚与TEN的协同治疗,APP/PS1双转基因小鼠的AD样症状得到改善。
本文以APP/PS1转基因小鼠为依托,研究远志汤有效成分,即β-细辛醚+TEN抗AD氧化应激作用及对PI3K/Akt/GSK-3β通路信号分子的影响,进而探讨复方远志汤治疗AD的作用机制。实验结果显示,β-细辛醚+TEN在抑制APP/PS1双转基因小鼠SOD、CAT和GSH-PX活性降低与MDA含量升高的同时,还能升高APP/PS1双转基因小鼠Akt与GSK-3β磷酸化蛋白表达水平,可见β-细辛醚+TEN能干预体内的氧化应激反应,通过调节体内抗氧化防御体系来发挥抗AD作用。
本研究为阐明远志汤抑制Aβ诱导的神经元氧化应激的分子调控机制提供实验依据和理论支持,同时为提出防治AD的新策略和寻找具有新作用靶点的中药复方提供新思路。
[1]LÓPEZ N, TORMO C, DE BLAS I, et al. Oxidative stress in Alzheimer’s disease and mild cognitive impairment with high sensitivity and specificity[J]. J Alzheimers Dis, 2013, 33(3): 823-829.
[2]郭可, 缪红, 王树松, 等. 半枝莲黄酮抑制复合Aβ所致大鼠皮层细胞NFT沉积及其调节机制[J]. 中国病理生理杂志, 2016,32(12): 2147-2156.
[3]GAUTHIER S, MOLINUEVO J L. Benefits of combined cholinesterase inhibitor and memantine treatment in moderatesevere Alzheimer’s disease[J]. Alzheimers Dement, 2013, 9(3):326-331.
[4]宗鑫, 季旭明, 魏凤琴, 等. 基于中医传承辅助系统的治疗老年痴呆组方规律分析[J]. 中国中药杂志, 2014, 39(4): 640-643.
[5]曾子轩, 化杜平, 吴赛, 等. 石菖蒲远志配伍对消化系统作用研究 [J]. 湖北中医杂志 , 2015, 37(10): 75-77.
[6]CHAN K Y, WANG W, WU J J, et al. Epidemiology of Alzheimer’s disease and other forms of dementia in China, 1990-2010: a systematic review and analysis[J]. Lancet, 2013, 381(9882): 2016-2023.
[7]EVANS J L, GOLDFINE I D. A New road for treating the vascular complications of diabetes: so let’s step on the gas[J]. Diabetes,2016, 65(2): 346-348.
[8]HUANG X S, CHEN H P, YU H H, et al. Nrf2-dependent upregulation of antioxidative enzymes:a novel pathway for hypoxic preconditioning-mediated delayed cardioprotection[J]. Mol Cell Biochem, 2014, 385(1-2): 33-41.
[9]RAMESH A, VARGHESE S S, DORAISWAMY J N, et al. Herbs as an antioxidant arsenal for periodontal diseases[J]. J Intercult Ethnopharmacol, 2016, 5(1): 92-96.
[10]WANG Y, YANG R, GU J, et al. Cross talk between PI3KAKT-GSK-3β and PP2A pathways determines tau hyperphosphorylation[J]. Neurobiol Aging, 2015 36(1): 188-200.
[11]CHEN Y, SU Y, RUN X, et al. Pretreatment of PC12 cells with 17β-estradiol prevents Aβ-induced down-regulation of CREB phosphorylation and prolongs inhibition of GSK-3β[J]. J Mol Neurosci, 2013, 50(3): 394-401.
[12]NOH M Y, KOH S H, KIM S M, et al. Neuroprotective effects of donepezil against Aβ42-induced neuronal toxicity are mediated through not only enhancing PP2A activity but also regulating GSK-3β and nAChRs activity[J]. J Neurochem, 2013, 127(4):562-567.
[13]刘万富, 陈国忠, 刘鸿章, 等. 电休克影响抑郁模型大鼠认知功能的机制研究[J]. 中国现代医学杂志, 2016, 26(1): 5-10.
[14]巴哈尔 哈德尔, 张凯, 王晓林, 等. 名老中医治疗老年性痴呆的组方用药规律[J]. 中华中医药杂志, 2012, 27(10): 2684-2687.
(张蕾 编辑)
Study on protective effect of effective components of Polygala Decoction on oxidative damage in APP/PS1 double transgenic mice*
Hai-ying Dong, Huan Cong, Jun-ping Wang, Jian Gong, Qing-yang Bai
(Pathological Diagnosis Center, Qiqihar Medical University, Qiqihaer, Heilongjiang 161006, China)
ObjectiveTo observe the regulative effect of β-asarone and Tenuigenin on the PI3K/Akt/GSK-3β signaling pathway in APP/PS1 double transgenic mice, to explore the mechanism of Polygala Decoction in prevention and treatment of Alzheimer’s disease.MethodsThree-month-old APP/PS1 double transgenic mice were divided into model group, Donepezil hydrochloride group (0.33 mg/kg·d), high-dose β-asarone and Tenuigenin group, medium-does β-asarone and Tenuigenin group and low-dose β-asarone and Tenuigenin group (18.5, 37.0 and 74.0 mg/kg·d). C57BL/6 mice of the same age were selected as the control group. Morris water maze test and new object recongnition task were used to measure the spatial learning and memory ability. Spectrophotometer was used to detect the activity of SOD, catalase (CAT) and glutathione peroxidase (GSH-PX) and the content of MDA.Western blot was performed to evaluate the expressions of glycogen synthase kinase-3β (GSK-3β), p-GSK-3β, Akt and p-Akt.Resultsβ-asarone and Tenuigenin significantly ameliorated the cognitive defect of APP/PS1 double transgenic mice, increased the activity of SOD, CAT and GSH-PX, while decreased the content of MDA, suppressed the activation of GSK-3β and enhanced the activation of Akt.Conclusionsβ-asarone and Tenuigenin can inhibit the oxidative stress of brain tissue, and exhibit positive therapeutic effect on Alzheimer’s disease by regulating the activity of the PI3K/Akt/GSK-3β signaling pathway.
β-asarone; Tenuigenin; APP/PS1 double transgenic mouse; PI3K/Akt/GSK-3β signaling pathway
R749.1;R-332
A
10.3969/j.issn.1005-8982.2017.28.002
1005-8982(2017)28-0006-06
2017-02-11
国家自然科学基金青年项目(No:81403131)
柏青杨,E-mail:b1bqy7@sohu.com

