土壤中对硝基酚迁移转化和去除技术研究进展
刘星邑,温玉娟,刘 欢,杨悦锁,2*
土壤中对硝基酚迁移转化和去除技术研究进展
刘星邑1,温玉娟1,刘 欢1,杨悦锁1,2*
(1.沈阳大学区域污染环境生态修复教育部重点实验室,沈阳 110044;2.吉林大学地下水资源与环境教育部重点实验室,长春130021)
对硝基酚是一种有毒难降解有机物,在土壤中的来源众多,其主要来源之一就是农业活动中农药的中间代谢。对硝基酚作为新型污染物进入土壤后易被土壤所吸附进而长期蓄积在土壤中对环境造成影响,其降解特征对环境风险的评估具有重要意义。基于国内外的研究进展,综述了对硝基酚的生物毒性、代谢途径和迁移转化过程,并从物理、化学和生物角度出发对对硝基酚的去除技术进行了论述,进而对其污染的修复进行了展望。
对硝基酚;生物毒性;降解;土壤污染
随着工业和农牧业的不断发展,印染、石油化工、医药等领域所产生的硝基酚类物质逐步进入到环境并形成新型污染。农业活动会把诸多农药和化肥成分释放到环境中,其中有机磷农药组分中的硫磷及氧硫磷在微生物的水解作用下可被转化为含硝基的有机农药,含硝基的有机农药在光催化作用下发生光解反应可以生成硝基酚[1]。与此同时,目前环境中84%的对硝基酚则来自于有机磷农药、8%来自合成对乙酰基酚(扑热息痛)、8%来自皮革制造[2]。除此以外,柴油机尾气颗粒(Diesel exhaust particles,DEP)中也含有对硝基酚[3]。由于其具有一定的生物毒性,对硝基酚已被美国环保署以及我国环保部门列为“优先控制污染物”,并因对硝基酚在环境中的长期暴露,可能导致土壤、地表水、地下水受到不同程度的污染。
美国对硝基酚的年产量约为2万t,在我国对硝基酚钠和对硝基酚的年产量为8~10万t,排放含酚废水30~40万t[4]。目前,对硝基酚已经在环境中被检出,淮河江苏段对硝基酚的检出率为100%,平均质量浓度为5.05 μg·L-1[5];钱塘江流域中对硝基酚的最大检出质量浓度为4.550μg·L-1[6];辽河流域浑河沈阳段地表水中检出的对硝基酚质量浓度为8.929 μg·L-1[7]。虽然目前报道的对硝基酚检出地多为河流段,针对土壤中检出对硝基酚的报道甚少,但在不断加强的农业活动强度下,土壤必定受到对硝基酚残留的影响。
对硝基酚在环境中存在一定的累积性和持久性,将对环境造成长期的危害。进入土壤中的对硝基酚会在土壤及地下水环境中迁移,对地表植物和地下水环境构成的危害不可忽视,本文对对硝基酚的物化和生物特性及其在土壤环境中的迁移转化进行初步阐述,并对其污染的修复及其未来的发展进行展望。
1 对硝基酚的物化特性
对硝基酚的纯品为浅黄色结晶,无味,熔点为114~116℃,沸点为279℃。常温下微溶于水(1.6%,25℃),不易随蒸气挥发。易溶于乙醇、氯仿及乙醚。溶于酸液时,淡黄色逐渐退去,pH在3~4之间,无色,溶于碱液时,颜色加深。
硝基酚结构中存在苯环,通常情况下不易发生氧化反应,芳香环难以断裂,并且由于苯环中存在着大π键,在π电子的离域作用下,苯环结构会变得更加牢固,对外界的氧化作用有较强的抵抗力[8]。
2 对硝基酚的毒性机理
酚类污染物是一种中等强度的环境干扰素,可通过皮肤黏膜、呼吸系统及消化系统进入生物体内,使细胞变性并造成蛋白质凝固,严重时可致昏迷死亡。研究表明,对硝基酚的生物毒性会随pH值的降低而增加[9]。柴油机尾气颗粒(Diesel exhaust particles,DEP)在空气中的暴露成为大气环境中对硝基酚的重要来源之一,尾气颗粒可通过呼吸系统被人体吸收,同时对硝基酚随之进入人体,造成呼吸系统疾病,如肺癌[10]、过敏性鼻炎[11]及支气管哮喘样疾病[12]等。此外,对硝基酚已被证明是一种环境内分泌干扰物(Environmental endocrine disruptors,EEDs)[12],它具有雌激素和抗雄激素活性[13],可引起睾丸激素分泌紊乱[14]。Ramos等[15]研究了硝基酚对蛋白核小球藻生长的抑制,实验表明,细胞内污染物在0.1~1.6 mmol·g-1和0.5~17 mmol·g-1浓度时可抑制 10%~50%的细胞生长。这与对硝基酚浓度为 0.7~2.3 mmol·g-1、2~14 mmol·kg-1时抑制羊角月牙藻的情况完全一致,随着污染物疏水性和氢结合供体能力的强化、氢结合受体能力的弱化,其毒性会有所增强。
对硝基酚具有环境内分泌干扰物(EEDs)特性,会通过干扰生物体内参与调节发育过程的天然激素的合成、分泌、运输、结合、反应、代谢等过程,对脊柱类生物体的代谢功能系统产生外源性的影响[16]。外源性的物质进入生命体后,代谢转化过程会经由肝脏,部分外源性物质经过生物代谢转化后会形成毒性更高的次级产物,但也存在许多外源性物质进入生命体后被转化为无毒性或低毒性的产物。对硝基酚进入动物体内后一般经由肝脏代谢,代谢最终产物为葡萄糖醛栓盐(PNP-G)或硫酸盐(PNP-S),这两种盐类均为无毒性的[17],动物代谢对硝基酚的途径见图1。

图1 对硝基酚的分子结构及其在肝脏中的代谢途径[17]Figure 1 Molecular structure of p-nitrophenol and its metabolic pathways in liver[17]
除具有肝脏的脊椎类动物外,由于其他生命体不能通过上述途径将对硝基酚降解,使得对硝基酚在其体内富集从而对本体产生毒害作用。但对于对硝基酚在脊椎类动物肝脏中代谢全过程的研究并不彻底,目前的研究仅说明最终代谢产物的无毒性质,对于其中间代谢产物毒性的探究仍处于空白。与此同时对于对硝基酚的非脊椎类动物毒性的研究主要集中在藻类、甲壳类水生生物、鱼类、跳虫的急性毒性等方面。具体研究结果见表1。关于对硝基酚等苯环类难降解有机物在植物体内的转化机理及其对植物整体或某一组织的毒性机理研究鲜有报道。
3 对硝基酚在环境中的迁移转化
对硝基酚溶解性较高,在水中解离呈弱酸性,因此更易随着水流穿过包气带到达含水层,污染地下水。对硝基酚在整个包气带中的迁移转化途径可归纳为吸附、解吸及微生物降解作用[24]。对硝基酚作为极性分子在包气带中随毛细水迁移,迁移过程中由于包气带表面颗粒的吸引力作用,极性水分子会脱离溶液,导致远端对硝基酚的浓度较高。此外,植物的吸收和对硝基酚的挥发对其在土壤含水层中迁移转化也有影响。Khan等[25]研究了小麦对于土壤中对硝基酚的影响,实验结果表明小麦植株能在24 h内将0.6 mmol·kg-1的对硝基酚吸收降解94.7%。图2为对硝基酚在环境中的来源、迁移概念模型。

表1 对硝基酚对生物的毒性Table 1 Biotoxicity of p-nitrophenol
由于在土壤中的自然衰减主要依靠微生物的代谢活动,对硝基酚在土壤中的降解半衰期从一天到几十天不等[26]。通常土壤中对硝基酚的初始浓度对其衰减的影响很大,除此以外环境温度、湿度、土壤湿度、构成、有机质含量以及人为添加有机肥料的量等都能够间接地对对硝基酚的降解造成影响[27]。
3.1 挥发
挥发是指物质从液相中进入到气相的过程,是有机物在包气带含水层中的迁移转化的过程之一。对硝基酚熔点114~116℃,沸点279℃,闪点169℃,不易随蒸气挥发。考虑到挥发在对硝基酚迁移的过程中影响非常小,所以不考虑其对于对硝基酚在整体环境中迁移转化的影响。
3.2 吸附
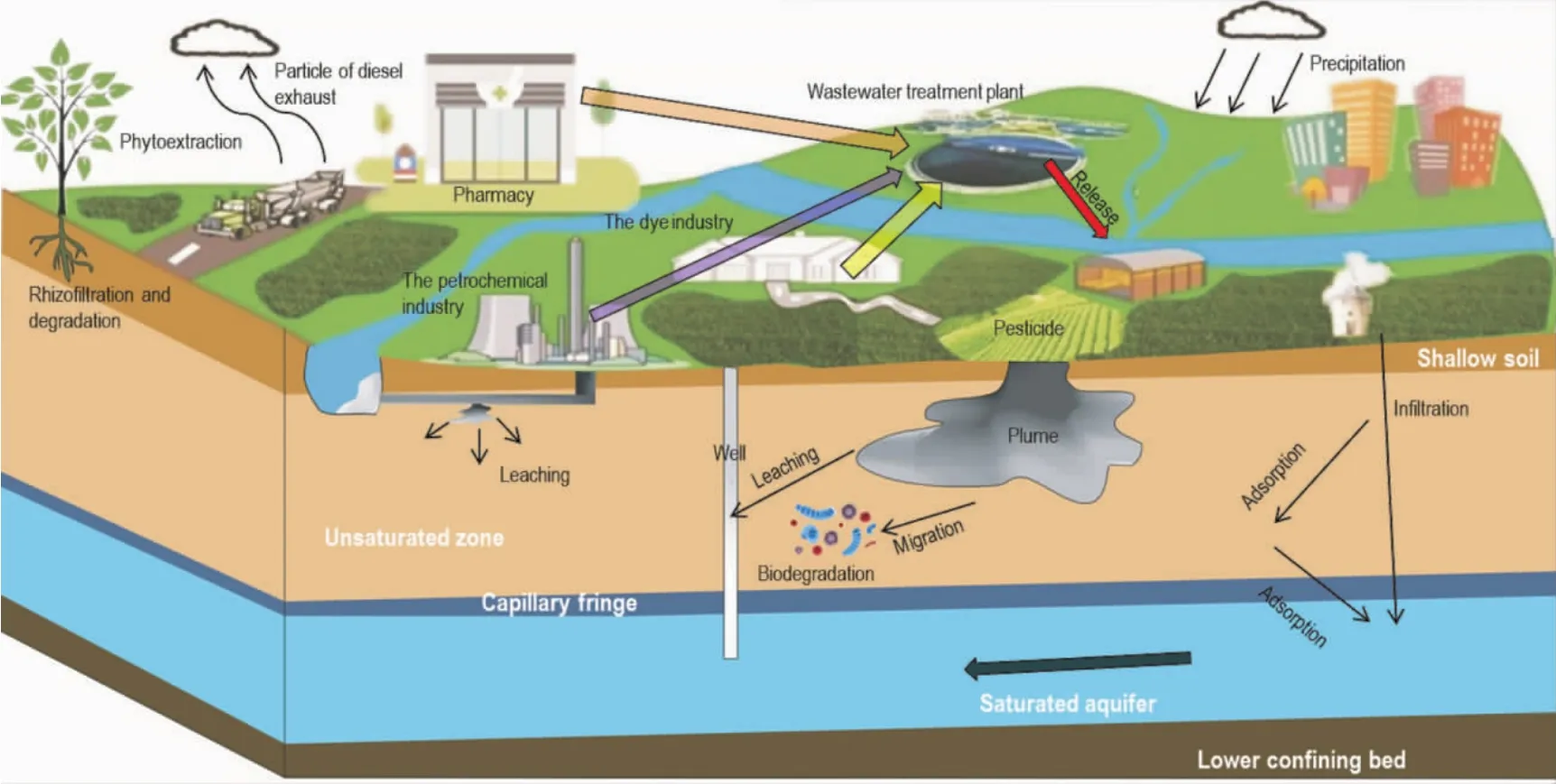
图2 对硝基酚在地下环境中的迁移转化概念模型图Figure 2 The conceptual model of the p-nitrophenol transport in subsurface environment
吸附现象主要是通过范德华力和氢键及化学键相互作用产生的。土壤和包气带中对于对硝基酚的吸附主要依靠分配作用和表面吸附来完成[28]。Zhang等[29]研究发现,土壤pH为弱酸性时有助于对硝基酚的吸附,土壤颗粒的内扩散并不是影响吸附速率的唯一因素,单层吸附和活性点异构能量的分布也对其有影响。张敏[30]研究了不同土壤对对硝基酚的吸附(表2),结果表明,有机质对对硝基酚的吸附起着很重要的作用,沼泽土对对硝基酚有很强的吸附能力(有机碳吸附常数KOC=1 241.84),棕色森林土对对硝基酚的吸附能力则较弱(有机碳吸附常数KOC=73.84)。陈宝梁等[31]用薄层土壤层析法研究了对硝基酚在土壤中的移动性,发现对硝基酚在土壤中的迁移性较复杂,一般情况下表面活性剂中的阴离子能够促进对硝基酚在土壤中的迁移,而阳离子则能够增强对硝基酚在土壤中的吸附性,减小其在土壤中的迁移能力。

表2 常见土壤对对硝基酚的吸附参数(25℃)[30]Table 2 Adsorption constant of p-nitrophenol in different soils(25℃)[30]
3.3 生物转化
生物转化作用是有机物在环境中转化的重要途径之一。生物转化是指利用微生物、高等植物和动物的作用将高分子有机物分解成小分子化合物的过程,其中微生物降解起主要作用,特别是针对难降解有机污染物。对硝基酚在土壤中的降解主要依靠微生物的生长活动,微生物能将对硝基酚作为能源进行生长代谢,在代谢过程中将对硝基酚转化为次级有机物或H2O和CO2。Zheng等[32]从长期受有机磷农药污染的棉花地里筛选出一株能以对硝基酚为唯一碳源、氮源的菌株HS-D38,它在无机盐培养基中能够在10 h内将200 mg·L-1的对硝基酚降解94%。这充分说明土壤中对硝基酚的降解转化受到土壤微生物的控制和影响。Zhang等[33]从受有机磷农药和污染的土地里分离出一株能降解对硝基酚的红球菌(Rhodococcus sp.)CN6,经过微生物碳氢化合物附着(Microbial adherence to hydrocarbon,MATH)试验发现,CN6 的表面疏水性随着底物对硝基酚的浓度增大而增大,可推测土壤中的部分土著微生物在受到对硝基酚污染时,其表面疏水性会增强,进而更好地吸附并降解转化对硝基酚。
4 对硝基酚污染的去除
4.1 物理吸附
常见的物理法包括吸附、萃取以及膜分离,其中吸附法与萃取法、膜分离法相比,没有液液分离的困难,不会造成二次污染,能耗较低,并且不会出现膜孔堵塞等特点[34]。吸附法中常见的吸附材料包括黏土[35]、沸石[36]、分子筛[37]、膨润土[38]、碳材料[39]等。这些材料经过一定的改性过程,通过增加孔隙率进而增加比表面积,或添加表面活性剂,增强吸附效果。Jovic等[39]通过对以酰胺为低分子量藻类有机物的系统下动力学扩散系数和平衡系数的分析,发现大量的弱极性酰胺会减少活性炭对对硝基酚的吸附能力,并且认为这种巨大的变化是由外部扩散比内部扩散强所造成的。单程楠等[40]用不同方法改性的沸石对对硝基酚进行吸附试验比对,发现不同改性沸石的吸附能力依次为:有机改性沸石(0.42 mg·g-1)>酸热联合改性沸石(0.07 mg·g-1)>酸改性沸石>灼烧(500℃)改性沸石(-0.05 mg·g-1)>天然沸石(-0.16 mg·g-1)。成岳等[41]用 Silicalite-2分子筛对对硝基酚的吸附效果进行研究,结果表明Silicalite-2分子筛可对浓度为20 mg·L-1的对硝基酚进行有效吸附,吸附饱和时能达到98.4 mg·g-1,并且用1.44%的氢氧化钠可将其有效洗脱,达到循环利用。Cotoruelo等[42]研究木质素改性的活性炭材料吸附性能试验发现,试验材料对对硝基酚的吸附能力在1~4.4 mmol·g-1之间,影响材料吸附性能的因素主要有温度、pH、活性炭的煅烧时间。Zhou等[43]对人工复合材料N-Fe/OMC的可再生性进行了研究,发现NFe/OMC在经过0.2 mol·L-1的NaOH洗脱4次后继续使用,对对硝基酚的去除仍有75.5%,且在吸附对硝基酚的同时能吸附Pb(Ⅱ),吸附效率可达83.2%。Li等[44]研究改性壳聚糖对对硝基酚的吸附性能时发现,EPI-CD、CS-CD、CS-SA改性的壳聚糖的最佳吸附条件受疏水基团、氢键、π-π键、温度的影响,温度越低对酚类物质的吸附效果越好。目前通过吸附对对硝基酚进行降解的研究主要集中在水处理工艺方向,真正将其用于土壤修复的很少,其主要原因有:①由于土壤环境中对硝基酚和吸附介质可接触性差,为了达到良好的接触性,在实际场地中会对土壤进行翻动,导致处理成本增加;②对于对硝基酚吸附材料的研究包括改性沸石、改性分子筛及一些复合材料,这些材料在完成吸附后不可能一直留存于土壤中,因此吸附材料的回收一定程度上限制了吸附法在土壤环境中的应用;③在对吸附材料进行洗脱时,洗脱溶剂的成本及洗脱废液排放的潜在风险。若在今后的研究中能解决上述问题,那么将会为对硝基酚土壤修复提供新的思路和见解。4.2化学氧化
对硝基酚的化学氧化法研究目前主要集中于电化学氧化、光催化氧化、催化剂催化氧化。电化学氧化具有速度快,无二次污染等特点,但处理费用较高;光催化氧化和催化剂催化氧化都是通过外加催化作用,促使对硝基酚进行降解,但在处理量、处理时间以及能耗上存在诸多问题。田玫等[45]研究了Ti/PbO2电极对于对硝基酚降解的电催化活性,研究结果表明对硝基酚电催化氧化降解首先生成对苯二酚、邻苯二酚、对苯醌、丁烯二酸和草酸,最终变成二氧化碳和水,验证了电化学氧化的无二次污染的特点。孙杰等[46]研究了在紫外光(UV)照射下,Fe(Ⅲ)-富马酸盐体系对对硝基酚的光降解反应,实验结果表明在pH值为3.0~6.0范围内,对硝基酚的降解率与pH呈反比,Fe(Ⅲ)和富马酸盐的初始浓度的增大可以加大光解效果。Qiu等[47]用原始的α-Bi2O3联合微波处理催化氧化废水中对硝基酚和总有机碳TOC,实验结果表明对硝基酚和TOC的降解效率分别为99.74%和97.80%,对产物用气相色谱与质谱联用(GC-MS)进行检测,结果显示无有机成分残留,推测该方法能将对硝基酚直接氧化为CO2和H2O。Subbulekshmi等[48]通过纳米氧化铜(Nano CuO)对粉煤灰沸石(Fly ash zeolite,FAZ)进行改性,改性后的CuO/FAZ对初始浓度为20 mg·L-1对硝基酚的降解率可达98%,在连续运行4次后去除效率仍然高达90%。对单独CuO、单独FAZ以及CuO/FAZ运行的结果进行分析发现,CuO和FAZ的联合作用是催化对硝基酚降解的主要作用,对其降解途径的研究发现CuO/FAZ可作为一种新的异构菲林催化剂。
对硝基酚是具有苯环结构的难降解有机物,通过化学氧化法虽具有高效、无二次污染等特点,但由于反应本身具有的氧化性或还原性可能对土壤的理化性质及酶活性造成影响,导致土壤微生态环境发生改变形成新的潜在环境问题。因此,目前国内外就化学氧化在土壤对硝基酚污染修复中的研究鲜有报道。在将来的研究中,可寻求具有单一氧化性的试剂材料或体系来针对土壤中某一特定污染物进行去除,以保证土壤原有的理化性质。
4.3 生物降解
生物途径主要依靠微生物、植物和土壤动物对对硝基酚进行吸收、代谢和降解,最终达到低风险,少扰动、不产生二次污染、运行成本低的效果。目前,生物途径主要的研究方向为微生物途径和植物途径。
4.3.1 游离态微生物修复技术
游离态微生物修复技术指的是利用好氧菌和厌氧菌对有机污染物进行降解处理。一般情况下好氧菌能降解环数小的芳香烃,对于四环及以上的多环芳烃的降解效果则不理想[49]。此时,可利用厌氧菌能够通过硝酸根、硫酸根等作为电子受体代替氧气进行呼吸作用[50],将好氧菌难以降解的污染物进行降解。目前,由于厌氧菌在培养速度和降解速率上存在比较缓慢的问题,研究者对其降解的机理研究较少;反之,对于能进行高速降解的好氧菌的降解机理研究较多,是目前的热门研究内容。到目前为止,很多研究者从受污染的土壤、污泥中分离纯化得到了对对硝基酚类有机物具有降解能力的微生物,这些微生物中好氧细菌偏多[51]。常见的降解菌包括假单胞菌(Pseudomonas sp.)[52]、节杆菌(Arthrobacter sp.)[53]、芽孢杆菌(Bacillus sp.)[54]、红球菌(Rhodococcus sp.)[55]等。常见对硝基酚降解菌菌属及降解途径见表3。Munnecke等[56]和Jain等[57]分别在1974年和1994年研究对硝基酚降解的时候发现了对硝基酚的对苯二酚和偏苯三酚代谢途径,为后续的研究提供了强有力的理论依据。对硝基酚的两种经典代谢途径见图3。Zohar等[58]通过对杆菌4HB接种量大小的控制,使得4HB能够在24 h内降解400 mg·L-1的对硝基酚;当对硝基酚浓度增加到800 mg·L-1、接种菌体量在OD600为0.8时,4HB能对对硝基酚产生有效的耐受性,并在68 h内将其降解17%。Zheng等[32]从受有机磷污染的棉花种植土地中筛选出铜绿假单胞杆菌,该菌能在24.0±0.5 h内有效降解500 mg·L-1的对硝基酚,且对硝基酚是以对苯二酚降解途径进行的。张清等[59]筛选出一株能耐受降解较高浓度的对硝基酚降解菌,并发现其代谢最佳pH为8,在有牛肉膏作为外加N源的情况下,降解效果更加明显。除此以外,以碳纸为阳极、空气电极为阴极、葡萄糖和对硝基酚为混合燃料进行研究,发现微生物燃料电池(MFC)对废水中不同浓度的对硝基酚均有一定的去除效果,400 mg·L-1的对硝基酚降解4 d的去除率74.1%,降解6 d的去除率为82.1%;MFC的输出电压最高为0.293 V(外阻10008),最大输出功率密度为5615 mW·m-3。任何军等[60]分离得到一株能以对硝基酚为唯一碳源和氮源的假单胞菌PN-1,除了能降解对硝基酚外,还具有卡那霉素和氯霉素抗性,其对 4 种重金属 Cd2+、Pb2+、Zn2+和 Cr6+的最低抑制浓度(minimum inhibitory concentration,MIC)分别为700、500、800、100 mg·L-1,同时 PN-1 还具有产吲哚乙酸(IAA)和铁载体的能力,能与植物进行联合修复。据国内外研究可以发现,目前针对游离菌修复土壤中的对硝基酚污染的报道较少,且多为国外研究团队。针对国内于此新型农业污染的场地研究为空白,笔者认为在今后的研究中可加大微生物游离技术在实际场地应用中的探究,做到防范于未然。

表3 常见对硝基降解菌种属及其代谢途径Table 3 Strain and degradation pathway of degradation bacteria for p-nitrophenol
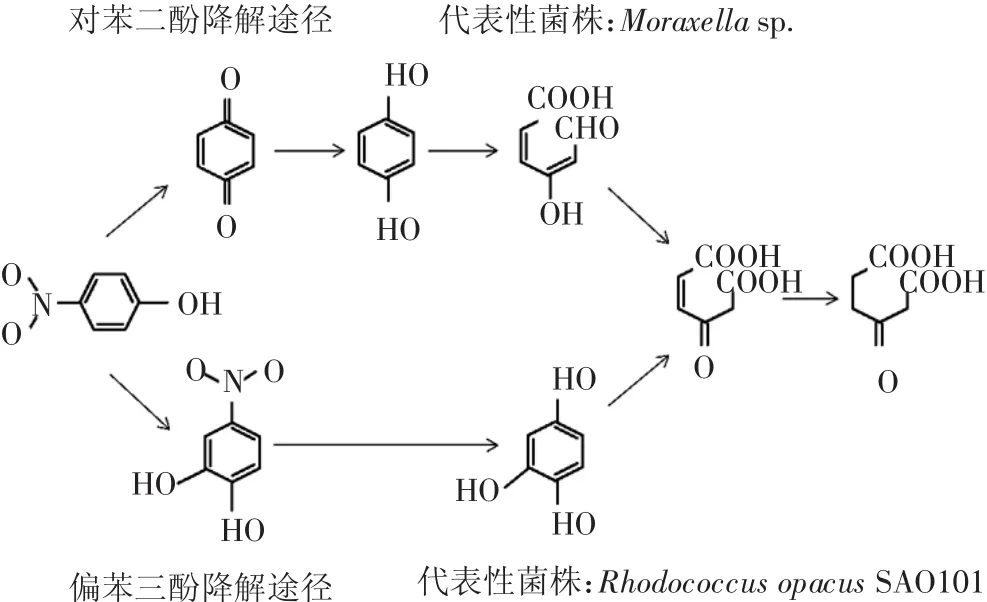
图3 对硝基酚的两种氧化代谢途径及其代表菌株[56-57]Figure 3 Two classical metabolic pathways of p-nitrophenol and typical strain[56-57]
4.3.2 微生物固定化技术
微生物固定化技术是指通过物理或化学手段将游离的微生物(游离细胞及酶)固定于限定的空间中,使其始终保持活性并可以重复利用的技术[73]。微生物固定化修复技术与游离细菌相比避免了人为破坏酶活性的可能,增强了微生物抗毒性侵入的能力,具有高稳定性以及能适应复杂环境等特点。一般常用的固定化方法有4大类,分别是吸附法、交联法、包埋法以及共价键结合法。不同固定化方法的特点如表4。王红[74]在研究利用FG-01和FG-02两种固定化微生物降解酚类物质时发现,对于固定化单一菌体降解硝基酚的效率来说,CMC-钙基膨润土固定化微生物颗粒>CMC-钙基膨润土固定化颗粒>游离菌>CMC固定化微生物颗粒;对于固定化复合微生物来说,当包埋微生物FG01/FG02比例为2∶1时降解效率好。

表4 不同生物固定化方法的特点[75]Table 4 Characteristic of different ways for immobilized strain[75]
现阶段微生物固定化技术降解对硝基酚的研究主要集中在水处理工艺方面,关于土壤中使用固定化降解菌技术修复对硝基酚的研究甚少。通常固定化降解菌修复污染土壤的效率取决于降解菌与污染物的接触面积和接触时间。对硝基酚在土壤层中迁移的动力由毛细水提供,非雨季或降雨量偏小的时候对硝基酚在土壤层中的迁移减小,同固定化降解菌的接触减少,降解效果将大打折扣。因此,为了增加降解效果可考虑:①定时翻土,定期补充固定化降解菌,保证固定化降解菌同对硝基酚的接触,但该方法修复成本高,修复效果与翻土频率及固定化降解菌补充量有关;②将固定化降解菌技术与高吸附性材料进行联合,实现对硝基酚富集和降解一体化,针对污染情况较为严重的点源污染效果显著,既保证了高污染下降解菌的活性,又增大了降解菌与污染物的可接触性。但此种方法的研究主要偏向于处理土壤中的PAHs、DDT等持久性有机污染物,对于新型农业污染物对硝基酚的探究报道很少。
4.3.3 植物修复技术
植物对于有机污染物的修复过程比较复杂,通常会经过吸附、吸收、转移降解、挥发等作用,最终通过植物分泌物激活微生物对有机污染物进行彻底的降解转化[76]。植物对于土壤环境中有机物修复过程可分为直接作用和间接影响两种。直接作用表现为植物对有机物的吸收、代谢以及转化,间接影响是指利用植物根际效应促进有机物的降解。植物的根际效应促进有机污染物的吸收是指植物能够通过根系释放O2提高根际土壤的氧气含量,改变土壤中原有的微生物群落结构,增强好氧的微生物活性。同时植物通过根际向土壤中分泌酶和一些黏性分泌物能有效改善微生物的生长代谢条件,从而提高土壤微生物的数量、刺激微生物的活性以及改变群落结构。激发微生物对污染物的降解功效,并能改变土壤中的一部分有机污染物的可降解性。植物根系分泌物中的小分子有机酸乙酸会显著增加土壤有机质中腐植酸吸附疏水性酚类污染物的能力,可增加对硝基酚在土壤中的吸附性,减少其迁移转化。图4为植物根际效应及相关的修复机理。王聪[77]研究发现,在盆栽条件下接种降解菌的苜蓿对对硝基酚的降解率为85.6%,未接种降解菌的苜蓿对对硝基酚的降解率为29.9%,从长期来看接种了降解菌的苜蓿长势一直好于未接种的。降解菌对植株起到了一定的保护作用。
目前,对于植物修复土壤中对硝基酚鲜有报道,仅有的研究也主要集中在根系共生菌和根际效应。植物根系对于对硝基酚的直接吸收及对硝基酚在植物各个组织之间的迁移分布的研究几乎空白。在今后的研究中可以更多考虑以下几个方面:①加强植物修复机理的研究,虽然目前有很多针对于植物修复、植物-微生物联合修复的研究,但主要集中在去除率和降解效果方面,没有太多针对于降解机理的研究;②大部分的研究都是在实验室模拟情况下开展的,对于某些实际场地的污染问题还没有办法进行应用,建议进行实际场地的修复试验,真正实现植物修复的意义;③某些添加剂会对植物生长及根际植物的生长产生积极的影响,增强修复效果,例如:有机酸、生物表面活性剂、螯合剂。
5 展望
目前,对硝基酚作为中等生物毒性的有机污染物,进入环境后产生较强的积累效应,对环境形成潜在的风险。这种新型污染物对于农业环境及其相关生态环境的影响和作用尤为显著和重要,因而其深入研究具有重大现实意义。
纵观国内外相关研究状况,我们认为由于农业活动等引起的土壤对硝基酚的研究还非常有必要深入开展。如果从农业环境的生态健康及其相关环境污染防控和修复治理角度考虑,我们建议从以下几个方面进行深入研究。
(1)土壤环境中对硝基酚的来源识别和解析,仍然是一个关键科学问题,也是表征其污染特征、确定进一步污染风险并进行污染预防和治理的基本内容。
(2)对硝基酚作为农业环境中的一种新型污染物,其土壤环境的归宿和迁移转化机理、环境影响因素和土壤物理-化学-生物系统对于对硝基酚的效应机制需要深入研究。
(3)不同农业环境中,对硝基酚的独特毒性和毒理研究,特别是在当地特有的农业活动、种植方式、耕作条件等条件下,对硝基酚对于生态和土壤质量的影响,需要深入研究。
(4)在农业环境中,类似于对硝基酚的污染属于面源污染(非点源污染),治理难度和费用很高,这是一个与流域管理、土壤特点和修复技术密切相关的“系统工程”。
鉴于典型农业环境的治理和修复技术也是核心内容,对此进一步展望如下。
物理吸附法和化学氧化法对于对硝基酚的去除,常见于污水中,并不太适用于土壤污染的原位修复处理。例如,吸附材料不便植入土壤中,且达到饱和后从土壤中取出需要大量的土建工程,花费较大;若将氧化剂直接投入土壤中虽然会快速将目标污染物对硝基酚快速降解,但氧化剂进入土壤后可能改变土壤的pH等土壤参数,进而改变土壤微生态环境,对实际场地造成更深层的危害和影响。
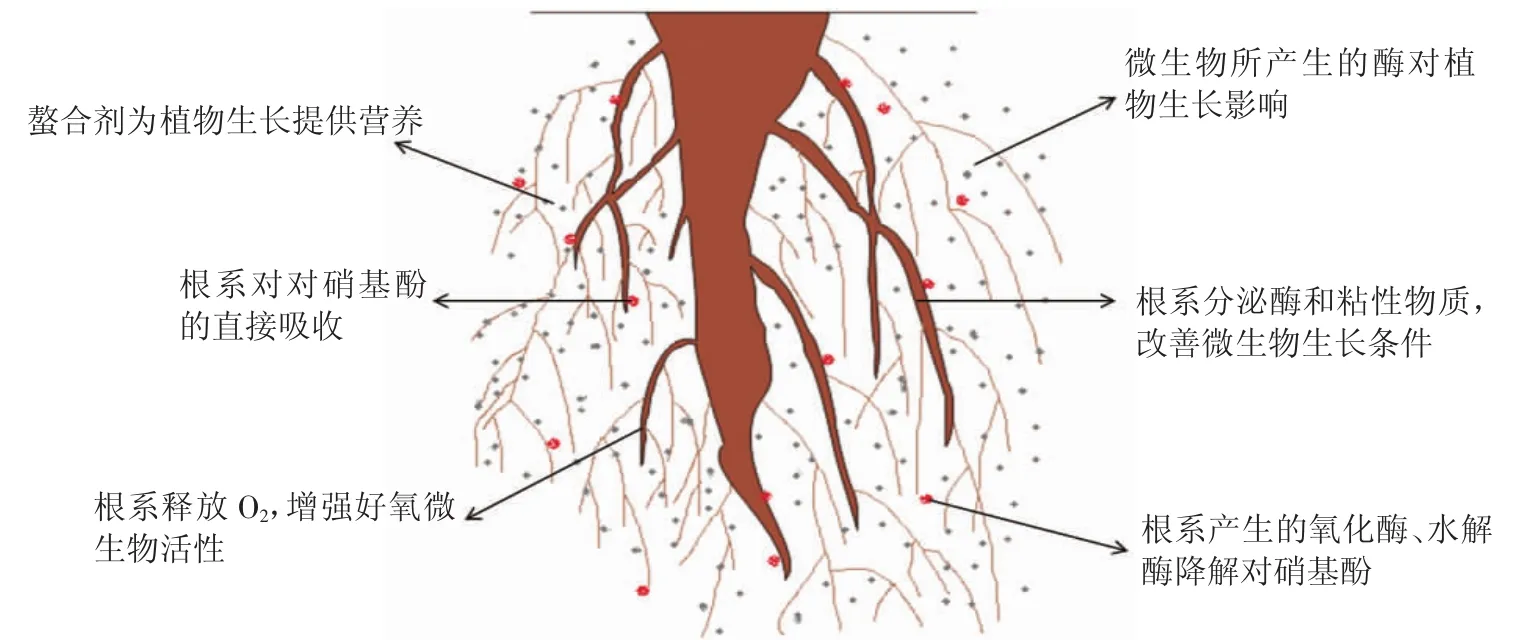
图4 植物修复机理示意图Figure 4 Diagram of phytoremediation mechanisms
土壤中对硝基酚去除的研究主要集中在生物处理,特别是原位生物修复、植物和微生物的联合修复等能够快速应对和治理复合污染场地。目前针对植物和微生物在同一环境中相互作用的机理研究主要在土壤中重金属的吸附治理上,对于具有苯环的难降解有机污染物的植物-微生物联合修复研究的机理偏少。未来,针对土壤中对硝基酚污染的去除应着重考虑以下问题:①高效强适应性降解菌的分离、筛选和驯化;②加强高效降解菌降解机理和途径研究;③应用基因工程技术将降解基因转移到适应性强、繁殖能力快、对土壤微生态环境影响较小的菌体上;④研究植物根际效应对对硝基酚的去除机理;⑤着重研究植物和降解菌联合作用下的修复机理。
[1]Sun S P,Lemley A T.P-Nitrophenol degradation by a heterogeneous Fenton-like reaction on nano-magnetite:Process optimization,kinetics,and degradation pathways[J].Journal of Molecular Catalysis A:Chemical,2011,349(1):71-79.
[2]Subashchandrabose S R,Megharaj M,Venkateswarlu K,et al.p-nitrophenol toxicity to and its removal by three select soil isolates of microalgae:The role of antioxidants[M].Wiley:2012.
[3]Inomata S,Fushimi A,Sato K,et al.4-nitrophenol,1-nitropyrene,and 9-nitroanthracene emissions in exhaust particles from diesel vehicles with different exhaust gas treatments[J].Atmospheric Environment,2015,110:93-102.
[4]张 蕾,孙秋香.大孔树脂在高浓度有机废水处理中的应用[J].湖北第二师范学院学报,2008,25(8):51-54.
ZHANG Lei,SUN Qiu-xiang.The application of the macroreticular polymeric adsorbent resin to treat waste water containing high concentration organic chemicals[J].Journal of Hubei University of Education,2008,25(8):51-54.
[5]Wang B,Yu G,Yu Y J,et al.Health risk assessment of organic pollutants in Jiangsu reach of the Huaihe river,China[J].Water Science&Technology,2009,59(5):907-916.
[6]陈海荣,朱利中,杨 坤,等.钱塘江水系中酚类化合物的浓度水平及污染特征[J].中国环境科学,2005,25(6):729-732.CHEN Hai-rong,ZHU Li-zhong,YANG Kun,et al.Concentration and pollution characteristics of phenolic compounds in Qiantang River[J].China Environmental Science,2005,25(6):729-732.
[7]王 莉,王玉平,卢迎红,等.辽河流域浑河沈阳段地表水重点控制有机污染物的筛选[J].中国环境监测,2005,21(6):59-62.
WANG Li,WANG Yu-ping,LU Ying-hong,et al.The sifting of priority control organic pollutants in Hunhe River of Liaohe basin in Shenyang City[J].Environmental Monitoring in China,2005,21(6):59-62.
[8]An L C,Niu H,Zeng Heng.A new biosensor for rapid oxygen demand measurement[J].Water Environment Research,1998,70(5):1070-1074.
[9]Samuel M S,Sivaramakrishna A,Mehta A.Bioremediation of p-Nitrophenol by Pseudomonas putida 1274 strain[J].Journal of Environmental Health Science and Engineering,2014,12(1):1-8.
[10]Seto W K,Lai C L,Philip P C,et al.A large population histology study showing the lack of association between ALT elevation and significant fibrosis in chronic hepatitis B[J].PloS One,2012,7(2):e32622.
[11]Mi Y L,Tu L L,Wang H M,et al.Supplementation with quercetin attenuates 4-nitrophenol-induced testicular toxicity in adult male mice[J].The Anatomical Record,2013,296(10):1650-1657.
[12]Lam S H,Ung C Y,Hlaing M M,et al.Molecular insights into 4-nitrophenol-induced hepatotoxicity in zebrafish:Transcriptomic,histological and targeted gene expression analyses[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2013,1830(10):4778-4789.
[13]Kobayashi M,Yamamoto M.Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J].Advances in Enzyme Regulation,2006,46(1):113-140.
[14]Zhang D D.Mechanistic studies of the Nrf2-Keap1 signaling pathway[J].Drug Metabolism Reviews,2006,38(4):769-789.
[15]Ramos E U,Vaes W H J,Mayer P,et al.Algal growth inhibition of Chlorella pyrenoidosa by polar narcotic pollutants:Toxic cell concentrations and QSAR modeling[J].Aquatic Toxicology,1999,46(1):1-10.
[16]Meeker J D.Exposure to environmental endocrine disruptors and child development[J].Jama Pediatrics,2012,166(10):952-958.
[17]Abiko Y,Shinkai Y,Sumi D,et al.Reduction of arsenic-induced cytotoxicity through Nrf2/HO-1 signaling in HepG2 cells[J].Journal of Toxicological Sciences,2010,35(3):419-423.
[18]石美霞,邢立群,史小雪,等.我国淡水水生生物对硝基酚基准研究[J].中国环境监测,2014(1):98-102.
SHI Mei-xia,XING Li-qun,SHI Xiao-xue,et al.Deriving freshwater quality criteria for p-nitrophenol in China[J].Environmental Monitoring in China,2014(1):98-102.
[19]Kim K T,Lee Y G,Kim S D.Combined toxicity of copper and phenol derivatives to Daphnia magna:Effect of complexation reaction[J].Environment International,2006,32(4):487-492.
[20]郑新梅,丁 亮,刘红玲,等.对硝基酚对大型蚤和斑马鱼胚胎的毒性[J].生态毒理学报,2010,5(5):692-697.
ZHENG Xin-mei,DING Liang,LIU Hong-ling,et al.Toxicity of p-nitrophenol to Daphnia magna and zebrafish(Brachydanio rerio)embryo[J].Asian Journal of Ecotoxicology,2010,5(5):692-697.
[21]雷 忻,李宗强,廉振民,等.双酚A和对硝基酚对泥鳅的急性毒性效应[J].生态学杂志,2009,28(11):2257-2261.
LEI Xin,LI Zong-qiang,LIAN Zhen-min,et al.Acute toxicity effects of bisphenolA and p-nitrophenol to Misgurnus anguillicadatus[J].Chinese Journal of Ecology,2009,28(11):2257-2261.
[22]孙芬芬,乔 敏,徐玉新.典型酚类化合物对土壤跳虫的慢性毒性[J].生态毒理学报,2014,9(6):1076-1082.
SUN Fen-fen,QIAO Min,XU Yu-xin.Chronic toxicity of typical phenolic compounds on soil-dwelling springtail[J].Asian Journal of Ecotoxicology,2014,9(6):1076-1082.
[23]辛苗苗,危起伟,王志坚,等.对硝基酚对稀有鮈鲫胚胎的急性毒性[J].淡水渔业,2014(5):43-48.
XIN Miao-miao,WEI Qi-wei,WANG Zhi-jian,et al.Acute toxicity of p-nitrophenol to Gobiocypris rarus[J].Freshwater Fisheries,2014(5):43-48.
[24]Paul D,Singh R,Jain R K.Chemotaxis of Ralstonia sp.SJ98 towards p-nitrophenol in soil[J].Environmental Microbiology,2006,8(10):1797-1804.
[25]Khan N U,Varma B,Imrana N,et al.Phytoremediation using an indigenous crop plant(wheat):The uptake of methyl parathion and metabolism of p-nitrophenol[J].Terapevticheskiǐ Arkhiv,2011,52(9):30-34.
[26]张蕾蕾.对硝基酚(PNP)降解菌在废水处理及土壤污染修复中应用[D].东北师范大学,2012.
ZHANG Lei-lei.PNP-degrading bacterium and its application in wasterwater treatment and soil pollution remediation[D].Northeast Normal University,2012.
[27]Dai Y,Yan Z,Jia L,et al.The composition,localization and function of low-temperature-adapted microbial communities involved in methanogenic degradations of cellulose and chitin from Qinghai-Tibetan Plateau wetland soils[J].Journal of Applied Microbiology,2016,121(1):163.
[28]高 鹏.松花江水体中酚类污染物时空分布及迁移转化过程研究[D].哈尔滨工业大学,2011.
GAO Peng.Spatial-temporal distribution and transformation-transportation processes for phenolic pollutants in the Songhua River[D].Harbin Institute of Technology,2011.
[29]Zhang J Y,Wu C D,Jia A Y,et al.Kinetics,equilibrium and thermodynamics of the sorption of p-nitrophenol on two variable charge soils of Southern China[J].Applied Surface Science,2014,298(8):95-101.
[30]张 敏.三种硝基酚异构体高效液相色谱分析方法及其环境行为研究[D].东北师范大学,2005.
ZHANG Min.HPLC analytical method of three nitrophenols and the reseach of their environment′s action[D].Northeast Normal University,2005.
[31]陈宝梁,朱利中,林 斌,等.阳离子表面活性剂增强固定土壤中的苯酚和对硝基苯酚[J].土壤学报,2004,41(1):148-151.
CHEN Bao-liang,ZHU Li-zhong,LIN Bin,et al.Enhancement of cationic surfactant on immobilizing p-nitrophenol and phenol in soils[J].Acta Pedologica Sinica,2004,41(1):148-151.
[32]Zheng Y L,Liu D L,Liu S W,et al.Kinetics and mechanisms of p-nitrophenol biodegradation by Pseudomonas aeruginosa HS-D38[J].Journal of Environmental Sciences,2009,21(9):1194-1199.
[33]Zhang J S,Sun Z T,Li Y Y,et al.Biodegradation of p-nitrophenol by Rhodococcus sp.CN6 with high cell surface hydrophobicity[J].Journal of Hazardous Materials,2009,163(2/3):723-728.
[34]Koyuncu H,Y覦ld覦z N,Salg覦n U,et al.Adsorption of o-,m-and p-nitrophenols onto organically modified bentonites[J].Journal of Hazardous Materials,2011,185(2/3):1332-1339.
[35]Hadjltaief H B,Sdiri A,Ltaief W,et al.Efficient removal of cadmium and 2-chlorophenol in aqueous systems by natural clay:Adsorption and photo-Fenton degradation processes[J].Comptes Rendus Chimie,2017.doi:10.1016/j.crci.2017.01.009.
[36]Wan C L,Ding S,Zhang C,et al.Simultaneous recovery of nitrogen and phosphorus from sludge fermentation liquid by zeolite adsorption:Mechanism and application[J].Separation&Purification Technology,2017,180:1-12.
[37]Teixeira M,Rodrigues S C,Campo M,et al.Boehmite-phenolic resin carbon molecular sieve membranes:Permeation and adsorption studies[J].Chemical Engineering Research&Design,2014,92(11):2668-2680.
[38]Ye W M,He Y,Chen Y G,et al.Adsorption,desorption and competitive adsorption of heavy metal ions from aqueous solution onto GMZ01 Bentonite[M].Springer International Publishing,2015.
[39]Jovic′B,Kordic′B,Mi觢kov V,et al.Amides as a model system of low molar mass algal organic matter:Influence on the adsorption of p-nitrophenol on activated carbon[J].Arabian Journal of Chemistry,2017.doi:10.106/j.arabjc.2017.01.016
[40]单程楠,唐 见,赵海涛,等.不同改性方法对沸石吸附对硝基苯酚能力的影响[J].农业环境科学学报,2010,29(11):2214-2220.
SHAN Cheng-nan,TANG Jian,ZHAO Hai-tao,et al.Effects of different modification methods on adsorption capacity of zeolite to p-nitrophenol[J].Journal of Agro-Environment Science,2010,29(11):2214-2220.
[41]成 岳,潘顺龙,魏桂英,水热合成silicalite-2分子筛及对对硝基苯酚的吸附与脱附性能[J].环境化学,2014(8):1404-1409.
CHENG Yue,PAN Shun-long,WEI Gui-ying,et al.Hydrothermal synthesis of silicalite-2 zeolites and its adsorption and desorption for p-nitrophenol[J].Environmental Chemistry,2014(8):1404-1409.
[42]Cotoruelo L M,Marqués M D,Díaz F J,et al.Adsorbent ability of lignin-based activated carbons for the removal of p-nitrophenol from aqueous solutions[J].Chemical Engineering Journal,2012,184(3):176-183.
[43]Zhou Y Y,Liu X C,Tang L,et al.Insight into highly efficient co-removal of p-nitrophenol and lead by nitrogen-functionalized magnetic ordered mesoporous carbon:Performance and modelling[J].Journal of Hazardous Materials,2017,333(5):80-87.
[44]Li J M,Meng X G,Hu C W,et al.Adsorption of phenol,p-chlorophenol and p-nitrophenol onto functional chitosan[J].Bioresource Technology,2009,100(3):1168-1173.
[45]田 玫,王 晶,杨丽娟,等.阴阳极协同作用下对硝基苯酚的电催化降解[J].应用化学,2012,29(11):1286-1290.
TIAN Mei,WANG Jing,YANG Li-juan,et al.Electrocatalytic degradation of p-nitrophenol affected by the synergsic effect of cathode and anode[J].Chinese Journal of Applied Chemistry,2012,29(11):1286-1290.
[46]孙 杰,陈果仓,曾 沛.UV/Fe(Ⅲ)-富马酸盐体系降解对硝基苯酚[J].化学通报,2014,77(8):814-818.
SUN Jie,CHEN Guo-cang,ZENG Pei.Degradation of p-nitrophenol in Fe(Ⅲ)-fumarate system under ultraviolet irradiation[J].Chemistry Bulletin,2014,77(8):814-818.
[47]Qiu Y,Zhou J C,Cai J J,et al.Highly efficient microwave catalytic oxidation degradation of p-nitrophenol over microwave catalyst of pristine α-Bi2O3[J].Chemical Engineering Journal,2016,306:667-675.
[48]Subbulekshmi N L,Subramanian E.Nano CuO immobilized fly ash zeolite Fenton-like catalyst for oxidative degradation of p-nitrophenol and p-nitroaniline[J].Journal of Environmental Chemical Engineering,2017,5:1360-1371.
[49]陈辉伦.石油污染浅层含水层的微生物修复研究进展[J].安全与环境工程,2015,22(1):66-72.
CHEN Hui-lun.Research progress in microbial remediation of petroleum-contaminated shallow aquifer[J].Safety and Environmental Engineering,2015,22(1):66-72.
[50]Walworth J,Harvey P,Snape I,et al.Low temperature soil petroleum hydrocarbon degradation at various oxygen levels[J].Cold Regions Science&Technology,2013,96(4):117-121.
[51]温玉娟.再生水中硝基芳香族有机物污染的SAT及其生物强化修复机理研究[D].长春:吉林大学,2016.
WEN Yu-juan.Removal mechanisms of para-nitrophenol in reclaimed water using SAT and its bio-enhancement[D].Changchun:Jilin University,2016.
[52]Chen Z,Niu Y,Zhao S,et al.A novel biosensor for p-nitrophenol based on an aerobic anode microbial fuel cell[J].Biosensors&Bioelectronics,2016,85:860.
[53]Qiu X,Wu P,Zhang H,et al.Isolation and characterization of Arthrobacter sp.HY2 capable of degrading a high concentration of pnitrophenol[J].Bioresource Technology,2009,100(21):5243-5248.
[54]Sreenivasulu C,Megharaj M,Venkateswarlu K,et al.Degradation of pnitrophenol by immobilized cells of Bacillus spp.isolated from soil[J].International Biodeterioration&Biodegradation,2012,68(2):24-27.
[55]Yamamoto K,Nishimura M,Kato D,et al.Identification and characterization of another 4-nitrophenol degradation gene cluster,nps,in Rhodococcus sp.strain PN1[J].Journal of Bioscience&Bioengineering,2011,111(6):687-694.
[56]Munnecke D M,Hsieh D P H.Microbial decontamination of parathion and p-nitrophenol in Aqueous media[J].Applied Microbiology,1974,28(2):212-217.
[57]Jain R K,Dreisbach J H,Spain J C.Biodegradation of p-nitrophenol via 1,2,4-benzenetriol by an Arthrobacter sp[J].Applied&Environmental Microbiology,1994,60(8):3030-3032.
[58]Zohar S,Kviatkovski I,Masaphy S.Increasing tolerance to and degradation of high p-nitrophenol concentrations by inoculum size manipulations of Arthrobacter 4Hβ isolated from agricultural soil[J].International Biodeterioration&Biodegradation,2013,84(Complete):80-85.
[59]张 清,温玉娟,任何军,等.一株对硝基苯酚降解菌的筛选鉴定及其降解特性[J].环境污染与防治,2013,35(2):17-21.
ZHANG Qing,WEN Yu-juan,REN He-jun,et al.Isolation and characterization of p-nitrophenol degrading bacteria and the degradation characteristic[J].Environmental Pollution&Control,2013,35(2):17-21.
[60]任何军,王 聪.一株对硝基酚降解菌的筛选及其植物促生特性[J].科技导报,2016,34(2):231-236.
REN He-jun,WANG Cong.Isolation of a para-nitrophenol degrading bacterium and characterization of its plant growth-promoting properties[J].Science&Technology Review,2016,34(2):231-236.
[61]Chauhan A,Pandey G,Sharma N K,et al.P-nitrophenol degradation via 4-nitrocatechol in Burkholderia sp.SJ98 and cloning of some of the lower pathway genes[J].Environmental Science&Technology,2010,44(9):3435-3441.
[62]Cho Y G,Yoon J H,Park Y H,et al.Simultaneous degradation of p-nitrophenoland phenol by a newly isolated Nocardioides sp[J].The Journal of General and Applied Microbiology,1998,44(5):303-309.
[63]Masaphy S,Zohar S,Jander S G.Biodegradation of p-nitrophenol sorbed onto crystal violet-modified organoclay by Arthrobacter sp.4Hβ[J].Applied Microbiology and Biotechnology,2014,98(3):1321-1327.
[64]Cassidy M B,Lee H,Trevors J T,et al.Chlorophenol and nitrophenol metabolism by Sphingomonas sp UG30[J].Journal of Industrial Microbiology&Biotechnology,1999,23(4):232-241.
[65]Crawford R L,Jung C M,Strap J L.The recent evolution of pentachlorophenol(PCP)-4-monooxygenase(PcpB)and associated pathways for bacterial degradation of PCP[J].Biodegradation,2007,18(5):525.
[66]Su J,Zhang C,Zhang J J,et al.Crystal structure of the γ-hydroxymuconic semialdehyde dehydrogenase from Pseudomonas sp.strainWBC-3:A key enzyme involved in para-nitrophenol degradation[J].BMC Structural Biology,2013,13(1):1-8.
[67]Zhang S,Sun W,Xu L,et al.Identification of the para-nitrophenol catabolic pathway,and characterization of three enzymes involved in the hydroquinone pathway,in Peudomonas sp.1-7[J].BMC Microbiology,2012,12(1):1-11.
[68]Paul D,Rastogi N,Krauss U,et al.Diversity of‘benzenetriol dioxygenase’involved in p-nitrophenol degradation in soil bacteria[J].Indian Journal of Microbiology,2008,48(2):279-286.
[69]Kitagawa W,Kimura N,Kamagata Y.A novel p-nitrophenol degradation gene cluster from a gram-positive bacterium,Rhodococcus opacus SAO101[J].Journal of Bacteriology,2004,186(15):4894.
[70]Wei Q,Liu H,Zhang J J,et al.Characterization of a para-nitrophenol catabolic cluster in Pseudomonas sp.strain NyZ402 and construction of an engineered strain capable of simultaneously mineralizing both paraand ortho-nitrophenols[J].Biodegradation,2010,21(4):575-584.
[71]Perry L L,Zylstra G J.Cloning of a gene cluster involved in the catabolism of p-nitrophenol by Arthrobacter sp.strain JS443 and characterization of the p-nitrophenol monooxygenase[J].Journal of Bacteriology,2007,189(21):7563-7572.
[72]Kadiyala V,Spain J C.A two-component monooxygenase catalyzes both the hydroxylation of p-nitrophenol and the oxidative release of nitrite from 4-nitrocatechol in Bacillus sphaericus JS905[J].Applied and Environmental Microbiology,1998,64(7):2479-2484.
[73]黄真真,陈桂秋,曾光明,等.固定化微生物技术及其处理废水机制的研究进展[J].环境污染与防治,2015,37(10):77-85.
HUANG Zhen-zhen,CHEN Gui-qiu,ZENG Guang-ming,et al.Research progress of immobilized microorganism technology an its mechanisms in wastewater treatment[J].Environmental Pollution&Control,2015,37(10):77-85.
[74]王 红.固定化微生物对酚类物质的降解性能研究[D].太原理工大学,2015.
WANG Hong.Biodegradation of phenols from wastewater by microorganism immobilized in bentonite and carboxymethyl cellulose gel[D].Taiyuan University of Technology,2015.
[75]胡金星,苏晓梅,韩慧波,等.固定化微生物技术修复多氯联苯污染土壤的应用前景[J].应用生态学报,2014,25(6):1806-1814.
HU Jin-xing,SU Xiao-mei,HAN Hui-bo,et al.Application prospect about bioremediation of polychlorinated biphenyls-contaminated soil with immobilized microorganism technique:A review[J].Chinese Journal of Applied Ecology,2014,25(6):1806-1814.
[76]赵 胡,李裕红.环境中多环芳烃的植物修复技术研究进展[J].土壤通报,2009(2):456-460.
ZHAO Hu,LI Yu-hong.The progress of phytoremediation of PAHs pollutedenvironments[J].ChineseJournalofSoilScience,2009(2):456-460.
[77]王 聪.植物促生菌Pseudomonas monteilii PN1对对硝基酚降解及其联合苜蓿对污染土壤的修复[D].长春:吉林大学,2016.
WANG Cong.Plant growth-promoting rhizobacteria Pseudomonas monteilii PN1 on PNP-degrading and bioremidation of contaminated soil with clovers[D].Changchun:Jilin University,2016.
Research review of transport fate and techniques for removing p-nitrophenol from soil
LIU Xing-yi1,WEN Yu-juan1,LIU Huan1,YANG Yue-suo1,2*
(1.Key Laboratory of Eco-Restoration of Regional Contaminated of Environment Ministry of Education,Shenyang University,Shenyang 110044,China;2.Key Lab of Groundwater Resources and Environment Ministry of Education,Jilin University,Changchun 130021,China)
p-Nitrophenol(PNP)is a toxic and persistent organic compound.It has many sources,but is most commonly derived from the intermediate products of pesticides.PNP is an emerging contaminant;it is easily absorbed by soil particles,accumulates over a long period,and poses a risk to the environment.Therefore,its degradation characteristics are relevant to environmental risk assessment.Based on the results of global research,this paper reviews the biotoxicity,metabolic routes,and transport processes of PNP.Removal using physical,chemical,and biological methods,and PNP pollution prevention are also reviewed.
p-nitrophenol;biotoxicity;degradation;soil pollution
S153.6
A
1672-2043(2017)11-2161-10
10.11654/jaes.2017-0608
刘星邑,温玉娟,刘 欢,等.土壤中对硝基酚迁移转化和去除技术研究进展[J].农业环境科学学报,2017,36(11):2161-2170.
LIU Xing-yi,WEN Yu-juan,LIU Huan,et al.Research review of transport fate and techniques for removing p-nitrophenol from soil[J].Journal of Agro-Environment Science,2017,36(11):2161-2170.
2017-04-26 录用日期:2017-07-13
刘星邑(1992—),男,四川成都人,硕士研究生,主要从事对硝基酚植物和微生物降解方面的研究。E-mail:liuxingyichina@gmail.com
*通信作者:杨悦锁 E-mail:yangyuesuo@jlu.edu.cn
国家自然科学基金项目(41472237,41703125);高等学校博士学科点专项科研基金(20130061110066);辽宁省创新团队项目(LT201502);沈阳市科学事业费竞争性选择项目(城市生态风险管理及其修复技术研究)
Project supported:National Natural Science Foundation of China(41472237,41703125);Specialized Research Fund for the Doctoral Program of Higher Education of China(20130061110066);Specialized Research Fund for Liaoning Innovation Team(LT201502);Competitive Selection Project of Scientific Undertakings,Shenyang City(Study of City Ecological Risk Management and Remediation Technologies)

