紫外线照射对刺参体腔细胞吞噬活性的影响
田 景 玉, 丁 月, 张 晶, 姜 鹏 飞, 周 大 勇,, 宋 亮,
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
紫外线照射对刺参体腔细胞吞噬活性的影响
田 景 玉1, 丁 月1, 张 晶1, 姜 鹏 飞2, 周 大 勇1,2, 宋 亮1,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
采用流式细胞仪(FCM)技术与激光共聚焦显微镜技术(LSCM)对紫外线(UVA)照射后的刺参(Stichopusjaponicus)体腔细胞的吞噬活性进行了检测。通过对刺参体内、外荧光吞噬微球孵育体系的筛选和比较,确定采用体外孵育方法测定吞噬率。在体外吞噬中,以荧光微球与体腔细胞的体积比为1∶1 500测定刺参体腔细胞吞噬率。结果表明,刺参经UVA照射,静置不同时间(0~4 h)后提取体腔细胞,采用FCM检测其吞噬率在静止1 h后达到最大,随后下降,LSCM检测结果与之相同;采用FCM检测发现,随着静置时间的延长,刺参体腔细胞的死亡率呈不断上升趋势,推测UVA照射会对刺参体腔细胞的免疫功能造成一定程度的损伤,其死亡率与吞噬率之间存在着一定的联系。通过检测刺参体腔细胞吞噬率的变化可以判断刺参的鲜活状态。
刺参;体腔细胞;吞噬;紫外线;死亡率
0 引 言
刺参(Apostichopusjaponicus(Selenka)),又称仿刺参,属棘皮动物门 (Echinodermata),为典型的温带种类[1]。到2015年底,我国刺参产量达到了20.5万t[2]。与刺参产业的迅猛发展相比,刺参生理免疫学研究相对滞后,导致其在刺参的养殖、加工和运输产业缺乏完善的理论依据,加之市场管理与运作没有在科学的指导下进行,出现了诸如腐烂化皮现象频发、苗种资源贫乏等问题,造成了巨大的经济损失,成为制约该产业健康、可持续发展的主要瓶颈之一。
国外学者对棘皮动物免疫系统的研究开始仅仅是对棘皮动物的直观观察,包括观察其体腔细胞的吞噬作用、包裹及同种异物体的排斥现象[3]。目前已有国内外学者陆续对海胆、海星等棘皮动物进行免疫系统研究,而对刺参的免疫系统研究较少。刺参具有比较宽阔的真体腔,体腔中的体腔液有参与免疫反应的细胞,而体腔细胞可与多种体腔免疫因子共同并直接作用于入侵病原构成其免疫应答[4]。刺参机体免疫系统主要由细胞免疫和体液免疫构成,两者相互协同,共同对体内异物进行识别,从而完成伤口修复作用。随着研究的逐步深入,对刺参免疫系统组成已有初步的了解, 但仍然有很多防御机制未知[5]。有研究表明,棘皮动物体腔细胞的吞噬作用是机体最重要的免疫功能之一,其吞噬活力的大小直接影响了免疫效应的高低。
本研究将鲜活刺参经过紫外线(UVA)照射后,静置不同时间,通过测定体腔细胞吞噬率及死亡率的变化情况来监测刺参机体状态,以期从分子水平上研究刺参细胞免疫功能提供科学可靠的依据。
1 材料与方法
1.1 材 料
试剂:0.75 μm YG荧光羧基微球。
仪器:流式细胞仪,BD FACSVerseTM;激光共聚焦显微镜,Leica SP8。
1.2 方 法
1.2.1 刺参原料的制备
鲜活刺参,体长(12.5±1.6) cm,体质量(128.3±7.2) g,产自大连金州周边海域。在低温条件下运至实验室,暂养于25 L玻璃水族箱内,不间断充气,每天投饲换过滤海水,维持水温15 ℃左右,盐度28~31,pH 7.9~8.2,3 d后用于实验。
1.2.2 体腔细胞悬液制备
用无菌注射器于刺参腹部近1/3处提取体腔液,300目滤布过滤。每个试验点均保证3只刺参的体腔液等体积混合作为一次实验,重复测定3次。取适宜体积的混合体腔液于2 700 r/min离心5 min后除去上清液,利用高压灭菌的体腔液进行重悬,制备得到细胞浓度为106~107个/mL的体腔细胞悬液,用于后期实验。
扎实推进高中化学实验探究性教学,需要教师转变思维观念,理解教学本质,为学生创造利于“学”的环境.实验探究体现了实事求是、科学求真的精神,也促进了学习方式的多样化.笔者将以创设问题的方式作为实验探究的开端,引导学生通过实验亲身求证书本结论,以加强学生对知识的掌握能力.
1.2.3 样本前处理
1.2.3.1 细胞体内荧光标记及体腔细胞吞噬率检测
利用无菌注射器由刺参的尾部向体内注射30 μL的荧光微球原液,分别体内孵育30、60、120 min 后提取体腔液,制成待检测样品。
1.2.3.2 荧光微球浓度对体外体腔细胞吞噬率的影响
取制备好的体腔细胞悬液,设置荧光微球与体腔细胞体积比分别为1∶250、1∶250、1∶500、1∶1 000、1∶1 500、1∶2 000,室温置于摇床上,慢速暗反应孵育30 min,300目滤布过滤,制成待检测样品。
1.2.3.3 紫外线照射后刺参体外吞噬率的比较
1.2.3.4 紫外线照射后刺参体腔细胞死亡率的比较
设置对照组与UVA照射后静置0、1、2、3、4 h 组,取100 μL体腔细胞悬液,加入5 μL PI暗反应孵育染色15 min后,加入400 μL的Binding Buffer,混匀,300目滤布过滤,制成待检测样品。
1.2.4 流式细胞术检测细胞吞噬率和死亡率
利用流式细胞仪在测定吞噬率与死亡率时,首先在FSC/SSC散点图中圈定细胞群体,再根据吞噬荧光微球的细胞及死亡细胞所具有的荧光信号,在荧光频道数(FITC,吞噬率;PE,死亡率)单参数的直方图中区分吞噬荧光微球的细胞与未吞噬荧光微球的细胞、活细胞与死细胞,横坐标FITC与PE代表荧光信号强度,纵坐标Counts代表细胞数目。
在细胞吞噬率[6]计算公式中,P3代表吞噬荧光微球的细胞群体,P2代表未吞噬荧光微球的细胞群体,公式为
吞噬率=P3/(P2+P3)×100%
在细胞死亡率[6]的计算公式中,P′2代表死亡细胞数,P′3代表活细胞数,公式为:
死亡率=P′2/(P′2+P′3)×100%
1.2.5 激光扫描共聚焦显微镜检测
将待检测样品用300目滤布过滤于共聚焦培养皿中,以氩-氪激光为激光光源,激发光为458 nm,在460~510 nm波长下观察,物镜镜头为65倍油浸镜头,图像采集为512×512像素。为减少因荧光淬灭带来的影响,在成像之前接受可见光和激光照射的时间尽可能短且相等。
2 结果与讨论
2.1 体内荧光标记及吞噬率检测
利用FCM检测相同浓度下体内孵育荧光微球不同时间其吞噬率的变化情况,发现体内孵育30 min吞噬率为2.04%,60 min吞噬率为8.42%,120 min后吞噬率降到0.32%,吞噬率都相对较低。如图1所示,经激光共聚焦显微镜检测,发现虽光镜图像中存在细胞,但荧光图像中并不存在荧光微球。因此,无法进行荧光微球标记的体内检测。

(a)荧光图像;(b)光镜图像;(c)合成图像
图1 体内吞噬荧光微球后的刺参体腔细胞激光扫描共聚焦成像图
Fig.1Invivophagocytizing activities in coelomocytes on fluorescent microspheres detected by laser scanning confocal microscopy
2.2 体外荧光微球孵育比例对吞噬率的影响
荧光微球体外吞噬经流式细胞仪检测的吞噬率结果如图2所示。结果表明,无论设置体积比为多少,吞噬率明显高于体内吞噬,当荧光微球与体腔细胞体积比为1∶2 000时,吞噬率仍大于30%,并且随着比例的增大,荧光含量也逐渐增加。体外吞噬实验中,在荧光微球与体腔细胞体积比为1∶250与1∶500条件下孵育,其体腔细胞吞噬率均大于80%;但采用这两个比例进行UVA照射刺参后静置不同时间的体腔细胞吞噬率的检测,可能会由于荧光微球含量过高,造成实验结果差异不明显。因此最终选择1∶1 500进行刺参体腔细胞吞噬率的检测。

图2 荧光微球与刺参体腔细胞按不同体积比进行体外吞噬荧光微球的细胞吞噬率
Fig.2Invitrophagocytizing rates of coelomocytes with different volume ratio of fluorescent microspheres to coelomic cells
体腔细胞在刺参体内能够保持较高并且稳定的吞噬活力,在正常条件,体内的吞噬活性应高于体外吞噬,因此首先进行了体内吞噬实验,但是实验结果发现,体内吞噬的荧光含量远远低于体外吞噬组。研究表明,刺参机体免疫系统主要由细胞免疫和体液免疫构成,同时由于棘皮动物的开放式循环系统,体液免疫反应成为棘皮动物抵抗外来物种侵略的主要防御反应[5]。在体内吞噬实验中,体液作为刺参的主要构成[7],在激光共聚焦检测的明场下可以明显发现凝集现象较为普遍,而凝集现象作为体液免疫的指标之一[8],认为在体内吞噬实验中主要发生了体液免疫。因此,本研究的刺参体腔细胞吞噬率检测,不宜采用体内孵育荧光微球的方法。
2.3 UVA照射后刺参体腔细胞的体外吞噬率
经UVA照射30 min后,静置0~4 h,FCM检测结果如图3所示。结果表明,吞噬率在1 h达到峰值,随着静置时间的延长,吞噬率逐渐降低。经LSCM检测结果(图4)与之相同。
有研究表明,紫外线照射后会使免疫细胞及其功能发生根本改变,能够显著提高机体的特异性免疫功能和非特异性免疫功能[9]。由此可以推测,经过一定的紫外线刺激后,刺参体腔细胞的吞噬能力被激活,在静置1 h后达到峰值,随后吞噬率不断下降。由于吞噬率属于海参的主要免疫指标之一,吞噬率的下降反映机体免疫能力下降[10]。推测吞噬率降低的原因可能有三方面:一是由于应激过度,造成吞噬能力下降;二是由于荧光微球属于乳胶微粒,体腔细胞在识别并内吞之后,由于无法对微球进行分解消化,随着微球在体腔细胞内不断堆积,使得部分细胞未能及时消化,影响细胞的正常功能,导致部分细胞溶解,因此后期吞噬率下降可能是由于细胞数量减少[11];三是由于细胞本身的胞吞胞吐作用,当部分微球被识别吞噬后,但由于最终微球无法被识别消化,使得微球被排除细胞外,导致其吞噬率降低[12]。
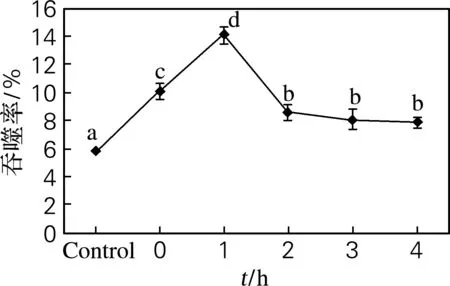
图3 UVA照射后刺参静置不同时间的体腔细胞体外吞噬率
Fig.3Invitrophagocytizing rates of coelomocytes after UVA-induced incubation for different duration

(a)荧光成像;(b)光镜成像;(c)合成图像

2.4 UVA照射后刺参体腔细胞的死亡率
对UVA照射30 min静置不同时间的体腔细胞死亡率进行流式检测,得到细胞死亡率流式散点图和统计数据结果,分别如图5和图6所示。可以看出,随着静置时间的延长,刺参体腔细胞的死亡率呈不断上升趋势。有研究表明,美洲牡蛎在快速升温胁迫下,细胞的死亡率显著升高,可能是由于存活的细胞移除死亡细胞残害的能力下降、吞噬能力下降、免疫能力降低,因此推测死亡率与吞噬率之间存在着一定的联系,通过吞噬率的变化来判断细胞的状态,进而可以判断刺参的鲜活程度。
3 结 论
刺参属于开放式循环系统,本实验中采用体内检测方法得到的吞噬率较低,因此采用体内孵育方法检测吞噬率不可行。而对于体外吞噬实验,刺参体腔细胞的吞噬率会随着荧光吞噬微球浓度的增大而升高,但过高的荧光微球浓度可能会造成吞噬率差异不显著而影响实验结果。经验证,选择荧光微球与体腔细胞体积比为1∶1 500进行刺参体腔细胞吞噬率的测定。紫外线照射后,静置不同时间(0~4 h)检测刺参体腔细胞吞噬率,结果发现,刺参体腔细胞吞噬率在静置1 h后达到峰值,随后随着静置时间的延长,吞噬率不断降低;此外,随着静置时间的延长,刺参体腔细胞的死亡率呈上升趋势,表明紫外线照射会对刺参体腔细胞的免疫功能造成一定程度的损伤,通过检测刺参细胞吞噬率可以判断刺参的鲜活程度,从分子水平为研究刺参的免疫功能提供了科学依据。
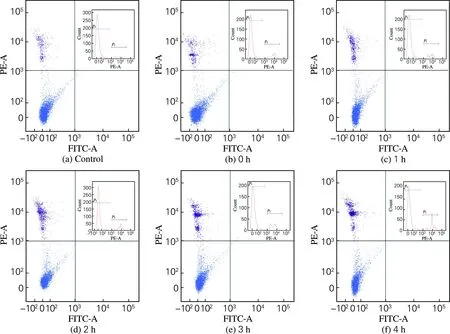
图5 UVA照射后静置不同时间的刺参体腔细胞死亡率的流式散点图
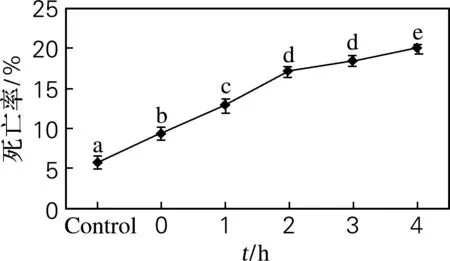
图6 细胞死亡率的流式定量分析
Fig.6 Quantitative analysis of coelomocytes mortality detected by flow cytometric
[1] 廖玉麟.中国动物志:1卷[M].北京:科学出版社,1997.
[2] 农业部渔业局.2015中国渔业统计年鉴[M].北京:中国农业出版社,2015.
[3] COFFARO K A, HINEGARDNER R T. Immune response in the sea urchinLytechinuspictus[J]. Science, 1977, 197(4311): 1389-1390.
[4] 孟繁伊,麦康森,马洪明,等.棘皮动物免疫学研究进展[J].生物化学与生物物理进展,2009,36(7):803-809.
[5] 孙永欣,王吉桥,汪婷婷,等.海参防御机制的研究进展[J].水产科学,2007,26(6):358-361.
[6] 王海娜,王宜艳,孙虎山.用流式细胞术研究二氢吡啶对刺参体腔细胞免疫功能的影响[J].湖北农业科学,2009,48(1):147-149.
[7] 臧元奇.刺参对典型环境胁迫的生理生态学响应及其机制研究[D].青岛:中国海洋大学,2012.
[8] 王长法,张士璀,王昌留.水生无脊椎动物凝集素研究概述[J].海洋科学,2005,29(4):63-67.
[9] 李达,田福利,任永卫,等.紫外线照射充氧自血回输对高血压病患者T淋巴细胞亚群及白细胞介素2受体的影响[J].中华医疗杂志,1996,19(1):15-16.
[10] GROSS P S, AL-SHARIF W Z, CLOW L A, et al. Echinoderm immunity and the evolution of the complement system[J]. Developmental and Comparative Immunology, 1999, 23(4/5): 429-442.
[11] 徐翊轩,战文斌,邢婧.温度与脂多糖对栉孔扇贝血细胞吞噬活力的影响[J].中国海洋大学学报(自然科学版),2015,45(6):31-38.
[12] 陈东亚,陆罗定,俞萍,等.流式细胞术检测小鼠腹腔巨噬细胞吞噬能力的方法学探讨[J].中国免疫学杂志,2014(8):1074-1077.
EffectofUVAonthephagocyticactivityofcoelmocyteinseacucumberStichopusjaponicus
TIANJingyu1,DINGYue1,ZHANGJing1,JIANGPengfei2,ZHOUDayong1,2,SONGLiang1,2
( 1.SchoolofFoodScienceandTechnology,DalianPolytechnicUniversity,Dalian116034,China;2.NationalEngineeringResearchCenterofSeafood,DalianPolytechnicUniversity,Dalian116034,China)
The coelmocyte phagocytic activity ofS.japonicuswas measured with flow cytometry (FCM) and laser scanning confocal microscope (LSCM). Phagocytizing rate (PR) of coelmocyte in suspensions with different fluorescent microsphere concentrations inS.japonicuswas testedinvivoandinvitro. Fluorescent microspheres could not be detected by LSCMinvivo, while the induction of phagocytosisinvitrovia injection was feasible. The results showed that the volume ratio of fluorescent microspheres to coelomic cells of 1∶1 500 was a suitable proportion for PR evaluation of coelmocyte inS.japonicus. According to FCM test, PR of coelmocyte reached to the maximum after 1 h and then gradually declined, which demonstrated consistent results with LSCM. Meanwhile, the mortality rate (MR) of coelomocyte inS.japonicuscontinued rising throughout the trial. It was concluded that UVA irradiation could cause a certain degree of damage to the immune function of coelmocyte, its MR was possibly associated with PR in this study. The freshness ofS.japonicascould be determined by detecting the change of PR fromS.japonicascoelmocyte.
Stichopusjaponicus; coelmocyte; phagocytic; UVA; mortality
田景玉,丁月,张晶,姜鹏飞,周大勇,宋亮.紫外线照射对刺参体腔细胞吞噬活性的影响[J].大连工业大学学报,2017,36(6):406-410.
TIAN Jingyu, DING Yue, ZHANG Jing, JIANG Pengfei, ZHOU Dayong, SONG Liang. Effect of UVA on the phagocytic activity of coelmocyte in sea cucumberStichopusjaponicus[J]. Journal of Dalian Polytechnic University, 2017, 36(6): 406-410.
2017-03-15.
国家自然科学基金项目(31401562);辽宁省农业领域青年科技创新人才培养计划项目(2015002);辽宁省教育厅科学研究一般项目(L2014220).
田景玉(1991-),女,硕士研究生;通信作者:宋 亮(1980-),男,讲师.
TS254.9
A
1674-1404(2017)06-0406-05

