微型制备型电泳比较从细胞中提取蛋白质的3种方法
顾 芳,汪慎燚,秦宜德
(安徽医科大学 生物化学与分子生物学教研室,合肥 230032)
微型制备型电泳比较从细胞中提取蛋白质的3种方法
顾 芳,汪慎燚,秦宜德
(安徽医科大学 生物化学与分子生物学教研室,合肥 230032)
为探索建立适用于从人卵巢癌细胞株SKOV3中提取蛋白质的最优化方法,通过培养人卵巢癌细胞株SKOV3,分别采用Pull-Down Lysis、RIPA裂解法和加有硫脲的细胞裂解液提取细胞总蛋白,使用 Bradford法测定蛋白质浓度,聚丙烯酰胺凝胶电泳(SDS-PAGE )分析,然后使用微型制备型电泳分离蛋白,根据色谱图上的吸收峰比较从人卵巢癌细胞株SKOV3细胞中提取蛋白质的3种方法。结果表明:不同方法提取人卵巢癌细胞株SKOV3总蛋白的丰度及色谱图存在差异,Pull-Down Lysis 试剂法在分离相对分子质量为15~80 kDa的蛋白质方面具有明显的优势。3种方法中以Pull-Down Lysis 试剂法为人卵巢癌细胞株SKOV3蛋白质提取的最优方法,与微型制备型电泳的兼容性更好。
蛋白质提取; SKOV3细胞; 制备型电泳; 优化方法
0 引 言
凝胶电泳和毛细管电泳技术广泛应用于核酸、蛋白质等生物物质的分析领域[1-2]。但是,由于电泳技术不易放大,有关制备型电泳技术的研究报道很少[3-5]。1997年,Cole 等利用设计的一套可在线收集样品的制备型电色谱装置,实现了标准蛋白质混合物的分离[6-7]。本实验所用的微型制备型电泳为美国BIO-RAD公司生产,它将凝胶电泳、毛细管电泳技术及色谱分析技术相结合,能快速、有效地分离核酸和蛋白质等生物大分子。它能分离相对分子质量差别仅有2%的蛋白,通过非变性PAGE胶纯化等电点只相差0.1pH单位的蛋白。但它对样品的质量要求比较高,因此样品的制备是制备型电泳分析中最重要的环节,它直接影响后续的研究分析。
本文实验以人卵巢癌细胞株SKOV3为对象,比较3种不同的蛋白质提取方法,即Pull-Down Lysis、RIPA裂解法和加有硫脲的细胞裂解液法,了解不同裂解液的提取蛋白效率以及它们与制备型电泳的兼容性,从而建立SKOV3细胞总蛋白的相对最优提取方法。
1 材料与方法
1.1材料
人卵巢癌细胞株SKOV3由本实验室保存。DMEM培养液购自美国GIBCO 公司,胎牛血清购于杭州四季青公司。胰蛋白酶、丙酮酸钠和谷氨酰胺均购自美国 AMRESCO 公司。二氧化碳培养箱购自美国Thermo公司,超声破碎仪是美国Sonics。微型制备型电泳购于美国BIO-RAD公司,型号为Mini Prep Cell。
1.2细胞培养
培养SKOV3细胞,接种于含10%胎牛血清的DMEM细胞培养液中,在37 ℃、5%CO2饱和湿度的细胞培养箱里培养。待单细胞层接近汇合时,用0.1%的胰酶(含0.1 mol/L EDTA)消化,分别以 5×104个/mL的密度接种于直径为100 mm的3个细胞培养皿中,24 h后换液并继续培养24 h,提取蛋白质(此时每皿细胞数达到1×107个)。
1.3细胞总蛋白的提取
Pull-Down Lysis 试剂法:用胰酶消化后离心收集细胞,用预冷的 PBS洗涤细胞3次,加Pull-Down Lysis试剂(1 mL每1×107个细胞),在冰上静置裂解30 min,期间颠倒混匀数次,4 ℃、12 000g离心20 min后,取上清储存于-80 ℃冰箱备用。
RIPA裂解法 :离心收集胰酶消化的细胞后,用预冷的PBS 洗细胞3次,然后加500 μL RIPA,RIPA buffer中加入PMSF 5 μL放于冰上静置裂解30 min。超声(180 W)10次,每次10 s,间隔 10 s,最后以4 ℃,12 000g离心20 min后,取上清储存于-80 ℃冰箱备用。
硫脲裂解法(参照 Herman 等[8]的方法) :离心收集到的细胞经预冷的PBS洗2次后,在1×107个细胞中加含硫脲裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,现加 65 mmol/L DDT)1 mL。放于冰上静置裂解30 min,再超声180 W,每次工作10 s,间隔10 s,最后以4 ℃,12 000g离心20 min,取上清储存于-80 ℃冰箱备用。
1.4蛋白质定量
采用Bradford法[9-11]定量,以牛血清白蛋白标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,计算蛋白浓度。
1.5聚丙烯酰胺凝胶电泳(SDS-PAGE)
采用SDS-PAGE非连续变性电泳检测:12%浓度的分离胶,4%浓度的浓缩胶,沸水浴5 min后上样。用考马斯亮蓝R-250染色。
1.6微型制备型电泳分析
采用Native-PAGE[12]非变性胶:10%浓度的下层胶,4%浓度的上层胶。分别取含30 μL上述方法提取的总蛋白质液与上样缓冲液混合,用注射器穿过上槽缓冲液的液面,将样品缓缓加到微型制备型电泳仪的胶面,将电源调制恒流6 mA,启动电源,并接通核酸蛋白检测仪和自动部分收集器。
2 结果与分析
2.1标准曲线的绘制及蛋白质含量、浓度的对比分析
由图1可知,牛血清白蛋白浓度与吸收度A在0~0.8 g/L范围内线性关系良好,其回归方程为:Y=0.815X-0.810(R2=0.992)。由此对3种蛋白提取方法得到的蛋白质含量及浓度对比分析见表1。
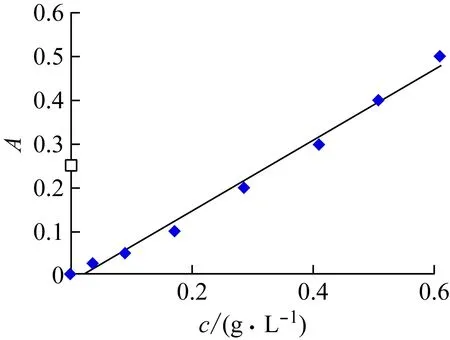
图1 牛血清白蛋白的标准曲线

表1 3种提取蛋白方法蛋白质含量及浓度比较
从表1可见,3种提取蛋白方法从蛋白质含量和蛋白质浓度上看,Pull-Down Lysis 试剂法优于细胞裂解法和硫脲裂解法。
2.2蛋白质的SDS-PAGE电泳分析
在细胞数相同、不同方法提取蛋白后终体积相同、 电泳上样体积相同的条件下,电泳结果如图2所示。
从图2可以看出,蛋白质带型基本不变,但泳道2所示蛋白质条带着色较深,蛋白质含量较高;泳道1和泳道3蛋白质条带着色浅,蛋白质含量较低,其结果与蛋白质含量及浓度计算相吻合。进一步表明Pull-Down Lysis 试剂法适合作为SKOV3细胞总蛋白的提取方法。
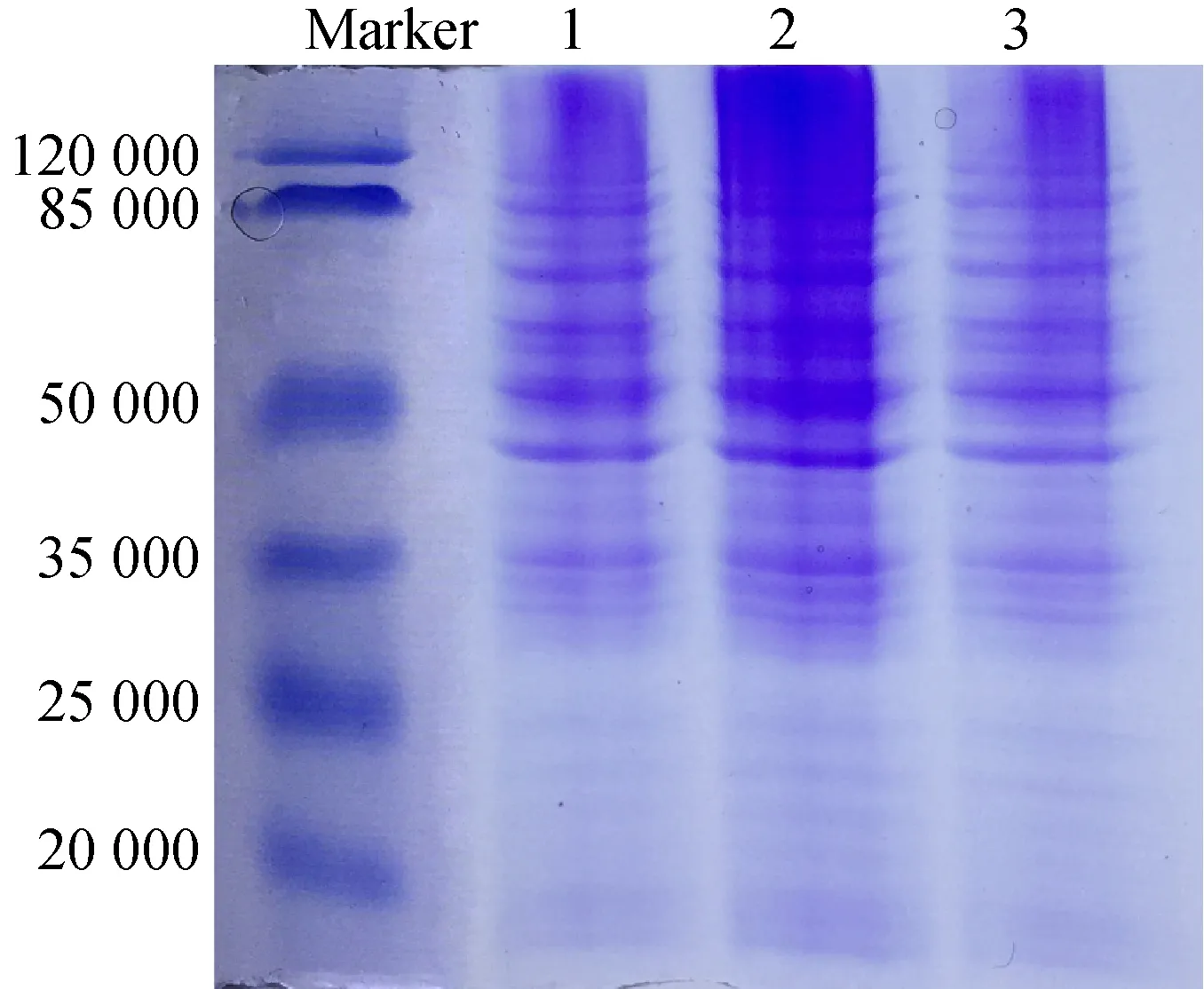
1-RIPA裂解法;2-Pull-Down Lysis试剂法;3-硫脲裂解法图2 3种方法提蛋白SDS-PAGE电泳图谱
2.3微型制备型电泳分析
样品通过微型制备型电泳分离由核酸蛋白检测仪检测到的吸收峰经HD-A电脑采集器分析结果如下:图3(b)出峰数及峰面积均高于图3(a)及图3(c)。出峰时间图3(c)晚于图3(a)及图3(b),图3(a)的出峰时间稍早于图3(b),基本一致,表明样品浓度不同出峰时间会有差别。
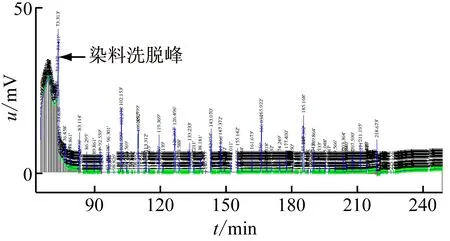
(a) RIPA裂解法
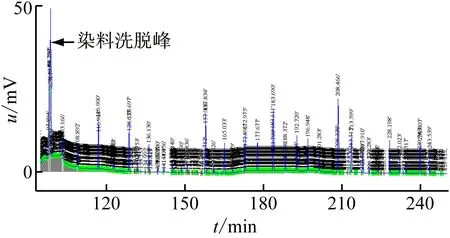
(b) Pull-Down Lysis试剂法
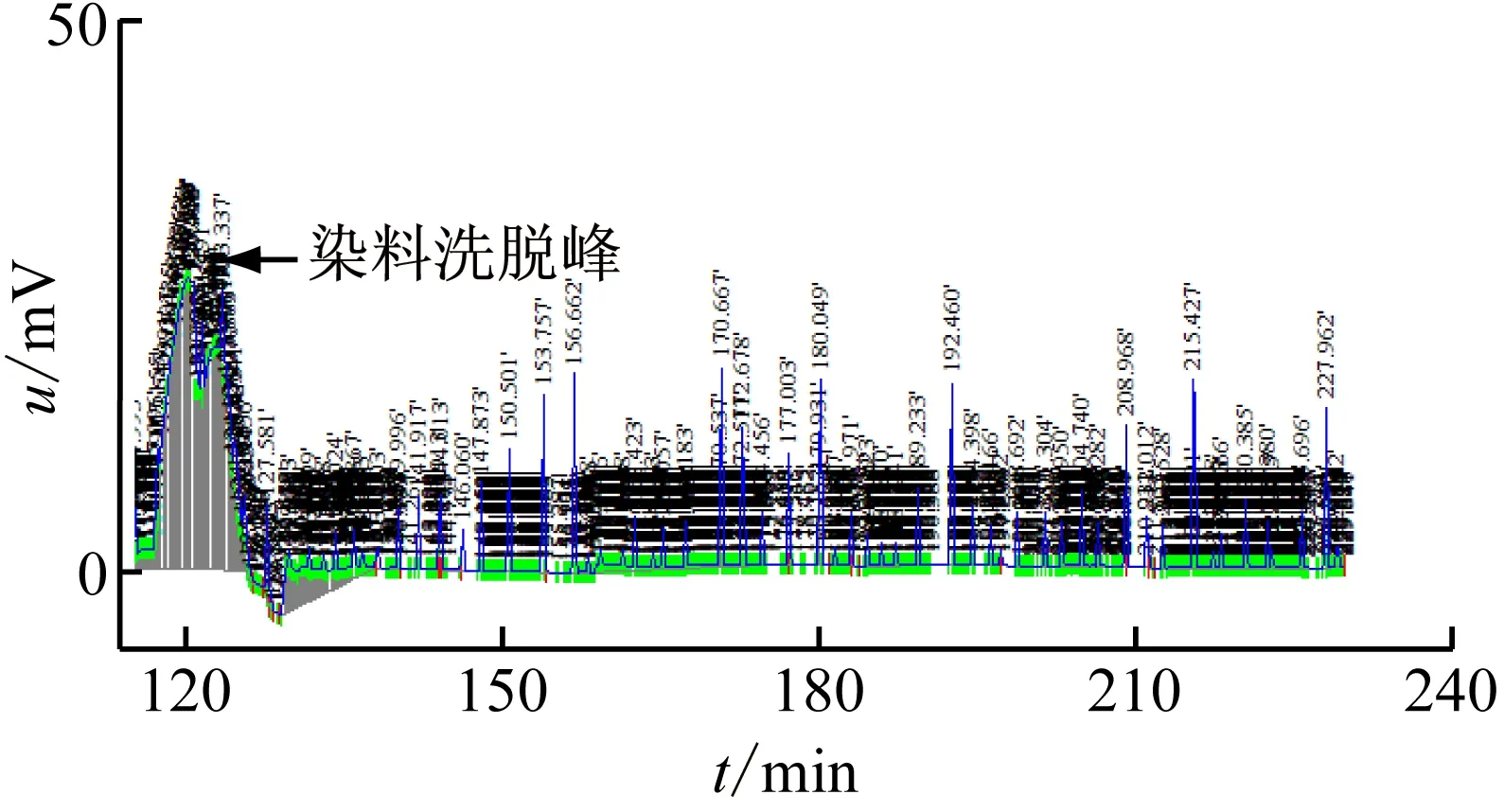
(c) 硫脲裂解法图3 3种方法提取总蛋白的吸收峰色谱图
3 结 论
本研究所用的微型制备型电泳是一种设计精巧的核酸蛋白样品分离纯化系统。它的功能就是从样品中分离纯化出目标蛋白或者目标核酸。样品在柱状胶中进行电泳,蠕动泵给予样品洗脱以动力,带动样品从凝胶柱中流出,流出的样品被分子截留膜截留后,经过陶瓷冷却棒中心的管道流经紫外检测仪,最后为自动部分收集器收集以便进行后续研究。电泳仪的电泳液经循环泵和陶瓷冷却棒,保持一定温度,保证样品条带平行地洗脱,并可以最大限度地确保在用非变性胶分离纯化样品的过程中,保持样品活性。
样品的质量是微型制备型电泳分析中最关键的环节之一,直接影响制备型电泳的分辨率和可靠性。本研究采取了3种从SKOV3细胞中提取总蛋白的方法,发现相比其他两种方法,Pull-Down Lysis 试剂法步骤少,操作简单快速,蛋白质得率高。RIPA裂解法是比较常用的提取蛋白的方法,含有高效去垢剂成分1%NP-40,可以破坏脂质双分子层[13]。硫脲是高效率的变性剂,能溶于高浓度的尿素溶液,从而改善疏水性膜蛋白的溶解性。提取液中所加的 CHAPS 是兼性分子,不带净电荷,能溶于高浓度的尿素溶液,可以进一步提高蛋白质的溶解性[14-15]。但RIPA裂解法和硫脲裂解法解法提取蛋白的步骤相对较多、耗时比较长,可能会引起蛋白的降解。从制备型电泳分离的色谱图看,Pull-Down Lysis试剂法在分离相对分子质量为15~80 kDa的蛋白质方面具有明显的优势,色谱图分辨率更高结果重复性好,有利于后续的蛋白质研究和分析。当然该试剂的分离纯化效率与样品来源关系密切,所以需针对来源不同的样本探索选择适宜的提取方法。
通过本实验,3种方法中以Pull-Down Lysis 试剂法为SKOV3 细胞的蛋白质提取的最优方法,与微型制备型电泳的兼容性更好。
[1] Garcia A A,Bonen M R,Ram irez-Vick J,etal.Bioseparation physical form s of plasmid DNA using a combination of low electric Process Science[M].Beijing: Tsinghua University Press,2002:277-298.
[2] 吴娟芳,陈令新,罗国安,等.毛细血管技术在药物分析中的研究进展[J].药学学报,2006,41(5):385-389.
[3] 冯 蕾,赵风生.制备型电泳法分离腺苷酸混合物[J].化学与生物工程,2009,26 (4) :50-54.
[4] Karim S,Aoyama M.Separation of Humic Acid Constituents by Polyacrylamide Gel EIectro phoresis in the Presence of Concentrated Urea Using a Preparative Electrophoresis System[J].Humic Acid,2012(6):28-31.
[5] 郝斐然,付 斌,张养军,等.基于电迁移的蛋白质制备技术和方法新进展[J].色谱,2015,33(12):1226-1233.
[6] Cole K D,Cabezas H J.Improved preparative electrochromatography column design[J].Journal of Chromatography A,1997,3(10):57-62.
[7] Tellez C M,Cole K D.Preparative electrochr omatography of proteins in various types of porous media[J].Electrophoresis,2000,21(5):1001-1009.
[8] Herman E M,Helm R M,Jung R,etal.Genetic modification removes an immunodominant allergen from soybean [J].Plant Physiology,2003, 132 : 36-43.
[9] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976, 72(5):248-254.
[10] 李 宁.几种蛋白质测定方法的比较[J].山西农业大学学报,2006,26(2):132-134.
[11] 解 毅.油菜种子微粒体制备及蛋白浓度检测方法研究[J].安徽农业科学,2011,39(15):8885-8886.
[12] 郭尧君.蛋白质电泳实验技术[M].北京 :科学技术出版社,2005,98-105.
[13] 李 阳,龚依伊,谢亦林,等.小型猪发育期牙胚蛋白提取方法探讨[J].口腔生物医学,2015,6(2):83-86.
[14] Zou Q,Habermann-Rottinghans S M,Murphy K P.Urea effents on protein stability:hydrogen bonding and the hydrophobic effect [J].Proteins,1998,31(2):107-115.
[15] Herbert B.Advances in protein solubilisation for two-dimensional electrophoresis[J].Electrophoresis,1999,20(4~5):660-663.
ComparisonofThreeProteinExtractionMethodsbyMiniPreparativeElectrophoresis
GUFang,WANGShenyi,QINYide
(Department of Biochemistry and Molecular Biology, Anhui Medical University, Hefei 230032, China)
Protein extraction from tissue or cells is an important step to effect high-resolution protein separation by preparative electrophoresis.Three protein extraction methods were compared in order to determine an optimal one for human ovarian cancer cell line SKOV3.The three methods including Pull-Down Lysis kit, RIPA lysis buffer and Thiourea lysis buffer were adopted to extract the total protein from human ovarian cancer cell line SKOV3.The protein concentration was determined by Bradford protein assay for calculation of the protein yield, and then the protein samples were separated by sodium dodecyl sulfate-polyacrylamide electrophoresis(SDS-PAGE)and preparative electrophoresis.Data showed the protein yielded by the method of using Pull-Down Lysis kit is high.The Pull-Down Lysis method generated the best resolution in which most proteins with molecular weight from 15 kDa to 80 kDa were distributed.Experiment showed that the Pull-Down Lysis method has the best protein solubilization ability in three protein extraction methods.
protein extraction; SKOV3 cells; mini preparative electrophoresis; optimization mathod

R 34
A
1006-7167(2017)10-0021-03
2017-01-12
国家自然科学基金资助项目(81472448) ;安徽省自然科学基金资助项目(1508085MH196)
顾 芳(1978-),女,安徽合肥人,博士生,实验师,研究方向为生物活性肽及实验教学与管理。Tel.:13855120256; E-mail:wsxgf2013@163.com
秦宜德(1962-),男,安徽合肥人,博士,教授,研究方向为生物活性肽。Tel.:0551-65161131;E-mail:qinyide@hotmail.com

