利用基因组重排技术选育高产洛伐他汀红曲菌株
李 亮, 林 娟, 叶秀云
(福州大学福建省海洋酶工程重点实验室, 福建 福州 350116)
利用基因组重排技术选育高产洛伐他汀红曲菌株
李 亮, 林 娟, 叶秀云
(福州大学福建省海洋酶工程重点实验室, 福建 福州 350116)
采用基因组重排法选育高产洛伐他汀红曲菌株. 原生质体制备条件: 溶壁酶1.0%(质量分数), 菌丝菌龄66 h, 酶解时间3 h, 酶解温度30 ℃, 高渗磷酸盐缓冲液pH值为6.0, 再生培养基的渗透压稳定剂为0.6 mol·L-1NaCl; 原生质体灭活条件: 紫外灭活120 s, 微波灭活300 s; 原生质体融合条件: PEG 30%(质量分数), Ca2+0.03 mol·L-1,30 ℃融合12 min, 原生质体融合率1.95%. 以经紫外和微波诱变得到的正突变菌株为亲本进行三轮基因组重排, 获得一株遗传稳定、 高产洛伐他汀菌株R″-30, 洛伐他汀产量较原始菌株SH2-7提高52%。
红曲霉; 洛伐他汀; 选育; 基因组重排
0 引言
红曲在我国已有1 000多年历史, 一直被当作食疗两用的中药材[1]. 红曲霉是一种小型丝状腐生真菌, 可产生众多对人体有益的代谢产物, 如洛伐他汀、 红曲色素、 麦角固醇[2]、 γ-氨基丁酸[3]等, 其中洛伐他汀能够强烈抑制胆固醇的合成. 近年来, 随着生活条件的提高, 患有心血管疾病的人越来越多, 红曲洛伐他汀因其高效、 低毒、 安全等特点[4], 已成为世界公认的治疗心血管疾病的理想药剂. 但是, 初筛得到的原始菌株往往因产量低、 遗传不稳定等缺点, 难以用于工业生产. 基因组重排技术是Stemmer等在传统分子重组育种的基础上于1998年提出的一种分子育种方法[5], 其最大优点是快速、 高效. 目前为止, 利用基因组重排技术选育高产洛伐他汀红曲菌株的研究较少, 本文采用该方法对产洛伐他汀红曲菌株进行选育, 以期获得洛伐他汀高产菌株, 为后期工业生产应用打下基础.
1 材料与方法
1.1 实验材料
1) 菌种. 紫色红曲霉菌SH2-7, 由本实验室筛选、 保存.
2) 试剂. 内酯型洛伐他汀: 分析标准品, 购自上海晶纯生化科技股份有限公司; 溶菌酶、 纤维素酶, 聚乙二醇(PEG)6000, 乙腈(色谱纯), 购自国药集团化学试剂有限公司; 蜗牛酶, 溶壁酶, 购自上海如吉生物科技发展有限公司; 其他试剂均为分析纯.
磷酸盐缓冲液(PBS): 称取31.21 g的NaH2PO4·2H2O, 用蒸馏水溶解并定容至1 000 mL(甲液), 然后称取71.64 g的Na2HPO4·12H2O , 用蒸馏水溶解并定容至1 000 mL(乙液). 调整甲液与乙液的混合比例, 配制不同pH值的磷酸盐缓冲液.
高渗缓冲液: 以0.7 mol·L-1NaCl作溶剂配制PBS.
聚乙二醇(PEG)溶液: 称量所需的PEG, 用0.05 mol·L-1CaCl2配制, 另加0.05 mol·L-1甘氨酸.
酶液配制: 高渗缓冲液溶解溶壁酶, 无菌滤膜(0.45 μm)过滤除菌.
3) 培养基. PDA培养基[6]. 再生培养基: 0.6 mol·L-1NaCl配制PDA.
种子培养基: 葡萄糖30 g·L-1, 蛋白胨20 g·L-1, 酵母膏20 g·L-1, 黄豆粉10 g·L-1, 甘油50 g·L-1, MgSO4·7H2O 1 g·L-1, NaNO32 g·L-1, ZnSO4·7H2O 2 g·L-1, KH2PO41 g·L-1, pH值自然.
液体发酵培养基: 葡萄糖20 g·L-1, 甘油50 g·L-1, 蛋白胨10 g·L-1, 酵母膏10 g·L-1, NaNO32 g·L-1, MgSO4·7H2O 1 g·L-1, ZnSO4·7H2O 2 g·L-1, KH2PO41 g·L-1, pH值自然.
4) 主要仪器设备. PYX-PHS-X 型恒温培养箱(上海跃进医疗仪器一厂); ZWY-2102C型恒温培养振荡器(上海智城分析仪器制造有限公司); T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司); E100光学显微镜(Nikon ECLIPSE); D-2000 Elite型高压液相色谱仪(日本HITACHI); MM720KG1-PW微波炉(广东美的微波制造有限公司); XB.K.25血球计数板(上海市求精生化制剂仪器公司).
1.2 实验方法
1.2.1 洛伐他汀产量的测定
发酵液与70%乙醇1∶9混匀, 水浴摇床55 ℃, 130 r·min-1振荡提取1 h; 4 200 r·min-1离心5 min, 取上清; 有机微孔滤膜(0.22 μm)过滤, 取滤液采用高效液相色谱法(HPLC)[7]检测洛伐他汀含量.
1.2.2 菌株培养条件
将菌株划线接种于PDA平板, 30 ℃避光培养3 d, 打孔器打2个菌饼(直径6 mm)接入种子培养基, 32 ℃, 120 r·min-1避光培养2 d, 转接到液体发酵培养基, 接种量8%(体积分数), 避光变温培养: (1) 28 ℃、 180 r·min-1, 2 d; (2) 26 ℃、 230 r·min-1, 2 d; (3) 25 ℃、 230 r·min-1, 2 d; (4) 23 ℃、 230 r·min-1, 数天, 跟踪测定发酵液中洛伐他汀含量.
1.2.3 孢子悬液的制备
参考黑曲霉孢子悬液的制备方法[8]进行部分改良, 如在充分打散孢子后经4层无菌擦镜纸过滤去除菌丝.
1.2.4 紫外诱变
将制备好的孢子悬液分装至带有大头针的无菌培养皿(直径6 cm)中, 装液量5 mL, 依据紫外诱变法[6]分别照射0、 1、 2、 3、 4、 5、 6 min, 以未经照射的孢子悬液为对照组. 将以上7组孢子悬液分别进行适当稀释后涂布于PDA平板上, 30 ℃避光培养3~4 d, 数菌落, 计算致死率, 经发酵检测后, 计算正突变率.
致死率(%)= [(未经诱变处理菌落数-诱变处理后菌落数)/未经诱变处理菌落数]×100%
正突变率(%)=(正突变菌株数/诱变处理后菌落数)×100%
1.2.5 微波诱变
无菌试管分装孢子悬液(调整其浓度至103~104个·mL-1), 装液量5 mL, 将试管置于小烧杯中, 于微波炉中进行诱变处理. 微波辐射采用高档火, 微波每处理5 s便将试管取出冰浴去除热效应, 将菌液分别用微波处理0、 40、 80、 120、 160、 200 s, 诱变时间为微波处理累加时间, 以处理0 s的孢子悬液作对照. 将以上6组孢子悬液分别进行适当稀释后涂布于PDA平板上, 30 ℃培养3~4 d, 计算致死率和正突变率, 方法和公式同1.2.4.
1.2.6 原生质体制备
红曲霉于PDA平板30 ℃培养4~5 d; 接入种子液, 30 ℃ 120 r·min-1培养2~3 d; 参考里氏木霉原生质体的制备方法[9]制备原生质体, 计算原生质体再生率, 公式如下:
原生质体再生率=[(再生培养基菌落数-PDA培养基菌落数)/原生质体数 ]×100%
1.2.7 原生质体灭活
紫外灭活: 吸取制备好的原生质体悬液于灭菌的6 cm平皿(内有大头针)内, 置于磁力搅拌器上, 放置于距离15 W紫外灯30 cm处进行灭活处理, 照射时间分别为30、 60、 90、 120、 150 s.
热灭活: 取制备好的原生质体悬液5 mL于灭菌的离心管内, 置于恒温水浴摇床(50 ℃ 150 r·min-1)中分别处理4、 6、 8、 10、 12、 14、 16、 18 min.
微波灭活: 吸取制备好的原生质体悬液于灭菌的小试管内, 置于微波炉中, 采取高档火, 分别辐射120、 150、 200、 250、 300、 350 s, 每辐射5 s就拿出用冰水冷却一次以消除热效应.
取经上述方式灭活过的原生质体悬液, 用高渗缓冲液适当稀释后涂布于再生培养基上, 并以未经灭活的悬液作对照, 30 ℃培养3~4 d, 数菌落, 并计算灭活率.
灭活率=[(未经灭活平板菌落数×相应稀释倍数-灭活后平板菌落数×相应稀释倍数)/(未经灭活平板菌落数×相应稀释倍数)]×100%
1.2.8 原生质体融合
取不同方式灭活的原生质体悬液1∶1(体积比)混合, 加入适量的PEG促融剂, 振荡均匀后, 置于30 ℃、 150 r·min-1恒温水浴摇床中, 融合10 min取出并加入大量高渗缓冲液稀释促融剂, 充分振荡后离心(4 000 r·min-1、 10 min), 收集沉淀, 再用高渗缓冲液洗涤后重悬浮, 适当稀释涂布于再生培养基, 以未灭活原生质体混合液为对照, 30 ℃培养3~4 d后, 数菌落数, 计算融合率.
融合率=[(融合后菌落数×相应稀释倍数)/(灭活前混合原生质体菌落数×相应稀释倍数)]×100%
2 结果与讨论
2.1 正突变库的建立
2.1.1 诱变剂量的选择
分别对红曲菌株SH2-7的单孢子悬液进行不同时间的紫外、 微波诱变处理, 结合致死率和正突变率, 选择最佳诱变剂量, 结果如图1所示. 可以看出, 紫外照射4 min时致死率达到79%, 此时正突变率最高达到8%, 因此选择紫外照射4 min对菌株SH2-7进行诱变处理; 微波处理160 s时致死率达到82.5%, 此时正突变率最高达到8%, 因此选择微波处理160 s对菌株SH2-7进行诱变处理.

图1 出发菌株SH2-7的诱变曲线Fig.1 Mutation curves of original strain SH2-7
2.1.2 正突变菌株的筛选
经筛选, 紫外诱变获得2株正突变菌株, 其编号为4-4、 5-5, 产洛伐他汀能力较SH2-7分别提高了27%和20%; 微波诱变获得3株正突变菌株, 其编号为W2、 W42、 W44, 洛伐他汀产量较SH2-7分别提高了22%、 28%、 27%. 正突变菌株菌落形态与SH2-7的对比结果见图2, 4-4、 5-5菌落形态与出发菌株相比没有发生明显变化, W42、 W44菌落颜色较SH2-7更深, W2无明显区别.

图2 出发菌株SH2-7和正突变菌株的菌落形态Fig.2 Colony morphology of original strain SH2-7 and mutant strains
2.2 原生质体制备条件的研究

表1 不同种类酶液对原生质体制备及再生的影响Tab.1 The effects of different types of enzyme on protoplast preparation and regeneration
目前原生质体制备最常用的方法为酶解法; 微生物种类繁多, 其细胞壁成分亦不同, 需要选择相应的酶液对其进行酶解.
采用两种酶液反应3 h, 实验结果如表1所示, 编号1为0.3%(质量分数)溶菌酶+0.1%(质量分数)纤维素酶+0.1%(质量分数)蜗牛消化酶, 编号2为0.5%(质量分数)溶壁酶. 可以看出, 0.5%(质量分数)溶壁酶制备的原生质体数量较多, 原生质体的再生率也比较高. 因此, 选择溶壁酶进行后续研究. 进一步对溶壁酶浓度、 原生质体制备的最适菌龄、 酶解时间、 酶解温度、 缓冲液pH、 渗透压稳定剂等因素进行探究, 结果见图3.

图3 原生质体制备条件研究Fig.3 Study on preparation conditions of protoplasts
由图3(a)可知, 加大酶浓度, 原生质体产量呈上升趋势, 但再生率却呈下降趋势, 可能是较高浓度的酶液会破坏其活性, 使其不易再生. 综合考虑, 选择1.0%(质量分数)溶壁酶为原生质体制备的最终酶浓度. 菌丝菌龄对原生质体产量和再生率的影响均呈先升后降趋势, 见图3(b). 当菌丝菌龄为66 h时, 产量和再生率均达到最高, 过早菌丝量不够, 过晚细胞壁因物质的堆积而变得越来越厚, 难以被酶解, 导致产量下降.
由图3(c)可知, 酶解时间对原生质体制备影响显著, 当时间由2 h延长到3 h, 其产量和再生率均迅速增加. 说明反应对时间较敏感, 酶解时间过短, 反应不够完全, 酶解时间过长, 又会使得较早成型的原生质体失去再生能力. 结果显示酶解3 h时, 原生质体数和再生率均处于峰值.
酶解温度既影响溶壁酶的反应速率, 又影响原生质体活性. 结果如图3(d)所示, 30 ℃时, 原生质体产量和再生率都处在峰值; 随着温度升高, 产量略有下降, 但再生率却下降明显, 说明高温不利于原生质体的再生.
分别在pH值为6.0、 7.0、 8.0的环境中进行酶解, 实验结果如图3(e), 在pH值为6.0的高渗缓冲液中, 原生质体制备和再生的效果最佳.
渗透压稳定剂能使原生质体在环境中不易膨胀或皱缩. 渗透压稳定剂常用的有两类: 无机盐和有机物, 如NaCl、 KCl、 甘露醇、 山梨醇、 蔗糖等, 浓度一般控制在0.3~1.0 mol·L-1. 其中丝状真菌主要选用无机盐. 本实验采用0.6 mol·L-1NaCl、 KCl、 甘露醇、 山梨醇配制再生培养基, 实验结果如图3(f), 0.6 mol·L-1NaCl的效果最好, 原生质体再生率高达1.45%. 醇类物质做渗透压稳定剂效果不明显, 可能是由于其营养物质较丰富, 可被未完全破壁的原生质体利用来提前再生, 进而竞争性抑制了原生质体的再生.
2.3 原生质体灭活
进行原生质体融合时, 为方便重组体的筛选, 多使用带有遗传标记的亲本菌株. 在本实验中, 选用双亲本原生质体灭活标记法. 分别采用紫外、 热、 微波三种不同方式对原生质体进行灭活处理, 探讨各自最适灭活时间, 结果见图4. 由图4可知, 紫外照射120 s、 50 ℃热灭活14 min、 微波处理300 s, 原生质体灭活率都接近100%, 满足灭活要求.

图4 红曲霉原生质体灭活曲线Fig.4 Inactivation curves of protoplasts of Monascus
2.4 原生质体融合
目前, 用于原生质体融合的方法主要是PEG结合高Ca2+诱导法. 实验对不同灭活方式的多种组合及融合条件(PEG浓度、 融合时间和温度以及Ca2+浓度)进行研究, 结果见图5.
不同灭活方式致死的原理不同, 所以, 选择经过不同方式灭活的原生质体进行融合, 可起到损伤互补的作用, 使得融合后的原生质体拥有再生能力. 图5(a)显示, 将经紫外灭活与微波灭活的原生质体进行融合, 效果明显高于其他两种组合方式.
PEG可有效促进原生质体接触、 融合, 但浓度太低起不到促进作用, 太高又会抑制质膜充分接触, 所以适当的PEG浓度是原生质体高效融合的前提条件. 由图5(b)可知, 当PEG浓度为30%(质量分数)时, 效果最好.
融合时间将直接影响融合的效果. 本次实验研究了融合时间为8、 12、 16、 20 min的原生质体融合效果, 结果见图5(c), 当融合时间为12 min时, 效率最高.
提高温度, 溶液粘性下降, PEG流动性增强, PEG与原生质体能更充分地接触, 从而有利于提高融合率; 但温度过高时, 则可能会破坏原生质体活性. 本次实验设置了25、 30、 35、 40 ℃四个温度梯度进行融合, 图5(d)表明, 原生质体融合率在30 ℃时最高.
在PEG中添加一定浓度的Ca2+有利于促进原生质体的融合, 通常丝状真菌在PEG中添加0.01~0.1 mol·L-1Ca2+浓度为宜. 图5(e)显示, 在30%PEG(质量分数)中添加0.03 mol·L-1Ca2+时, 原生质体融合效果最好, 达到1.95%.
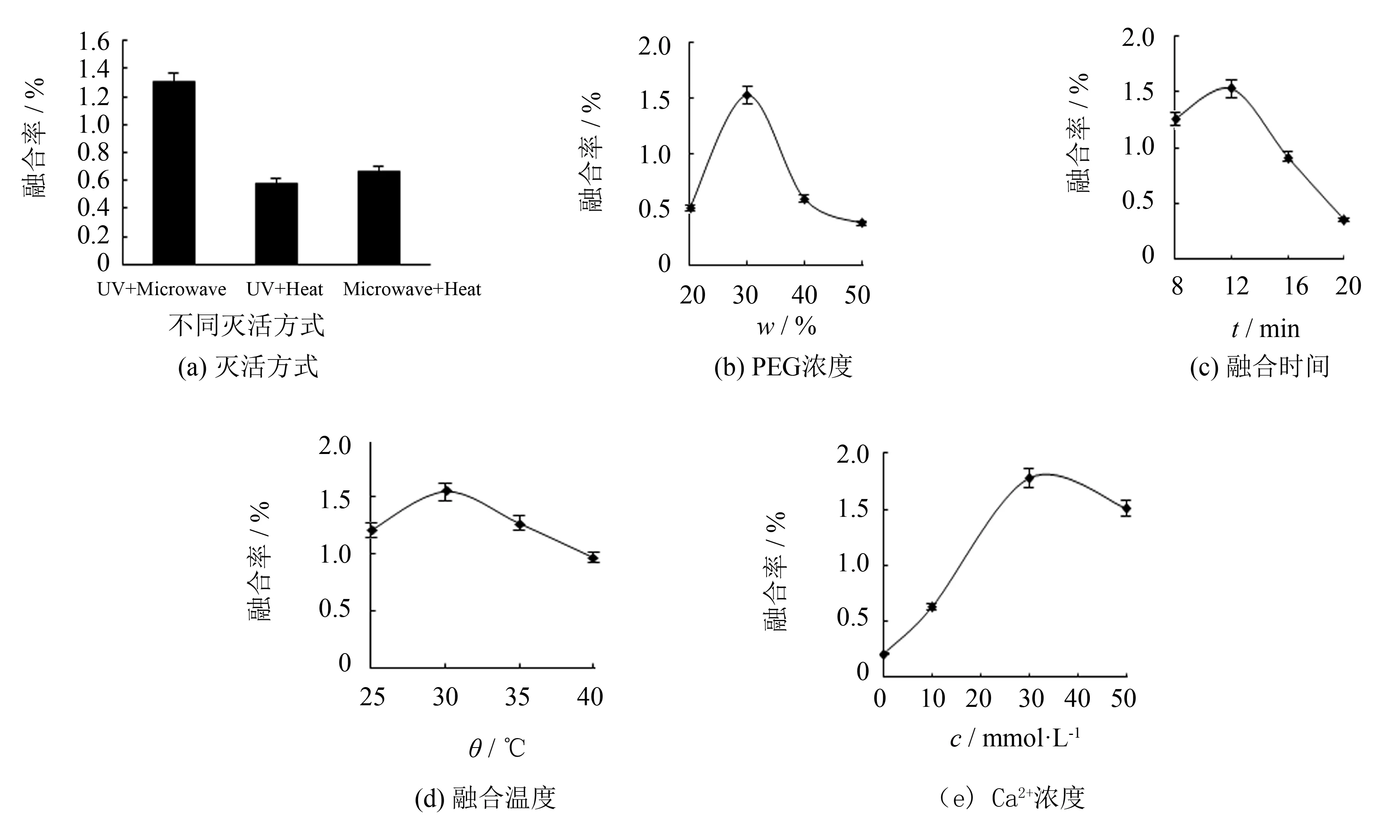
图5 原生质体融合条件研究Fig.5 Study on protoplast fusion conditions
2.5 基因组重排

图6 三轮基因组重排筛选菌株的菌落形态Fig.6 Colony morphology of screening strains of three rounds of genome shuffling
将紫外照射4 min、 微波处理160 s这2种诱变方法获得的正突变菌株4-4、 5-5、 W2、 W42、 W44作为亲本进行第一轮基因组重排. 将第一轮筛选出的高产融合子作为亲本, 进行下一轮基因组重排, 以此类推.
经过第一轮基因组重排, 筛选出5株洛伐他汀产量提高25%以上的融合子R4、 R10、 R17、 R23、 R28; 以这5株融合子作为亲本进行第二轮基因组重排, 筛选获得了5株洛伐他汀产量提高30%以上的融合子R′-4、 R′-8、 R′-14、 R′-35、 R′-51; 再以这5株融合子作亲本进行第三轮基因组重排, 最终获得了4株洛伐他汀产量提高45%以上的融合子R″-2、 R″-11、 R″-30、 R″-33. 三轮基因组重排筛选获得的高产融合子菌落形态见图6, 与出发菌株SH2-7的洛伐他汀产量比较见表2.

表2 三轮基因组重排筛选结果Tab.2 The screening results of three rounds of genome shuffling
2.6 融合子遗传稳定性研究

图7 融合子的传代稳定性实验Fig.7 The genetic stability offusants
将融合子R″-2, R″-11, R″-30, R″-33连续传承5代, 测定每一代发酵液中洛伐他汀含量, 实验结果如图7所示. 由结果可知, 除菌株R″-11有明显的退化现象外, R″-2、 R″-30、 R″-33 三株菌的产量较稳定, 其中以R″-30洛伐他汀产量最高, 基本稳定在312 mg·L-1以上.
3 结语
与传统诱变方法比较, 基因组重排采用多个拥有各自有利突变位点的亲本进行递推式融合, 更易发生多交换和多基因重组, 因此更易实现大幅度的提高率[10]. 到目前为止, 应用基因组重排技术选育高产洛伐他汀红曲菌的研究还很少. 本研究采用基因组重排技术选育高产洛伐他汀红曲菌, 获得一株产量明显提高、 遗传稳定的融合子R″-30, 产量较出发菌株SH2-7提高了52%.
[1] 张建文. 福建代表性红曲米主要特性的研究及其标准制定[D]. 福州: 福建农林大学, 2011.
[2] 郭宝禹, 郝林. 红曲霉产物的功能及研究进展[J]. 酿酒科技, 2010, 192(6): 89-91.
[3] SUN B S, ZHOU L P, JIA X Q,etal. Response surface modeling for gamm-aminobutyric acid production by Monascus pilosus GM100 under solid-state fermentation[J]. African Journal of Biotechnology, 2008, 7(24): 4 544-4 550.
[4] KLAWITTER J, SHOKATI T, MOLL V,etal. Effects of lovastatin on breast cancer cells: a proteo-metabonomic study[J]. Breast Cancer Research Bcr, 2010, 12(2): 1-20.
[5] 申乃坤, 张红岩, 王青艳, 等. Genome shuffling研究进展及其在微生物育种中的应用[J]. 酿酒科技, 2009, 185(11): 24-27.
[6] 沈萍, 陈向东. 微生物学试验[M]. 4版. 北京: 高等教育出版社, 2007.
[7] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2010.
[8] 石瑞丽, 邱树毅, 李秧针, 等. 黑曲霉利用五倍子生料固体发酵产单宁酶优化发酵条件研究[J]. 中国食品添加剂, 2009(3): 107-111.
[9] 张素敏, 王国增, 叶秀云, 等. 基因组重排技术选育纤维素酶高产菌株[J]. 中国食品学报, 2016, 16(11): 105-110.
[10] PETRI R, CLAUDIA S D. Dealing with complexity: evolutionary engineering and genome shuffling[J]. Current Opinion in Biotechnology, 2004, 15(4): 298-304.
BreedingofMonascusstrainswithhighyieldlovastatinbygenomeshuffling
LI Liang, LIN Juan, YE Xiuyun
(Fujian Key Laboratory of Marine Enzyme Engineering, Fuzhou University, Fuzhou, Fujian 350116, China)
Genome shuffling was used to breedMonascusstrains with high yield lovastatin. The results showed that the optimum conditions ofMonascusprotoplast preparation were as follows: lywallzyme concentration 1.0%, mycelium age 66 h, enzymolysis time 3 h and temperature 30 ℃, hypertonic phosphate buffer pH6.0, regeneration medium containing 0.6 mol·L-1NaCl. The protoplast inactivation conditions: UV treating 120 s and microwave radiating 300 s. The protoplast fusion rate could reach 1.95% after fusing in 30% PEG containing 0.03 mol·L-1Ca2+for 12 min at 30 ℃. A genetic stable fusant R″-30 was obtained after three rounds of genome shuffling, of which lovastatin yield was 52% higher than that of original strain SH2-7.
Monascus; lovastatin; breeding; genome shuffling
10.7631/issn.1000-2243.2017.05.0754
1000-2243(2017)05-0754-07
Q939.9
A
2016-05-03
林娟(1970-), 女, 博士, 教授, 主要从事应用微生物学和分子酶学等方面的研究, ljuan@fzu.edu.cn
福建省高校产学合作资助项目(2013N5005)
(责任编辑: 蒋培玉)

