炎症在动脉性肺动脉高压病理生理过程中的作用
,,,3*
(1.中南大学湘雅药学院药理学系,长沙 410078;2.南昌大学第二附属医院药学部;3.心血管研究湖南省重点实验室)
·讲座与综述·
炎症在动脉性肺动脉高压病理生理过程中的作用
葛晓月1,张卫芳2,胡长平1,3*
(1.中南大学湘雅药学院药理学系,长沙 410078;2.南昌大学第二附属医院药学部;3.心血管研究湖南省重点实验室)
炎症在肺动脉高压肺血管重构中发挥重要作用,如引起内皮细胞功能障碍、中膜平滑肌细胞增殖及外膜成纤维细胞肌化,亦可促进损伤血管处原位血栓的形成及丛状病变。损伤的血管细胞及活化的血小板可进一步产生炎症因子,正反馈促进血管炎症反应。基于炎症靶点的抗炎治疗将有望成为治疗肺动脉高压的新手段。
肺动脉高压; 炎症; 炎症细胞; 促炎因子; 抗炎因子; 抗炎治疗
肺动脉高压(pulmonary hypertension,PH)是临床上常见的一种疾病,其发病机制复杂,至今在临床上还没有彻底的治愈方法。2013年第五届世界PH会议将肺动脉高压分为动脉性肺动脉高压(pulmonary arterial hypertension,PAH)、左心疾病相关性PH、肺疾病或缺氧相关性PH、肺动脉血栓栓塞性PH、不明原因或多种机制所致PH五大类。PH主要发病机制包括:血栓形成、过度血管收缩、炎症以及内膜、中膜、外膜的细胞增殖与凋亡失衡。炎症参与心血管疾病时内皮损伤及动脉硬化,也与PH的发生发展密切相关[1]。在PH病理生理过程的早期,炎症细胞可粘附在内皮细胞上,分泌一些炎症因子,导致内皮损伤;中晚期,炎症细胞分泌生长因子、趋化因子等可促进平滑肌细胞的迁移、增殖和纤维细胞的肌化。炎症细胞通过与血管细胞相互作用,共同促进PH的发生发展。本文主要论述炎症在第一类肺高压即PAH发生发展中的作用。
1 动脉性肺动脉高压中的炎症证据
PAH的发生与多种因素有关,如全身炎症反应、门脉高压、骨形成蛋白Ⅱ型受体(bone morphogenetic protein receptor Ⅱ,BMPR Ⅱ)基因突变、服用食欲抑制药、人类免疫缺陷病毒感染、自身免疫性疾病等。炎症参与PAH发生发展的证据可追溯到1994年,Tuder等人发现在PAH患者的肺动脉丛状病变损伤血管周围有巨噬细胞、T细胞、B细胞等炎症细胞浸润[1],并且多项研究发现特发性PAH患者血液中炎症标志物水平显著升高,包括C反应蛋白(C-reactive protein,CRP)、白细胞介素(interleukin,IL;如IL-1、IL-6、IL-8、IL-10)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素γ(interferon,INF)、高迁移率蛋白B1(high mobility group box chromosomal protein 1,HMGB1)及血小板源生长因子(platelet-derived growth factor,PDGF-A)等[2]。以上研究提示,炎症参与了PAH的发生发展(图1)。
PAH肺血管内膜层炎症因子作用于内皮细胞,使内皮细胞功能紊乱;中膜平滑肌细胞层T细胞、B细胞等炎症细胞浸润,释放炎症因子,导致平滑肌细胞增殖;外膜纤维细胞层亦有免疫细胞粘附,使其肌化。
2 动脉性肺动脉高压中的炎症细胞
炎症细胞对组成肺动脉的各种血管细胞均有影响。炎症细胞可粘附在肺动脉内皮上引起内皮细胞功能紊乱,其分泌的细胞生长因子可促进平滑肌细胞和成纤维细胞增殖。炎症细胞还可分泌众多炎症因子,正反馈促进炎症的进一步发生发展。
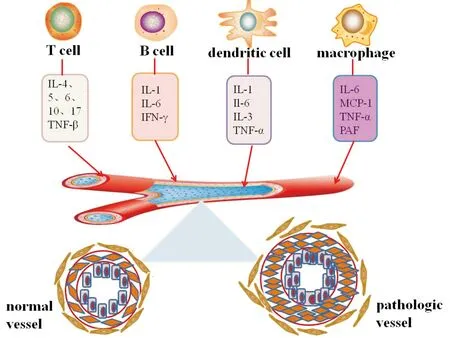
图1 PAH肺血管炎症改变
2.1 T细胞在动脉性肺动脉高压中的作用T细胞包括辅助T细胞(Th)、细胞毒T细胞(Tc)及调节性T细胞(Treg),而Th细胞可进一步分为Th1、Th2和Th17。其中,Th17细胞可通过促进IL-17、IL-21和IL-22释放发挥促炎作用,而Treg细胞可通过调节效应T细胞的功能维持免疫稳态,抑制炎症反应。生理条件时Th17和Treg处于动态平衡,Th细胞可刺激B细胞分化及巨噬细胞活化;Tc细胞可结合组织相容蛋白-1,清除被感染的细胞。Treg细胞主要调节Th17和Th2的平衡,保持自身的耐受性和自身免疫反应。PAH时Th17和Treg平衡被打破,表现为促炎作用的Th17细胞增多而发挥抗炎保护作用的Treg细胞活化减少、功能降低[3]。有研究发现,在特发性PAH患者及低氧诱导的PH小鼠肺动脉中T细胞浸润增加,CD4+T细胞分化为Th17细胞增多[4]。在特发性/遗传性/组织相关性PAH患者中,Treg细胞活化降低、功能失调[4]。敲除Th细胞可缓解野百合碱诱导的大鼠PH进程[3]。在低氧诱导的PH小鼠模型中,给予Treg细胞治疗后能显著降低PH小鼠右心室收缩压,减少促炎因子的表达,增强抗炎因子如IL-10的表达,并且可以通过调节细胞增殖周期抑制肺动脉平滑肌细胞增殖[5]。这些均表明T细胞在PAH炎症病理生理过程中起重要作用。
2.2 B细胞在动脉性肺动脉高压中的作用在体液免疫过程中,抗原可激活B淋巴细胞分化为具有合成与分泌抗体功能的浆细胞。在细胞免疫过程中,B淋巴细胞具有提呈抗原、分泌各种细胞因子、诱导T淋巴细胞分化及辅助树突状细胞等功能。已有研究发现,在特发性PAH患者外周血及肺血管周围均存在活化的B淋巴细胞[4]。鉴于PAH患者血液中B淋巴细胞被激活,有研究发现在人类疱疹病毒8引起的伴有淋巴结增生的PAH患者使用抗CD20抗体利妥昔单抗即可去除B淋巴细胞逆转PAH[6]。活化的B细胞可分泌多种自身抗体,如抗核抗体、抗内皮细胞抗体及抗成纤维细胞抗体等。自身抗体沉积到肺动脉内膜,诱导黏附分子表达及内皮细胞凋亡,进而诱导产生凋亡抵抗表型的内皮细胞过度增殖,形成丛状病变和肺血管闭塞,最终使PAH病情恶化。
2.3树突状细胞在动脉性肺动脉高压中的作用树突状细胞(dendritic cells,DCs)是目前已知功能最强大的专职抗原提呈细胞,也是目前发现唯一能激活初始型T淋巴细胞使其增殖并使其发挥效应T细胞作用的一种细胞类型。在特发性PAH患者损伤的肺血管中存在大量树突状细胞特异性细胞间黏附分子(dendritic cell-specific intercellular adhesion molecule-grabbing nonintegrin,DC-SIGN)阳性细胞浸润。在野百合碱诱导的PAH大鼠肺动脉中OX-62阳性DCs数显著增加,DC-SIGN阳性细胞可与T细胞表面的黏附分子结合,进而参与T细胞的活化[7]。特发性/遗传性PAH患者单核细胞来源的DCs可增强T细胞的迁移,促进T细胞增殖,且可增加CD4+T细胞向Th17分化[4]。而DCs作为机体免疫反应的始动者,其与T细胞之间的相互作用在人体免疫反应、炎症及自身免疫性疾病中起着关键作用。也有学者发现DCs可分化为内皮样细胞从而促进肿瘤血管新生,从另一个侧面提示DCs在PAH血管失稳态中可能扮演着重要角色。
2.4单核细胞/巨噬细胞在动脉性肺动脉高压中的作用巨噬细胞广泛存在于人体的各种组织,可分化成不同亚型,在不同生理和病理状态下发挥不同的作用。巨噬细胞根据不同的炎症状态被分为经典激活巨噬细胞(M1)、替代激活巨噬细胞(M2)、调节巨噬细胞。M1由干扰素-γ和TNF-α激活,发挥杀灭微生物和抵抗肿瘤的作用。M2由IL-4和IL-13激活,可特异性表达精氨酸酶-1、炎症区域分子-1、几丁质酶-3、甘露糖受体及C-型血凝素。在血管损伤之初,单核细胞在损伤部位聚集分化为巨噬细胞,而在已损伤的血管部位原有巨噬细胞的自身增殖是巨噬细胞数量增加的主要途径。在心肌梗死、动脉粥样硬化、高胆固醇血症等慢性炎症疾病过程中,巨噬细胞处于促炎状态,当炎症消退时,巨噬细胞转向于促进损伤修复的状态。PAH肺血管重构也是一种慢性炎症过程。最近研究表明,在低氧诱导的PH小鼠模型中,M2型巨噬细胞可促进肺动脉平滑肌细胞增殖,参与肺血管重构[8]。
3 炎症细胞因子在动脉性肺动脉高压中的作用
3.1白介素-1/白介素-6 动物和临床研究表明,IL-1/ IL-6在PAH发生发展过程中起重要作用。肺中IL-1受体通路的改变与PAH的发生密切相关,阻滞IL-1信号后可延缓PAH的发生发展[9]。在PAH患者血清及肺中IL-6水平增加,促进平均肺动脉压升高和终末肺小动脉的肌化、增生[10]。IL-6可通过上调血管内皮生长因子(vascular endothelial growth factor,VEGF)以及下调BMPR Ⅱ和转化生长因子受体的表达,促进肺动脉平滑肌细胞增殖。此外,IL-6还可诱导内皮细胞分泌趋化蛋白CX3CLl/fractalkine,促进炎症细胞聚集。
3.2白介素-10 IL-10是由Th2淋巴细胞产生的一种多功能的抗炎因子。利用腺病毒转染IL-10后可减少多种促炎因子如转化生长因子-β(transforming growth factor-β,TGF-β)、IL-6和IL-8的表达,增加肺中具有抑制血管重构功能的血红素氧合酶-1的水平,减少巨噬细胞的浸润和肺动脉平滑肌细胞增殖,进而抑制野百合碱诱导的大鼠PAH发生发展[11]。
3.3单核细胞趋化蛋白-1 MCP-1作为单核细胞和淋巴细胞的强力趋化激活因子,在PAH炎症过程中发挥重要作用。研究表明,在胶原血管疾病相关PAH患者血浆及特发性PAH初期患者的血浆及肺组织中MCP-1水平显著升高[12]。拮抗MCP-1后,可以减轻野百合碱诱导的小鼠PAH肺血管重构[12]。在损伤血管处,MCP-1可招募炎症细胞,活化单核细胞及巨噬细胞,使其释放大量炎症因子。MCP-1亦可促进TGF-β和基质金属蛋白酶(matrix metalloproteinase,MMP)的表达,参与肺血管重构。
3.4肿瘤坏死因子TNF-α在肺循环中发挥强大的炎症调节作用。研究发现,在特发性PAH患者及严重肺高压小鼠模型血浆中TNF-α水平增加[13]。给予TNF-α抗体可显著改善野百合碱诱导大鼠PAH时血流动力学状况及肺血管重构。研究表明。TNF-α抗体可以降低嗜中性粒细胞及内皮细胞中黏附分子的表达,进而减少嗜中性粒细胞在血管中聚集,降低嗜中性粒细胞对血管及肺组织的损坏[14]。另有研究发现,TNF-α可诱导肺动脉平滑肌细胞生成前列环素,激活血小板活化因子进而诱导的血管收缩反应[14],还可通过抑制肺动脉平滑肌细胞中BMPR2表达,参与PAH的进程[15]。
3.5干扰素INF是由病毒和其他种类的干扰素诱导剂刺激网状内皮系统、巨噬细胞、淋巴细胞以及体细胞所产生的一种糖蛋白。INF可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用。系统性硬皮病相关PAH患者血清中INF水平升高,INF-α和INF-β可以诱导内皮素-1(endothelin-1,ET-1)的表达;INF-γ可上调IFN诱导蛋白(interferon-inducible protein,IP-10)基因的表达[16]。ET-1可与主要分布在平滑肌细胞上的ET-A受体结合,导致平滑肌收缩;也可与主要分布在内皮细胞上的ET-B受体结合,介导PGI2和NO的分泌;ET-1还有强大的促有丝分裂功能,可促进平滑肌细胞和内皮细胞的增殖。IP-10可招募T细胞、巨噬细胞、自然杀伤细胞,从而引起血管损伤部位的炎症浸润[16]。硬皮病或HIV患者接受INF治疗后,患PAH的几率大大增加,而当患者停止INF治疗后,患者血液动力学指标明显改善[17]。
3.6 C-反应蛋白CRP属于穿透素家族,是由5个亚基组合形成的一个圆盘状或者环状复合物,也是系统炎症标志蛋白。在慢性心衰、心血管疾病及慢性阻塞性肺疾病中,高敏感CRP(high sensitive CRP,hsCRP)水平升高。在多种类型的PAH患者中亦发现血清hsCRP水平升高,其可通过促进平滑肌细胞增殖,增加ET-1的分泌,减少NO的产生而加剧肺血管收缩和重构;CRP也可直接导致血管平滑肌细胞和内皮细胞产生炎症反应,释放IL-6、MCP-1等[18]。这些结果提示,CRP在PAH病理生理过程中起重要作用,阻断CRP通路有可能成为治疗PAH的新靶点。
3.7高迁移率蛋白B1 HMGB是一族含量丰富的非组蛋白核蛋白,在细胞内主要与DNA结合。HMGB 有三个成员,即HMGB1、HMGB2和HMGB3,三者在氨基酸序列上有80%的 同源性。HMGB1一旦被释放到细胞外,可与膜上的Toll样受体4(toll-like receptor 4,TLR4)、TLR9、糖基化终产物受体(receptor for advanced glycation end products,RAGE)结合,活化NF-κB引起促炎因子的释放,进而引起内皮细胞损伤,炎症细胞数目增加。在特发性PAH患者肺动脉中,同心血管损伤及丛状血管损伤部位观察到有核外HMGB1,而在正常人体内HMGB1严格分布在核内,且在患者血清中的浓度是正常对照组的6倍[19]。在野百合碱诱导的PAH大鼠和低氧诱导的PH小鼠模型的支气管肺泡灌流液及血浆中,HMGB1水平升高。给予HMGB1的抗体之后可减缓肺部炎症、肺血管壁增厚、右心室收缩压的升高,进而提高野百合碱诱导的PAH大鼠的生存率[20]。
4 动脉性肺动脉高压的抗炎治疗
现在治疗PAH的药物主要有内皮素受体拮抗药、一氧化氮、磷酸二酯酶-5抑制药、前列环素、血管紧张素转化酶抑制药等血管扩张药,用于减轻肺血管阻力,缓解PAH。随着PAH炎症学说的提出,一些抗炎药物相继应用于PAH的临床治疗,如糖皮质激素类药物、炎症因子抑制药、环磷酰胺、环孢霉素等(图2)。
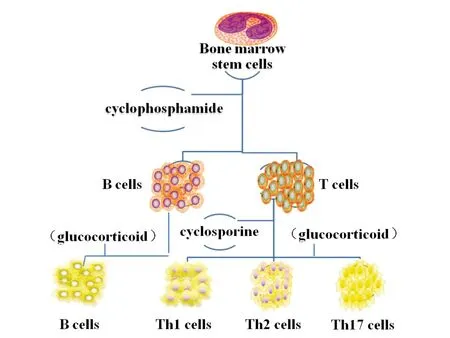
图2 临床上常用抗炎及免疫抑制药
环磷酰胺可直接抑制骨髓干细胞分化为B细胞和T细胞;环孢霉素可选择性抑制T细胞的分化及活化,减少Th1、Th2、Th17的数目;糖皮质激素类药物可抑制B细胞和T细胞分化及活化。
4.1糖皮质激素类药物糖皮质激素类药物作为一类目前作用最强的抗炎药物,对PAH具有一定的缓解作用。新近研究发现,在野百合碱诱导的炎症相关PAH小鼠肺组织中,血清糖皮质激素诱导型蛋白激酶-1(serum-glucocorticoid regulated kinase 1,SGK-1)水平显著上调,而敲除SGK-1或者给予SGK-1的抑制剂均可阻止野百合碱诱导的PAH发生发展[21]。Sanches等人发现糖皮质激素可明显改善系统性红斑狼疮合并PAH患者的血流动力学指标,其机制可能与抑制肺动脉平滑肌细胞增殖有关。
4.2炎症因子抑制药在多种类型的PAH中,存在TNF-α、IL-1、IL-6、和MCP-1等主要炎症因子及TGF-β、VEGF、PDGF等信号通路的改变。多项研究表明,给予炎症因子抑制药可缓解PAH。如TNF-α抗体可预防和逆转野百合碱诱导的PAH,减轻CD8+T细胞介导的氧化应激损伤[22]。在野百合碱诱导的PAH大鼠模型及低氧诱导的PH小鼠模型中,给予PDGF受体拮抗药STl571-甲磺酸伊马替尼后,肺动脉平滑肌细胞增殖减少,右心室收缩压降低,右心肥厚减轻[23]。另有临床研究发现,使用PDGF受体活性抑制药伊马替尼可使PAH患者血氧饱和度增加,肺血管压力降低,心排血量增加[24]。在成人斯蒂尔病合并PAH患者,给予IL-6拮抗药Tocilizumab后,患者血液动力学指标得到改善[25]。
4.3环磷酰胺环磷酰胺是一种常用的烷化剂,可通过多种途径发挥抗炎作用:①通过与DNA发生交叉联结或使DNA烷化,进而抑制蛋白质合成,杀伤增殖期和/或某些静止期淋巴细胞,最终导致循环中淋巴细胞数目减少;②可对骨髓细胞和成熟淋巴细胞产生直接的细胞毒性,使T细胞和B细胞数目减少;③可降低NK细胞活性,从而抑制炎症反应。临床上,环磷酰胺与类固醇糖皮质激素共同使用可用于治疗组织性疾病(如系统性红斑狼疮、系统性硬皮病等)相关PAH[26]。而对于系统性红斑狼疮相关PAH患者,使用环磷酰胺和血管舒张药后可明显降低肺动脉收缩压和肺动脉平均压,延缓PAH的发生发展[27]。
4.4环孢霉素环孢霉素常与糖皮质激素类药物共同用于治疗免疫性疾病。环孢霉素可通过干扰T细胞的产生及Th细胞的分化和功能发挥免疫抑制作用。环孢霉素可抑制磷酸酶途径,而磷酸酶是活化T细胞核因子(nuclear factor for activated T cells,NFAT)活化的重要分子。研究表明,系统性红斑狼疮相关PAH患者服用环孢霉素及霉酚酸酯后血液动力学指标明显改善[28]。
5 结论与展望
PAH是进行性的肺血管重构性疾病,由于肺动脉压力持续性增高,可诱发右心室衰竭,最终导致患者死亡。目前为止,PAH患者平均存活时间仅为3.6年。因此,深入探讨PAH的发病机制,寻找新的治疗靶点,对于防治PAH具有重要意义。以往针对PAH的治疗主要集中在舒张肺动脉血管方面如磷酸二脂酶抑制药、前列环素、内皮素受体拮抗药的应用,而随着研究的不断深入,炎症在PAH病理生理过程中的作用越来越突出。炎症既可作为PAH诱因介导其发生(如病毒感染及自身免疫性疾病可诱导PAH的发生),同时PAH本身亦可诱发炎症反应,进一步加重PAH的进程。近些年一些抗炎药物也相继应用于PAH的临床治疗,取得了一定的疗效。但由于炎症在PAH发生发展中的机制尚未阐明,需要更深入的研究来阐明炎症在PAH发生发展中的重要作用,,进而研发更加有效的药物,从而提高PAH的临床疗效。
[1] Price LC,Wort SJ,Perros F,et al.Inflammation in pulmonary arterial hypertension[J].Chest,2012,141(1):210-221.
[2] Pezzuto B,Badagliacca R,Poscia R,et al.Circulating biomarkers in pulmonary arterial hypertension:update and future direction[J].J Heart Lung Transplant,2015,34(3):282-305.
[3] Maston LD,Jones DT,Giermakowska W,et al.Central role of T helper 17 cells in chronic hypoxia-induced pulmonary hypertension[J].Am J Physiol Lung Cell Mol Physiol,2017,312(5):L609-L624
[4] Huertas A,Phan C,Bordenave J,et al.Regulatory T cell dysfunction in idiopathic,heritable and connective tissue-associated pulmonary arterial hypertension [J].Chest,2016,149(6):1482-1493.
[5] Chu Y,Xiangli X,Xiao W.Regulatory T cells protect against hypoxia-induced pulmonary arterial hypertension in mice[J].Mol Med Rep,2015,11(4):3181-3187.
[6] Voelkel NF,Tamosiuniene R,Nicolls MR,et al.Challenges and opportunities in treating inflammation associated with pulmonary hypertension[J].Expert Rev Cardiovasc Ther,2016,14(8):939-951.
[7] Perros F,Dorfmüller P,Souza R,et al.Dendritic cell recruitment in lesions of human and experimental pulmonary hypertension[J].Eur Respir J,2007,29 (3):462-468.
[8] Vergadi E,Chang MS,Lee C,et al.Early macrophage recruitment and alternative activation are critical for the later development of hypoxia-induced pulmoary hypertension[J].Circulation,2011,123(18):1986-1995.
[9] Lawrie A,Hameed AG,Chamberlain J,et al.Paigen diet-fed apolipoprotein E knockout mice develop severe pulmonary hypertension in an interleukin-1-dependent manner[J].Am J Pathol,2011,179(4):1693-1705.
[10] Fang M,Huang Y,Zhang Y,et al.Interleukin-6 -572C/G polymorphism is associated with serum interleukin-6 levels and risk of idiopathic pulmonary arterial hypertension[J].J Am Soc Hypertens,2017,11(3):171-177.
[11] Ito T,Okada T,Miyashita H,et al.Interleukin-10 expression mediated by an adeno-associated virus vector prevents monocrotaline-induced pulmonary arterial hypertension in rats[J].Circ Res,2007,101(7):734-741.
[12] Itoh T,Nagaye N,Ishibashi-Ueda H,et al.Increased plasma monocyte chemoattractant protein-1 level in idiopathic pulmonary arterial hypertension[J].Respirology,2006,11(2):158-163.
[13] Soon E,Holmes AM,Treacy CM,et al.Elevated levels of inflammatory cytokines predict survival in idiopathic and familial pulmonary arterial hypertension[J].Circulation,2010,122(9):920-927.
[14] Yang Y,Mingxin G,Li H,et al.Pulmonary artery perfusion with anti-tumor necrosis factor alpha antibody reduces cardiopulmonary bypass-induced inflammatory lung injury in a rabbit model[J].PLoS One,2013,8(12):e83236.
[15] Hurst LA,Dunmore BJ,Long L,et al.TNFα drives pulmonary arterial hypertension by suppressing the BMP type-II receptor and altering NOTCH signaling[J].Nat Commun,2017,8:14079.
[16] George PM,Oliver E,Dorfmuller P,et al.Evidence for the involvement of type I interferon in pulmonary arterial hypertension[J].Circ Res,2014,114(4):677-688.
[17] Savale L,Sattler C,Sitbon O,et al.Pulmonary arterial hypertension in patients treated with interferon[J].Eur Respir J,2014,44(6):1627-1634.
[18] Varga J,Palinkas A,Lajko I,et al.Pulmonary arterial pressure response during exercise in COPD:a correlation with C-reactive protein (hsCRP)[J].Open Respir Med J,2016,10:1-11.
[19] Eileen M Bauer,Shapiro R,Zheng H,et al.High mobility group box 1 contributes to the pathogenesis of experimental pulmonary hypertension via activation of toll-like receptor 4[J].Mol Med,2012,18:1509-1518.
[20] Sadamura-Takenaka Y,Ito T,Noma S,et al.HMGB1 promotes the development of pulmonary arterial hypertension in rats[J].PLOS ONE,2014,9(7):e102482.
[21] Xi X,Liu S,Liu S,et al.Serum-glucocorticoid regulated kinase 1 regulates macrophage recruitment and activation contributing to monocrotaline induced pulmonary arterial hypertension[J].Cardiovasc Toxicol,2014,14(4):368-378.
[22] Sutendra G,Dromparis P,Bonnet S,et a1.Pyruvate dehydrogenase inhibition by the inflammatory cytokine TNFα contributes to the pathogenesis of pulmonary arterial hypertension[J].J Mol Med(Berl),2011,89(8):771-783.
[23] Schermuly RT,Dony E,Ghofrani HA,et al.Reversal of experimental pulmonary hypertension by PDGF inhibition[J].J Clin Invest,2005,115(10):2811-2821.
[24] Ghofrani HA,Morrell NW,Hoeper MM,et al.Imatinib in pulmonary arterial hypertension patients with inadequate response to established therapy[J].Am J Respir Crit Care Med,2010,182(9):1171-1177.
[25] Kadavath S,Zapantis E,Zolty R,et al.A novel therapeutic approach in pulmonary arterial hypertension as a complication of adult-onset Still's disease:targeting IL-6[J].Int J Rheum Dis,2014,17(3):336-340.
[26] Miyamichi-Yamamoto S,Fukumoto Y,Sugimura K,et al.Intensive immunosuppressive therapy improves pulmonary hemodynamics and long-term prognosis in patients with pulmonary arterial hypertension associated with connective tissue disease[J].Circ J,2011,75(11):2668-2674.
[27] Kommireddy S,Bhyravavajhala S,Kurimeti K,et al.Pulmonary arterial hypertension in systemic lupus erythematosus may benefit by addition of immunosuppression to vasodilator therapy:an observational study[J].Rheumatology (Oxford),2015,54(9):1673-1679.
[28] Prete M,Fatone MC,Vacca A,et al.Severe pulmonary hypertension as the initial manifestation of systemic lupus erythematosus:a case report and review of the literature[J].Clin Exp Rheumatol,2014,32(2):267-274.
10.15972/j.cnki.43-1509/r.2017.04.001
2017-02-30;
2017-04-17
国家自然科学基金(91439105,81473209,81273512,81460010);江西省科技厅青年科学基金(20142BAB215035);江西省博士后科研择优资助项目(2016KY51).
*通讯作者,E-mail:huchangping@csu.edu.cn.
R96
A
秦旭平)

