骨桥蛋白与帕金森病非运动症状的相关性研究
杨新新 胡珍珠 王钰乔 张尊胜
骨桥蛋白与帕金森病非运动症状的相关性研究
杨新新 胡珍珠 王钰乔 张尊胜
目的探讨骨桥蛋白(OPN)在帕金森病(PD)诊断中的临床价值以及与PD患者非运动症状之间的相关性。方法收集患者的一般资料,并应用日常活动能力量表、统一帕金森病评定量表第二部分评分(UPDRSII)、PD非运动症状量表(NMSS)、汉密尔顿焦虑量表(HAMA)、疲劳量表-14(FS-14)、匹兹堡睡眠质量指数(PSQI)、简易精神状态检查量表(MMSE)、爱泼沃斯思睡量表(ESS)、汉密尔顿抑郁量表(HAMD)、39项帕金森病调查表(PDQ-39)对PD患者的非运动症状进行评估;用酶联免疫吸附测试法检测100例原发性PD患者血清中OPN的表达水平,Spearman秩相关分析比较OPN表达水平与PD患者病程及非运动症状的相关性;受试者工作特征曲线(ROC)评价OPN诊断PD的敏感性和特异性。结果(1)与对照组比较,PD组患者血清中OPN水平[(21.5±6.18)ug/L]明显高于健康对照组[(17.80±6.18)μg/L](t=7.41,P<0.01);(2)PD患者血清OPN表达水平与MMSE、日常活动能力评分呈负相关(r=-0.5658,-0.7111,P均<0.05),与UPDRSII、PDQ-39、ESS、NMSS、HAMD、PSQI、HAMA评分均呈正相关(r=0.394 7~0.709 4,P均<0.01),但OPN与PD患者的FS-14评分无明显相关性(r=0.1603,P=0.1111)。此外,PD患者的血清OPN水平与病程呈正相关(r=0.59,P<0.01);(3)ROC曲线显示曲线下面积为0.775(95%CI:0.7106~0.8394),OPN诊断帕金森病的灵敏度为78%、特异度为66%。结论OPN可以作为诊断PD的参考指标,其水平与PD患者的非运动症状有关。
帕金森病 骨桥蛋白 非运动症状 炎症 诊断
帕金森病(Parkinson's disease,PD)也称震颤麻痹,是中老年人群中常见的中枢神经系统退行性变性疾病,随着人口老龄化,我国PD患者数量有增加趋势,给患者家庭及社会带来沉重负担[1]。PD患者的特征性临床表现为静止性震颤、肌强直、运动迟缓和姿势步态异常等运动症状[2]。然而,近些年的研究发现PD患者尚可有植物神经功能紊乱、疼痛、焦虑、抑郁、疲劳、睡眠障碍、痴呆等非运动症状[3-5]。既往的研究显示PD临床诊断的准确率为65%~93%。Charles等学者的研究表明,在未治疗或治疗反应不明确的患者中临床诊断PD的准确率只有26%[6]。因此,需要早期诊断PD,从而采取治疗措施。PD非运动症状可以出现在PD的早期出现,因此探讨PD非运动症状的相关标记物可能有助于PD的早期诊断。骨桥蛋白(OPN)是一种炎性蛋白质,在中枢神经系统免疫炎症反应中发挥重要作用,而炎症在PD的发生中具有重要作用。基于此,本研究通过对100例PD患者和健康对照组血清OPN水平的测定,分析OPN与PD非运动症状的相关性,并通过ROC曲线来分析OPN对PD的预测价值,从而评价OPN诊断PD的临床价值。
1 对象与方法
1.1 病例选择
(1)PD诊断符合英国PD脑库诊断标准,并排除PD综合征和PD叠加综合征。(2)排除骨关节病、心脑血管疾病、内分泌疾病、自身免疫性疾病(系统性红斑狼疮、干燥综合征等)、风湿免疫性疾病、阿尔兹海默病、肿瘤以及有酒精药物滥用史的患者,以防止其他疾病对OPN表达水平的干扰。
1.2 研究对象
(1)PD组:研究对象为2013年12月~2015年2月在徐州医科大学附属医院住院治疗且诊断明确的100例PD患者,其中男58例,女42例,年龄45~90岁,平均年龄(67.6±8.7)岁;病程0.08~15年,平均病程(3.94±3.56)年;多巴丝肼(美多芭)等效口服剂量375~1125 mg/d,平均口服剂量(348.2±232.4)mg/d;(2)正常对照组:选择同期在本院进行体格检查的健康志愿者100例,其中男56例,女44例;年龄46~89岁,平均年龄(65.1±5.3)岁。
1.3 方法
1.3.1 神经心理学测验 利用以下量表对PD患者的非运动症状进行评估,包括日常活动能力量表、统一帕金森病评定量表第二部分评分(UPDRSII)、PD非运动症状量表(NMSS)、汉密尔顿焦虑量表(HAMA)、疲劳量表-14(FS-14)、匹兹堡睡眠质量指数(PSQI)、简易精神状态检查量表(MMSE)、爱泼沃斯思睡量表(ESS)、汉密尔顿抑郁量表(HAMD)、39项帕金森病调查表(PDQ-39)。
1.3.2 实验室检测 所有受试者均于清晨空腹采集肘静脉血3 mL,置负压采血管中,4 ℃下离心、转速3000 r/min,离心10 min,留取血清,置-80 ℃冰箱保存备用。采用酶联免疫吸附试验(ELISA)测定OPN的水平,检测试剂盒购白上海西唐生物科技有限公司,操作步骤严格按照试剂盒说明书进行。

2 结 果
2.1 PD组与对照组的一般资料比较
本研究共纳入了100例PD患者,平均病程为(3.94±3.56)年,UPDRSII评分为(15.77±8.57)分,平均NMSS评分为(53.91±26.85)分,平均HAMA评分为(19.91±8.58)分,平均HAMD评分为(15.63±8.74)分,平均FS-14评分为(9.14±3.69)分,平均PSQI评分为(10.41±4.96)分,平均MMSE评分为(21.99±6.59)分,平均ESS评分为(8.13±5.77)分,平均PDQ39评分为(58.70±28.74)分,平均日常活动能力评分为(70±22)%。PD组与对照组比较,性别(χ2=2.861,P=0.321)、年龄(t=0.259,P=0.802)无统计学差异。
2.2 血清骨桥蛋白的表达水平
健康对照组血清OPN水平为(17.80±6.18)μg/L,而PD组的血清OPN水平为(21.5±6.18)μg/L,PD组血清OPN水平较健康对照组升高(t=7.41,P<0.01)。
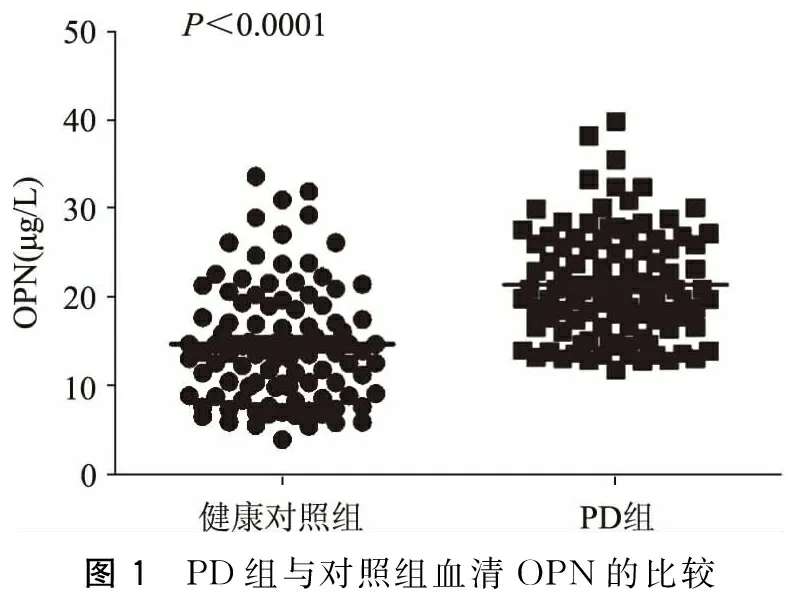
图1 PD组与对照组血清OPN的比较
2.3 血清OPN表达水平变化与PD患者非运动症状的相关性分析
PD患者血清OPN表达水平与MMSE(r=-0.5658,P<0.05)、日常活动能力评分(r=-0.7111,P<0.05)呈负相关,与UPDRSII、PDQ-39、ESS、NMSS、HAMD、PSQI、HAMA评分呈正相关(r=0.3947~0.7094,P均<0.01),但OPN与PD患者的FS-14评分无明显相关性(r=0.1603,P=0.1111)。
2.4 PD组OPN表达水平和病程的相关性分析
随着PD患者发病时间的延长,OPN表达水平也在逐渐升高;OPN表达水平和PD的病程呈正相关(r=0.59,P<0.01)。
2.5 OPN诊断帕金森病的敏感性与特异性
为了检验OPN对PD的诊断价值,将血清OPN作为预测因子,绘制ROC曲线显示曲线下面积为0.775(95%CI:0.7106~0.8394),其诊断灵敏度和特异度分别为78%和66%。

图2 OPN诊断PD的敏感性与特异性
3 讨 论
PD的发病机制涉及环境因素、基因、线粒体功能障碍、氧化应激、细胞凋亡和炎症等方面。近年的研究显示,炎症和免疫反应在PD患者多巴胺能神经元的凋亡中起重要作用[7]。虽然目前没有足够的证据证明炎症是多巴胺能神经元变性的最初触发因素,但是临床和流行病学数据表明在无症状的PD患者中慢性炎症有可能是一个缓慢而稳定的致病因素[8],在PD相关的神经退化中发挥关键性作用。
1979年Senger等首次报道与恶性转化有关的一种包含RGD(精氨酸-谷氨酸-天冬氨酸)整合素结合区的磷酸化糖蛋白与肿瘤的关系,称之为转化相关性磷酸蛋白。后来Franzen等从骨基质和牙齿中分离出一种磷酸蛋白,特性与转化相关性磷酸蛋白相似,人们将其命名为骨桥蛋白。在神经退行性疾病中OPN在脑部特别是大脑黑质中的出现被认为与控制胶质细胞介导的神经炎症相关,从而在PD病程中可能扮演一个重要的角色[9]。研究证实其参与了氧化应激和细胞凋亡、线粒体损伤、细胞因子调控和趋化性等。OPN与PD的多巴胺能神经元丢失相关[10]。给鼠腹腔内注入脂多糖后大脑黑质部位多巴胺能神经元数目显著减少,并且伴有小胶质细胞/巨噬细胞的活化以及黑质内OPN表达水平呈时间依赖性增加,这些表明OPN与PD可能存在密切关系。Maetzler等研究发现PD患者血清中OPN水平升高[11],且与H-Y分期呈正相关。但是由于入组样本量仅30例,且该试验仅对患者进行H-Y分期和痴呆量表评分,其与PD患者其他非运动症状的关系尚不明确。本实验纳入100例PD患者,测量了其外周血中骨桥蛋白的表达水平,为了分析血液中骨桥蛋白表达水平与PD非运动症状的相关性,本研究对入组的PD患者均进行了多个非运动症状量表进行问卷调查。本研究结果显示PD组患者血清OPN表达水平明显高于健康对照组,且差异有统计学意义,提示OPN可以作为PD诊断的一个生物学指标。此外,本研究发现OPN与多个非运动症状相关,相关性从高到低依次为日常活动能力>UPDRSII>PDQ39>MMSE>ESS>NMSS>HAMD>PSQI>HAMA,但与PD患者的疲劳症状无明显相关性。
本研究对OPN参与PD非运动症状的原因进行了推测,众所周知,随着患者病程的延长,血清中OPN表达水平升高,患者的睡眠质量呈下降趋势,其可能的原因是随着病情进展,患者的H-Y分期升高,其运动障碍更加明显,翻身困难,且患者可能合并了夜尿多、噩梦、焦虑抑郁、不安腿综合征等症状,影响了患者的睡眠。不仅如此,PD疾病本身及其治疗过程中药物对患者中枢神经系统造成的损害、病情的恶化、药物疗效的减退等都能导致或加重患者的焦虑和抑郁。从本研究结果可以看出少数痴呆症状明显的晚期PD患者睡眠质量评分高于中期PD患者,可能与晚期患者痴呆的焦虑抑郁减轻,出现淡漠和睡眠增多有关。随着病程的延长,患者HAMA、HAMD评分逐渐升高,与骨桥蛋白表达水平的升高有关,其r值较小,这可能与患者服用抗PD药物、抗焦虑抑郁药物有关。本研究对OPN诊断PD的敏感性及特异性进行了检测发现血清OPN诊断PD的特异性不高,但敏感性较高,这可能是由于PD患者脑内的炎症与多种因素有关,而OPN仅仅是其中之一的原因。
总之,PD患者血清OPN表达水平与多个非运动症状相关,PD组OPN水平波动范围大,可能反映了不同的病因和致病途径,对OPN表达水平进行检测可能有助于对PD患者的病情及预后进行评估。
[1] Hunn BH,Cragg SJ,Bolam J,et al.Impaired intracellular trafficking defines early Parkinson's disease[J].Trends Neurosci,2015,38(3):178-188.
[2] Berganzo K,Tijero B,Gonzalez-Eizaguirre A,et al.Motor and non-motor symptoms of Parkinson's disease and their impact on quality of Life and on different clinical subgroups[J].Neurologia,2016,31(9):585-591.
[3] Falup-Pecurariu F,C.Fatigue assessment of Parkinson's disease patient in clinic:specific versus holistic[J].J Neural Transm,2013,120(4):577-581.
[4] Rana AQ,Kabir A,Jesudasan MA,et al.Pain in parkinson's disease: analysis and literature review[J].Clin Neurol Neurosurg,2013,115(11):2313-2317.
[5] Xu YY,Kuo SH,Liang Z,et al.The natural history of depression in parkinson's disease within 30-Month Follow-Up[J].Parkinsons Dis,2015,doi:10.1155/2015/362892.
[6] Adler CH,Beach TG,Hentz JG,et al.Low clinical diagnostic accuracy of early vs advanced Parkinson disease Clinicopathologic study[J].Neurology,2014,83(5):406-412.
[7] Kannarkat GT,Boss JM,Tansey MG.The role of innate and adaptive immunity in Parkinson's disease[J].J Parkinsons Dis,2013,3(4):493-514.
[8] Melissa KA.Neuroinlammation in parkinson's disease[J].Journal of Neuroimmune Pharmacology,2009,4(4):419-429.
[9] Ailane S,Long P,Jenner P,et al.Expression of integrin and CD44 receptors recognising osteopontin in the normal and LPS-lesioned rat substantia nigra[J].European Journal of Neuroscience,2013,38(3):2468-2476.
[10] Iczkiewicz J,Jackson MJ,Smith LA,et al.Osteopontin expression in substantia nigra in MPTP-treated primates and in Parkinson's disease[J].Brain Res,2006,1118(1):239-250.
[11] Maetzler W,Berg D,Schalamberidze NA,et al.Osteopontin is elevated in Parkinson's disease and its absence leads to reduced neurodegeneration in the MPTP model[J].Neurobiol Dis,2007,25(3):473-482.
AclinicalstudyonthecorrelationbetweenOPNandnon-motorsymptomsinParkinson'sdisease
YangXinxin,HuZhenzhu,WangYuqiao,etal.
DepartmentofNeurology,TheAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002
ObjectiveTo investigate the value of OPN in diagnosing Parkinson’s disease (PD).Methods100 PD patients and 100 healthy controls were involved in this study, and their blood samples were monitored by ELISA. The non-motor symptoms of patients with PD were assessed by observing Activity of Daily Living Scale (ADL), Unified Parkinson's Disease Rating Scale (UPDRS), non-motor symptoms of PD Scale (NMSS), Hamilton Anxiety Scale (HAMA), FS-14, Pittsburgh Sleep Quality Index (PSQI), mini-Mental State Examination (MMSE), Epworth sleeping scale (ESS), Hamilton Depression Rating Scale (HAMD), Parkinson's disease quality of life questionnaire-39 (PDQ-39). Then the correlation between OPN and non-motor symptoms of PD was analyzed by Spearman rank correlation analysis. Receiver operating characteristic (ROC) curve was utilized to investigate the sensitivity and specificity of YKL-40 in diagnosing PD.ResultsThe OPN levels in PD patients were (21.5 6.18) ug/L, which was significantly higher than that in healthy controls (17.80±6.18) μg/L,t=7.41,P<0.01). There was a negative correlation between OPN and MMSE (r=-0.5658,P<0.05) and ADL scores (r=-0.7111,P<0.05), and a positive correlation between OPN and ADL, UPDRSII, PDQ-39, PSQI, ESS, NMSS, HADA and HAMA scores (r=0.3947~0.7094, allP<0.01). While there was no significant correlation between OPN and FS-14 scores (r=0.1603,P=0.1111). Moreover, there was a positive correlation between OPN and disease duration (r=0.59,P<0.01). ROC curve indicated that the area under the ROC curve was 0.775 (95%CI=0.7106-0.8394), as well as sensitivity and specificity of OPN in diagnosing PD were 78% and 66% respectively.ConclusionThere was a correlation between OPN and the non-motor symptoms of PD and OPN could be used as a biomarker in diagnosing PD.
Parkinson disease OPN Non-motor symptoms Inflammation Diagnosis
R742.5
A
1007-0478(2017)06-0489-04
10.3969/j.issn.1007-0478.2017.06.002
国家自然科学基金(81671269);江苏省六大人才高峰基金(WSN-120)
221002 江苏省徐州医科大学附属医院神经内科[杨新新 胡珍珠 王钰乔 张尊胜(通信作者)]
(2017-04-13收稿)

