红景天和轮叶党参混合提取物戊糖乳杆菌发酵条件及抗氧化作用分析
姜国哲,全贞玉,金润浩,HONG Heedo*,韩春姬,*
红景天和轮叶党参混合提取物戊糖乳杆菌发酵条件及抗氧化作用分析
姜国哲1,全贞玉1,金润浩1,HONG Heedo2,*,韩春姬1,*
(1.延边大学医学院,吉林 延吉 133002;2.韩国食品研究院,京畿道 城南 462-746)
目的:优化红景天和轮叶党参混合提取物(mixed extracts from Rhodiola sachalinensis and Codonopsis lanceolata,RCME)戊糖乳杆菌发酵条件,分析发酵产物的主要活性成分组成与含量,评价其抗氧化作用。方法:RCME中接种戊糖乳杆菌,以发酵液中的pH值、总酸含量及生物量为指标,研究发酵所需的最佳时间、培养基组成(红景天和轮叶党参混合比例)、RCME最佳质量浓度;采用比色法测定RCME发酵前后的总蛋白质、中性糖、酸性多糖及总酚含量变化,采用高效液相色谱法分析RCME发酵前后的红景天苷和酪醇含量变化,采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) diammonium salt radical,ABTS+·)清除实验评价RCME发酵物的抗氧化作用。结果:单纯红景天提取物发酵24~72 h,其pH值和总酸含量无明显变化,随着发酵时间延长,乳杆菌数明显减少(P<0.01)。红景天和轮叶党参混合质量比达到3∶2,发酵24 h后发酵液的pH值下降幅度和总酸含量升高的幅度最大,发酵48 h时后,pH值和总酸含量无明显的变化,乳杆菌数有所减少。可溶性固形物质量分数在1.0%~3.0%范围内,红景天苷转化为酪醇的转化率无明显差异。RCME发酵24 h后,红景天苷含量显著减少(P<0.01),酸性多糖、总酚、蛋白质及酪醇含量均显著增加(P<0.05或P<0.01)。RCME发酵后DPPH自由基和ABTS+·清除能力明显增强。结论:RCME发酵条件为红景天-轮叶党参混合比例3∶2、可溶性固形物质量分数1.0%~3.0%、发酵时间24 h。
红景天;轮叶党参;戊糖乳杆菌;发酵;抗氧化
生长在长白山的高山红景天(Rhodiola sachalinensis A. Bor)为景天科红景天属多年生草本植物,具有明显的耐缺氧、抗疲劳、抗肿瘤、抗氧化、抗炎、调节血糖、抗肝毒性等多种功效[1-6]。因此,高山红景天作为保健食品的良好原料备受关注。高山红景天中的主要活性成分为红景天苷及其苷元酪醇,这些成分具有明显的抗氧化及抗疲劳作用[7-8]。酪醇在体外清除羟自由基的能力高于红景天苷[9]。红景天苷在大鼠体内药代动力学研究结果表明,经口给予红景天苷后0.5~4 h内仅在肝脏中检测到红景天苷,而在心、肝、脾、肺、肾等组织中均检测到其苷元酪醇,表明红景天苷在体内代谢为酪醇后发挥生物学作用[10]。
研究表明,将红景天与红参混合,用乳酸菌发酵后,总酚、总蛋白及酪醇含量明显增加,红景天苷含量明显减少,其抗氧化作用明显增强[11],进一步研究结果表明红参和红景天混合发酵物可使骨骼肌细胞内谷胱甘肽过氧化物酶、Cu/Zn-超氧化物歧化酶基因表达明显增强[12]。但由于红参原料价格昂贵,造成红景天发酵产品的成本极高,如何得到红参的替代材料成为降级产品价格的关键。
轮叶党参(Codonopsis lanceolata Benth. et Hook.)为多年生草本植物,主要分布在中国、韩国、朝鲜等地区,具有消炎、镇咳、祛痰、通乳等功效,因其含有丰富的淀粉、矿物质等营养成分,作为山野菜广泛食用,其水提取物无急性或亚急性毒性[13]。与红参相比,轮叶党参同样含有丰富的皂苷、黄酮类及多糖成分,具有抗疲劳、增强免疫力、抗氧化、抗肿瘤、降血脂等多种与红参类似的功能[14-15],并且易被乳酸菌发酵[16],同时价格比人参更为低廉。
本研究拟以轮叶党参作替代红参,通过将轮叶党参和红景天作为乳杆菌发酵培养基,探讨发酵的适宜条件,分析发酵产物的理化特征及抗氧化作用,为高山红景天资源的大规模开发利用提供实验依据。
1 材料与方法
1.1 材料与试剂
高山红景天和轮叶党参干燥根为吉林省延边州安图县高山红景天种植基地和轮叶党参种植基地产品,用粉碎机进行微粉碎(80目)。
戊糖乳杆菌菌株Lactobacillus pentosus KFRI 1183(L1183) 韩国食品研究院;红景天苷对照品中国食品药品检定研究院;酪醇对照品 美国Chromadex公司;2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azo-bis (2-amidinopropane) dihydrochloride,AAPH) 上海源叶生物有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenly-2-picrylhydrazyl,DPPH) 日本Wako公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国Sigma公司。
1.2 仪器与设备
430型pH计 美国Corning公司;Mega 17R低温离心机 韩国Hanil Science Indusrrial公司;CyclotecTM1093粉碎机 美国Foss公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 日本日立公司。
1.3 方法
1.3.1 红景天-轮叶党参混合提取物的制作
将红景天和轮叶党参粉末以质量比1∶0、9∶1、4∶1、7∶3、3∶2、1∶1的比例混合,分别加10倍于原料质量的蒸馏水,90℃恒温加热回流提取3 h,过滤,滤液经8 000 r/min低温离心10 min,上清液用滤纸过滤,冷冻干燥,得到红景天-轮叶党参混合提取物(mixed extracts from Rhodiola sachalinensis and Codonopsis lanceolata,RCME),此滤液作为L1183发酵的液体培养基。
1.3.2 L1183发酵RCME
1.3.2.1 L1183发酵条件
将L1183接种在MRS肉汤培养基中,在37 ℃培养20 h左右进行活化。将制备好的RCME稀释成一定质量分数(0.5%~3.0%),在121℃灭菌15 min,将活化的L1183以1%(106CFU/mL)的质量分数接种于高压灭菌处理过的RCME中,在37℃下发酵24~72 h后,冷冻干燥,得到红景天-轮叶党参混合提取液发酵物(fermented RCME,FRCME)。
1.3.2.2 菌落数测定
取1 mL L1183发酵液FRCME加入到9 mL无菌生理盐水中,分阶段稀释,取0.1 mL稀释液涂抹在MRS琼脂培养基培养后测量生成的菌落数,最后平均菌落数乘以稀释倍数即可计算每毫升提取物中的菌落数。
1.3.3 理化特征与指标成分分析
1.3.3.1 pH值与可滴定酸度测定
利用pH计测量RCME在发酵过程中的pH值。采用GB/T 12456—2008《食品中总酸的测定》的方法测定发酵液的总酸质量分数。
1.3.3.2 多糖及糖醛酸含量测定
采用苯酚-硫酸法[17]测定多糖含量。将RCME及FRCME分别置于试管中,加蒸馏水溶解,使其质量浓度达到1 g/100 mL,用0.45 μm薄膜过滤,取续滤液各1 mL置于新的试管中,加入5%苯酚溶液1 mL,充分混匀,加入磺酸5 mL,反应30 min,在490 nm波长处测定吸光度,通过测得的葡萄糖含量来计算多糖含量。
采用咔唑-硫酸法[18]测定糖醛酸的含量。将RCME及FRCME分别加入到试管中,加蒸馏水溶解,使其质量浓度达到1 g/100 mL,用0.45 μm薄膜过滤。取续滤液各0.5 mL,置于新的试管中,加入0.125%咔唑溶液0.25 mL,充分混匀,加入硫酸3 mL,在85 ℃水浴中反应15 min,在525 nm波长处测定吸光度。以β-D-半乳糖醛酸为标准物计算糖醛酸的含量。
1.3.3.3 总酚含量的测定
采用多酚物质与磷钼酸反应后发生青色反应的Folin Deinis法[19]测定总酚含量。即将RCME及FRCME分别置于试管中,加蒸馏水溶解,使其最终质量浓度达到1 g/100 mL,用0.45 μm滤膜过滤。取新的试管,分别加入不同样品续滤液0.1 mL,再加入蒸馏水5 mL,充分混匀,各试管分别加入福林-酚试剂0.5 mL,加入饱和Na2CO3溶液1.5 mL及蒸馏水2.9 mL,常温放置2 h后在765 nm波长处测定吸光度,最后以没食子酸标准品计算总酚含量。
1.3.3.4 蛋白质含量测定
用改良的Bradford[20]法测定样品中的蛋白质含量,以牛血清白蛋白为标准物。即将受试物分别放入试验管中,加蒸馏水溶解,使最终质量浓度达到1 g/100 mL,用0.45 μm滤膜过滤。取新试管,分别加入续滤液0.1 mL,加入Bradford dye试剂1 mL,充分混匀,在常温下反应10 min,在600 nm波长处测定吸光度并计算蛋白质含量。
1.3.3.5 发酵前后成分分析
为了分析FRCME中的红景天苷和酪醇的含量,取红景天苷和酪醇对照品各10 mg,溶于甲醇,配制成所需质量浓度。准确称取待测样品0.100 0 g溶于10 mL甲醇,用0.45 μm滤膜过滤,采用HPLC仪分析。色谱分析条件:色谱柱为ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相为90%乙腈(A)和0.3%冰醋酸(B),梯度洗脱(0~8 min,8% A;8~25 min,8%~15% A;25~35 min,15%~8% A;35~40 min,8%A);检测波长278 nm,流速1 mL/min,柱温35 ℃,紫外检测器,样品注入量20 μL。
1.3.4 抗氧化作用评价
1.3.4.1 DPPH自由基清除实验
参考Huang Bo等[21]方法进行DPPH自由基清除率测定。取乙醇2.8 mL,加入实验液0.4 mL和4×10-4mol/L的DPPH溶液0.8 mL混合,室温放置10 min,525 nm波长处测定吸光度。DPPH自由基清除率的计算如式(1)所示:

1.3.4.2 ABTS+·清除实验
ABTS+·清除实验参考Tuberoso等[22]提出的改良方法进行。1 mmol/L的AAPH:将100 mmol/L磷酸盐缓冲液加2.5 mmol/L的ABTS,混匀并在68 ℃恒温中反应12 min。ABTS溶液的浓度控制在734 nm波长处吸光度0.650±0.2。最后取待测样品20 μL和ABTS试液980 μL混匀,在37 ℃恒温水浴中反应10 min,734 nm波长处测定吸光度。ABTS+·清除率的计算如式(2)所示:

1.4 数据统计处理
实验结果采用SPSS Statistics 17.0进行统计分析,用Bonferroni方法检验各组间统计有效性。
2 结果与分析
2.1 RCME最适发酵条件的确定
为筛选L1183菌株对RCME的最适发酵条件,将红景天与轮叶党参原料以不同比例混合,制备RCME,接种L1183菌株后在37℃发酵24~72 h,在不同时间点测定发酵液的pH值、总酸含量及L1183菌落数,测定结果见表1和表2。单纯红景天发酵24、48 h及72 h后,其pH值无显著变化(P>0.05),表明红景天提取物几乎未发酵。
表1 不同混合比例条件下FRCME中pH值及总酸含量的变化(,n=3)Table 1 Changes in pH and acidity of FRCME with different Rhodiola sachalinensis to Codonopsis lanceolata ratios (x s, n=3)
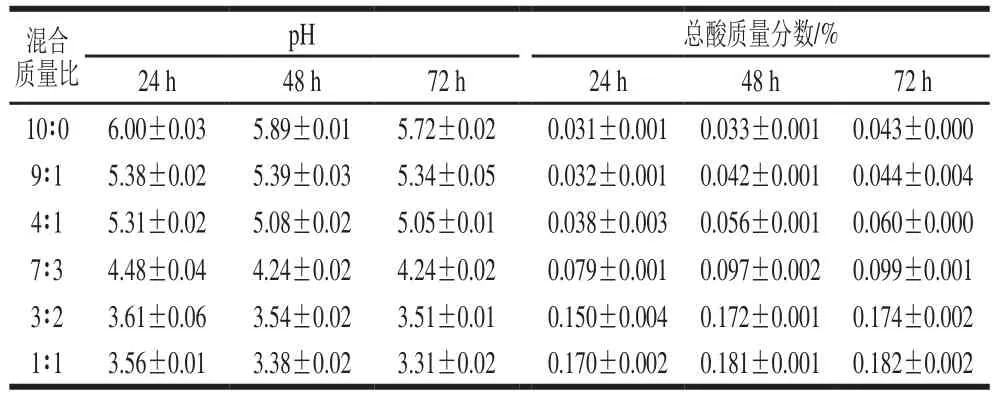
表1 不同混合比例条件下FRCME中pH值及总酸含量的变化(,n=3)Table 1 Changes in pH and acidity of FRCME with different Rhodiola sachalinensis to Codonopsis lanceolata ratios (x s, n=3)
混合质量比pH 总酸质量分数/%24 h 48 h 72 h 24 h 48 h 72 h 10∶0 6.00±0.03 5.89±0.01 5.72±0.02 0.031±0.001 0.033±0.001 0.043±0.000 9∶1 5.38±0.02 5.39±0.03 5.34±0.05 0.032±0.001 0.042±0.001 0.044±0.004 4∶1 5.31±0.02 5.08±0.02 5.05±0.01 0.038±0.003 0.056±0.001 0.060±0.000 7∶3 4.48±0.04 4.24±0.02 4.24±0.02 0.079±0.001 0.097±0.002 0.099±0.001 3∶2 3.61±0.06 3.54±0.02 3.51±0.01 0.150±0.004 0.172±0.001 0.174±0.002 1∶1 3.56±0.01 3.38±0.02 3.31±0.02 0.170±0.002 0.181±0.001 0.182±0.002
表2 不同混合比例条件下FRCME中L1183活菌数的变化(x ±s,n=3)Table 2 Changes in L1183 viable cell count in FRCME with different Rhodiola sachalinensis to Codonopsis lanceolata ratios (, n= 3)
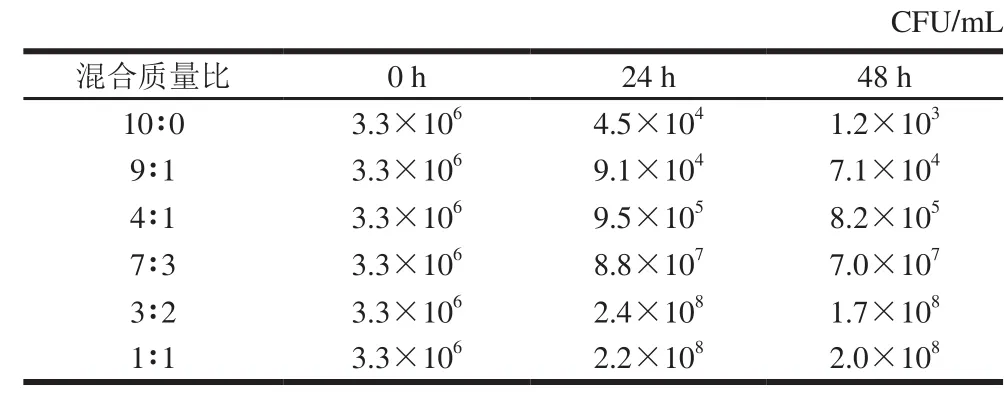
表2 不同混合比例条件下FRCME中L1183活菌数的变化(x ±s,n=3)Table 2 Changes in L1183 viable cell count in FRCME with different Rhodiola sachalinensis to Codonopsis lanceolata ratios (, n= 3)
CFU/mL混合质量比 0 h 24 h 48 h 10∶0 3.3×106 4.5×104 1.2×103 9∶1 3.3×106 9.1×104 7.1×104 4∶1 3.3×106 9.5×105 8.2×105 7∶3 3.3×106 8.8×107 7.0×107 3∶2 3.3×106 2.4×108 1.7×108 1∶1 3.3×106 2.2×108 2.0×108
红景天加不同比例的轮叶党参混合制备RCME在发酵24、48 h及72 h后,随着轮叶党参添加比例的增加,其pH值逐渐下降,总酸含量逐渐增高。轮叶党参添加比例为30%以上,发酵24 h后,与单纯红景天组比较(pH 6.0),其pH值明显下降(P<0.001),总酸含量明显增高(P<0.001)。当轮叶党参添加比例达到50%时,发酵24、48 h及72 h后pH值分别下降了2.44、2.51及2.41,不同时间点pH值下降幅度无显著差异(P>0.05),表明添加轮叶党参的比例越高,发酵后的pH值越低,总酸含量越高,发酵24 h后再延长发酵时间对发酵无明显的影响,因此最适发酵时间可确定为24 h。一般情况下,乳酸菌发酵过程中pH值下降的现象是由于发酵过程中生成醋酸、丙酸、丁酸、柠檬酸等有机酸所致[23],本实验实际测定的总酸含量结果也表明类似趋势。
菌落数测定结果表明,单纯红景天随着发酵时间延长,菌落数急剧减少,发酵24 h后菌落数减少了98.6%,发酵48 h后减少了99.9%,表明单纯红景天提取物对L1183有明显的抑制作用,无法进行发酵,该结果与Sung等[11,24]的研究结果基本一致。与0 h相比,当轮叶党参添加比例增加至30%时,发酵24 h后菌落数增加至26.7倍;轮叶党参添加比例达到40%时,发酵24 h增加至72.7倍,发酵48 h后有所减少;轮叶党参添加比例达到50%,发酵24 h和48 h后菌落数增加至66.7倍和60.6倍,表明红景天中添加轮叶党参40%~50%,L1183发酵良好。发酵48 h后菌落数比发酵24 h时有所减少,该结果与Song等[25]研究结果基本一致,其可能的原因是发酵时间超过24 h后,混合提取物中的L1183增殖所需的营养物质逐渐减少,以及增殖过程中产生的代谢产物堆积,从而抑制乳酸菌增殖。
根据以上结果判断,红景天中添加轮叶党参的比例达到40%时可以进行L1183发酵。后续的实验采用红景天-轮叶党参混合比例为3∶2。
为了确定混合提取液中可溶性固形物含量对发酵过程的影响,取RCME(混合比例为1∶1)的固形物质量分数分别为1.0%和3.0%,接种L1183菌株。在发酵24、48 h及72 h时分别测定pH值、总酸含量及菌落数的变化,结果如图1所示。
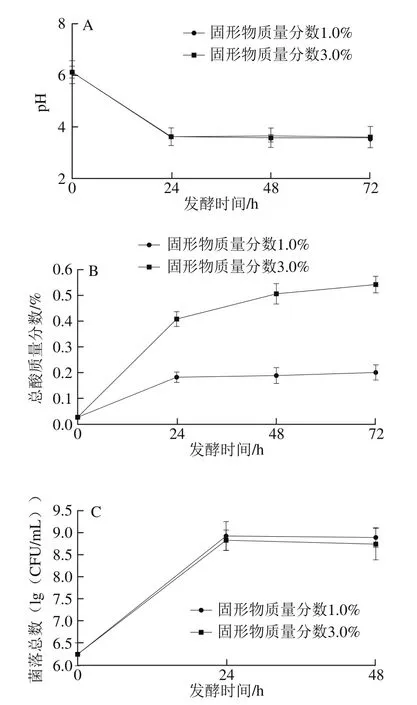
图1 不同固形物含量条件下pH值(A)、总酸质量分数(B)及L1183菌落数(C)变化Fig. 1 Changes in pH, acidity and viable cell counts of FRCME with different soluble solid contents
固形物质量分数为1.0%和3.0%时,发酵前pH值均为6.13,发酵24 h后pH值下降至3.59和3.61,继续延长发酵时间,pH值无明显变化。固形物质量分数为1.0%和3.0%时,发酵前总酸质量分数为0.028%,发酵24 h后分别提高至0.184%和0.409%,分别提高到原来的6.6 倍和14.6倍,固形物质量分数为3.0%时的总酸含量明显高于固形物质量分数1.0%的总酸含量(P<0.01),发酵48 h和72 h后总酸含量进一步提高,但与24 h时比较无明显差异。菌落数测定结果:发酵前为6.25(lg(CFU/mL)),发酵24 h后增加至8.92(lg(CFU/mL))和8.83(lg(CFU/mL))(发酵前后发酵后比较,P<0.01),发酵48 h后菌落数有所减少。固形物质量分数在1.0%~3.0%范围内,对L1183增殖无明显的影响。
综合上述结果,发酵的最适条件为:红景天-轮叶党参混合比例3∶2、可溶性固形物质量分数1.0%、发酵时间24 h。
2.2 发酵前后成分分析

图2 红景天苷(A)、酪醇(B)、FRCME(C)和RCME(D)的HPLC图Fig. 2 HPLC chromatograph of salidroside (A), tyrosol (B),FRCME (C) and RCME (D)

图3 RCME和FRCME溶液中红景天苷(a)和酪醇(b)含量的变化Fig. 3 Changes in salidroside and tyrosol contents of RCME
为观察RCME发酵后红景天有效成分变化,采用HPLC法检测红景天苷及其苷元酪醇含量,结果如图2、3所示。RCME溶液固形物质量分数为1.0%时,红景天苷和酪醇含量分别为481.5 mg/100 g和37.0 mg/100 g,发酵24 h后FRCME红景天苷含量减少至207.4 mg/100 g,酪醇含量增加至333.3 mg/100 g,发酵后红景天苷减少了56.9%,酪醇增加了8.01 倍。RCME溶液的固形物质量分数为3.0%时,红景天苷和酪醇含量分别为570.4 mg/100 g和51.9 mg/100 g,发酵24 h后红景天苷含量减少至133.3 mg/100 g,酪醇含量增加至374.1 mg/100 g,发酵后红景天苷减少了76.6%,酪醇增加了6.21 倍,表明在发酵过程中,红景天苷水解,转化为其苷元酪醇。可溶性固形物质量分数在1.0%~3.0%范围内,红景天苷转化为酪醇的转化率无明显差异。
红景天苷是糖的半缩醛羟基与醇羟基脱水形成的醇苷,是一种由葡萄糖与酪醇以苷键结合而成的糖苷。催化红景天苷降解的第一个酶是β-D-葡萄糖苷酶。本实验中,用L1183发酵RCME后,红景天苷含量明显减少,而酪醇含量显著增高。其可能的机制是L1183在增殖过程中产生β-D-葡萄糖苷酶,促进红景天苷水解转化为酪醇,其确切机制有待于今后进一步研究。
林俊芝等[26]研究结果显示,给大鼠分别灌胃红景天苷和酪醇各100 mg/kg后,红景天苷血药浓度在30 min达峰,而酪醇血药浓度在5 min后达峰,表明酪醇在肠道中的吸收比红景天苷迅速。Guo Na等[10]报道,给大鼠灌胃红景天苷100 mg/kg后,仅在肝组织中检测到红景天苷,但在心、肝、肾、脾、肺等组织中均检测到酪醇,表明红景天苷被吸收后在组织脏器中主要以酪醇的形式发挥生物学作用。本实验结果表明,红景天与轮叶党参混合,经乳酸菌发酵后,使大部分红景天苷转化为酪醇,可提高其在胃肠道中的吸收速度及在体内的生物利用率[27]。
2.3 理化性质及成分特征分析
表3 发酵前后主要成分的含量变化(x±s,n=3)Table 3 Changes in major component contents of RCME after fermentation (x s, n=3)
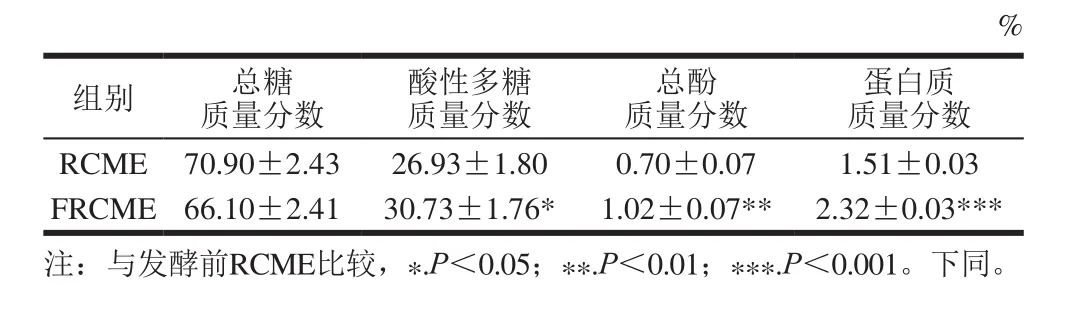
表3 发酵前后主要成分的含量变化(x±s,n=3)Table 3 Changes in major component contents of RCME after fermentation (x s, n=3)
%蛋白质质量分数RCME 70.90±2.43 26.93±1.80 0.70±0.07 1.51±0.03 FRCME 66.10±2.41 30.73±1.76* 1.02±0.07** 2.32±0.03***注:与发酵前RCME比较,*.P<0.05;**.P<0.01;***.P<0.001。下同。组别 总糖质量分数酸性多糖质量分数总酚质量分数
如表3所示,RCME发酵后总糖质量分数由发酵前70.9%减少至66.1%,酸性多糖质量分数由发酵前26.93%增加至30.73%。发酵后总酚和蛋白质含量显著高于发酵前(总酚类化合物t=5.787,P<0.01;蛋白质t=35.074,P<0.001),总酚由发酵前的0.70%增加至1.02%,蛋白质由发酵前的1.51%增加至2.32%。蛋白质含量显著增加的主要原因是乳酸菌大量增殖,总酚含量显著增加的主要原因可能是红景天和轮叶党参中含有的高分子酚类化合物在发酵过程中分离成许多低分子酚类化合物或游离的酚类化合物,从而增加总酚类化合物含量。植物原料中总酚类化合物的含量越高,其抗氧化活性越强[28]。由此推测,红景天经乳酸菌发酵后,在体内抗氧化、清除自由基的生物活性可能有一定的增强。
2.4 FRCME抗氧化作用评价
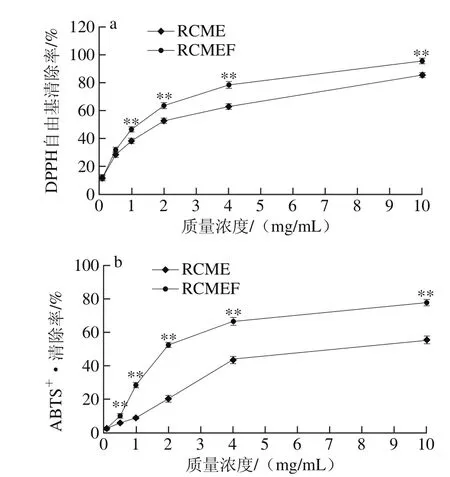
图4 发酵前后的DPPH自由基(a)和ABTS+·(b)清除能力Fig. 4 DPPH radical and ABTS+· scavenging activities of RCME and FRCME
如图4所示,用FRCME 1 mg/mL处理时DPPH自由基清除率为46.8%,与发酵前比较具有显著差异(P<0.01),用FRCME 10 mg/mL处理时,其DPPH自由基清除率达到95.6%,比发酵前提高了10%(P<0.01)。FRCME在0.5~6.0 mg/mL质量浓度范围内ABTS+·和DPPH自由基清除率均显著高于RCME(P<0.05或P<0.01),FRCME和RCME清除DPPH自由基的IC50分别为1.10 mg/mL和1.61 mg/mL,FRCME和RCME清除ABTS+·的IC50分别为3.33 mg/mL和4.69 mg/mL。总酚是广泛分布于植物中的次级代谢产物,具有多种结构和分子质量,酚类化合物中的酚羟基具有抑制脂质过氧化、抗氧化、抗癌、降血压等多种生理活性[29-30]。Akter[31]和Oke-Altuntas[32]等研究结果表明,DPPH自由基和ABTS+·清除能力随着总多酚含量的增高而逐渐增强,总酚含量与自由基清除能力具有较高的相关性。本研究中,FRCME清除DPPH自由基和ABTS+·能力明显高于RCME,这一结果与FRCME和RCME的总酚含量变化相吻合,与其他研究结果一致。
3 结 论
本研究通过考察RCME在戊糖乳杆菌发酵过程中的理化指标及活菌数的变化,研究了红景天和轮叶党参混合发酵的最佳条件,采用DPPH自由基和ABTS+·清除实验方法考察了FRCME的抗氧化作用。结果表明:单纯红景天几乎不能用戊糖乳杆菌发酵,当红景天与轮叶党参原料以3∶2比例混合提取后,接种戊糖乳杆菌发酵24 h,与单纯红景天组比较,活菌数增加至2.4×108CFU/mL,pH值由6.0下降至3.61,总酸由0.031%增加至0.150%,发酵时间延长至48 h时,活菌数增加量有所减少,pH值进一步下降,总酸含量进一步提高。发酵液中可溶性固形物质量分数为1.0%,发酵24 h后菌落数由发酵前的6.25(lg(CFU/mL))增加至8.92(lg(CFU/mL)),约增加了467倍;可溶性固形物质量分数提高至3.0%,发酵24 h后菌落数增加至8.83(lg(CFU/mL)),约增加了380 倍,但两者无明显差异。经戊糖乳杆菌发酵24 h,红景天苷含量明显减少(P<0.01),酸性多糖、总酚、蛋白质及酪醇含量均显著增加(P<0.05或P<0.01)。因此,红景天和轮叶党参混合提取物戊糖乳杆菌发酵的最佳条件为:红景天和轮叶党参混合比例3∶2,可溶性固形物质量分数1.0%~3.0%,37℃发酵24 h。发酵产物的抗氧化作用评价结果显示:戊糖乳杆菌发酵后,FRCME质量浓度在1~6 mg/mL范围内DPPH自由基和ABTS+·清除率明显高于RCME。
[1] LEE Y. A study on the anti-oxidative activities of rhodiolarosearoot[J].The Korea Journal of Herbology, 2012, 27(6): 91-98. DOI:10.6116/kjh.2012.27.6.91.
[2] CHOE K, KWON J, PARK K, et al. The antioxidant and antiinf l ammatory effects of phenolic compounds isolated from the root of Rhodiola sachalinensis A. BOR[J]. Molecules, 2012, 17(10): 11484-11494. DOI:10.3390/molecules171011484.
[3] 王媛媛, 林宏. 红景天提取物体外抗肿瘤转移作用机制研究[J].天津药学, 2015, 27(6): 1-4. DOI:10.3969/j.issn.1006-5687.2015.06.001.
[4] 金铁, 杨咏洁, 李铉军, 等. 高山红景天对小鼠抗疲劳及抗氧化作用的研究[J]. 食品研究与开发, 2013, 34(19): 24-26; 121. DOI:10.3969/j.issn.1005-6521.2013.19.007.
[5] ZHAO H, SHI X, WEI W, et al. Effect of the regimen of Gaoshanhongjingtian on the mechanism of poly (ADP-ribose) polymerase regulation of nuclear factor kappa B in the experimental diabetic retinopathy[J]. Chinese Medical Journal, 2013, 126(9): 1693-1699.DOI:10.3760/cma.j.issn.0366-6999.20123457.
[6] WU Y, LIAN L, JIANG Y, et al. Hepatoprotective effects of salidroside on fulminant hepatic failure induced by D-galactosamine and lipopolysaccharide in mice[J]. The Journal of Pharmacy and Pharmacology, 2009, 61(10): 1375-1382. DOI:10.1211/jpp/61.10.0015.
[7] HU Y, LV X, ZHANG J, et al. Comparative study on the protective effects of salidroside and hypoxic preconditioning for attenuating anoxiainduced apoptosis in pheochromocytoma (PC12) cells[J]. Medical Science Monitor, 2016, 22: 4082-4091. DOI:10.12659/MSM.897640.
[8] XING S, YANG X, LI W, et al. Salidroside stimulates mitocho ndrial biogenesis and protects against H2O2-induced endothelial dysfunction[J]. Oxidative Medicine and Cellular Longevity, 2014,2014: 904834. DOI:10.1155/2014/904834.
[9] 马天翔, 史宁, 陈乾, 等. 红景天中8 种成分体外抗氧化作用的比较[J]. 中国药理学通报, 2012, 28(9): 1224-1228. DOI:10.3969/j.issn.1001-1978.2012.09.010.
[10] GUO N, ZHU M X, HAN X J, et al. The metabolism of salidroside to its aglyconep-tyrosol in rats following the administration of salidroside in rats following the administration of salidroside[J]. PLoS ONE,2014, 9(8): e103648. DOI:10.1371/journal.pone.0103648.
[11] SUNG S, RHEE Y, CHO C, et al. Physicochemical properties and antioxidative activity of fermented Rhodiola sachalinensis and Korean red ginseng mixture by Lactobacillus acidophilus[J]. The Korean Journal of Food and Nutrition, 2013, 26(3): 358-365. DOI:10.9799/ksfan.2013.26.3.358.
[12] YOON B, KIM Y, LEE J, et al. Protective effect of ferments of hot-water extract mixture from Rhodiola sachalinensis and red ginseng on oxidative stress-induced C2C12 myoblast[J]. The Korean Journal of Food and Nutrition, 2013, 26(3): 485-491. DOI:10.9799/ksfan.2013.26.3.485.
[13] LEE S, KIM Y, KIM D, et al. Acute and subchronic (28 days)oral toxicity studies of Codonopsis lanceolata extract in Sprague-Dawleyrats[J]. Regulatory Toxicology and Pharmacology, 2015,71(3): 491-497. DOI:10.1016/j.yrtph.2015.02.014.
[14] LI W, XU Q, HE Y, et al. Anti-tumor effect of steamed Codonopsis lanceolata in h22 tumor-bearing mice and its possible mechanism[J]. Nutrients, 2015,7(10): 8294-8307. DOI:10.3390/nu7105395.
[15] 姜国哲, 金润浩, 韩春姬. 轮叶党参的植物化学物及生物活性研究进展[J]. 食品科学, 2016, 37(17): 257-262. DOI:10.7506/spkx1002-6630-201617043.
[16] WEON J B, YUN B R, LEE J, et al. Neuroprotective effect of steamed and fermented Codonopsis lanceolata[J]. Biomolecules and Therapeutics(Seoul), 2014, 22(3): 246-253. DOI:10.4062/biomolther.2014.019.
[17] 郑小亮, 蔡亚平, 冯宇飞. 注射用五味子多糖的含量测定[J]. 中医药学报, 2010, 38(2): 99-101. DOI:10.3969/j.issn.1002-2392.2010.02.039.
[18] 夏永刚, 梁军, 杨炳友, 等. 麻黄多糖中糖醛酸含量的测定[J]. 中医药学报, 2011, 39(1): 71-73. DOI:10.3969/j.issn.1002-2392.2011.01.030.
[19] ILOKI S, LEWIS L, RIVERA G, et al. Effect of maturity and harvest season on antioxidant activity, phenolic compounds and ascorbic acid of Morinda citrifolia L. (Noni) grown in Mexico[J]. African Journal of Biotechnology, 2013, 12: 4630-4639. DOI:10.5897/AJB2013.12073.
[20] GERMANO M P, ANGELO V D, SANOGO R, et al. Hepatoprotective and antibacterial effects of extracts from Trichilia emetica Vahl.(Meliaceae)[J]. Journal of Ethnopharmacology, 2005, 96(1/2):227-232. DOI:10.1016/j.jep.2004.09.011.
[21] HUANG B, KE H, HE J, et al. Extracts of Halenia elliptica exhibit antioxidant properties in vitro and in vivo[J]. Food and Chemical Toxicology, 2011, 49(1): 185-190. DOI:10.1016/j.fct.2010.10.015.
[22] TUBEROSO C I G, BOBAN M, BIFULCO E, et al. Antioxidant capacity and vasodilatory properties of Mediterranean food: the case of Cannonau wine, myrtle berries liqueur and strawberry-tree honey[J]. Food Chemistry, 2013, 140(4): 686-691. DOI:10.1016/j.foodchem.2012.09.071.
[23] LEE I, PARK K. Preparation and quality characteristic of yoghurt added with cultured ginseng[J]. Korean Journal of Food Science and Technology, 2003, 35(2): 235-241.
[24] SUNG S, RHEE Y, CHO C, et al. Physicochemical properties and antioxidative activity of lactic acid bacteria fermented Rhodiola sachalinensis using adsorption process[J]. The Korean Journal of Food and Nutrition, 2012,25(4): 779-786. DOI:10.9799/ksfan.2012.25.4.779.
[25] SONG H, HONG K, MIN H, et al. Changes in physicochemical and sensory properties of Hizikia fusiforme water extract by fermentation of lactic acid bacteria[J]. The Korean Society of Fisheries and Aquatic Science, 2011, 44(2): 104-110. DOI:10.5657/kfas.2011.44.2.104.
[26] 林俊芝, 张定堃, 邹亮, 等. 红景天苷与酪醇在大鼠体内的药动学研究[J]. 中成药, 2014, 32(9): 1845-1849. DOI:10.3969/j.issn.1001-1528.2014.09.012.
[27] AKAO T, HATTORI M, NAMBA T, et al. Metabolic activation of crude drug components by intestinal bacterial enzymes[J]. Wakan Iyaku Gakkaishi, 1992, 9(1): 1-13.
[28] DUVAL B, SHETTY K. The stimulation of phenolics and antioxidant activity in pea (Pisum sativum) elicited by genetically transformed anise root extract[J]. Journal of Food Biochemistry, 2001, 25(5): 361-377. DOI:10.1111/j.1745- 4514.2001.tb00746.x.
[29] LEE S, LEE Y, HWANG I, et al. Antioxidant activities and quality characteristics of germinated rough rice tea according to roasting temperature, time and leaching condition[J]. Korean Journal of Food Science and Technology, 2009, 41(4): 386-391. DOI:KTKPTSS-0000047753.
[30] HEO B, CHO J, PARK Y, et al. Sensuous characteristics and physiological activity of cheongteajeon tea produced with the inoculation of microbial stains[J]. The Korean Journal of Community Living Science, 2010, 21(4): 139-148. DOI:10.9799/ksfan.2013.26.4.693.
[31] AKTER K, BARNES E C, BROPHY J J, et al. Phytochemical profile and antibacterial and antioxidant activities of medicinal plants used by aboriginal people of New South Wales, Australia[J].Evidence-Based Complementary and Alternative Medicine, 2016.DOI:10.1155/2016/4683059.
[32] OKE-ALTUNTAS F, IPEKCIOGLU S, YAGLIOGLU A S, et al.Phytochemical analysis, antiproliferative and antioxidant activities of Chrozophora tinctoria: a natural dye plant[J]. Pharmaceutical Biology,2017, 55(1): 966-973. DOI:10.1080/13880209.2016.1277767.
Fermentation Conditions and Antioxidative Activity of Mixed Extracts from Rhodiola sachalinensis and Codonopsis lanceolata by Lactobacillus pentosus
JIANG Guozhe1, QUAN Zhenyu1, JIN Runhao1, HONG Heedo2,*, HAN Chunji1,*
(1. Medical College, Yanbian University, Yanji 133002, China; 2. Korea Food Research Institute, Sungnam 462-746, Korea)
Objective: To investigate the optimization of the fermentation of mixed extracts from Rhodiola sachalinensis and Codonopsis lanceolata (RCME) by Lactobacillus pentosus and to determine the composition of bioactive compounds and antioxidative activity of fermented RCME. Methods: The pH, acidity and mycelial biomass were evaluated as a function of the ratio between Rhodiola sachalinensis and Codonopsis lanceolata, soluble solid content of RCME and fermentation time.Variations in the total protein, neutral sugar, acidic polysaccharide and total phenolics contents in RCME before and after fermentation were determined using colorimetric method, as well as variations in salidroside and tyrosol contents by HPLC.The antioxidant activity of fermented RCME was evaluated using 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) diammonium salt (ABTS) radical scavenging assay. Results: The pH and total acidity were little changed from 24 to 72 h of fermentation when Rhodiola sachalinensis was fermented alone and the viable cell count signif i cantly decreased (P < 0.01). A 3:2 mixture of Rhodiola sachalinensis and Codonopsis lanceolata showed the greatest pH decline and largest increase in acidity at 24 h of fermentation, which remained little changed from 48 h onward,but the viable cell count dropped. Soluble solid content was in the range of 1.0%–3.0%, and the conversion rate of salidroside to tyrosol was not changed significantly from 48 to 72 h. However, salidroside content significantly decreased at 24 h compared with that at 0 h (P < 0.01), whereas tyrosol, acidic polysaccharide, total phenolics and protein signif i cantly increased(P < 0.05 or P < 0.01). DPPH and ABTS+· scavenging activity of fermentation product were signif i cantly higher than those of RCME (P < 0.01). Conclusion: The optimum fermentation conditions of RCME were determined as follows: ratio between Rhodiola sachalinensis and Codonopsis lanceolata ratio, 3:2; soluble solid concentration of RCME 1.0%–3.0%, temperature 37 ℃, and time 24 h.
Rhodiola sachalinensis; Codonopsis lanceolata; Lactobacillus pentosus; fermentation; antioxidant activity
10.7506/spkx1002-6630-201802020
Q815
A
1002-6630(2018)02-0124-07
姜国哲, 全贞玉, 金润浩, 等. 红景天和轮叶党参混合提取物戊糖乳杆菌发酵条件及抗氧化作用分析[J]. 食品科学,2018, 39(2): 124-130.
10.7506/spkx1002-6630-201802020. http://www.spkx.net.cn
JIANG Guozhe, QUAN Zhenyu, JIN Runhao, et al. Fermentation conditions and antioxidative activity of mixed extracts from Rhodiola sachalinensis and Codonopsis lanceolata by Lactobacillus pentosus[J]. Food Science, 2018, 39(2): 124-130.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802020. http://www.spkx.net.cn
2017-02-10
国家科技部国际合作专项基金项目(2011DFA33470)
姜国哲(1989—),男,博士研究生,主要从事分子毒理学及保健食品研究。E-mail:gzjiang@ybu.edu.cn
*通信作者简介:Hong Heedo(1964—),男,研究员,博士,主要从事食品发酵工程及功能食品研究。E-mail:hdstraw@naver.com
韩春姬(1960—),女,教授,博士,主要从事分子毒理学及保健食品研究。E-mail:chjihan@126.com

