紫外诱变选育耐高温香菇新品种
武晓雨,邓百万,2,*,陈文强,2,解修超,2
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000; 2.陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
紫外诱变选育耐高温香菇新品种
武晓雨1,邓百万1,2,*,陈文强1,2,解修超1,2
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000; 2.陕西省食药用菌工程技术研究中心,陕西 汉中 723000)
为通过紫外诱变育种技术选育香菇耐高温新品种,以野生耐高温香菇品种XG-1为出发菌株,采用不同紫外照射时间和强度筛选耐高温香菇新品种,并对综合性状较好的诱变菌株进行栽培试验。结果显示:在诱变时间25~30 s,诱变强度为12~16 W时,筛选出诱变菌株XG-5,定名为金西1号;其出菇温度可达38 ℃,属耐高温品种;斜靠栽培每袋(规格17 cm×33 cm的聚乙烯袋)可产1.013 kg,生物转化率达92.09%。
高温香菇;紫外诱变;诱变时间;诱变温度;生物转化率
香菇(Lentinusedodes)是产于北半球温带与亚热带地区的一种腐生真菌,不仅营养丰富,而且具有较高的保健价值,自古以来深受人们的喜爱。我国香菇主产于河南、山东、福建、浙江等地区。代料栽培是我国20世纪80年代兴起的香菇生产新技术,该技术用工农业生产的废料或下脚料代替传统的段木栽培香菇,具有原料来源广,产量高,周期短,经济效益好等特点[1]。近年来,受全球气候变暖的影响,特别是夏季高温给香菇栽培带来新的挑战。每年7—8月份,高温对全国各大香菇产区造成很大的影响,出现病虫害发生严重,香菇产量下降,市场供应量减少等问题,给菇农造成很大的经济损失[2]。因此,选育香菇高温品种用于栽培具有十分现实的意义。
食用菌的育种方法主要有人工选择育种、杂交育种、原生质体融合育种、诱变育种、基因工程育种等,它们都曾在食用菌的菌种改良方面发挥了巨大的作用[3]。况丹等[4]利用紫外诱变技术选育出高产量的杏鲍菇,选育出的菌株较原始菌株产量提高35%和34%。王连会等[5]利用原生质体紫外诱变技术筛选出对5′-FOA敏感性较高的香菇‘L26’菌株。陆佩丽等[6]利用紫外诱变技术筛选出诱变菌株Tm-3-21,为胞内多糖发酵的优质菌株,其胞内多糖产量达0.67 mg·mL-1,得率是9.41%,比出发菌株提高1.19倍。本研究利用诱变育种技术,采用不同紫外照射时间和强度来筛选诱变菌株;同时对诱变菌株进行栽培试验,并对其生物学特性进行分析。
目前,鉴定新品种的分子技术中,利用PCR扩增真菌核糖体转录间隔区(internal transcribed spacers,ITS)进行真菌鉴定技术取得迅猛发展。真菌rDNA的ITS区段既具保守性,又在科、属、种水平上具有特异性序列,且进化速率较快,已被广泛用于生物种内变异和种间、近亲属间的分子系统学研究[7-8]。本研究对选育菌株进行ITS序列鉴定,阐明其系统发育过程,旨在为香菇新品种的初步鉴定提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
在陕西省汉中市西乡县进入夏季高温期阶段,从高川采集野生香菇子实体1个,标记为XG-1。香菇18、香菇808、香菇9608、香菇931、香菇290、香菇241-6、香菇602、沪农1号、Chamsongi、渝化2号、渝化3号、森立8号、森立15号、韩8、台香8号、高温香菇由陕西省资源生物重点实验室食药用菌菌种保藏中心提供。武香1号由食用菌研究所提供,南山1号由福建三明真菌研究所提供。
高温型香菇:南山1号、武香1号、高温香菇、台香8号、香菇931;中低温型香菇:香菇808、香菇290、香菇241-6、香菇602、Chamsongi、森立8号、韩8;普通型香菇:香菇18、香菇9608、沪农1号、渝化2号、渝化3号、森立15号。
1.1.2 培养基
CPDA综合培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂8.0~15.0 g,MgSO43.0 g,KH2PO40.5 g,蛋白胨5.0 g,水1 000 mL。
CPDA液体培养基:马铃薯200.0 g,葡萄糖20.0 g,MgSO43.0 g,KH2PO40.5 g,蛋白胨5.0 g,水1 000 mL。
栽培培养基配方:阔叶木屑78.0%,麦麸16.0%,蔗糖1.0%,石膏l.0%,石灰1.0%,豆饼粉1.5%,玉米粉1.5%,含水量(58±5)%。
1.1.3 主要仪器及设备
无菌洁净工作台(型号:SW-CJ-2D),苏州安泰空气技术有限公司;生化培养箱(型号:5PX-250B5H-Ⅱ),上海新苗医疗器械制造有限公司;高压蒸汽灭菌锅(型号:LDZX-50KBS),上海申安医疗器械厂;恒温培养振荡器(型号:ZHWY-B2112B),上海志城分析仪器制造有限公司;超低温冷冻冰箱(型号:MDF-U32V),日本三洋电器集团;精密电子天平(型号:BSA8201),北京赛多利科学仪器有限公司;水平电泳仪(型号:DYCZ-22A),北京六一厂;生物显微电脑图像分析系统(型号:GEL-RAD),上海志城分析仪器制造有限公司。
1.2 方法
1.2.1 分离方法
选择野生高温香菇XG-1,将香菇子实体去除菌柄,移入无菌操作台,用0.1% HgCl2溶液表面消毒30 s,75%乙醇擦拭,无菌水冲洗2~3次,用无菌滤纸吸干表面水分后正放在培养皿上,盖上玻璃钟罩,置于有漫射光照射、温度21~26 ℃条件下。1~2 d后收集孢子,无菌水稀释后制成100 mL的孢子悬浮液,4 ℃冰箱保存备用[9]。
1.2.2 紫外诱变
将保存于冰箱的孢子悬液适当稀释,吸取300 μL涂布于CPDA培养基,共涂布60个,每10个为1组。打开培养皿盖,放入已预热15 min的紫外灯下分别照射5、10、15、20、25、30 s(黑暗条件下操作),将平板置于28 ℃恒温培养箱中黑暗培养7~15 d,观察并记录再生情况。每组以长势较好的3个培养皿菌落数的平均值作为该组的菌落数,计算不同照射时间梯度下的致死率,多次重复试验,求平均值后绘制致死曲线。筛选出最佳照射时间后,在此基础上采用相同方法筛选最佳紫外强度(0、4、8、12、16、20 W)[10]。
致死率=(未经诱变处理菌落数-诱变处理后菌落数)/未经诱变处理菌落数×100%。
1.2.3 拮抗反应
采用拮抗反应方法检测诱变菌株,将亲本菌株与诱变菌株接种到CPDA培养基上,28 ℃培养10~15 d,观察拮抗反应。亲缘关系较近的菌株之间拮抗较弱或无拮抗现象,亲缘关系较远的菌株之间则有明显的拮抗现象[11]。
1.2.4 栽培试验
将武香1号、南山1号2个高温型代料香菇品种,与诱变获得的菌株及原始菌株进行品种比较试验。采用袋栽方式,每袋(规格:17 cm×33 cm的聚乙烯袋)装干料1.1 kg,常压灭菌,冷却后接种。试验采用随机区组设计,每1个品种为1个处理,每个处理10袋,设3次重复,观察记录不同品种菌丝生长及出菇产量情况。
以诱变育种中综合性状较好的诱变菌株为试验材料进行栽培试验,采用袋栽方式(方法同上)。试验采用随机区组设计,分别采用覆沙、斜靠、架式3种出菇方式。每个品种做3个处理,每个处理200袋,设3次重复。观察记录不同品种的子实体性状、产量及生物转化率,同时观察记录不同出菇方式的子实体性状、产量及生物转化率[12],分别对每一茬出菇的品种及出菇方式进行详细记录,最后进行汇总。
1.2.5 遗传稳定性试验
将出菇试验中综合性状优良的XG-5诱变株连续传代10次,观察其遗传稳定性。
1.2.6 生物学特性
观察XG-5诱变株的菌丝特征、子实体特征。以菌丝体每2 d的生长速度为衡量标准,利用单因素试验对其培养温度、pH进行筛选。在pH自然的条件下,设置22、24、26、28、30 ℃共5个温度梯度,筛选最佳培养温度;在最佳培养温度下,设置4.40、4.60、4.80、5.00、5.20、5.40、5.60、5.80、6.00、6.20、6.40、6.60共12个pH梯度,筛选最佳pH。
1.2.7 DNA分子指纹图谱鉴定
采用CTAB法提取菌丝体基因组总DNA,选用通用引物:ITS1 (5-TCCGTAGGTGAACCTGC-3),ITS4 (5’-TCCTCCGCTTATTGATATGC-3’)。PCR扩增程序:94 ℃ 5 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 1 min,33个循环;72 ℃ 10 min。反应结束后进行琼脂糖凝胶电泳检测,扩增出的16S rDNA基因片段送至生工生物工程(上海)股份有限公司测序,将测序结果提交至NCBI比对并获取登录号。选择同源性较高的21株真菌的16S rDNA序列,利用MEGA 5.0通过最大似然值法和进化距离阵法等进行近邻结合(Neigh-bor-Joining)聚类,1 000个重复作Bootstrap值分析构建系统发育树。
1.2.8 酯酶(EST)同工酶分析
将试验所用各菌株菌丝体1 g置于研钵中,加液氮充分研磨后,4 ℃ 30 000g离心20 min,上清液为酶液。采用垂直板聚丙烯酰胺凝胶电泳法[13],配制5%浓缩胶,10%分离胶,电极缓冲液为Tris-Glycine系统,pH值8.3。上样量:酶液6 μL,溴酚蓝指示剂2 μL,10%蔗糖5 μL。浓缩胶电压80 V,室温电泳45 min;分离胶电压120 V,4 ℃电泳4 h。取下凝胶,置于α、β-乙酸萘酯和坚牢蓝配制的染色液中,37 ℃轻微振荡,染色25 min。将出现红褐色酶带的凝胶置于7%醋酸溶液中脱色、保存,扫描照相。
2 结果与分析
2.1 诱变菌株的筛选
2.1.1 紫外诱变条件的选择

图1 XG-1紫外诱变效应曲线Fig.1 UV mutagenesis curve of XG-1
香菇孢子紫外诱变效应曲线及诱变致死率如图1所示。在紫外强度为8 W的基础上,随着紫外照射的延长,菌落数逐渐减少,诱变致死率越来越高。紫外诱变时间为25 s时,菌落数为5,诱变致死率83%;紫外诱变时间为30 s时,菌落数为0,诱变致死率为100%(图1-A)。紫外照射时间为25 s时,随着紫外强度的不断增强,菌落数逐渐减少,诱变致死率越来越高。紫外强度为12 W时,菌落数为9,诱变致死率为70%;紫外强度为16 W时,菌落数为5,诱变致死率为83%;紫外强度为20 W时,菌落数为0,诱变致死率达100%(图1-B)。因此,为了获得较高的正诱变率,本研究选择致死率为70%~83%,即诱变时间25~30 s,诱变强度12~16 W的照射剂量作为诱变条件。
2.1.2 耐高温诱变菌株的获得
拮抗反应试验结果表明,30株诱变菌株与亲本菌株中间的拮抗线较明显,分别为诱变菌株XG-2、XG-3、XG-4、XG-5、XG-6、XG-7、XG-8、XG-9、XG-10、XG-11、XG-12、XG-13、XG-14、XG-15、XG-16、XG-17、XG-18、XG-19、XG-20、XG-21、XG-22、XG-23、XG-24、XG-25、XG-26、XG-27、XG-28、XG-29、XG-30、XG-31,其中XG-3、XG-5、XG-14、XG-23、XG-29与亲本拮抗效果最明显,拮抗效果分别为较弱、明显、较弱、较弱、明显。
2.2 栽培试验
由表1可知,在品种比较试验中,XG-5菌株的菌丝生长速度最快,平均为0.313 cm·d-1。武香1号、南山1号及XG-5在30 ℃以上可以正常出菇,而且XG-5最高出菇温度可达38 ℃,XG-1出菇温度为15~29 ℃。其中,XG-5的转色期最早,南山1号、XG-5的出菇期最早。XG-5的产量最高,为0.975 kg·袋-1,生物转化率达88.64%,达到香菇新品种选育标准。
通过测定菌丝生长速度、菌龄、出菇温度等指标,从5个诱变菌种中筛选出可以在30 ℃以上正常出菇,且菇形好、产量高、抗逆性强的XG-5菌株,定名为金西1号。该菌株菌龄期60 d以上,培养温度降低菌龄延长,属高温型早熟品系。进一步分析了不同出菇方式对金西1号农艺性状及产量的影响,结果(表2)表明:性状上,覆沙栽培最好,其次是斜靠栽培,架式栽培最差;产量上,斜靠栽培最高,覆沙栽培其次,架式栽培最低。金西1号子实体单生、肉质厚,菌柄粗,平均每袋产量为0.975 kg;出菇温度范围更广,在38 ℃条件下,西乡县其他香菇品种已不能出菇,金西1号仍能正常出菇。因此,金西1号是夏季袋料香菇中表现较好的品种之一。
2.3 遗传稳定性
将栽培试验中综合性状表现优良的诱变菌株金西1号连续传代10次,然后38 ℃热激3 h。结果表明,不同代诱变菌株的耐高温能力并未发生大的变异,说明金西1号遗传特性较稳定(表3)。洁白,不易产生褐色色素(图2)。其中,金西
表1不同菌株菌丝生长及出菇产量比较
Table1Comparison of mycelium growth and fruiting yield of different bacterial strains

菌株Bacterialstrains菌丝生长速度Myceliagrowthrate/(cm·d-1)点种日期Sowingdate/(month⁃day)转色期Turncolordate/(month⁃day)出菇期Fruitingdate/(month⁃day)出菇温度Fruitingtemperature/℃产量Yield/(kg·bag-1)生物转化率Bioconver⁃sionrate/%武香1号029302⁃2005⁃0806⁃1315~3209178336南山1号026402⁃2005⁃0306⁃1014~3509558682XG⁃1021302⁃2005⁃0306⁃1515~2907807091XG⁃3022702⁃2005⁃0406⁃1514~2808297536XG⁃5031302⁃2005⁃0106⁃1012~3809758864XG⁃14027502⁃2005⁃0606⁃1415~2507837118XG⁃23021002⁃2005⁃0306⁃1113~2808247491XG⁃29024902⁃2005⁃0206⁃1514~2907767055
表2金西1号不同出菇方式的农艺性状及产量
Table2Agronomic traits and yield of Jinxi 1 under different fruiting ways
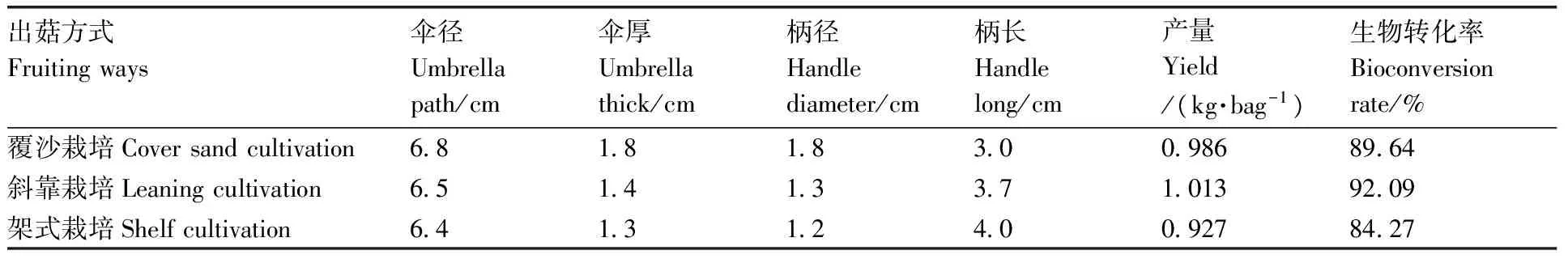
出菇方式Fruitingways伞径Umbrellapath/cm伞厚Umbrellathick/cm柄径Handlediameter/cm柄长Handlelong/cm产量Yield/(kg·bag-1)生物转化率Bioconversionrate/%覆沙栽培Coversandcultivation6818183009868964斜靠栽培Leaningcultivation6514133710139209架式栽培Shelfcultivation6413124009278427
表3XG-1与金西1号传代培养对比试验
Table3Comparison of subculture of XG-1 and Jinxi 1

菌株Strains菌丝平均生长速度Myceliagrowthrate/(cm·d-1)第7代7thgeneration第8代8thgeneration第9代9thgeneration第10代10thgenerationXG⁃10215020501850190金西1号0312031103230311
2.4 生物学特性
2.4.1 菌丝特征
原始菌株XG-1与诱变菌株金西1号菌丝均洁白,不易产生褐色色素(图2)。其中金西1号母种菌丝浓密、洁白、粗壮,并向四周延伸,气生菌丝旺盛,日生长量达4 mm。

A,金西1号;B,XG-1A, Jinxi 1; B, XG-1图2 原始菌株XG-1与诱变菌株金西1号的菌丝Fig.2 Mycelia of original strain XG-1 and mutant strain Jinxi 1
2.4.2 子实体特征
栽培试验表明:金西1号子实体单生,形态圆整;菌盖呈半球形,直径4~7 cm,表面颜色棕褐色;肉质厚1.3~2.0 cm,组织致密,菌柄较粗,平均长度3.5 cm。与原始菌株XG-1的子实体相比,金西1号菌盖表面无明显褶皱,较光滑,且肉质较厚,颜色更偏向于棕色(图3)。
2.4.3 不同温度、pH对金西1号菌株生长的影响
自然pH值条件下,金西1号生长的最适宜温度为26 ℃,菌丝体长度达0.450 cm(图4-A);在26 ℃培养条件下,最适宜pH为4.8,此时,菌丝体长度达0.428 cm(图4-B)。表明金西1号属高温型菌类,适宜在偏酸性环境中生长。

A,金西1号;B,XG-1;C,金西1号(覆沙栽培)A, Jinxi 1; B, XG-1; C, Jinxi 1(Cover sand cultivation)图3 原始菌株XG-1和诱变菌株金西1号的子实体Fig.3 Fruiting bodys of original strain XG-1 and mutant strain Jinxi 1

图4 温度(A)和pH(B)对金西1号菌丝体生长的影响Fig.4 Effects of different temperature (A) and pH (B) on the mycelium growth of Jinxi 1
2.4.4 香菇新品种的进化分析
利用Bankit在NCBI上获取金西1号的登录号为KF707519,构建金西1号菌株和部分栽培种的系统发育树。结果(图5)表明,金西1号、香菇808、香菇602、香菇290、森立8号、Chamsongi聚为一个分支,属于中低温型香菇;渝化3号、香菇18以及渝化2号聚为一个分支,属于普通型香菇;高温香菇、南山1号聚为一个分支,属于高温型香菇。其中金西1号与香菇602、香菇290、Chamsongi聚在同一分支,其遗传距离小,相似性大,说明其亲缘关系较近。金西1号与香菇808以及森立8号的遗传距离较大,相似性较小,说明其亲缘关系相对较远。
2.4.5 香菇不同菌株酯酶(EST)同工酶检测
通过聚丙烯酰胺凝胶电泳得到香菇15个不同菌株的酯酶(EST)同工酶谱(图6)。香菇不同菌株酯酶同工酶除共有的酶带和酶带颜色深浅存在差异外,还均具有特异性谱带;其中,编号3、4、6、8、13、14为高温菌株特征条带。对15个香菇菌株的酯酶同工酶谱进行分析还发现,金西1号、南山1号、香菇290、香菇931的酶带比较集中,而森立15号、香菇241-6、森立8号与其他菌株的酶带数量及颜色相差较大。15种香菇菌株的酯酶同工酶谱带数均比较稳定,表现出相似的遗传学基础,但又各不相同。因此,可作为香菇种以下单位或品种鉴定的依据。
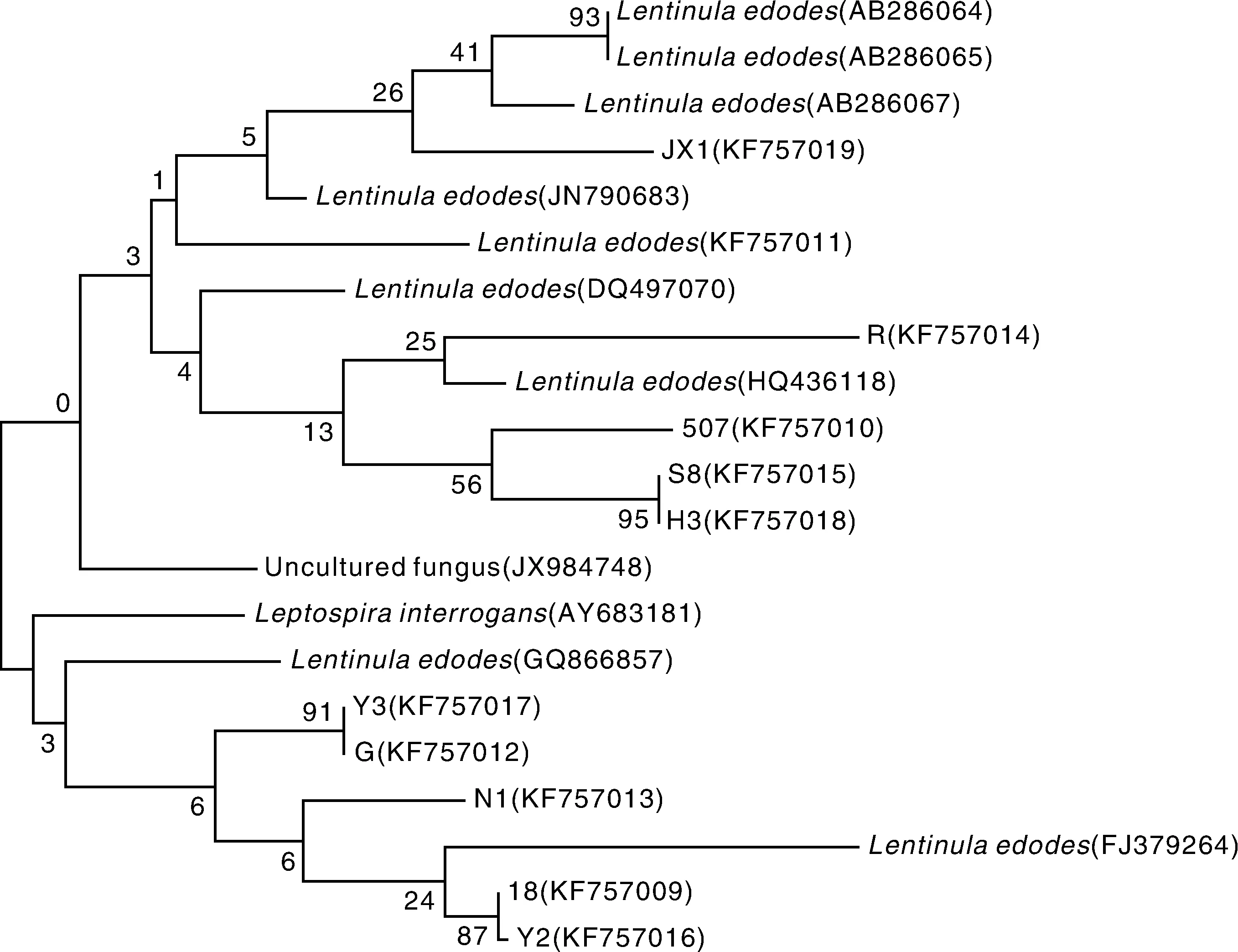
Lentinula edodes(AB286064),香菇290;Lentinula edodes(AB286065),香菇602;Lentinula edodes(AB286067),Chamsongi;Lentinula edodes(JN790683),森立8号;Lentinula edodes(KF757011),香菇808Lentinula edodes(AB286064), xianggu 290; Lentinula edodes(AB286065), xianggu 602; Lentinula edodes(AB286067), Chamsongi; Lentinula edodes (JN790683), senli 8; Lentinula edodes(KF757011), xianggu 808图5 金西1号菌和部分栽培种的系统发育树Fig.5 Phylogenetic tree of Jinxi 1 and some cultivars
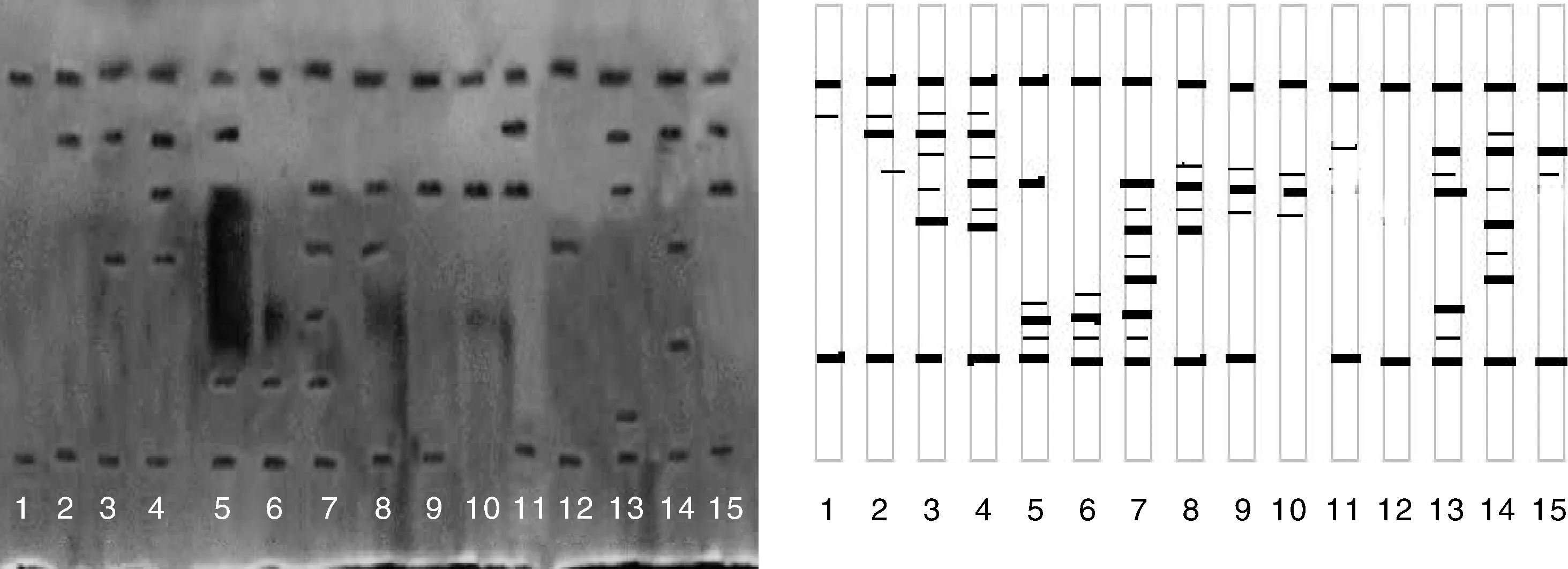
1,森立15号;2,香菇602,3,金西1号;4,南山1号;5,韩8;6,高温香菇;7,香菇290;8,台香8号;9,香菇9608;10,沪农1号;11,香菇241-6;12,森立8号;13,武香1号;14,香菇931;15,Chamsongi1, Senli 15; 2, Xianggu 602; 3, Jinxi 1; 4, Nanshan 1; 5, Han 8; 6, Gaowenxianggu; 7, Xianggu 290; 8, Taixiang 8; 9, Xianggu 9608; 10, Hunong 1; 11, Xianggu 241-6; 12, Senli 8; 13, Wuxiang 1; 14, Xianggu 931; 15,Chamsongi图6 十五种香菇菌株酯酶同工酶电泳谱图Fig.6 Electrophoresis profiles of lipase isoenzymes from 15 different strains of Lentinus edodes
3 讨论
食用菌的育种方法中,与杂交育种、原生质体融合育种、基因工程育种相比,紫外诱变育种操作更加简单,便于新品种的技术推广。本研究利用紫外诱变育种技术筛选出最高出菇温度可达38 ℃的耐高温香菇新品种——金西1号,其营养菌丝体生长温度为5~35 ℃,最适24~28 ℃;子实体形成温度为12~38 ℃,最适为18~28 ℃;子实体生长最适温度26 ℃,pH范围4.4~6.6,最适pH为4.80。金西1号在NCBI中的登录号为KF707519,系统发育树分析表明,金西1号与香菇290、香菇602、Chamsongi亲缘关系较近。酯酶同工酶谱分析发现,金西1号、南山1号、香菇290、香菇931的酶带比较集中,进一步确定了它们是相近种。栽培试验表明,金西1号具有耐高温,产量高,遗传性状稳定,生物学转化效率高,子实体品质好等优点,可作为优势菌种进行市场推广。
[1] 尉文龙, 崔德芳, 杜复. 北方段木栽香菇应注意的问题[J]. 食用菌, 1998 (2): 5.
WEI W L, CUI D F, DU F. Northern section of wood plantingLentinulaedodeswhich should pay attention to the problem[J].EdibleFungus, 1998 (2): 5. (in Chinese)
[2] 徐年声. 香菇不同菌株高温适应性研究[C]//中国菌物学会, 菌物学报编辑部. 第八届全国食用菌学术研讨会暨新产品新技术交流会论文汇编. 2008: 213-216.
[3] 付立忠, 吴学谦, 魏海龙, 等. 我国食用菌育种技术应用研究现状与展望[J]. 食用菌学报, 2005, 12(3): 63-68.
FU L Z, WU X Q,WEI H L, et al. Present situation and prospect of applied research on edible fungi breeding technology in China[J].ActaEdulisFungi, 2005, 12(3): 63-68. (in Chinese)
[4] 况丹, 叶亚建, 王飞. 杏鲍菇高产菌株的紫外线诱变选育[J]. 安徽农业科学, 2010, 38(16): 8404-8405.
KUANG D,YE Y J,WANG F. Breeding by UV mutation of high yieldPleurotuseryngiistrains[J].JournalofAnhuiAgriculturalScience, 2010, 38(16): 8404-8405. (in Chinese with English abstract)
[5] 王连会, 茅文俊, 鲍大鹏. 香菇尿嘧啶营养缺陷型菌株的筛选与分子验证[J]. 上海农业学报, 2014 (3): 6-9.
WANG L H, MAO W J, BAO D P. Selected and molecular verification for uracil auxotrophic mutants ofLentinulaedodes[J].ActaAgriculturaeShanghai, 2014 (3): 6-9. (in Chinese with English abstract)
[6] 陆佩丽, 李慧, 钱秀萍. 松口蘑Tm-3菌株的紫外诱变育种[J]. 中国食用菌, 2004, 23(6): 9-11.
LU P L, LI H, QIAN X P. Breeding on the strain ofTricholomamatsutakeTm-3 with UV-irradiation[J].EdibleFungiofChina, 2004, 23(6): 9-11. (in Chinese with English abstract)
[7] 陈剑山, 郑服丛. ITS序列分析在真菌分类鉴定中的应用[J]. 安徽农业科学, 2007, 35(13): 3785-3786.
CHEN J S, ZHENG F C. Application of ITS sequences in fungi classification and identification[J].JournalofAnhuiAgriculturalScience, 2007, 35(13): 3785-3786. (in Chinese with English abstract)
[8] PALAPALA V A, AIMI T, INATOMI S, et al. ITS-PCR-RFLP method for distinguishing commercial cultivars of the edible mushroom,Flammulinavelutipes[J].JournalofFoodScience, 2002, 67(7): 2486-2490.
[9] 占琦, 霍光华, 王飞, 等. 一种获得大型真菌纯培养的有效方法——改良孢子弹射法[J]. 食用菌, 2010, 32(1): 29-30.
ZAN Q, HUO G H, WANG F, et al. An effective method for obtaining pure cultivate of large fungi: Spore ejection method[J].EdibleFungus, 2010, 32(1): 29-30. (in Chinese)
[10] 王丽宁, 赵妍, 张宝粉, 等. 利用原生质体紫外诱变技术选育耐高温香菇菌株[J]. 微生物学通报, 2014, 41(7):
1350-1357.
WANG L N, ZHAO Y, ZHANG B F, et al. Breeding thermo-tolerant strains ofLentinulaedodesby UV induced protoplast mutagenesis[J].MicrobiologyChina, 2014, 41(7): 1350-1357. (in Chinese with English abstract)
[11] 王玉玲. 几种香菇、金针菇菌丝体的氨基酸组成及相互之间的拮抗现象[J]. 河南师范大学学报(自然科学版), 1999, 27(3):106-108.
WANG Y L. The amino acid composition of severalLentinulaedodesandFlammulinamycelia with the antagonism between them[J].JournalofHenanNormalUniversity(NaturalScienceEdition), 1999, 27(3): 106-108. (in Chinese)
[12] 梁枝荣, 安沫平, 通占元. 香菇原生质体分离诱变育种研究[J]. 微生物学通报, 2001, 28(2): 38-41.
LIANG Z R, AN M P, TONG Z Y. The breeding study by UV-inducing protoplasts ofLentinusedodes[J].MicrobiologyChina, 2001, 28(2): 38-41. (in Chinese with English abstract)
[13] 郑素月, 张海花. 同工酶技术及其在食用菌种质资源研究中的应用与进展[J]. 邯郸农业高等专科学校学报, 2004, 21(3): 16-18.
ZHENG S Y, ZHANG H H. Research advances of isozyme and applications in mushroom germplasm[J].JournalofHandanAgriculturalCollege, 2004, 21(3): 16-18. (in Chinese with English abstract)
Breedingthermo-tolerantstrainsofLentinulaedodesbyUVmutation
WU Xiaoyu1, DENG Baiwan1,2,*, CHEN Wenqiang1,2, XIE Xiuchao1,2
(1.SchoolofBiologicalScienceandEngineering,ShaanxiSci-TechUniversity,Hanzhong723000,China; 2.ShaanxiEngineeringResearchCenterofEdibleandMedicinalFungi,Hanzhong723000,China)
In order to breed new varieties ofLentinusedodeswhich can bear high temperature by UV mutation, a wild high temperature resistantL.edodessample XG-1 was used as the starting strain. New varieties of high temperature resistantL.edodeswere screened by different UV irradiation time and intensity, and the cultivated strains with better comprehensive characters were cultivated. Mutant XG-5, known as Jinxi 1 was screened when the mutation time was 25~30 s and mutation intensity was 12~16 W; Its fruited temperature was up to 38 ℃, so it belonged to high temperature resistant varieties. In leaning cultivation mode, the field of Jinxi 1 could reach 1.013 kg per bag (polyethylene bag size 17 cm × 33 cm), and the biotransformation rate reached 92.09%.
high temperatureLentinulaedodes; UV mutagenesis; mutagenesis time; induced temperature; bioconversion rate
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(12): 2015-2022
http://www.zjnyxb.cn
武晓雨, 邓百万, 陈文强, 等. 紫外诱变选育耐高温香菇新品种[J]. 浙江农业学报, 2017, 29(12): 2015-2022.
10.3969/j.issn.1004-1524.2017.12.09
2017-06-05
陕西省教育厅科研计划项目(13JS021)
武晓雨(1991—),男,河北张家口人,硕士研究生,研究方向为微生物资源保育及开发利用。E-mail: 793063822@qq.com
*通信作者,邓百万,E-mail: 2210309868@qq.com
S646.1+2
A
1004-1524(2017)12-2015-08
(责任编辑侯春晓)

