大红菇水不溶性多糖硫酸酯的制备及抗氧化性研究
王白娟,杨青松,陈 婷,秦向东, 3,唐卿雁,肖 尧,杨云宇,赵 艳*
(1.云南农业大学理学院,云南 昆明 650201; 2.云南民族大学 民族医药学院,云南 昆明 650500;3.云南省高校生物天然气产业化技术工程研究中心,云南 昆明 650201;4.云南农业大学食品科学技术学院,云南 昆明 650201)
大红菇水不溶性多糖硫酸酯的制备及抗氧化性研究
王白娟1,杨青松2,陈 婷1,秦向东1, 3,唐卿雁4,肖 尧1,杨云宇1,赵 艳1*
(1.云南农业大学理学院,云南 昆明 650201; 2.云南民族大学 民族医药学院,云南 昆明 650500;3.云南省高校生物天然气产业化技术工程研究中心,云南 昆明 650201;4.云南农业大学食品科学技术学院,云南 昆明 650201)
【目的】大红菇(RussulaalutaceaFr.)子实体中含有大量碱溶性的多糖,由于具有难溶于水的特性而限制开发,可以借助化学改性的方法,通过提高其水溶性来促进生物活性,并使应用范围得到大幅度拓宽。【方法】本研究提取水溶性多糖后,用碱提法提出水不溶性多糖,并对其采用硫酸法进行修饰,改善其水溶性。【结果】分析并比较水溶性多糖、水不溶性多糖、硫酸酯多糖和维生素c对羟基自由基、DPPH自由基、超氧阴离子的清除能力。结果表明:水溶性多糖的得率为1.447 %、水不溶性多糖的得率为1.346 %;硫酸基质量分数为14.95 %,取代度(DS)为0.763 %。【结论】根据其EC50值表明,对羟基自由基的清除能力:硫酸酯多糖>维生素c >水不溶性多糖>水溶性多糖;对超氧阴离子的清除能力:维生素c > 硫酸酯多糖>水溶性多糖>水不溶性多糖;对DPPH的清除能力为:维生素c >硫酸酯多糖>水溶性多糖>水不溶性多糖。
大红菇;水不溶性多糖;硫酸酯;羟基自由基;DPPH;超阴离子
【研究意义】大红菇(RussulaalutaceaFr.)是一类外生菌根菌,常与林木共生,其在真菌分类系统中,隶属于担子菌纲(Basidiomycetes),红菇科(Russulaceae),红菇属(Russula)[1-2]。大红菇具有重要的经济价值,它不仅可食用还可以药用,其营养丰富,味道鲜美可口,药用方面具有补血、滋阴、清凉、解毒的功效,同时可以降低胆固醇、保肝护肝和抗癌等效果[3]。作为传统药食两用的食用菌,通过分子修饰的方法对其进行改性,能够得到红菇多糖的衍生物,不仅类型丰富,而且为全面理解多糖构效关系积累了基础资料。【前人研究进展】食用菌多糖由于其特有的生物学活性,受到了广泛的重视和关注。目前多糖的提取工艺较成熟,常用方法有溶剂提取法、生物酶解提取法、物理强化提取法等[4]。其中溶剂提取法较为常用,包括水提法、碱提法、酸提法等。但在碱溶液的提取过程中,从子实体、菌丝体中提取得到的大量多糖,因其水不溶性的特点,会影响后续的开发及应用。【本研究切入点】为了增加红菇多糖的水溶性,通过化学修饰的方法提高其生物活性,并大幅度地拓宽其应用范围。经过修饰后得到的硫酸酯多糖,含有硫酸基团,因此硫酸酯多糖是一类天然的多糖衍生物,或者是半合成的多糖衍生物[5],目前一些含有硫酸基团的天然动物和植物多糖具有抗病毒[6-7]、抗凝血[8-9]、抗肿瘤[10-13]、抗氧化[13-16]、增强机体免疫[17-18]等活性,经过分子修饰后的硫酸酯多糖,已成为多糖的研究热点。【拟解决的关键问题】利用分子修饰的方法,通过改变其原来的理化性质及生物学功能,进一步揭示红菇多糖的构效关系,还可以为研发具有高活性红菇多糖的产品提供理论指导,并促进红菇多糖的理论研究,拓宽其产业化应用范围,并为丰富多糖构效关系提供理论参考。
1 材料与方法
1.1 材料
试验样品大红菇购自云南省普洱市景谷县。
试验试剂活性炭、氢氧化钠、水杨酸、浓硫酸、硫酸钠、抗坏血酸氯化钡、硫酸亚铁、明胶、双氧水、盐酸、石油醚、氯仿、冰醋酸、正丁醇、苯酚、无水乙醇、三氯乙酸、三羟甲基氨基甲烷(Tris)、邻苯三酚、Tris-HCl缓冲液、DPPH,均为分析纯),购自天津市风船化学试剂科技有限公司。电子天平,购自北京赛多利斯天平有限公司;722N型光栅可见分光光度计,购自上海菁华科技仪器有限公司;摇床,购自上海世平实验设备有限公司;数显恒温水浴锅(DRHH-S4型),购自上海双捷实验设备有限公司。
1.2 方法
1.2.1 预处理 烘干至恒重的大红菇子实体粉碎过50目筛,精密称取大红菇10 g于三角瓶中,加入100 mL石油醚,密封,置于摇床中脱脂48 h,抽滤烘干,平行试验5组。
1.2.2 大红菇水溶性多糖样品的制备 经预处理后的大红菇样品置于圆底烧瓶中,按料液比为1∶20、温度为80 ℃、提取时间2 h加水提取,重复提取3次,离心取上清,滤渣备用。向上清液中加入3倍无水乙醇,放入冰箱中(4 ℃)静置12 h,取出离心,弃去上清液,晾干得到水溶性粗多糖RA1。RA1溶解于蒸馏水中,加入1 %(w/v)的活性炭,75 ℃下恒温振荡2.5 h,离心弃沉淀。经脱色后的上清液中加入5倍Sevage液(氯仿∶正丁醇=5∶1),振荡20~30 min,离心取上层清液,再向其中加入1倍无水乙醇,冰箱中(4 ℃)静置4 h,10 000 r/min离心取沉淀烘干得大红菇水溶性精多糖样品RA2。
1.2.3 大红菇水不溶性多糖样品的制备 滤渣置于圆底烧瓶中,料液比(m滤渣∶V5 %氢氧化钠=1∶20)为1∶20、温度为40 ℃、提取时间2 h。重复提取3次,离心弃沉淀。上清液中经冰醋酸中和,离心弃上清液,晾干得到水不溶性粗多糖RA3。RA3溶解于3 %氢氧化钠中,加入1 %(w/v)的活性炭,75 ℃下恒温振荡2.5 h,离心弃沉淀。经脱色后的上清液中加入5倍Sevage液(氯仿∶正丁醇=5∶1),振荡20~30 min,离心取上层清液,再向其中加入1倍无水乙醇,冰箱中静置(4 ℃)12 h,10 000 r/min离心取沉淀烘干得大红菇水不溶性精多糖样品RA4。
1.2.4 多糖含量测定[19]多糖含量的测定采用苯酚-硫酸法测定[19]。称取大红菇多糖,并准确配制成一定浓度的溶液,各试管中加入新配制的5 %苯酚溶液1.0 mL和浓硫酸溶液5.0 mL,迅速把溶液摇匀,把混匀溶液放入沸水浴,30 min后取出,立刻置于冰水中,冷却至室温,在波长490 nm处测吸光度。同时用葡萄糖作为标准品,绘制葡萄糖标准曲线后可以得到,水溶性多糖回归方程为y=7.6468x(R2=0.9997,图1),水不溶性多糖回归方程为y=7.9307x+0.0088 (R2=0.9998,图2),2组曲线在浓度0.04~0.2 mg/mL内,线性关系良好。
1.2.5 多糖提取率的测定 精确称取RA3 0.05 g、RA4 0.05 g于100 mL容量瓶中,RA3用去离子水、RA4 用3 %的氢氧化钠定容至刻度。精确吸取1.0 mL于试管中,再分别加入1.0 mL 5 %苯酚、5.0 mL浓硫酸溶液,摇匀试管中的溶液,30 min沸水浴后,立刻将试管取出,冰水浴中迅速冷却至室温。在波长490 nm处测定其吸光值A。根据葡糖糖标准曲线计算大红菇多糖的浓度c(以葡萄糖浓度计算)和提取率:
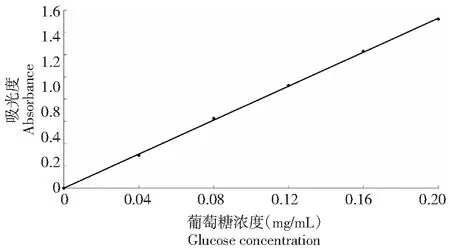
图1 水溶性多糖含量测定Fig.1 The determination of water-soluble polysaccharide

图2 水不溶性多糖含量测定Fig.2 The determination of water-insoluble polysaccharide
提取率(%)=(C×V×m1/ 0.05)/m
式中,C:提取液中大红菇多糖的质量浓度(mg/mL);V:定容体积(mL);m1:提取多糖的重量(mg);m:样品重量(mg)。
1.2.6 大红菇硫酸酯多糖的制备[20]量取浓硫酸7.5 mL,正丁醇2.5 mL,置于带干燥管及搅拌装置的三颈瓶中,把浓硫酸0.125 g缓慢加入,通过温和搅拌的方法,使用冰浴让其冷却到0 ℃,并把水不溶性多糖粉末0.5 g缓慢加入到瓶中,于0 ℃下反应30 min。反应经中和、离心后,用蒸馏水透析48 h,加入乙醇,静置后离心,收集沉淀物,该沉淀物为制备得到的大红菇硫酸酯多糖。
1.2.7 大红菇硫酸酯多糖的结构表征 硫酸基标准曲线的建立。硫酸基的测定采用明胶-比浊法[21]。精确吸取0、0.04、0.08、0.12、0.16、0.20 mL标准硫酸钠溶液于试管以盐酸溶液补至0.2 mL,空白对照用0.2 mL 盐酸溶液,再缓慢地加入3.8 mL三氯乙酸及1.0 mL明胶-氯化钡溶液,把溶液混合摇匀,室温下静置15 min后,于360 nm波长下测吸收度A1;氯化钡-明胶溶液用1.0 mL明胶溶液代替,同法进行吸光度A2的测定;横坐标为硫酸基毫克数,吸光度(A1-A2)为纵坐标,得图3。
硫酸基含量测定。取0.1 g大红菇硫酸酯多糖溶解于水定容至100 mL,按照硫酸基标准曲线的测定方法,在波长360 nm处,测定吸光度值,并对照硫酸基标准曲线,计算大红菇硫酸酯多糖的硫酸基含量。
取代度公式:DS=(1.62×S)/(32-1.02×S)
1.2.8 红外光谱分析 采用溴化钾压片的方法,称取1 mg的干燥样品,加入150 mg溴化钾,充分混合后研磨压片,并在4000~400 cm-1内进行扫描测定。
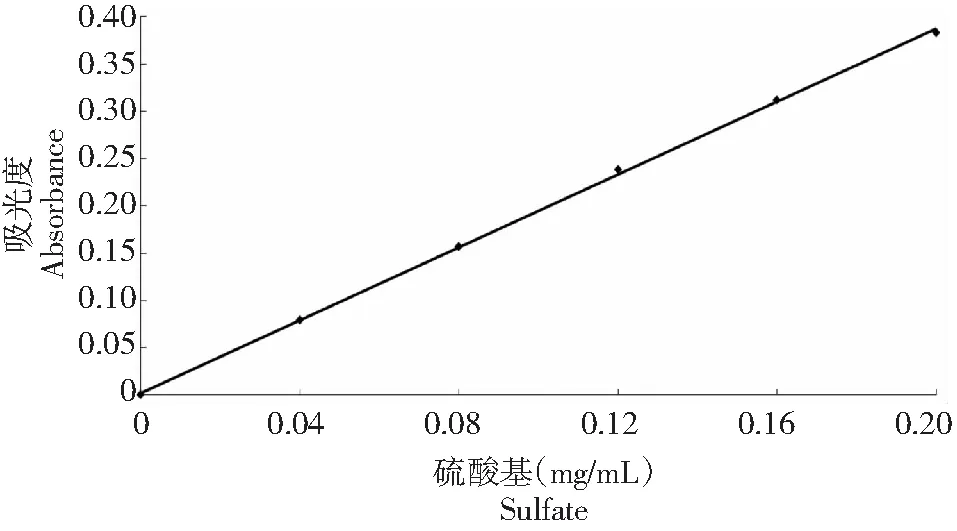
图3 测定硫酸基标准曲线Fig.3 Standard curve of determination sulfate group
1.2.9 抗氧化性测定[22]羟基自由基的测定。向试管中加入1.00 mL蒸馏水,1.8×10-4mol/L FeSO4溶液2.00 mL,水杨酸-乙醇1.50 mL,最后加0.03 % H2O20.10 mL启动反应,振荡混合, 在波长510 nm处测定其吸光度值,即为A0。
清除羟基自由基作用。向试管中加入一系列不同浓度多糖或抗坏血酸溶液1.00 mL, 7.5×10-3mol/L FeSO4溶液2.00 mL, 1.8×10-4mol/L水杨酸-乙醇1.50 mL, 最后加H2O2( 0.03 % ) 0.10 mL启动反应, 振荡混合, 水浴37 ℃, 保温30 min, 在波长510 nm下测量各自的吸光度值,即为AS。自由基清除率计算公式为:
D=(A0-AS)/A0×100 %
超氧阴离子的清除作用。准确量取0.05 mol/L Tris-HCl缓冲液(pH 8.2)5 mL,放在在25 ℃水浴中,20 min预热后,分别往试管中加入不同浓度的多糖溶液4 mL,于25 ℃水浴中20 min,再加入25 ℃水浴中预热20 min的3 mmol/L邻苯三酚溶液1 mL,混匀溶液后,置于25 ℃水浴中,反应5 min后,加入10 mol/L 盐酸溶液 1 mL来终止反应,于波长320 nm处测定吸光度,用相同体积的蒸馏水代替样品作为空白对照。超氧阴离子自由基清除率计算公式为:
E=(A空白-A样品)/A空白
A样品用相同样品浓度的空白调零,消除样品颜色的影响。
DPPH自由基的清除作用。准确吸取待测2.0 mL溶液,接着加入0.2 mmol/L DPPH溶液2.0 mL,溶液充分混匀,放置30 min后。用无水乙醇作为调零溶液,在波长517 nm处,测定吸光值A样品。同时,把待测样品溶液2.0 mL和无水乙醇2.0 mL充分混合,在波长517 nm处,测定混合液的吸光度A对照,然后把DPPH溶液2.0 mL和无水乙醇2.0 mL充分混合,在波长517 nm处,测定混合液的吸光值A空白。
清除率( %)=[1-(A样品-A对照)/A空白]×100
2 结果与分析
2.1 多糖得率
准确吸取样品液,在波长490 nm处,测定样品液的吸光度,代入葡萄糖标准曲线的回归方程,计算得到样品多糖的含量。大红菇水溶性多糖的得率为1.447 %、水不溶性多糖的得率为1.346 %。
2.2 大红菇硫酸酯多糖的制备及其结构表征
2.2.1 硫酸基含量的测定 利用浓硫酸法修饰大红菇多糖,制备得大红菇硫酸酯多糖,硫酸基的含量通过明胶比浊法进行测定,通过测定结果可知大红菇硫酸酯多糖的硫酸基质量分数为14.95 %,取代度(DS)为0.763 %。
2.2.2 红外光谱分析 硫酸酯多糖在1240 cm-1处有S=O伸缩振动,815 cm-1处有C-O-S的拉伸振动。以上结果表明多糖已经形成了硫酸酯。
2.3 抗氧化活性测定
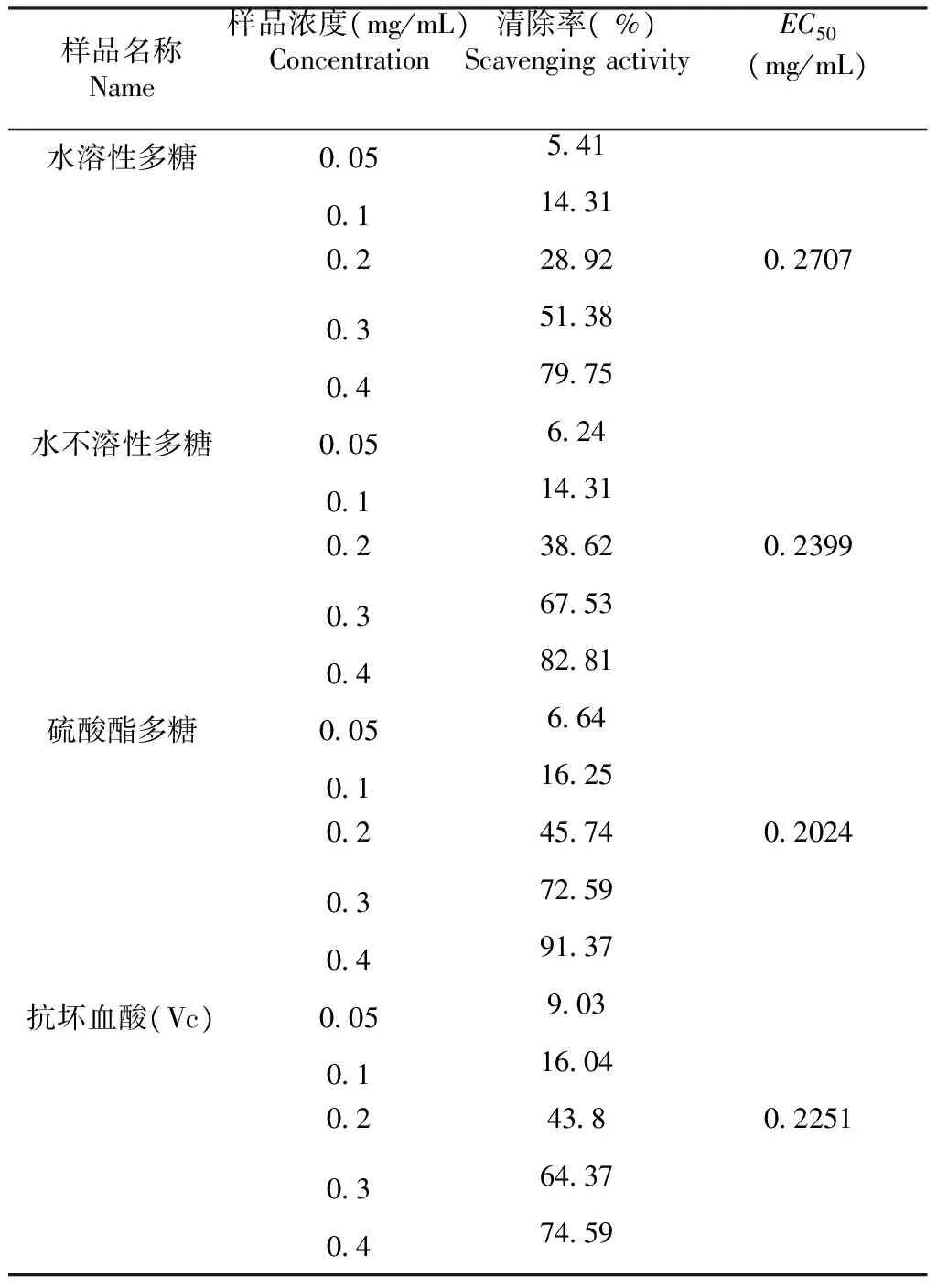
2.3.1 清除羟基自由基(·OH) 活性的测定 维生素c 为已知的一种强抗氧化剂。由表1可以看出,水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖、维生素c对·OH有较强的清除作用,在质量浓度0.05~0.40 mg/mL,可以看出样品质量浓度增加,羟基自由基的清除率增加。水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖、维生素c的最高清除率分别为79.75 %、82.81 %、91.37 %、74.59 %;在质量浓度0.05~0.10 mg/mL,水溶性多糖与水不溶性多糖对·OH 的清除能力没有显著性差异,清除率低于15 %;质量浓度为0.4 mg/mL时,水溶性多糖、水不溶性多糖与大红菇硫酸酯多糖均高于抗坏血酸;大红菇硫酸酯多糖与水不溶性多糖相比较,清除·OH的能力远高于水不溶性多糖。根据EC50的值可以看出,清除·OH的能力为大红菇硫酸酯多糖>维生素c>水不溶性多糖>水溶性多糖;硫酸酯化以后,水不溶性多糖活性增强。
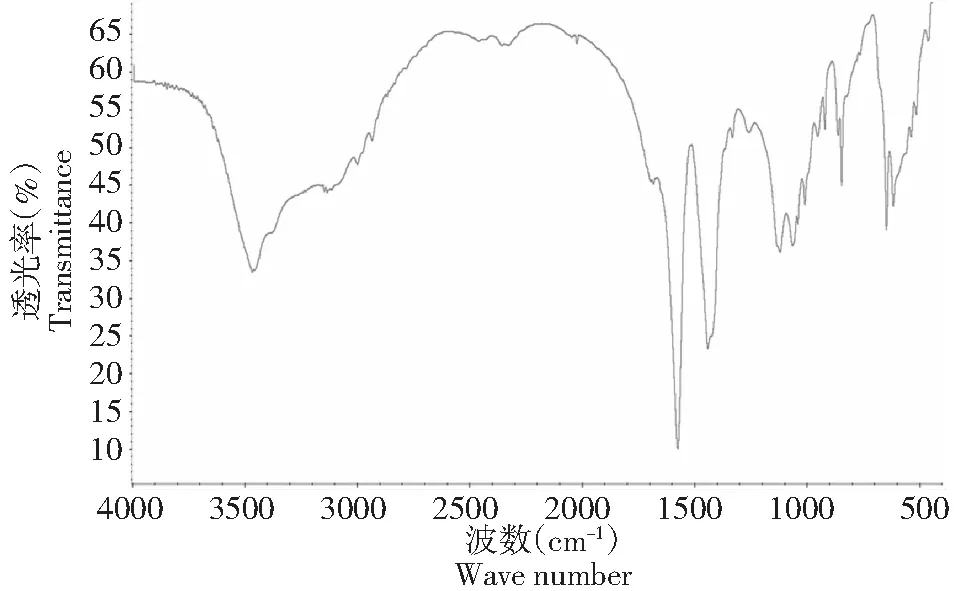
图4 水不溶性多糖红外图谱Fig.4 Infrared spectrum of water-insoluble polysaccharide
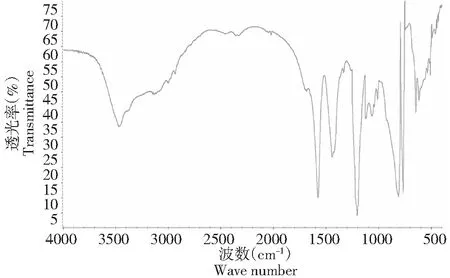
图5 硫酸酯多糖红外图谱Fig.5 Infrared spectrum of water-insoluble polysaccharide
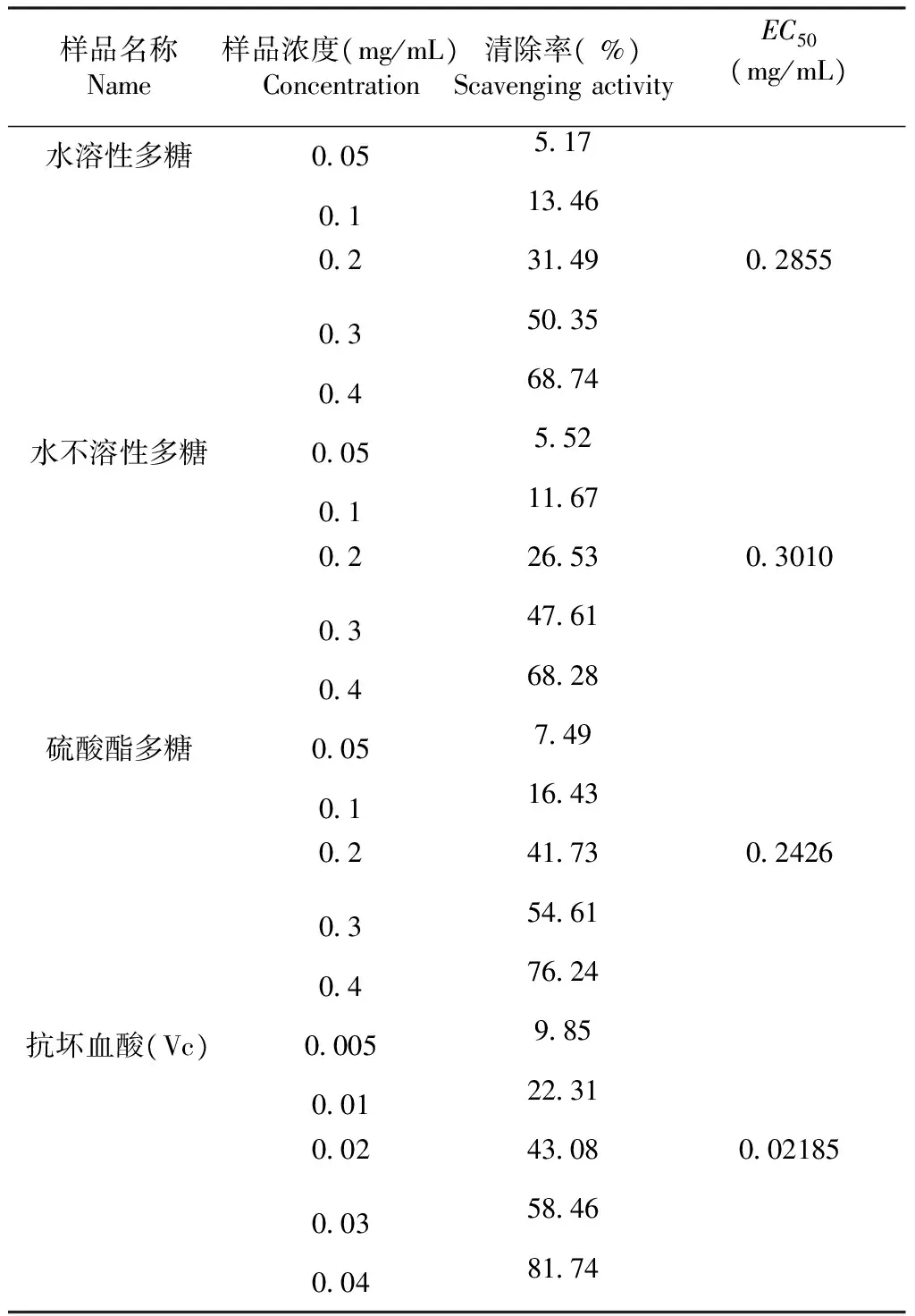
2.3.2 超氧阴离子的清除作用 由表2可以看出,水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖、维生素c对超氧阴离子有较强的清除作用,在质量浓度0.05~0.40 mg/mL,当样品的质量浓度增加,超氧阴离子的清除率增强。水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖、维生素c的最高清除率分别为68.74 %、68.28 %、76.24 %、81.74 %;在质量浓度0.05~0.10 mg/mL,水溶性多糖与水不溶性多糖对超氧阴离子的清除能力没有显著性差异,清除率低于15 %;在各个质量浓度时,大红菇硫酸酯多糖、水溶性多糖、水不溶性多糖对超氧阴离子的清除效果均低于维生素c;大红菇硫酸酯多糖与水不溶性多糖相比较,清除超氧阴离子的能力远高于水不溶性多糖。根据EC50的值可以看出,清除超氧阴离子的能力为维生素c > 大红菇硫酸酯多糖>水溶性多糖>水不溶性多糖;硫酸酯化以后,水不溶性多糖活性增强。
表1大红菇多糖对·OH清除作用
Table 1 The scavenging effect ofRussulaalutaceaFr. glycan on hydroxyl free radicals
样品名称Name样品浓度(mg/mL)Concentration清除率(%)ScavengingactivityEC50(mg/mL)水溶性多糖00554101143102289202707035138047975 水不溶性多糖00562401143102386202399036753048281 硫酸酯多糖00566401162502457402024037259049137 抗坏血酸(Vc)0059030116040243802251036437047459
表2大红菇多糖对超氧阴离子清除作用
Table 2 The scavenging effect ofRussulaalutaceaFr. glycan on superoxide anion
样品名称Name样品浓度(mg/mL)Concentration清除率(%)ScavengingactivityEC50(mg/mL)水溶性多糖00551701134602314902855035035046874 水不溶性多糖00555201116702265303010034761046828 硫酸酯多糖00574901164302417302426035461047624 抗坏血酸(Vc)00059850012231002430800218500358460048174
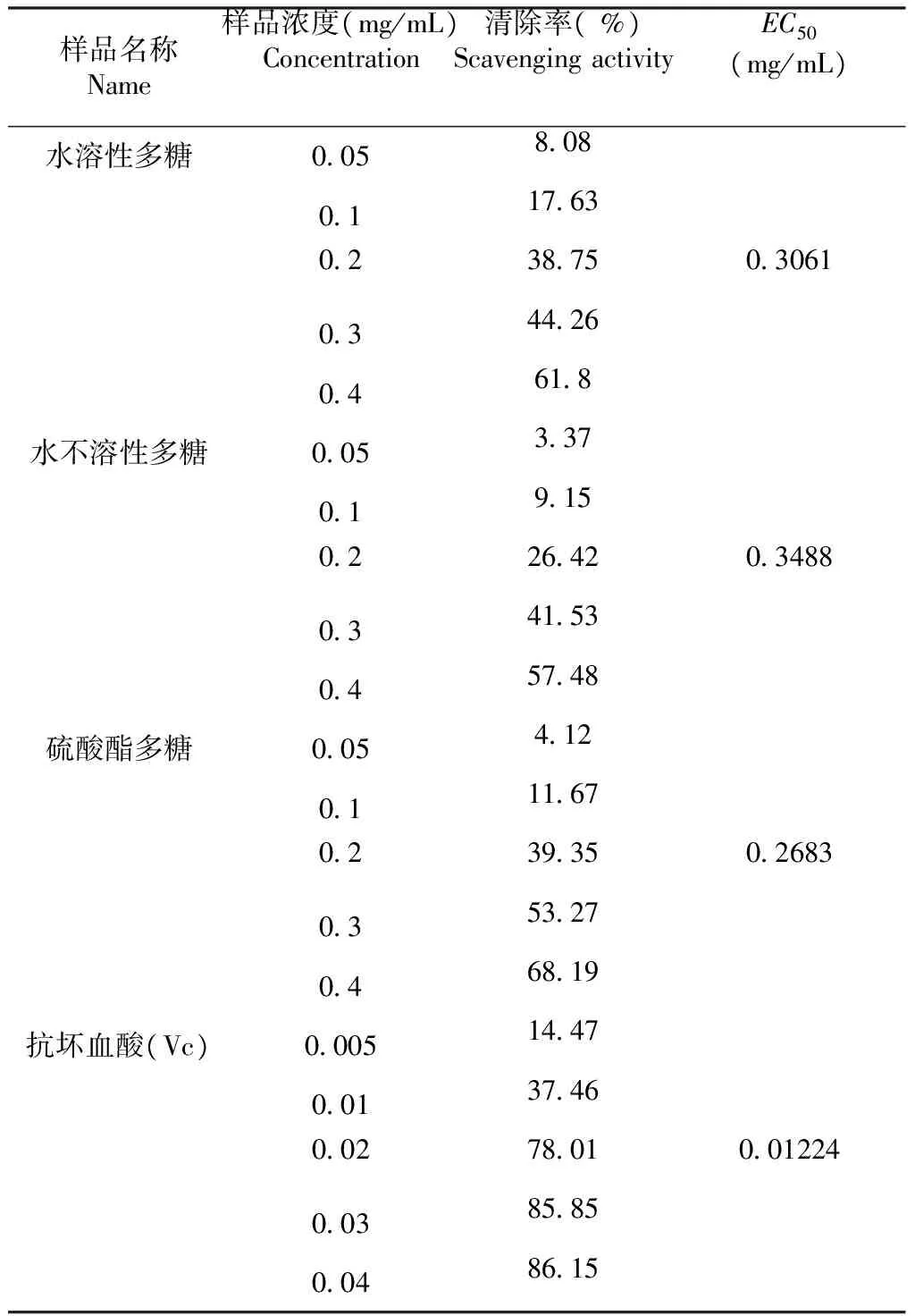
2.3.3 DPPH的清除作用 由表3可知,水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖、维生素c对DPPH有较强的清除作用;在质量浓度0.05~0.40 mg/mL,随着样品的质量浓度的增加,DPPH清除率明显上升。水溶性多糖、水不溶性多糖、大红菇硫酸酯多糖的最高清除率分别为61.8 %、57.48 %、68.19 %、74.59 %;维生素c在质量浓度0.005~0.040 mg/mL随着质量浓度的增加而变化,最高清除率为86.15;大红菇硫酸酯多糖与水不溶性多糖相比较,清除DPPH的能力高于水不溶性多糖。根据EC50的值可以看出,清除DPPH的能力为维生素c >大红菇硫酸酯多糖>水溶性多糖>水不溶性多糖;硫酸酯化以后,水不溶性多糖活性增强。
表3大红菇多糖对DPPH清除作用
Table 3 The scavenging effect ofRussulaalutaceaFr. glycan on DPPH free radicals
样品名称Name样品浓度(mg/mL)Concentration清除率(%)ScavengingactivityEC50(mg/mL)水溶性多糖0058080117630238750306103442604618 水不溶性多糖0053370191502264203488034153045748 硫酸酯多糖00541201116702393502683035327046819 抗坏血酸(Vc)000514470013746002780100122400385850048615
3 讨 论
硫酸酯化技术在多糖的抗氧化活性的研究中是重要的方法之一,由李国荣等[23]发表的研究硫酸酯化修饰对鸡腿菇多糖抗氧化活性的影响,为天然抗氧化剂的开发利用提供理论依据。采用氯磺酸-吡啶法,制备硫酸酯化多糖;以取代度为指标,采用单因素试验对制备硫酸酯化的酯化条件进行优化;采用邻苯三酚自氧化法和邻二氮菲-金属铁离子-H2O2体系,研究 硫酸酯化的体外抗氧化活性。最佳酯化条件为:酯化试剂体积比[V(氯磺酸)∶V(吡啶)= 1∶3],反应温度90 ℃,反应时间2 h。 硫酸酯化后的大红菇多糖对羟自由基清除率和超氧阴离子自由基清除率均有明显提高。与鸡腿菇多糖相比,硫酸酯化多糖清除羟自由基的能力显著提高,但清除超氧阴离子自由基的能力有所下降。硫酸酯化的鸡腿菇多糖(SWPC)对羟自由基和超氧阴离子自由基均具有一定的清除能力,但对不同基团的敏感性差异明显[23]。由此,多糖及其衍生物在抗氧化能力上的表现,与糖的种类密切相关,同时受取代位点和硫酸酯化多糖的立体结构影响,具体的机理有待进一步研究。姚秋萍等[24]研究中,对硫酸酯化修饰的油菜花粉多糖的抗氧化活性进行了研究,采用浓硫酸法分别在 0和 10 ℃条件下对油菜花粉多糖(RPP)进行硫酸酯化修饰,测定了其清除羟基自由基、超氧阴离子自由基和 DPPH自由基的能力,并进行了比较和分析。研究结果表明酯化后得到了取代度分别为 0.89 和 1.36 的 2 个改性产物(S-RPP 1 和 S-RPP 2 ),同时发现RPP,S-RPP 1 和 S-RPP 2 表现出不同程度的抗氧化活性。清除自由基能力大小顺序为 S-RPP 1 >S-RPP 2 >RPP,研究结果表明硫酸化修饰能提高油菜花粉多糖的体外抗氧化活性[24]。分析油菜花粉多糖的抗氧化活性提高的原因,可能是因为衍生化后,多糖的部分支链被水解,空间结构发生变化,进而使抗氧化活性提高[24]。谢明勇等[25]的研究中对多糖的硫酸化修饰及其结构与生物活性关系进行了讨论,分析了硫酸酯化改变抗氧化活性的原因。由于多糖的分子链具有一定的构象,即多糖分子在溶液中所形成的糖链的形态特点,包括多糖构象以及分子链的柔顺行等。相关研究表明硫酸化修饰可以改变多糖在溶液中的构象,多糖和硫酸化多糖均在水溶液中呈现球形链构象,而硫酸基团的引入使得多糖的构象变得更为伸展,进而提高其水溶性,从而利于其活性的表达。
根据不同文献的报道,硫酸酯化改变抗氧化活性的研究的进展突飞猛进,将拓宽多糖的应用领域和应用范围。同时为探索大红菇多糖的构效关系,丰富多糖构效关系研究及拓宽研究领域提供了理论基础基础。
4 结 论
大红菇经过水提、碱提得到的水溶性多糖、水不溶性多糖以及硫酸酯多糖化以后得到的硫酸酯多糖对羟基自由基、超氧阴离子、DPPH都有很好的清除作用。根据其EC50值表明:对·OH的清除能力:硫酸酯多糖>维生素c >水不溶性多糖>水溶性多糖;维生素c > 大红菇硫酸酯多糖>水溶性多糖>水不溶性多糖;对DPPH的清除能力为:维生素c >大红菇硫酸酯多糖>水溶性多糖>水不溶性多糖。
[1]李国杰,文华安.中国红菇属分类研究进展[J].菌物学报,2009,28(2):303-309.
[2]杜顺刚,赵同僚,席小敏,等.西峡县野生大红菇资源及生态调查初报[J].食用菌,2005,27(3):7-8.
[3]黄年来,林志彬,陈国良,等.中国食药用菌学[M].上海:上海科学技术文献出版社,2010.
[4]董汝晶. 多糖提取方法的研究进展[J]. 农产品加工·学刊:下, 2014(8):46-48.
[5]Bouhlal R, Haslin C, Chermann J C, et al. Antiviral Activities of sulfated polysaccharides isolated fromSphaerococcuscoronopifolius(Rhodophytha,Gigartinales) andBoergeseniellathuyoides(Rhodophyta,Ceramiales)[J].Marine Drugs, 2011, 9(7):1187-1209.
[6]Witvrouw M, De Clercq E. Sulfated polysaccharides extracted from sea algae as potential antiviraldrugs[J]. Gen Pharmacol, 1997, 29(4): 497-511.
[7]Yim J H, Kim S J, Ahn S H, et al. Antiviral effects of sulfated exopolysaccharide from the marine microalgaGyrodiniumimpudicumstrain KG03[J]. Mar Biotechnol, 2004, 6(1):17-25.
[8]Ciancia M, Quintana I, Cerezo A S. Overview of anticoagulant activity of sulfated polysaccharidesfrom seaweeds in relation to their structures, focusing on those of green seaweeds[J]. Current MedicinalChemistry, 2010,17: 2503-2529.
[9]Rabenstein, D L. Heparin and heparan sulfate: structure and function[J]. Natural Product Reports, 2002, 19:312-331.
[10]Athukorala Y, Ahn G N, Jee Y H, et al. Antiproliferative activity of sulfated polysaccharide isolated from an enzymatic digest of Ecklonia cava on the U-937 cell line[J]. J Appl Phycol, 2009, 21(3):307-314.
[11]Lins K O, Bezerra D P, Alves A P, et al. Antitumor properties of a sulfated polysaccharide from the red seaweedChampiafeldmannii(Diaz-Pifferer)[J]. J Appl Toxicol, 2009, 29(1): 20-26.
[12]Kwon M J, Nam T J. Porphyran induces apoptosis related signal pathway in AGS gastric cancer celllines[J]. Life Sci, 2006, 79: 1956-1962.
[13]Ye H, Wang K, Zhou C, et al. Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweedSargassumpallidum[J]. Food Chem, 2008, 111:428-432.
[14]Rocha de Souza M C, Marques C T, Guerra Dore C M, et al. Antioxidant activities of sulfated polysaccharides from brown and red seaweeds[J]. J Appl Phycol, 2007, 19(2):153-160.
[15]Ruperez P, Ahrazem O, Leal A. Potential antioxidant capacity of sulphated polysaccharides from the edible marine brown seaweedFucusvesiculosus[J]. J Agric Food Chem, 2002, 50: 840-845.
[16]Wang J, Zhang Q, Zhang Z,et al. Antioxidant activity of sulphated polysaccharide fractions extracted fromLaminariajaponica[J]. Int J Biol Macromol, 2008, 42: 127-132.
[17]Kim J K, Cho M L, Karnj anapratum S, et al. In vitro and in vivo immunomodulatory activity of sulfated polysaccharides fromEnteromorphaprolifera[J]. Int J Biol Macromol,2011, 49(5):1051-1058.
[18]Leiro J M, Castro R, Arranz J A, et al. Immunomodulating activities of acidic sulphated polysaccharides obtained from the seaweedUlvarigidaC. Agardh[J]. Int Immunopharmacol, 2007, 7(7): 879-888.
[19]杨青松, 赵 艳, 王 莹,等. 响应面法优化藏药红雪茶多糖提取工艺[J]. 食品工业, 2013(8):44-48.
[20]杨庆伟, 鲁梅芳, 金玉妍. 灰树花菌丝体多糖的硫酸酯化及其降血脂作用[J]. 天津科技大学学报, 2009, 24(4):25-28.
[21]Dodgson K S, Price R G. A Note on the determination of ester sulfate content of sulphated polysaccharides[J]. Biochem J, 1962, 84(1): 106-110.
[22]张建军, 谢丽源, 赵树海, 等[J]. 不同产地银耳抗氧化活性物质及抗氧化能力分析[J]. 西南农业学报, 2015, 28(1):333-338.
[23]李国荣, 刘娜女, 张 静, 等. 鸡腿菇多糖硫酸酯化条件的优化及抗氧化活性研究[J]. 西北农林科技大学学报:自然科学版, 2010(11):127-133.
[24]姚秋萍, 李 阳, 邓 健. 硫酸酯化修饰的油菜花粉多糖的抗氧化活性[J]. 食品科学, 2015, 36(13):65-68.
[25]谢明勇, 王之珺, 谢建华. 多糖的硫酸化修饰及其结构与生物活性关系研究进展[J]. 中国食品学报, 2015, 15(2):1-8.
PreparationandinvitroAntioxidantActivityofSulfatedWater-insolublePolysaccharidesfromRussulaalutaceaFr.
WANG Bai-juan1,YANG Qing-song2,CHEN Ting1,QIN Xiang-dong1, 3,TANG Qing-yan4,XIAO Yao1,YANG Yun-yu1,ZHAO Yan1*
(1.College of Science, Yunnan Agricultural University, Yunnan Kunming 650201, China;2.School of Ethnic Medicine, Yunnan Minzu University, Yunnan Kunming 650500, China ;3.Engineering and Research Center of Industrial Biogas Technology of Yunnan Province University, Yunnan Kunming 650201, China;4.College of Food Science and Technology, Yunnan Agricultural University, Yunnan Kunming 650201, China)
【Objective】 The fruit ofRussulaalutaceaFr. contained a large amount of alkali-soluble polysaccharides, which was chemically modified to increase its water solubility and thereby significantly improved the biological activity of polysaccharides and expanded its application.【Method】In this study, after water-soluble polysaccharides were extracted, the water-insoluble polysaccharides were extracted with alkali and the polysaccharide was modified by sulfuric acid method to improve its water solubility. The scavenging ability of water-soluble polysaccharides, water-insoluble polysaccharides, sulfuric acid polysaccharides and vitamin c to hydroxyl radicals, DPPH radicals and superoxide anions were analyzed and compared.【Result】 The water-soluble polysaccharide withRussulaalutaceaFr. content was 1.447 %, water-insoluble polysaccharide withRussulaalutaceaFr. content was 1.346 %, the sulfate mass parent was detected to be 14.95 %, the degree of sulfation was 0.763 %; 【Conclusion】According to itsEC50values, the values of scavenging activities of hydroxyl radical was in order:sulfated polysaccharides>vitamin C >water-insoluble polysaccharides > water-soluble polysaccharides, the values of scavenging activities of superoxide anion radical was in order:vitamin C > sulfated polysaccharides > water-insoluble polysaccharides > water-soluble polysaccharides, and the values of scavenging activities of DPPH was in order:vitamin C > sulfated polysaccharides > water-insoluble polysaccharides > water-soluble polysaccharides.
RussulaalutaceaFr.; Water-insoluble polysaccharide; Sulfate; Hydroxyl free radical; Superoxide anion; DPPH
1001-4829(2017)12-2673-07
10.16213/j.cnki.scjas.2017.12.010
2016-06-26
国家自然科学基金项目(31460137);云南省教育厅基金一般项目(2014C070Y);云南农业大学自然科学青年基金资助项目(2015ZR15);云南省应用基础研究计划项目(2015FB147);云南农业大学校企合作项目(KX140811)
王白娟(1979-),副教授,主要从事生物物理研究工作,E-mail:wangbaijuan123@126.com;*为通讯作者:赵 艳,E-mail:zhaoyankm@126.com。
R284.1
A
(责任编辑王家银)

