地肤对硼的耐受及富集能力研究
陆 俏,代 政,崔梦萦,马成仓,刘春光*
地肤对硼的耐受及富集能力研究
陆 俏1,代 政2,崔梦萦2,马成仓1,刘春光2*
(1.天津市动植物抗性重点实验室,天津师范大学生命科学学院,天津 300387;2.环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,南开大学环境科学与工程学院,天津 300350)
为了考察地肤对硼的耐受及富集能力,开展了溶液培养试验。将溶液硼浓度设置为0(对照)、10、20、30、40、80、120 mg·L-1,考察了硼胁迫对地肤植株生长、硼积累和细胞酶活性的影响。结果表明:地肤在溶液硼浓度为30 mg·L-1以下能够正常生长。溶液硼浓度超过30 mg·L-1后,随着溶液硼浓度的增加、地肤的生物量显著降低。当硼浓度达到120 mg·L-1时,根、茎、叶生物量分别比对照降低了56.0%、72.2%和71.4%。随着溶液硼浓度的增加,地肤根、茎、叶中的硼浓度均显著增加,在120 mg·L-1时,地肤体内硼浓度可达4000 mg·kg-1。经计算,地肤地上部和根部的BCF和TF值均大于1,地上部的BCF甚至大于20,表现出较强的硼富集能力。随着硼浓度的增加,地肤体内SOD和POD的浓度呈现先增加后降低的趋势,CAT的浓度呈现增加的趋势,表现出较好的抗氧化防御机制。综上所述,地肤在硼胁迫下有较好的抗氧化防御机制,其对高浓度硼具有较强的耐受和富集能力,可以作为高硼土壤植物修复的候选物种。
地肤;硼毒性;硼耐受性;生物富集系数;植物修复
硼是高等植物必需的微量元素,对生长发育起到重要的调节作用,但土壤中硼含量过高则会对植物产生毒害作用[1-2]。过量硼不但会引起植物细胞膜系统的损伤,影响细胞壁形成,还会抑制细胞分裂、分化,破坏抗氧化系统,进而影响植物的正常生长[3-5]。在世界范围内,许多地区土壤硼含量过高,硼毒害是半干旱地区农业生产中的一个重要问题,如南澳大利亚、土耳其、地中海国家、加利福尼亚、智利和我国辽宁宽甸等农业生产发达的地区都受到过量硼的影响[6-8]。土壤硼过量问题已成为限制作物产量的一个重要因素,在世界范围内引起了广泛关注[9]。
降低土壤硼含量的一个主要方法是用水灌溉淋洗[10],但是这种方法在干旱半干旱地区的应用受到限制。近年来,研究者开始尝试利用植物修复硼污染土壤。研究表明,碱茅(Puccinellia distans)体内硼富集量高达 6000 mg·kg-1;满天星(Gypsophila sphaerocephala)叶片中硼的含量可以达到 3300 mg·kg-1[11];垂序商陆(Phytolacca americana)、三裂叶豚草(Ambrosia trifida)和鸭跖草(Commelina communis)可以在 480~550 mg B·kg-1的土壤中生长,植物体内硼含量比土壤中高2~3倍[12]。然而,目前在我国,还鲜有耐硼植物和硼超积累植物的报道。尽管国外发现了一些耐硼物种,但是如果直接引入我国使用,将导致极大的生态风险。因此,有必要筛选适合我国硼矿区修复的本地物种,为我国开展硼污染土壤的植物修复提供理论依据。
在对辽宁和吉林的硼矿区进行调查的过程中,发现地肤是一种在高硼土壤上广泛分布的植物,这表明地肤对硼具有一定的耐受能力,对于地肤是否能够应用于硼污染土壤的修复有必要进一步探究。目前,对地肤的研究大多是地肤的抗逆性,尤其是对除草剂的抗性[13-14]。Varanasi等[15]证实了地肤对除草剂具有良好的抗性,并探究了其机制,Khan等[16]研究了盐和温度对地肤种子萌发的影响,麻莹等[17]研究了地肤对盐碱胁迫的生理响应,证实了地肤有良好的耐盐碱特性。关于地肤对土壤修复的研究主要集中在对土壤中重金属和石油污染的修复。陈碧华等[18]研究表明,地肤对锌、铅、铜、锰、镉等重金属有较好的去除效果,也揭示了地肤对不同重金属的富集部位。Moubasher等[19]发现地肤可以通过将石油降解来修复石油污染的土壤。其他的关于地肤的研究大多是关于其医学价值,邵荣杰等[20]研究发现,地肤子、地肤苗具有抗炎、抗过敏的功效,地肤根有降血糖的作用。然而,关于地肤对硼的耐受性及富集能力,目前尚未见报道。本研究采集了硼矿区的地肤(Kochia scoparia)种子并萌发获取幼苗,开展了溶液培养试验,在不同硼胁迫下考察地肤的生物量、硼的富集量以及抗氧化酶活性等指标的变化,通过分析生物量和植物硼浓度的变化规律,评估该物种对硼的耐受和富集能力,通过分析SOD、POD、CAT三种抗氧化酶活性对硼的响应,初步探究地肤对硼的耐受和富集机制,为高硼土壤的植物修复提供备选物种。
1 材料与方法
1.1 试验材料与仪器
本试验供试植物地肤种子采自辽宁宽甸某废弃硼矿区。采用溶液培养的方式进行培养,培养容器为具盖的聚丙烯杯(杯口和杯底直径分别为9 cm和6 cm,高12 cm,容量约450 mL),杯外壁覆盖有黑色不透光材料。培养溶液为1/2霍格兰(Hoagland)营养液(背景硼浓度为 0.25 mg·L-1)。
1.2 试验方法
挑选饱满的地肤种子直接播种于装有蛭石的育苗盘。待幼苗长至10~15 cm时,转移至装有1/2霍格兰营养液的聚丙烯杯中,培养一周以使幼苗适应溶液培养环境,然后开始实施胁迫。
通过添加硼酸(H3BO3)设置系列硼浓度,依次为0(对照)、10、20、30、40、80、120 mg·L-1。每个处理 5 组重复,每组4株幼苗。试验在室内日光灯培养架上开展,试验期间温度为22~30℃。试验期间每天用去离子水补充蒸发蒸腾损失的水分,定期更换容器的位置以保证每株幼苗受到的光照基本相同。胁迫15 d后,收获植株测定相关指标。
1.3 测定指标及方法
生物量:地肤植株洗净,吸去表面水分,将根、茎、叶分开,105℃下杀青1 h,85℃下烘干至恒重,分别称重。
硼浓度:称取0.10 g植株磨碎样品,加入10 mL 65%硝酸和1 mL 30%高氯酸,用石墨消解仪消解,消解液用去离子水定容至10 mL,4℃下保存。经0.22 μm醋酸纤维滤膜过滤后用电感耦合等离子体-原子发射光谱(ICP-OES)测定植物体内硼浓度。
生物富集系数(BCF):分别计算植株地上部和根的BCF,即植株硼浓度与溶液硼浓度的比值[21]。
转移系数(TF):植株地上部硼浓度与根部硼浓度的比值。
抗氧化酶活性:超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)法;过氧化氢酶(CAT)采用李仕飞等[22]的方法;过氧化物酶(POD)采用愈创木酚法。
这支镜头在镜身上设置了一个OLED对焦屏,能够实时显示对焦距离、景深范围等信息,更利于拍摄者确认拍摄参数。
1.4 数据处理
采用SPSS Statistics 22进行数据分析,用单因素方差分析(ANOVA)中的邓肯(Duncan′s)新复极差法进行多重比较检验不同处理之间的差异,用Origin 9.0软件绘图。
2 结果与分析
2.1 硼对地肤生物量的影响
由图1可知,随着营养液硼浓度的增加,地肤根、茎、叶的生物量总体呈先增大后减小的趋势。在低硼胁迫(0~20 mg·L-1)时,地肤生物量随着硼浓度的增加而增加;当硼浓度达到或高于 40 mg·L-1时,根、茎、叶的生物量均显著低于对照组;当硼浓度达到120 mg·L-1时,生物量的累积受到进一步的抑制,根、茎、叶生物量分别比对照减少了56.0%、72.2%和71.4%。由此可以看出,低浓度的硼能够促进地肤生物量的积累,而高浓度的硼对其生长产生显著的抑制作用,随着硼浓度的增加,抑制作用不断增强。
从图2可以看出,与对照相比,硼浓度不超过30 mg·L-1时,根冠比未出现明显变化。结合图1的结果,表明在低硼胁迫下,硼对地肤地上部和根部生物量的积累产生了相似的促进效果。随着硼浓度的增加,根冠比逐渐增加,在硼浓度为120 mg·L-1时,显著高于对照组。表明高浓度硼对地肤地上部生长的抑制大于对根的抑制。这可能与硼通过被动运输向地上部转移有关,地上部积累了高浓度的硼(图3),对植物地上部的生物量产生更强的抑制作用。

图1 不同硼浓度下地肤的生物量Figure 1 Dry weight of K.scoparia grown at different boron supply concentrations
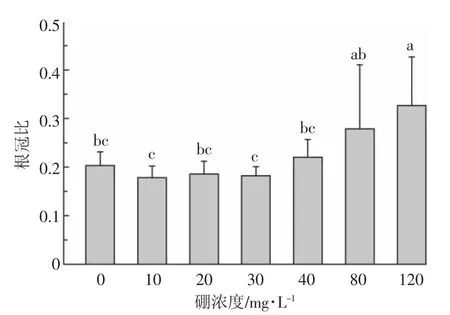
图2 硼对地肤根冠比的影响Figure 2 Effects of boron on root to shoot ratio of K.scoparia
2.2 地肤对硼的富集
由图3和图4可知,培养液中添加硼后,能够显著提高地肤体内的硼浓度,且地肤体内硼浓度与培养液硼浓度呈显著线性相关。硼浓度为10~40 mg·L-1时,硼在根中的浓度明显大于茎。随着溶液硼浓度继续增大,硼在茎中的富集量也急剧增加,直至与根中硼浓度相近。在溶液硼浓度为 120 mg·L-1时,根、茎、叶的硼浓度分别是对照组的200、19倍和26倍,这表明地肤对硼有很好的富集能力。不仅如此,当溶液硼浓度增大到 120 mg·L-1后,地肤叶中硼浓度达到 2.44 mg·g-1,分别是根和茎中硼浓度的2倍和5倍左右,这说明地肤不同部位对硼的富集量为叶>根>茎,并且由图4可知,地肤不同部位对硼的富集速率也是叶>根>茎,说明硼在地肤中主要向叶片中转移并积累。由图1可知,叶片的生物量也大于根和茎,说明地肤叶片中积累的大量的硼并没有对地肤叶片生物量产生强烈的抑制,表明地肤叶片对硼有很强的耐受能力。由于地肤对植物的毒害作用主要体现在叶片的损伤,由此可以推断,地肤对硼的耐受能力较强。
为了更好地说明地肤对硼的富集能力,本文计算了地肤地上部和根对硼的生物富集系数(BCF)和硼在植株内的转移系数(TF)(表1)。可以看出,地上部和根的BCF均大于1,地上部BCF明显大于根BCF,且TF均大于1,说明地肤的地上部和根对硼均有很好的富集能力,且地上部对硼的富集能力更强。当营养液硼浓度在 10~80 mg·L-1时,地上部和根部的 BCF均较为稳定,但硼浓度为120 mg·L-1时,根部BCF显著增加,说明高硼胁迫促进植物对硼的吸收。然而,TF随着硼浓度的增加而降低,在120 mg·L-1时达到最低,说明高硼胁迫显著抑制了硼在地肤体内的转运。地肤植株TF均大于1,TF随溶液硼浓度的升高略有降低。以上结果表明,地肤对硼有较强的富集能力,地上部更容易积累硼。
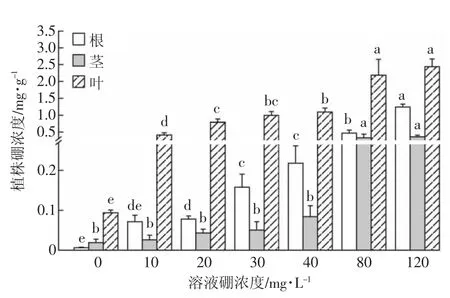
图3 不同硼浓度下地肤对硼的富集Figure 3 Boron concentrations in roots,stems and leaves of K.scoparia at different boron supply concentrations
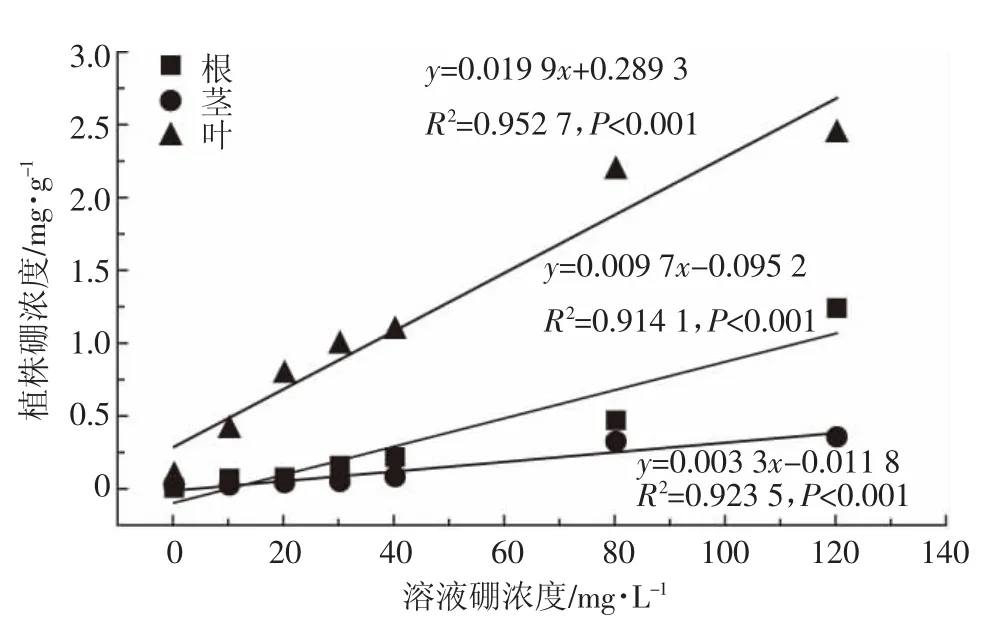
图4 溶液硼浓度与地肤植株硼浓度的关系Figure 4 Relationship between tissue boron concentration in K.scoparia and medium boron concentration
2.3 硼胁迫对地肤叶片细胞抗氧化酶活性的影响
2.3.1 硼对地肤叶片细胞SOD活性的影响
从图5可以看出,地肤叶片细胞SOD活性随着溶液硼浓度的增加呈先升高后降低的趋势。与对照相比,硼浓度为20 mg·L-1时,SOD活性提高了18.3%;在120 mg·L-1时,SOD活性减小了23.8%。上述结果表明,较低浓度的硼(≤30 mg·L-1)对地肤叶片细胞的SOD 活性有促进作用,而较高浓度的硼(>30 mg·L-1)对其活性有抑制作用。由此可以推测出,在低硼胁迫下,植物通过表达SOD缓解硼的毒害效应;在高硼胁迫下,SOD没有发生过度表达,地肤对高硼的耐受与SOD没有显著的相关性。
2.3.2 硼对地肤叶片细胞CAT活性的影响
如图6所示,地肤叶片细胞的CAT活性在溶液硼浓度较低(≤30 mg·L-1)时未出现显著变化。随着硼浓度进一步增大,CAT活性逐渐增大,显著高于低浓度硼处理。当硼浓度为120 mg·L-1时,细胞CAT活性比对照升高了 53.4%,表明较高的硼浓度(>30 mg·L-1)对地肤叶片细胞的CAT活性的影响较大。由此可以推断,在低硼胁迫时,植物对硼的耐受与CAT无关;而在高硼胁迫时,植物通过CAT的过度表达,抵御硼胁迫造成的氧化损伤。
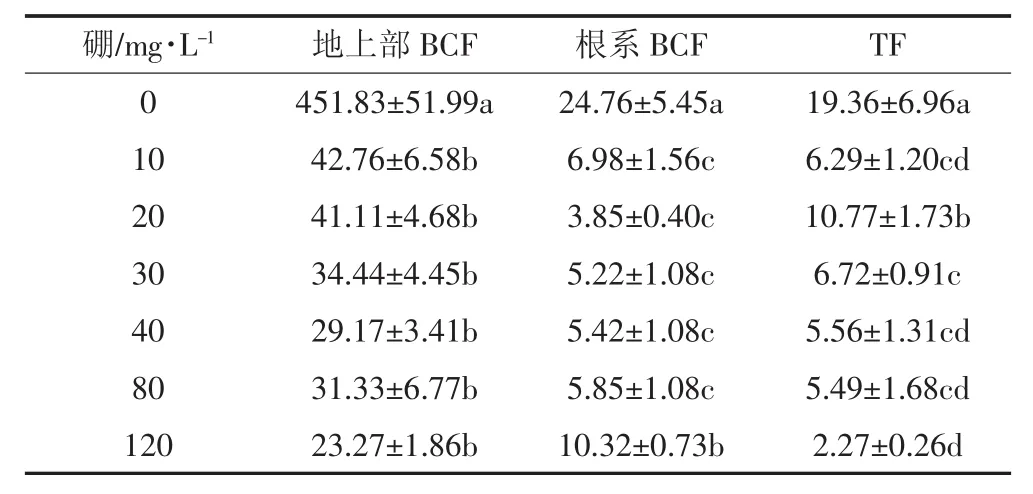
表1 不同硼浓度下地肤对硼的生物富集系数和转移系数Table 1 Bioconcentration factors(BCF)and translocation factors(TF)of K.scoparia at different boron concentrations
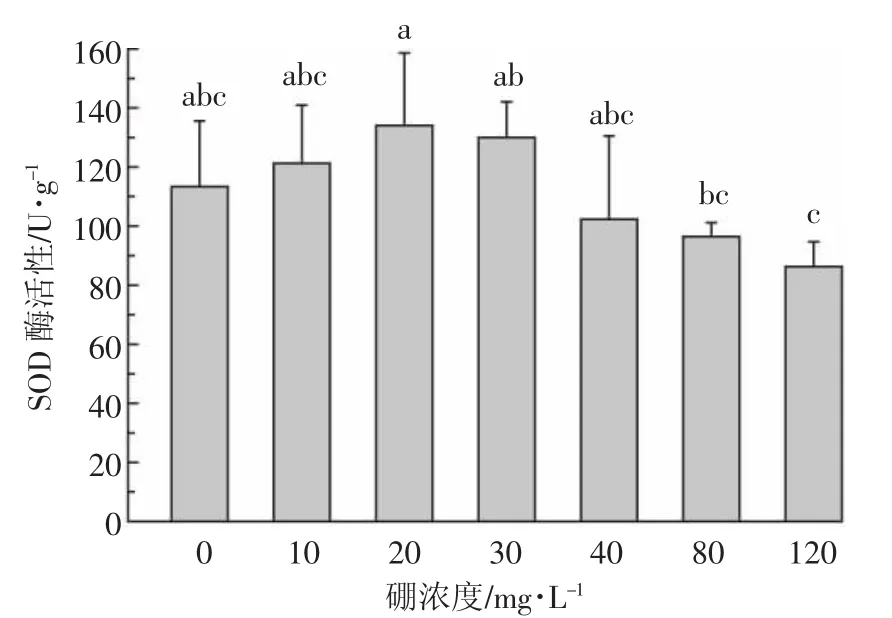
图5 硼对地肤叶片细胞超氧化物歧化酶活性的影响Figure 5 Effect of boron on the activities of SOD in the leaf cell of K.scoparia
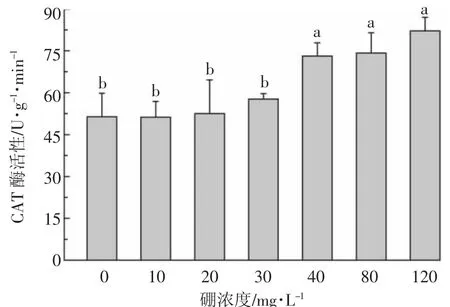
图6 硼对地肤叶片细胞过氧化氢酶活性的影响Figure 6 Effect of boron on the activities of CAT in the leaf cell of K.scoparia
2.3.3 硼对地肤叶片细胞POD活性的影响
从图7可以看出,随着硼浓度的升高,地肤叶片细胞的POD活性呈先升高后降低的趋势,在硼浓度为30 mg·L-1时达到最高。各处理组的POD活性均显著高于对照组,表明高浓度硼会导致地肤叶片细胞POD的活性显著提高。在高硼和低硼胁迫时,POD都会过度表达,来缓解硼毒害造成的氧化损伤,与低硼胁迫相比,POD在高硼胁迫时发挥更大的作用。
3 讨论
3.1 地肤对硼的耐受能力
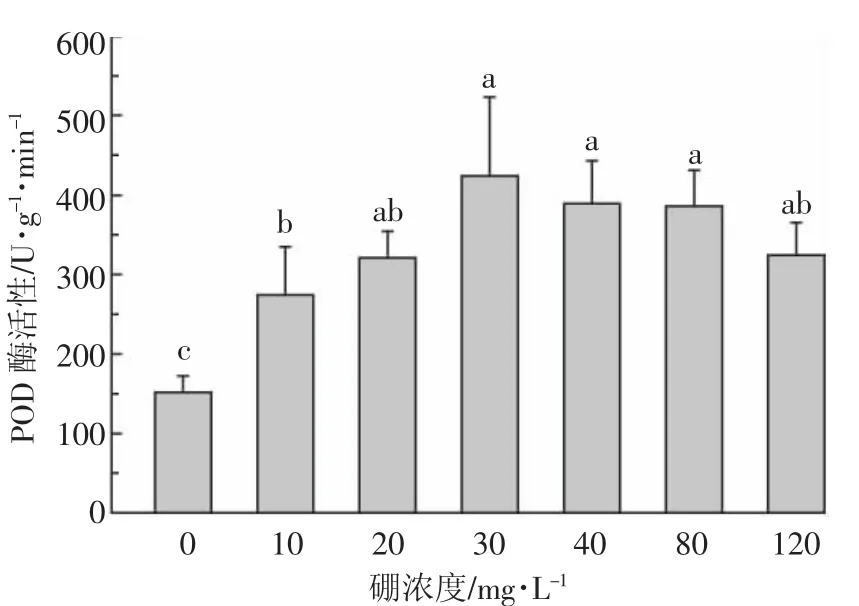
图7 硼对地肤叶片细胞过氧化物酶活性的影响Figure 7 Effect of boron on the activities of POD in the leaf cell of K.scoparia
虽然硼是植物生长的必需元素,但当硼浓度超过2~4 mg·L-1,就可能对植物造成毒害效应[23]。在本研究中,地肤能够在溶液硼浓度为30 mg·L-1及以下正常生长,生物量积累未受显著影响,而且在120 mg·L-1硼胁迫下,地肤也有较大的生物量(图1),同时,随着溶液硼浓度的增加,植株硼浓度不断增加(图4),这表明地肤对硼有较强的耐受能力。植物对硼的耐受机制可以分为三类:(1)植物通过限制其自身对硼的吸收利用,或者限制硼从植物根系转移至地上部(一般植物地上部对硼毒害更敏感),从而减轻硼毒害;(2)植物通过特定机制排出过多的硼;(3)植物自身具有特殊的耐受机制,例如通过抗氧化作用或将活性硼钝化为非活性态等机制,抵御硼的毒害[24-25]。在本研究中,随着溶液硼浓度的增加,地肤根、茎、叶中的硼浓度均显著增加(图4),且地上部的硼浓度显著大于根部硼浓度(图3,表1)。虽然随着溶液硼浓度的增加,地肤的BCF和TF均呈现降低的趋势,但始终大于1,说明地肤对硼胁迫的耐受机制是基于其特殊的耐受机制,降低硼毒害的。
本研究对硼胁迫下SOD、CAT和POD三种抗氧化酶活性的变化进行研究。结果表明,在硼胁迫下,SOD、CAT和POD的活性均显著增加(图5、图6、图7)。硼胁迫下,抗氧化酶活性提高,能够增强对活性氧的清除能力,从而提高植株对硼的耐受能力[26]。结合本研究结果可以得出,地肤对硼的特殊耐受机制之一就是其抗氧化系统。在硼胁迫的条件下,地肤通过增加抗氧化酶的活性,降低体内过高的硼浓度产生的毒害效应。然而,过高浓度的硼会使细胞抗氧化体系遭到破坏,导致植物活性氧清除能力削弱[27-28]。由图5、图6、图7可知,在硼浓度小于40 mg·L-1的条件下,SOD和POD的活性显著增加,CAT的活性保持不变,这表明,在低硼胁迫时,地肤的抗氧化系统中,SOD和POD对其硼耐受机制起主要作用。在高硼胁迫时,随着硼浓度的不断增加,SOD和POD的活性显著降低(图 5,图 7),CAT 活性显著增加(图 6),在 120 mg·L-1的条件下,SOD活性低于对照组(图5),POD活性高于对照组(图7),CAT活性达到最大(图6),这表明,在高硼胁迫时,CAT对其硼耐受机制起主要作用,POD也起一定的作用。
3.2 地肤对硼的富集能力
已有研究表明,一般植物体内硼浓度小于1000 mg·kg-1[29-32],在本研究中,地肤体内的硼浓度可达4000 mg·kg-1(图3),表明地肤除了对硼有较强的耐受能力外,对硼也有较好的富集能力。表1的结果可以进一步证实地肤对硼的富集能力。研究表明,若植物BCF和TF均大于1,则可作为超积累植物[33],当BCF大于2时,则认为其具有很高的利用价值[34]。在本研究中,地肤在不同硼浓度下的BCF均大于1,尤其地上部BCF均超过20,说明地肤有较强的富集硼的能力,且地上部对硼的富集能力更强,地上部超高的BCF增加了地肤的应用潜力。除此之外,地肤在不同硼胁迫下的TF也均大于1,表明地肤对硼的转移效率高,可以将根吸收的硼快速地向地上部转移并富集,也表现出地肤地上部对硼有较强的富集能力。
植物对硼的吸收主要是在硼的浓度梯度的作用下,通过根细胞的磷脂双分子层和通道蛋白进行的被动运输[35]。在本研究中,地肤的根冠比随着硼浓度的增加而显著增加(图2),说明高硼胁迫对地肤根的抑制作用更小,这有利于高硼胁迫下地肤对硼的吸收,而地肤对硼的TF均大于1,表明地肤根吸收的硼容易向地上部转移并富集,使地肤体内硼的浓度增加(图 3)。
在植物对硼的富集条件下,植物对硼的耐受机制主要包括液泡对硼的隔离、硼从细胞内向质外体运输和抗氧化防御体系的作用[31]。结合本研究的结果,地肤对硼的富集机制主要是抗氧化防御系统的作用。在低硼胁迫下,地肤体内SOD和POD的活性增强(图5、图7),清除由硼胁迫产生的活性氧自由基[26],保证地肤正常生长;在高硼胁迫下,CAT活动增强,且SOD和POD保持较强的活性(图5、图6、图7),降低了地肤体内过量的硼的毒害效应。
4 结论
地肤能够在硼浓度不超过30 mg·L-1的条件下正常生长,体内硼浓度可达4000 mg·kg-1,而且BCF和TF均大于1,表现出对硼有较强的耐受能力和富集能力。地肤对硼的耐受和富集机制主要是通过抗氧化系统的防御作用实现的,在低硼胁迫时,地肤体内SOD和POD发挥主要作用,在高硼胁迫时,CAT发挥主要作用。较强的耐受和富集能力,使得地肤可望被应用于高硼土壤的植物修复。
[1]Camacho Cristóbal J J,Rexach J,González-Fontes A.Boron in plants:Deficiency and toxicity[J].Journal of Integrative Plant Biology,2008,50(10):1247-1255.
[2]Gür N,Türker O C,Böcük H.Toxicity assessment of boron(B)by Lemna minor L.and Lemna gibba L.and their possible use as model plants for ecological risk assessment of aquatic ecosystems with boron pollution[J].Chemosphere,2016,157:1-9.
[3]Ardic M,Sekmen A H,Turkan I,et al.The effects of boron toxicity on root antioxidant systems of two chickpea(Cicer arietinum L.) cultivars[J].Plant and Soil,2009,314(1/2):99-108.
[4]Stangoulis J C R,Reid R J.Boron toxicity in plants and animals[M]//Boron in plant and animal nutrition.New York:Kluwer Academic Press,2002:227-240.
[5]Mittler R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[6]Schnurbusch T,Hayes J,Sutton T.Boron toxicity tolerance in wheat and barley:Australian perspectives[J].Breeding Science,2010,60(4):297-304.
[7]Aquea F,Federici F,Moscoso C,et al.A molecular framework for the inhibition of Arabidopsis root growth in response to boron toxicity[J].Plant,Cell and Environment,2012,35(4):719-734.
[8]王春利,邢小茹,吴国平,等.宽甸土壤及部分农作物中硼的分布及污染分析[J].中国环境监测,2004,19(5):4-7.
WANG Chun-li,XING Xiao-ru,WU Guo-ping,et al.Analyses of boron distribution and pollution in soil and some crops in Kuandian[J].Environmental Monitoring in China,2003,19(5):4-7.
[9]Emebiri L C,Ogbonnaya F C.Exploring the synthetic hexaploid wheat for novel sources of tolerance to excess boron[J].Molecular Breeding,2015,35(2):68.
[10]Smith T E,Grattan S R,Grieve C M,et al.Salinity′s influence on boron toxicity in broccoli:I.Impacts on yield,biomass distribution,and water use[J].Agricultural Water Management,2010,97(6):777-782.
[11]Babaog lu M,Gezgin S,Topal A,et al.Gypsophila sphaerocephala Fenzl ex Tchihat.:A boron hyperaccumulator plant species that may phytoremediate soils with toxic B levels[J].Turkish Journal of Botany,2004,28(3):273-278.
[12]Asada M,Parkpian P,Horiuchi S.Remediation technology for boron and fluoride contaminated sediments using green plants[J].Journal of ASTM International,2006,3(6):1-7.
[13]Wiersma A T,Gaines T A,Preston C,et al.Gene amplification of 5-enol-pyruvylshikimate-3-phosphate synthase in glyphosate-resistant Kochia scoparia[J].Planta,2015,241(2):463-474.
[14]Sebastian D J,Nissen S J,Westra P,et al.Influence of soil properties and soil moisture on the efficacy of indaziflam and flumioxazin on Kochia scoparia L.[J].Pest Management Science,2017,73(2):444-451.
[15]Varanasi V K,Godar A S,Currie R S,et al.Field-evolved resistance to four modes of action of herbicides in a single kochia(Kochia scoparia L.Schrad.)population[J].Pest Management Science,2015,71(9):1207-1212.
[16]Khan M A,Gul B,Weber D J.Influence of salinity and temperature on the germination of Kochia scoparia[J].Wetlands Ecology and Management,2001,9(6):483-489.
[17]麻 莹,郭立泉,张淑芳,等.盐、碱胁迫对药用植物碱地肤生长及其茎叶离子含量的影响[J].东北师大学报(自然科学版),2017,49(2):111-115.
MA Ying,GUO Li-quan,ZHANG Shu-fang,et al.Effects of salt and alkali stresses on growth and ions accumulation in shoot of medicinal plant Kochia sieversiana[J].Journal of Northeast Normal University(Natural Science Edition),2017,49(2):111-115.
[18]陈碧华,郭卫丽,王广印,等.地肤对大棚菜田土壤重金属的修复效应研究[J].北方园艺,2016(7):170-174.
CHEN Bi-hua,GUO Wei-li,WANG Guang-yin,et al.Research of remediation effect of Kochia scoparia on heavy metal contaminated vegetable field soil in plastic shed[J].Northern Horticulture,2016(7):170-174.
[19]Moubasher H A,Hegazy A K,Mohamed N H,et al.Phytoremediation of soils polluted with crude petroleum oil using Bassia scoparia and its associated rhizosphere microorganisms[J].International Biodeterioration and Biodegradation,2015,98:113-120.
[20]邵荣杰,邵世宏.地肤的各药用部位药用价值研究进展[J].中草药,2015,46(23):3605-3610.
SHAO Rong-jie,SHAO Shi-hong.Progress in study on medicinal value of medicinal parts of Kochia scoparia[J].Chinese Traditional and Herbal Drugs,2015,46(23):3605-3610.
[21]Rani P,Kumar A,Arya R C.Stabilization of tannery sludge amended soil using Ricinus communis,Brassica juncea and Nerium oleander[J].Journal of Soils and Sediments,2017,17(5):1449-1458.
[22]李仕飞,刘世同,周建平,等.分光光度法测定植物过氧化氢酶活性的研究[J].安徽农学通报,2007,13(2):72-73.
LI Shi-fei,LIU Shi-tong,ZHOU Jian-ping,et al.Measuration of catalase vigor in plants with spectrophotometry[J].Anhui Agricultural Science Bulletin,2007,13(2):72-73.
[23]Mitra G N.Boron(B)uptake[M]//Regulation of nutrient uptake by plants:A biochemical and molecular approach.Springer,New Delhi,2015:149-154.
[24]Rámila C D P,Leiva E D,Bonilla C A,et al.Boron accumulation in Puccinellia frigida,an extremely tolerant and promising species for boron phytoremediation[J].Journal of Geochemical Exploration,2015,150:25-34.
[25]Stiles A R,Bautista D,Atalay E,et al.Mechanisms of boron tolerance and accumulation in plants:A physiological comparison of the extremely boron-tolerant plant species,Puccinellia distans,with the moderately boron-tolerant Gypsophila arrostil[J].Environmental Science and Technology,2010,44(18):7089-7095.
[26]吴秀丽,欧庸彬,原改换,等.两种杨树对高硼胁迫的生理响应[J].植物生态学报,2015,39(4):407-415.
WU Xiu-li,OU Yong-bin,YUAN Gai-huan,et al.Physiological responses of two poplar species to high boron stress[J].Chinese Journal of Plant Ecology,2015,39(4):407-415.
[27]熊 博,叶 霜,邱 霞,等.硼对黄果柑生理及抗氧化酶活性的影响[J].浙江农业学报,2016,28(7):1171-1176.
XIONG Bo,YE Shuang,QIU Xia,et al.Effect of boron on physiological and antioxidant enzymes activity of Huangguogan[J].Acta Agriculturae Zhejiangensis,2016,28(7):1171-1176.
[28]Shah A,Wu X,Ullah A,et al.Deficiency and toxicity of boron:Alterations in growth,oxidative damage and uptake by citrange orange plants[J].Ecotoxicology and Environmental Safety,2017,145:575-582.
[29]Bañuelos G S,LeDuc D,Johnson J.Evaluating the tolerance of young hybrid poplar trees to recycled waters high in salinity and boron[J].International Journal of Phytoremediation,2010,12(5):419-439.
[30]Hamurcu M,Demiral T,Hakki E E,et al.Oxidative stress responses in watermelon(Citrullus lanatus) as influenced by boron toxicity and drought[J].Zemdirbyste-Agriculture,2015,102(2):209-216.
[31]Rámila C D P,Contreras S A,Di Domenico C,et al.Boron stress response and accumulation potential of the extremely tolerant species Puccinellia frigida[J].Journal of Hazardous Materials,2016,317:476-484.
[32]Alpaslan M,Gunes A.Interactive effects of boron and salinity stress on the growth,membrane permeability and mineral composition of tomato and cucumber plants[J].Plant and Soil,2001,236(1):123-128.
[33]Usman A R,Alkredaa R S,Al-Wabel M I.Heavy metal contamination in sediments and mangroves from the coast of Red Sea:Avicennia marina as potential metal bioaccumulator[J].Ecotoxicology and Environmental Safety,2013,97(5):263-270.
[34]Mellem J J,Baijnath H,Odhav B.Bioaccumulation of Cr,Hg,As,Pb,Cu and Ni with the ability for hyperaccumulation by Amaranthus dubius[J].African Journal of Agricultural Research,2012,7(4):591-596.
[35]Tanaka M,Fujiwara T.Physiological roles and transport mechanisms of boron:Perspectives from plants[J].Pflügers Archiv-European Journal of Physiology,2008,456(4):671-677.
Boron tolerance and accumulation in Kochia scoparia
LU Qiao1,DAI Zheng2,CUI Meng-ying2,MA Cheng-cang1,LIU Chun-guang2*
(1.Tianjin Key Laboratory of Animal and Plant Resistance,College of Life Sciences,Tianjin Normal University,Tianjin 300387,China;2.Key Laboratory of Pollution Processes and Environmental Criteria,Ministry of Education,Key Laboratory of Environmental Remediation and Pollution Control,College of Environmental Science and Engineering,Nankai University,Tianjin 300350,China)
To evaluate the capacity of boron(B)tolerance and accumulation in Kochia scoparia,hydroponic studies were conducted.Seedlings of K.scoparia were cultivated in solutions with B concentrations of 0(control),10,20,30,40,80 mg·L-1and 120 mg·L-1,respectively.The biomass,B accumulation and enzymatic activity were determined after 15-d cultivation.The results show that K.scoparia was able to grow normally at B supply concentrations ranging from 0 to 30 mg·L-1.The biomass of K.scoparia decreased significantly with increasing B supply concentrations at B supply concentrations greater than 30 mg·L-1.At B concentration of 120 mg·L-1,the biomass of root,stem and leaf of K.scoparia decreased by 56.0%,72.2%and 71.4%,respectively,compared to the control.Moreover,with increasing B supply concentrations,plant B concentrations increased gradually.At B supply concentration of 120 mg·L-1,the plant B concentration in K.scoparia was 4000 mg·kg-1.The BCF and TF values of K.scoparia were all greater than 1,and even greater than 20 for shoot BCF values,indicating a outstanding capacity of accumulating B for K.scoparia.With increasing B supply concentrations,the POD and SOD activities inK.scoparia increased firstly and then decreased and the CAT activity increased all the time,indicating that the defense system of active oxygen of K.scoparia was well-organised under B stress.Our results suggest that,K.scoparia has a considerable tolerance to B and is able to accumulate high level of B,due to the defense system of active oxygen of it.Therefore,K.scoparia is considered as a potential candidate for the phytoremediation of high-B soil.
Kochia scoparia;B toxicity;B tolerance;bioconcentration factor;phytoremediation
X171.5
A
1672-2043(2017)12-2407-07
10.11654/jaes.2017-1529
陆 俏,代 政,崔梦萦,等.地肤对硼的耐受及富集能力研究[J].农业环境科学学报,2017,36(12):2407-2413.
LU Qiao,DAI Zheng,CUI Meng-ying,et al.Boron tolerance and accumulation in Kochia scoparia[J].Journal of Agro-Environment Science,2017,36(12):2407-2413.
2017-11-03 录用日期:2017-11-30
陆 俏(1992—),女,天津人,硕士研究生,研究方向为污染土壤的植物修复。E-mail:1392715702@qq.com
*通信作者:刘春光 E-mail:liuchunguang@nankai.edu.cn
国家自然科学基金项目(31370519);高等学校学科创新引智计划(111计划)(T2017002);中央高校基本科研业务费专项
Project supported:The National Natural Science Foundation of China(31370519);The 111 Program of the Ministry of Education,China(T2017002);The Fundamental Research Funds for the Central Universities

