靶向沉默膀胱癌T24细胞系VEGF对树突状细胞分化成熟及免疫功能的影响
黄一珂,刁思军,梁 平,周婷婷,魏志涛,杨 伟,王 亮
(成都军区总医院 泌尿外科, 四川 成都 610083)
研究论文
靶向沉默膀胱癌T24细胞系VEGF对树突状细胞分化成熟及免疫功能的影响
黄一珂,刁思军,梁 平,周婷婷,魏志涛,杨 伟,王 亮*
(成都军区总医院 泌尿外科, 四川 成都 610083)
目的观察靶向沉默膀胱癌T24细胞系VEGF对树突状细胞(DC)分化成熟及免疫功能的影响。方法构建VEGF慢病毒干扰载体LV-VEGFA-RNAi(实验组)及慢病毒阴性对照载体LV-CON(阴性对照组),分别感染各组T24细胞,空白对照组不采取任何干预措施。分别用RT-PCR和ELISA检测各组T24细胞VEGFmRNA和蛋白的表达。各组T24上清分别与PBMC来源的未成熟DC共培养,用流式细胞仪检测DC分化成熟指标CD1a、CD83及免疫功能指标CD86。结果与空白对照组和阴性对照组相比,实验组T24细胞VEGFmRNA及蛋白的表达均受到显著抑制(P<0.05)。实验组DC表型CD1a、CD83和CD86较空白对照组明显增高(P<0.05),较阴性对照组亦明显增高(P<0.05)。结论靶向沉默膀胱癌T24细胞VEGF的表达,有利于微环境中DC的成熟及其免疫功能的发挥,可能通过修复DC被损害的免疫监视功能,增加DC的抗肿瘤能力。
膀胱癌;微环境;血管内皮生长因子;树突状细胞
膀胱癌是泌尿系统最常见的恶性肿瘤,全世界每年大约有35~38万例发病报道[1],免疫逃逸是导致膀胱癌复发和进展的重要机制。树突状细胞(dendritic cells, DC)是目前发现的肿瘤微环境中最主要的,功能最强的抗原递呈细胞(antigen-presenting cell, APC),在机体的抗肿瘤免疫反应中发挥着极为重要的作用。血管内皮生成因子(vascular endothelial growth factor, VEGF)是目前活性最强的血管生成因子,同时也是肿瘤微环境中极为重要的免疫抑制因子。研究显示[2]:肿瘤微环境中的免疫抑制因子会导致肿瘤患者外周血或肿瘤组织中DC前体细胞成熟度降低,成熟DC的数量减少,促使肿瘤发生免疫逃逸。因此推测,如果能够沉默肿瘤细胞免疫抑制因子VEGF的分泌,将可能增加DC细胞的成熟度,修复DC细胞的抗原呈递功能,甚至提高DC疫苗的疗效。本研究利用RNAi技术,构建VEGF慢病毒干扰载体LV-VEGFA-RNAi,靶向沉默膀胱癌T24细胞的VEGF表达,观察T24细胞培养上清对PBMC来源的DC的分化成熟及免疫功能的影响。
1 材料与方法
1.1 材料
人膀胱癌T24细胞系(中国科学院上海生命科学研究院细胞资源中心);人外周血单个核细胞(PMBC)(成都军区总医院干细胞实验室);慢病毒干扰载体LV-VEGFA-RNAi和阴性对照载体LV-CON和(上海吉凯基因化学技术有限公司);RPMI- 1640培养基和1%PBS缓冲液(Hyclone公司);胎牛血清(Gibco公司);胰蛋白酶和青链霉素(Millipore公司);重组人IL- 4、重组人GM-CSF和重组人TNF-α(Peprotech公司);RNA提取试剂盒(Sigma公司);PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒和SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa公司);PCR引物(成都擎科梓熙生物技术有限公司);人VEGF酶联免疫吸附测定试剂盒(福因德科技有限公司);FITC Mouse Anti-Human CD1a、APC Mouse Anti-Human CD83及PE Mouse Anti-Human CD86(Becton,Dickinson公司)。
1.2 方法
1.2.1 慢病毒干扰载体的分组:由上海吉凯基因化学技术有限公司合成的含有针对VEGF的有效干扰序列的慢病毒载体命名为LV-VEGFA-RNAi(实验组),不含有效干扰VEGF的阴性对照序列(无关序列)的慢病毒载体命名为LV-CON(阴性对照组)。两种载体所含序列见表1。
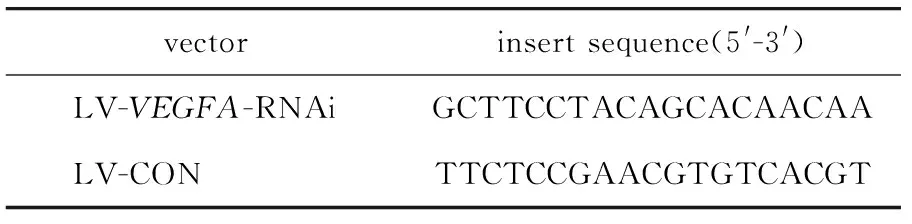
表1 两种慢病毒载体所含序列Table 1 Sequences of two lentiviral vectors
1.2.2 膀胱癌T24细胞的感染:感染前用孔稀释法对各组病毒进行滴度测定,选择所测滴度最高的病毒进行后续实验。根据上海吉凯提供的慢病毒感染手册规范,在正式感染前进行预实验,测试出最佳感染参数。正式感染需根据比例,计算病毒用量。人膀胱癌T24细胞按实验组、阴性对照组和空白对照组的设置接种于12孔板,每孔0.5×105个细胞,每组设3个复孔,采用含体积分数为10%胎牛血清和1%双抗的RPMI-1640培养基,置于37 ℃、5% CO2的孵箱中培养,当细胞培养至第3天对数增殖期时,按预实验得出的最佳感染参数(表2)分别对各组T24细胞进行慢病毒的感染,12 h后更换培养基,荧光显微镜下观察慢病毒感染效率,待各组细胞增殖至感染后第4天提取总RNA,使用GAPDH作内参,具体引物信息如表3。按说明书操作,反转录及定量PCR检测各组细胞VEGF mRNA的表达,ELISA检测各组细胞上清液中的VEGF的量,计算慢病毒干扰载体对目的基因VEGF的沉默效率。
1.2.3 T24细胞上清与DC共培养:使用含rh GM-CSF和rh IL- 4各100 ng/mL, 1%双抗10% FBS的1640培养基将PBMC(含未成熟DCs)等量接种于底面积为25 cm2带透气阀的培养瓶,分别对应前面的T24细胞分组,置于37 ℃、5%的CO2孵箱中培养至第4天和第6天,分别加入汇合度达90%的各组T24细胞培养上清(100 μL/mL),第9天时加入rh TNF-α(20 ng/mL),培养至第14天时收集成熟DC。用鼠抗人CD1a、CD83、CD86单克隆抗体分别对各组DC标记染色,进行流式细胞分析。

表2 各组感染参数Table 2 Infection parameters of each group
*CM(complete medium).

表3 目的基因及内参引物Table 3 Primers of VEGF and GAPDH
1.3 统计学分析
2 结果
2.1 慢病毒感染膀胱癌T24细胞
实验组和阴性对照组荧光强度相当,而空白对照组因未进行带荧光的病毒感染,故荧光视野下无表达绿色荧光的T24细胞(图1)
与阴性对照组和空白对照组相比,实验组T24细胞VEGFmRNA表达受到明显抑制(72.39%,P<0.05)(表4)。

图1 各组T24细胞的荧光表达情况Fig 1 Fluorescence expression of each T24 cell group(×40)

groupexpression(2-△△Ct)Ctnegativecontrolgroup 1.141±0.28920.45±0.04blankcontrolgroup 1.144±0.21320.90±0.20experimentalgroup 0.316±0.066*22.11±0.20
*P<0.05 compared with negative control group and blank control group.
与阴性对照组和空白对照组相比,实验组T24细胞上VEGF 蛋白的表达亦受到显著抑制(75.26%,P<0.05)(表5)。

表5 各组T24细胞VEGF 蛋白表达情况
*P<0.05 compared with negative control group and blank control group.
2.2 T24细胞上清与DC共培养
T24细胞上清与PBMC来源的未成熟DC共培养至第14天,光镜下观察结果(图2,箭头所指为成熟DC表面的树突)。可以看出,实验组DC变大变圆,出现了明显的毛刺状,呈悬浮增殖,为成熟DC特征;而阴性对照组和空白对照组DC则更多仍处于半贴壁状态,毛刺不明显,成熟程度较实验组低。
各组DC 3种标志物表达情况如表6。从表中可以看出,实验组DC成熟标志物CD1a、CD83和CD86的表达量明显高于阴性对照组和空白对照组(P<0.05)(图3)。
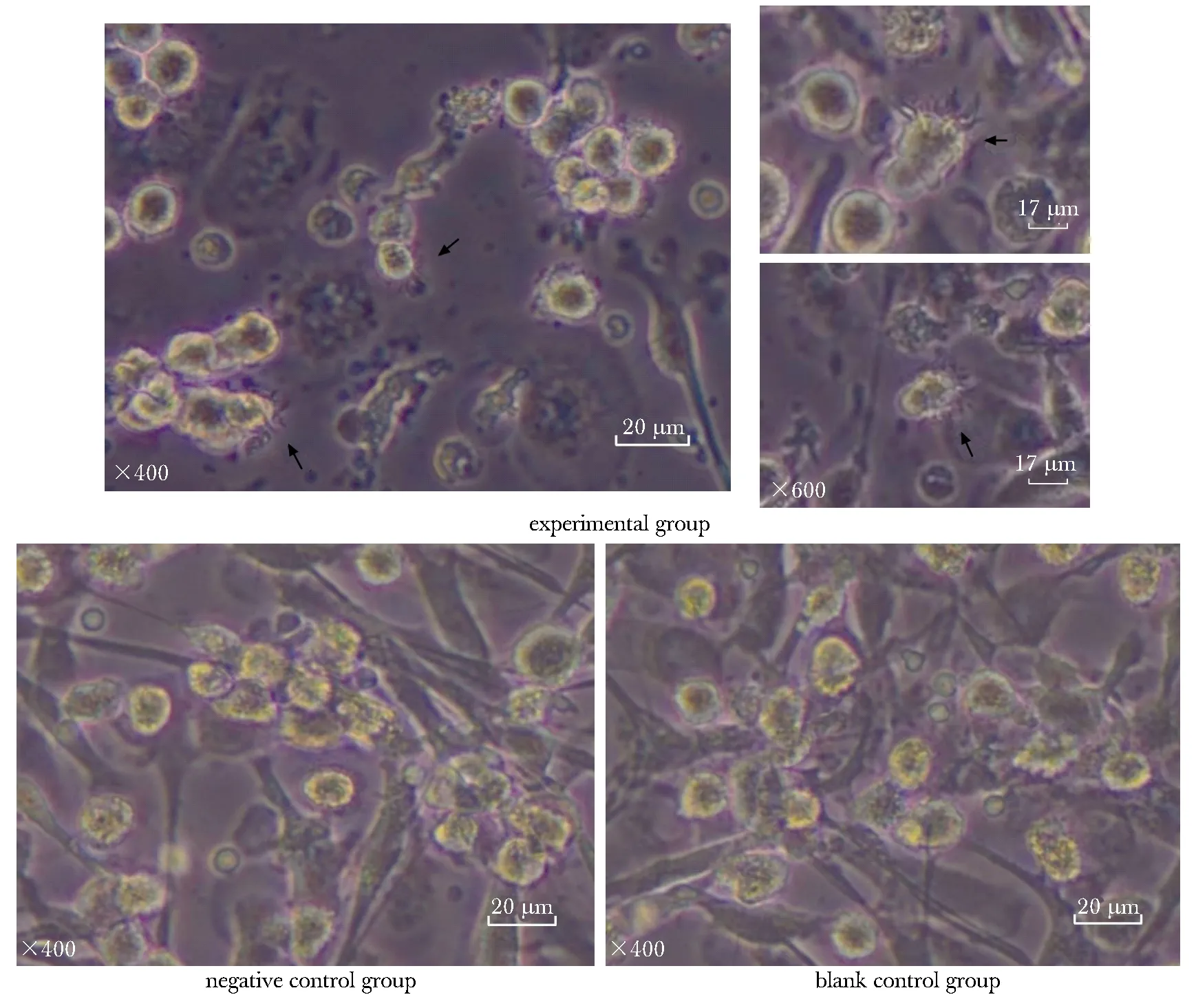
图2 第14天各组DC在倒置显微镜下的生长情况Fig 2 Growth of each group’s DC by inverted microscope on the 14th day

groupCD1aCD83 CD86 negativecontrol24.18±4.8724.12±5.0449.54±4.57blankcontrol21.62±3.7120.39±4.0545.42±5.03experimental49.47±5.16*45.81±5.12*83.92±5.67*
*P<0.05 compared with negative control group and blank control group.

图3 各组DC经流式细胞计分析结果Fig 3 Flow cytometry result of each group’s DC
3 讨论
DC是肿瘤微环境中功能最强大的专职APC,能激活初始型T淋巴细胞针对特异性抗原产生免疫应答[3]。DC具有未成熟(immature DC, imDC)及成熟(mature DC, mDC)两种状态,二者在形态、表型和功能等方面都有较大差异[4]。形态方面:imDC较小较圆,在镜下如葡萄串样集结成簇,呈半贴壁增殖,细胞表面较光滑;而mDC则呈分散悬浮增殖,细胞表面有明显不规则突起[5]。在本实验中,T24细胞上清与PBMC来源的未成熟DC共培养至第14天,光镜下观察结果与上述特征相符。表型方面,imDC少量表达主要组织相容性复合体(major histocompatibility complex,MHC)分子[6]、共刺激分子(如CD80和CD86)[7]等;而mDC则高表达上述分子及一些特征性标记(如CDla、 CD11c和CD83)[8]等。因此,本实验选取CD1a和CD83,以及CD86,分别用来反映DC的成熟度和免疫功能。功能方面,imDC负责抗原的摄取、加工和处理,诱导机体产生免疫耐受,体外激发混合淋巴细胞反应的能力较弱;随着imDC的不断成熟,其摄取、加工和处理抗原的能力逐渐丧失[9],取而代之的是不断增强的呈递抗原的能力以及活化T细胞的能力[10]。由此可见,VEGF通过将DC抑制在未成熟状态,使之只具备加工、处理抗原的能力,而不具备呈递抗原及活化T细胞的能力,故而使DC的抗肿瘤效应无法发挥。
研究证实绝大多数肿瘤都有VEGF分泌,并且在患者的肿瘤组织及血清中都可检测到VEGF异常增高[11],膀胱癌也不例外[12]。而肿瘤细胞分泌的VEGF能够抑制DC的分化成熟,诱发DC凋亡,通过阻碍DC的抗原递呈功能,促使肿瘤发生免疫逃避[13- 14]。本实验中,针对VEGF设计的干扰序列经慢病毒干扰载体感染T24细胞后,PCR和ELISA验证T24细胞VEGF表达下降,感染后的T24细胞上清与未成熟DC共培养之后,经流式细胞计鉴定,实验组DC的CD1a、CD83和CD86的表达量明显高于阴性对照组和空白对照组。证明T24细胞分泌VEGF,抑制了处于同一微环境中DC分化与成熟及免疫功能指标的表达。
综上所述,本研究提示通过对VEGF作用于DC途径的干扰,可增加肿瘤微环境中DC的成熟度,修复DC的免疫功能,同时还可能提高DC疫苗的疗效。
[1] Griffiths TRL. Current perspectives in bladder cancer management[J]. Int J Clin Pract, 2013, 67:435- 448.
[2] Lang F, Linlin M, Ye T,etal. Alterations of dendritic cell subsets and TH1/TH2 cytokines in the peripheral circulation of patients with superficial transitional cell carcinoma of the bladder[J]. J Clin Lab Anal, 2012, 26:365- 371.
[3] Wang H, Zhang L, Zhang S,etal. Inhibition of vascular endothelial growth factor by small interfering RNA upregulates differentiation, maturation and function of dendritic cells[J]. Exp Ther Med, 2015, 9:120- 124.
[4] Tan Y1, Meng Y, Wang Z,etal. Maturation of morphology, phenotype and functions of murine bone marrow-derived dendritic cells (DCs) induced by polysaccharide Kureha (PSK) [J]. Hum Vaccin Immunother, 2012, 8:1808- 1816.
[5] Wang W, Li J, Wu K,etal. Culture and identification of mouse bone marrow-derived dendritic cells and their capability to induce T lymphocyte proliferation [J]. Med Sci Monit, 2016, 22:244- 250.
[6] Kowalewicz-Kulbat M, Ograczyk E, Krawczyk K,etal. Type of monocyte immunomagnetic separation affects the morphology of monocyte-derived dendritic cells, as investigated by scanning electron microscopy[J]. J Immunol Methods. 2016, 439:79- 82.
[7] Zhou QQ, Zhang YL, Zhao M,etal. Mature dendritic cell derived from cryopreserved immature dendritic cell shows impaired homing ability and reduced anti-viral therapeutic effects[J]. Sci Rep. 2016, 6:39071. doi: 10.1038/srep39071.
[8] Wu J, Ji C, Cao F,etal. Bone marrow mesenchymal stem cells inhibit dendritic cells differentiation and maturation by microRNA- 23b[J]. Biosci Rep, 2017, 17. doi: 10.1042/BSR20160436.
[9] Dopheide JF, Zeller GC, Kuhlmann M,etal. Differentiation of monocyte derived dendritic cells in end stage renal disease is skewed towards accelerated maturation [J]. Adv Clin Exp Med, 2015, 24:257- 266.
[10] Katrin H, Daria G, Susann S,etal. The serotonin receptor 5-HT7R regulates the morphology and migratory properties of dendritic cells[J]. J Cell Sci, 2015, 128:2866- 2880.
[11] Kopfstein L, Veikkola T, Djonov VG,etal. Distinct roles of vascular endothelial growth factor-D in lymphangio-genesis and metastasis[J]. Am J Pathol, 2007, 170: 1348- 1361.
[12] Fauconnet S, Bernardini S, Lascombe I,etal. Expression analysis of VEGF-A and VEGF-B: relationship with clinicopathological parameters in bladder cancer[J]. Oncol Rep, 2009, 21:1495- 1504.
[13] Nguyen-pham TN, Lee YK, Kim HJ,etal. Immuno-therapy using dendritic cells against multiple myeloma: how to improve?[J]. Clin Dev Immunol, 2012, 2012:397648. doi:10.1155/ 2012/397648.
[14] Michielsen AJ, Hogan AE, Marry J,etal. Tumour tissue microenvironment can inhibit dendritic cell maturation in colorectal cancer[J]. PLoS One, 2011, 6:e27944. doi: 10.1371/journal.pone.0027944.
Influence of targeted geneVEGFsilencing of bladder cancer cell line T24 on differentiation, maturation and function of dendritic cells
HUANG Yi-ke, DIAO Si-jun, LIANG Ping, ZHOU Ting-ting, WEI Zhi-tao, YANG Wei, WANG Liang*
(Dept. of Urology, Chengdu Military General Hospital, Chengdu 610083, China)
ObjectiveTo observe the influence of targeted geneVEGFsilencing of bladder cancer cell line T24 on differentiation, maturation and function of dendritic cells.MethodsA lentiviral vector named LV-VEGFA-RNAi(experimental group) for gene silencing targetingVEGFand a lentiviral vector named LV-CON(negative control group) without any valid sequences were constructed. The blank control group accepted no intervention measures. The expression of VEGF’s mRNA and protein of T24 cells from each group were detected by RT-PCR and ELISA respectively. Then the immature DCs were co-cultured respectively with the supernatant of all the groups as mentioned above. CD1a, CD83 as the maturation marker and CD86 as the immunity marker of the DCs were detected by flow cytometry.ResultsThe expression of VEGF’s mRNA and protein of T24 cells in the experimental group were obviously inhibited (P<0.05) as compared with that in the negative control group and the blank control group. DCs of the experimental group had an obviously increased(P<0.05) expression of CD1a, CD83 and CD86 compared with the negative control group and the blank control group.ConclusionsTargeted geneVEGFsilencing by RNAi has advantages to the growth and immunity of DCs, which may strengthen the anti-tumor capacity of the DCs by repairing their damaged immune monitoring function.
bladder cancer; microenvironment; VEGF; DC
2016- 10- 31
2017- 05- 02
吴阶平基金(320.6750.13249)
*通信作者(correspondingauthor):wangliangcd@sina.com
1001-6325(2018)01-0057-06
R694;R737.14;R392.12
A

