缬沙坦抑制高糖环境下足细胞损伤的机制探究
朱伶俐+叶迅


[摘要] 目的 通过观察缬沙坦对高糖环境下足细胞EMT过程中ILK、MMP9、NEPH1 mRNA表达的影响,探讨缬沙坦保护受高糖损伤足细胞的可能机制。 方法 将培养分化成熟的足细胞随机分为5 mmol/L 葡萄糖培养组(对照组)和25 mmol/L 葡萄糖培养组(高糖组),在25 mmol/L葡萄糖培养液中分别加入2×10-7 mol/L (低Val组)、2×10-6 mol/L (中Val组)和2×10-5 mol/L(高Val组)缬沙坦。体外培养48 h后,倒置显微镜观察细胞形态,并采用PCR半定量分析技术检测ILK、MMP9、NEPH1的表达。 结果 高糖组细胞NEPH1的表达较对照组显著减少(P<0.01)。而各剂量缬沙坦干预组NEPH1的表达与高糖组相比均显著升高。与对照组比较,高糖组足细胞ILK和MMP9的表达显著升高,而各剂量缬沙坦干预组足细胞ILK和MMP9的表达对比高糖组均明显减少(P<0.01),其中以高Val组的干预作用最显著(P<0.01),高Val组ILK和MMP9的表达与对照组无明显差异(P>0.05)。 结论 缬沙坦可能通过抑制ILK通路保护高糖环境下受损的足细胞。
[关键词] 缬沙坦;足细胞;高糖;上皮-间充质转分化
[中图分类号] R587.2;R692 [文献标识码] B [文章编号] 1673-9701(2017)33-0035-05
[Abstract] Objective To observe the effect of valsartan on ILK, MMP9 and NEPH1 mRNA expression during the EMT process of podocytes under high glucose environment, and to explore the possible mechanism of valsartan in protecting the podocytes from high glucose. Methods The differentiated mature podocytes were randomly divided into 5 mmol/L glucose culture group (control group) and 25 mmol/L glucose culture group (high glucose group). 2×10-7 mol/L valsartan (low Val group), 2×10-6 mol/L valsartan (medium Val group) and 2×10-5 mol/L (high Val group) valsartan were added to 25 mmol/L glucose culture medium. After 48 hours of in vitro culture, the cell morphology was observed by inverted microscope, and the expression of ILK, MMP9 and NEPH1 were detected by PCR semi-quantitative analysis. Results The expression of NEPH1 in high glucose group was significantly lower than that in control group(P<0.01). The expression of NEPH1 in each dose of valsartan intervention group was significantly higher than that in high glucose group. Compared with the control group, the expression of ILK and MMP9 of podocytes in the high glucose group was significantly increased, and the expression of ILK and MMP9 of podocytes in each dose of valsartan intervention group was significantly lower than that in high glucose group(P<0.01). The intervention effect in high Val group was the most significant(P<0.01). The expression of ILK and MMP9 in high Val group was not significantly different from that in control group(P>0.05). Conclusion Valsartan may protect the podocytes from the high glucose environment by inhibiting the ILK pathway.
[Key words] Valsartan; Podocytes; High glucose; Epithelial-mesenchymal transdifferentiation
糖尿病腎病(diabetic nephropathy,DN)是糖尿病主要并发症之一,属于微血管病变的一种,以蛋白尿为主要表现。蛋白尿的形成,其组织学基础可归纳为足细胞足突融合、脱落,致使肾小球滤过屏障受损。足细胞通过已分化上皮细胞向间充质细胞转分化(epithelial-mesenchymal transition,EMT),失去nephrin、P-cadherin和NEPH1-3等上皮细胞特征性蛋白的表达,而上调间充质细胞样表型标志蛋白如整合素连接激酶(ILK)、成纤维细胞特殊蛋白l(fibroblast-specific protein l,FSP-1)和基质金属蛋白酶9(MMP-9)等的表达,是损伤肾小球滤过屏障的关键因素[1]。足细胞的EMT过程存在并影响着DN的进程[2]。研究[3]证实,当足细胞的EMT过程被抑制,足细胞其正常的上皮细胞表型能得以恢复,蛋白尿也随之减少。如何逆转该过程,是目前众多学者的研究热点。endprint
2016版《糖尿病肾病防治专家共识》中,推荐ACEI/ARB作为DN控制血压的药物应用,在肯定其降压效果的同时,鉴于临床文献的缺乏,对其降低尿微量白蛋白的作用不置可否。缬沙坦作为ARB类代表性的药物,在DN的治疗中应用多年,其降低尿微量白蛋白的疗效有目共睹。除降压效果之外,缬沙坦是否能有效减少DN蛋白尿的形成、减慢肾小球滤过率的下降, 延缓DN的进展,从而保护肾脏功能,这值得我们进一步探讨。
本文通过观察ILK、MMP9、NEPH1在不同浓度缬沙坦干预高糖环境下足细胞中的表达变化,探讨缬沙坦除降压之外,治疗DN的可能作用机制。
1 材料与方法
1.1材料来源
1.1.1 细胞与试剂 小鼠的肾小球足细胞由英国伦敦大学国王学院Guy' s 医院赠送,缬沙坦原粉由诺华生物制药有限公司提供;10%胎牛血清购自杭州四季青公司,RPMI 1640培养液购自美国Gibco公司,γ-干扰素购自美国 PEPRO Tech公司;SDS-PAGE凝胶试剂盒购自北京普利莱基因技术有限公司,RT-PCR试剂盒购自日本TaKaRa公司,Trizol提取试剂盒来自美国Invitrogen公司。引物合成PRIMER5.0引物软件设计,由上海生物工程公司合成。
1.1.2 仪器 ABI7900 实时定量荧光 PCR 仪器(美国 ABI 公司);X70光学显微镜(日本Olympus公司);PowerPac Basic WB电泳仪(美国BIO-RAD公司产品),GEL DOC凝胶成像系统。
1.2方法
1.2.1 细胞培养 常规操作复苏小鼠肾小球足细胞,加入含有5 mL 10% FCS1640培养液的25 cm2培养瓶中培养,每培养瓶中含有γ-干扰素500 U,培养箱孵育条件为33℃、5%CO2,细胞增殖后进行传代,细胞传代用0.25%胰蛋白酶-0.02%EDTA消化细胞,传代至所需细胞数后,转移入含有5 mL 10%FCS1640培养液的25 cm2培养瓶中培养,每瓶不加干扰素,培养箱孵育条件变为37℃、5%CO2,培养至细胞形态呈“树枝状”,即足细胞分化成熟。
1.2.2 实验分组 取50 mL细胞培养瓶接种已分化成熟的足细胞,通过RandA 1.0软件完全随机分组法,将足细胞分为5 组,每组5 瓶,A组(对照组D-葡萄糖5 mmol/L)、B组(高糖组,D-葡萄糖25 mmol/L)、C组(低Val组,25 mmol/L D-葡萄糖+缬沙坦 2×10-7 mol/L)、D组(中Val组,25 mmol/L D-葡萄糖+缬沙坦 2×10-6 mol/L)和E组(高Val组,25 mmol/L D-葡萄糖+缬沙坦 2×10-5 mol/L)。在37℃、5%CO2的培养箱孵育48 h后,在倒置显微镜下观察足细胞形态变化,并以RT -PCR 半定量法检测各组足细胞相关蛋白的表达。
1.2.3 RT-PCR半定量法检测相关蛋白RNA表达 先采用 Trizol 试剂和氯仿按照常规方法抽提肾小球足细胞总 RNA ,测定每个 RNA 样品的浓度(单位为μg/mL)后,在逆轉录酶M -MuLV 催化下合成 cDNA;在PCR仪上按照特定扩增条件进行 PCR扩增 反应。
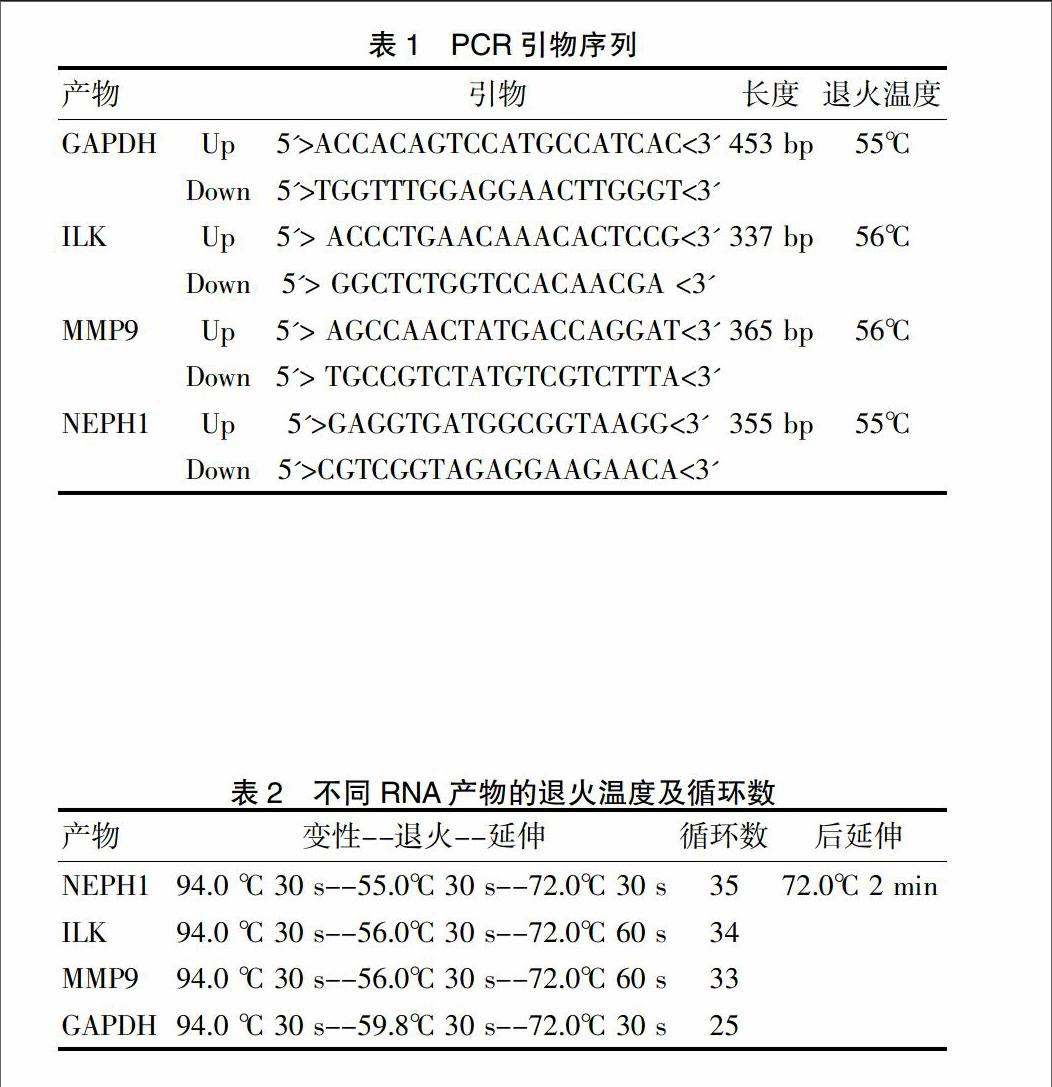
25 μL反应体系配比:dNTP 0.5 μL ,10 ×buffer 2.5 μL,引物正反义链各10 pmol, TaqDNA 聚合酶1.5 u,cDNA 1 μL,加DEPH水至终体积25 μL。阴性对照即不加入cDNA。聚合酶链反应( PCR) 引物正反义链序列见表 1。
1.2.4 扩增反应条件 在94℃ 2 min进行预变性后,根据不同RNA产物采取预实验中取定的退火温度及循环数。见表2。
1.2.5 电泳及凝胶半定量分析 制取1.7%琼脂糖凝胶(含0.5 μg/mL溴化乙锭),将各PCR产物与DNA Marker(购自上海生物工程公司)置入凝胶标本孔中,在0.5%TBE液中在100 V/cm下电泳 30 min,通过BIO-RAD凝胶成像分析系统分析成像,再以Quantity-one进行光密度值测定,将NEPH1、ILK、MMP9的条带光密度值与内参GAPDH的条带的光密度值进行比较,该光密度比值即代表各相关蛋白的mRNA表达的相对值,提示该种蛋白mRNA的表达情况。
1.3 统计学方法
利用SPSS 17.0统计软件对实验数据进行分析。计量资料以(x±s)表示,进行单因素方差分析(ANOVA),两两比较在方差齐时采用LSD检验,方差不齐时采用Tamhane检验。P<0.01为差异有统计学意义。
2 结果
2.1 小鼠足细胞的形态学改变
倒置显微镜下观察,可见A组足细胞分布均匀,基本铺满视野,细胞形态多为“分支状”,分化良好,细胞之间以“树枝状”足突相连,高糖刺激48 h后,足细胞部分凋亡,细胞数量减少,细胞形态发生变化,足突短少,部分呈椭圆形;C组即低剂量Val干预后,可见足细胞数量尚可,部分凋亡,足细胞足突较对照组短少;D组部分细胞聚集,贴壁一般,足细胞数量、形态尚可,足突粗短;E组足细胞数量与A组相似,未见明显凋亡,形态也呈“分支状”,足突细长。
由图1可见,对照组(A组)的肾小球足细胞生长情况良好,形态分化成熟,具有基本的形态特征,呈“树枝状”;高糖组(B组)足细胞部分凋亡,且丧失基本的形态特征,足突短少。而Val干预后,各组(C组、D组、E组)细胞的细胞数量均有所恢复,形态上更接近对照组(A组)足细胞的特征形态,其中高剂量的Val干预后(E组)的数量、形态变化最明显。
2.2 肾小球足细胞ILK、MMP9、NEPH1 mRNA 的表达情况
相较于对照组,高糖组的ILK和MMP9 mRNA的表达均显著升高(P<0.01),而NEPH1 mRNA的表达显著下降(P<0.01)。使用不同剂量Val干预的高糖环境刺激下的足细胞(C组、D组、E组),ILK和MMP9 mRNA的表达均较高糖组相比有不同程度下降,差异具有显著性(P<0.01),而NEPH1 mRNA的表达却显著升高(P<0.01),其中高Val组干预作用最显著,差异具有统计学意义(P<0.01)。而高Val组的ILK、MMP9 mRNA的表达与对照组相比,差异无统计学意义(P>0.05)。见表3、图2、3。endprint
3 討论
足细胞损伤是糖尿病肾病的结构学基础,而足细胞EMT则是足细胞损伤的重要机制之一。因而逆转足细胞EMT过程,是治疗糖尿病肾病,减少尿蛋白排泄的重要途径。目前认为,诱导足细胞EMT的信号通路涉及TGF - β 信号通路、Wnt 信号通路、Hedgehog 信号通路、Notch 信号通路、ILK 信号通路、uPAR 信号通路等[4-9]。各类信号通路交互运作,共同维持间质细胞表型。目前关于足细胞损伤修复的研究,基本基于这些理论,探讨通过抑制或刺激相关信号通路中的某一种蛋白的表达,以期逆转足细胞EMT,恢复足细胞表型特征。
缬沙坦在糖尿病肾病的防治中占有重要地位。2016年美国ADA制定糖尿病诊疗标准中,建议糖尿病肾病患者在积极控制血压、血糖,优化饮食结构的基础上,在尿白蛋白/肌酐比值(≥30 mg/g)及估算肾小球滤过率异常的情况下,适当采用ACEI/ARB等药物控制蛋白尿。
马丽[10]证实大剂量缬沙坦确实能够明显减少糖尿病肾病患者尿蛋白的排泄量,推测可能与缬沙坦抑制血管紧张素Ⅱ(AngⅡ)手套水平、提高胰岛素水平、降低血压有关。另有学者[11]通过与氨氯地平的对照实验证实,缬沙坦对糖尿病肾病确有独立于降压之外的疗效,其机制可能与其在AngⅡ受体水平全面阻断的效应有关。另有研究表明[12],缬沙坦能够通过调控 NADPH 氧化酶表达,来干预高糖刺激后氧化应激水平,从而使细胞外基质发生变化,进而保护足细胞的功能,并减少蛋白尿的产生。高峰等[13]发现缬沙坦具有抑制Notch通路,减少足细胞丢失,降低尿蛋白排泄水平,延缓肾小球硬化的作用。魏静等[14]证实,缬沙坦通过减缓内质网应激并可能通过抑制内质网特有的caspasel2凋亡途径,减少足细胞的凋亡,从而发挥对糖尿病肾病的保护作用。弓慧杰[15]提出缬沙坦能有效延缓肾小管上皮细胞的纤维化进程,具体表现在抑制肾小管上皮细胞转分化、减少高糖诱导的AP-1高表达、降低Periostin蛋白表达方面。缬沙坦是否存在延缓足细胞EMT的作用,及其作用机制,尚缺少相关研究。
肾小球足细胞相关蛋白1(NEPH1) 作为足细胞裂孔隔膜上的标志性蛋白,是足细胞滤过屏障的重要组成部分,维持裂孔隔膜的完整性。足细胞发生EMT时,NEPH1的表达明显下调,故而NEPH1的表达情况,可用于评价足细胞EMT的程度。如何上调足细胞NEPH1的表达,成为保护足细胞的研究热点[16]。
ILK是一种丝/苏氨酸蛋白激酶,广泛存在于细胞胞质中。其可能通过整合素途径调整相关蛋白的表达,破坏基底膜的完整性,从而介导足细胞EMT过程[17]。ILK也是TGF-β/Smads信号传导通路中重要的下游因子。ILK可直接磷酸化多种具有生物学功能的下游效应分子,如磷酸化GSK-3β,失活的GSK-3β可抑制细胞内β-catenin的降解,β-catenin核内聚积反过来又可以调节EMT进程中一列基因的表达[18]。Li Y等[19]提出,ILK表达的增加,可促进足细胞snail表达以及足细胞向间质细胞转分化。研究证实,抑制 ILK的表达后,可明显减少蛋白尿的产生。所以,靶向ILK信号可有效干预蛋白尿肾病[20]。
MMP9属于基质金属蛋白酶(MMPs),是肾小球足细胞发生EMT后的表面标志物之一。Ⅳ型胶原是构成肾小球基底膜的网络状框架的结构基础,而MMP9的主要作用就是降解Ⅳ型胶原。正常情况下,基底膜Ⅳ型胶原的合成与分解呈现一种动态的平衡。而MMP9的表达上调,可以造成基底膜Ⅳ型胶原合成和分解的平衡打破,肾小球基底膜的网状结构破坏,促进足细胞EMT过程[21]。大量研究表明,ILK与MMP9的表达关系密切,ILK可以上调MMP9的表达,而后者也能被ILK抑制剂所抑制,提示ILK可能通过上调MMP-9的表达进而诱导足细胞EMT过程[22]。
本研究证实,高糖环境(25 mmol/L葡萄糖)的诱导刺激下,足细胞NEPH1的表达与正常环境下相比明显下降,而足细胞的ILK、MMP9的表达则与正常环境下相比显著升高。说明高糖环境下,ILK通路过度激活可诱导足细胞EMT。缬沙坦干预后,高糖损伤的足细胞NEPH1的表达相较于正常足细胞有不同程度的升高,ILK、MMP9的表达相较于正常足细胞则有不同程度的减少,这点改变在高剂量缬沙坦组尤为明显,提示Val的干预作用呈一定的浓度依赖性。
综上所述,Val可能通过抑制ILK通路有效缓解高糖诱导的足细胞转分化。这为其独立于降压作用之外通过缓解足细胞EMT的进程来靶向保护足细胞,减轻DN早期蛋白尿,提供了分子生物学依据。
[参考文献]
[1] Durvasula RV,Shankland SJ. Podocyte injury and targeting therapy:An update[J].Curr Opin Nephrol Hypertens,2006,15(1):l-7.
[2] Louis K,Hertig A.How tubular epithelial cells dictate of renal fibrogenesis[J].World J Nphrol,2015,(4):367-373.
[3] Sam R,Wanan L,Gudehithlu KP,et al.Glomerlular epithelial cells transform to myofibroblasts:Early bat not late removal of TGF-Betal reverse transformation[J].Transl Res, 2006,148(3):142-148.
[4] Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial-mesenchymal-transition[J].Nature Reviews Molecular Cell Biology,2014,15(3):178-196.endprint
[5] Garg M. Epithelial-mesenchymal transition- activating transcription factors-multifunctional regulators in cancer[J].World J Stem Cells,2013,5(4):188-195.
[6] Zong D,Yin L,Zhong Q,et al.ZNF 488 enhances the invasion and tumorigenesis in nasopharyngeal carcinoma via the Wnt signaling pathway involving epithelial mesenchymal transition[J].Cancer Res Treat,2016,48(1):334 -344.
[7] Candy PA,Phillips MR,Redfern AD,et al.Notch-induced transcription factors are predictive of survival and 5-fluorouracil response in colorectal cancer patients[J].Br J Cancer,2013,109(4):1023-1030.
[8] Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions[J].J Clin Investi,2009,119(6):1429-1437.
[9] Wang Q,Wang Y,Zhang Y, et al. The role of uPAR in epithelial-mesenchymal transition in small airway epithelium of patients with chronic obstructive pulmonary disease[J].Respiratory Res,2013,(14):67.
[10] 馬丽.大剂量缬沙坦在治疗糖尿病肾病中对患者尿蛋白排泄量和肾功能的影响[J].中国实用医药,2015,10(21):153-155.
[11] Viberti G,Wheeldon NM,MicroAlbuminuria Reduction With Valsartan(MARVAL) Study Investigators.Microalbuminuria reduction with valsartan inpatients with type 2 diabetes mellitus:a blood pressure-independent effect[J].Circulation,2002,106(6):672-678.
[12] 张莹.缬沙坦对糖尿病肾病作用机制的实验研究[D].协和临床医学院,2007.
[13] 高峰,姚敏,王晓梅,等.缬沙坦对糖尿病小鼠肾小球组织 Notch 通路活化及足细胞丢失的影响[J].河北大学学报,2015,36(1):1-4.
[14] 魏静,赵建荣.缬沙坦抑制内质网应激对糖尿病肾损害大鼠足细胞的保护作用[J].武警医学,2015,26(12):1224-1227.
[15] 弓慧杰.缬沙坦对糖尿病肾病肾间质纤维化的影响及其机制初探[D].泸州医学院,2013.
[16] Arif E,Rathore YS,Kumari B,et al.Slit diaphragm protein Neph1 and its signaling:A novel therapeutic target for protection of podocytes against glomerular injury[J].J Biol Chem, 2014,289(14):9502-9518.
[17] Wu H,Ren Y,Pan W,et al.The mammalian target of rapamycin signaling pathway regulates myocyte enhancer factor-2C phosphorylation levels through integrin-linked kinase in goat skeletal muscle satellite cells[J].Cell Biol Int,2015,39(11):1264-1273.
[18] Thornton TM,Pedraza-Alva G,Deng B,et al.Phosphorylation by p38 MAPK as an alternative pathway for GSK3beta inactivation[J].Science,2008,(320):667-670.
[19] Li Y,Tan X,Dai C,et al.Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(9):1907-1918.
[20] Huber MA,Kraut N,Beug H.Molecular requirements for epithelialmesenchymal transtition during tumor pmgression[J].Curr Opin Cell Biol,2005,17(5):548-558.
[21] Bai Y,Wang L,YL,et al.High ambient glucose level smodulates the Production of MMP-9 and alPha5 collagen by cultured podocytes[J].Cell Physiol Biochem,2006, 17(l-2):57-68.
[22] Ito R Oue N,ZhuX,et al. Expression of integrin-linked kinase is closely correlated with invasion and metastasis of gastric carcinoma[J].Virchows Arch,2003,442(2):118-123.
(收稿日期:2017-08-17)endprint

