液态培养条件下烟曲霉去除Cd的研究
陈耀宁+汪元南+黎媛萍+陈艳容+苟宇+朱福造+张道利+刘耀
摘 要:研究了一株高耐Cd的烟曲霉在实验室摇瓶培养条件下对不同浓度Cd的去除效果,测定了其在去除过程中菌株产谷胱甘肽 (GSH) 的变化.结果表明,在重金属Cd浓度为50 mg/L时,烟曲霉去除Cd效率最佳,达到55.5%的去除率,其产生的GSH浓度达到了0.89 μmol/mg.研究比较了不同环境条件下烟曲霉对Cd的去除效率,发现在温度30 ℃,pH 5.0,加液量120 mL,转速100 r/min,接种量0.4 mL(1.0×107 CFU/mL)的培养条件下,烟曲霉能达到最佳去除Cd的效率.通过这种培养条件的优化,烟曲霉较初始条件下对50 mg/L Cd的去除率提高了29.8%,培养体系中GSH浓度增加了0.42 μmol/mg.谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR)的变化表明烟曲霉在优化的液态生长环境下可以较好去除培养体系中的重金属Cd,其产生的GSH对Cd的去除有促进作用,其解毒机制可能是依靠体内GPX和GR将应激产生的氧化性物质去除来实现.
关键词:烟曲霉;谷胱甘肽;液体培养;镉;去除
中图分类号:X506 文献标志码:A
Study on Removal of Cd by Aspergillus fumigatus in Liquid Culture
CHEN Yaoning1,2 ,WANG Yuannan1,2,LI Yuanping3,CHEN Yanrong1,2,
GOU Yu1,2,ZHU Fuzao1,2,ZHANG Daoli1,2,LIU Yao1,2
(1.College of Environmental Science and Engineering,Hunan University,Changsha 410082,China;
2.Key Laboratory of
Environmental Biology and Pollution Control(Hunan University),Ministry of Education,Changsha 410082,China;
3.College of Municipal and Mapping Engineering,Hunan City University,Yiyang 413000,China)
Abstract:The removal efficiency of a Cd-resistant Aspergillus fumigatus under different concentrations of Cd in laboratory flask culture was studied,and the changes of glutathione (GSH) production in the strain were determined. The results showed that the removal rate of Cd was 55.5% when the concentration of Cd was 50 mg/L,and the concentration of GSH was 0.89 μmol/mg. The comparison of Cd removal efficiency by Aspergillus fumigatus under different conditions showed that the optimal condition was 30 ℃,pH value of 5.0,add fluid volume of 120 mL,speed of 100 r/min,and inoculation amount of 0.4 mL (1.0×107 CFU/mL). Under the optimal condition,the removal rate of Cd was 29.8% higher than that under the initial condition,and the GSH content in the culture system was increased by 0.42 μmol/mg. Thechanges of glutathione peroxidase (GPX) and glutathione reductase (GR) indicated that Aspergillus fumigatus could remove the heavy metal Cd in the culture system under the optimized liquid growth conditions,GSH could promote the removal of cadmium,and its detoxification mechanism could be achieved by removing the oxidative substances produced by stress by GPX and GR in vivo.
Key words:Aspergillus fumigatus; glutathione; liquid culture; cadmium; removal
重金属的使用量随着工业化和城市化进程的快速发展不断增多,其在污染环境的同时还导致资源严重短缺.重金属不能被生物降解,但可通过一系列生物链的传遞在生物体内富集,严重威胁到人类的生产和生活,因而高效处理水体中重金属势在必行.镉是一种毒性很大的重金属,其化合物也大多属于毒性物质,极其微量的镉就可对人体造成伤害,震惊世界的日本“痛痛病”就是水田镉污染的典型事例[1].在中国土壤重金属污染状况也十分严重,如2013年5月“镉大米”事件、2014年广西大新县重金属污染事件等等[2].根据我国环境保护部和国土资源部2014年4月发布的《全国土壤污染状况调查公报》可知,全国土壤重金属的超标率为16.1%,其中重金属镉的超标率为7.0%,为首要污染物.我国农田重金属镉污染面积高达2万hm2,镉含量超标的农产品年产量高达14.6亿kg[3].可见我国重金属镉污染的严重性及广泛性.endprint
水体重金属污染的传统处理方法有沉淀法、反渗透法、电渗析法、离子交换法和氧化还原法等[4],但是这些方法成本高、能耗高,会产生二次污染,重金属浓度为1~100 mg/L时成本较高[5],难以很好地解决重金属回收和水资源再利用的问题.生物吸附有着价廉易得、易操作、选择性好、吸附速率快和吸附量大等优点,其中微生物更是被广泛用于水体重金属吸附的研究和实践[6-11].
有研究表明,包括藻类[6-7]、细菌[8-11]和真菌[12-14]在内的微生物体能用于降低水体中重金属含量,其中真菌有着较强的吸附能力,能够在较短的时间内吸附去除较多重金属,其细胞表面有多种基团还可以通过配位结合重金属离子[15].烟曲霉作为大型真菌中曲霉属的一种,对重金属有着较强的耐受性[16],其胞外聚合物对水体重金属吸附[17-18]和胞外产有机酸对土壤重金属淋滤[19]的研究已有一些报道,但将生长中的烟曲霉活体作为一种重金属吸附材料还少有报道.由于活体真菌生长受环境影响较大[20-22],对其在不同环境条件去除Cd的研究有助于推动活体真菌去除水体重金属的研究和实践.
谷胱甘肽系统是生物体内主要的抗氧化防御体系,在维持细胞内环境稳态及机体的解毒代谢中起重要作用.重金属刺激菌体细胞内产生过氧化氢和过氧自由基等氧化物,还原性谷胱甘肽(GSH)不仅可以与这些氧化物质发生氧化还原反应,还能与金属离子通过复杂络合反应形成复合物而将重金属排出体外[23],从而支持机体抵御不利环境条件.有研究证实稀土离子可以与GHS兩端的羟基负离子结合[24],有些金属离子能与GSH中的巯基进行相互作用形成配合物[25].谷胱甘肽过氧化酶(GPX)可将过氧化物在GSH的作用下转化成毒性很小的羟基衍生物,GSH在此过程中被转化为氧化型谷胱甘肽(GSSG),而GSSG可由谷胱甘肽还原酶(GR)催化重新还原成为GSH[26].目前,关于Cd刺激烟曲霉产GSH的相关研究还没有报道过.
本实验选用一株烟曲霉,研究了液体培养条件下活体烟曲霉对不同浓度镉的去除效果,进而优化了烟曲霉去除镉的液体培养条件,测定了不同条件下烟曲霉产GSH的变化,以期寻找烟曲霉去除Cd的较优液态培养条件,揭示Cd去除与GSH变化的关系,并通过结合谷胱甘肽相关酶了解GSH在此过程中的解毒机制,为活体真菌去除重金属的相关研究提供有益参考.
1 材料和方法
1.1 材 料
1.1.1 菌 种
烟曲霉(Aspergillus fumigatus),购于中国普通微生物菌种保藏中心(CGMCC 3.7795).将菌种于土豆琼脂葡萄糖培养基(PDA)30 ℃培养5 d,刮取少量孢子于无菌水中充分震荡,调节体积制备孢子浓度约为1.0×107 CFU/mL的菌悬液.
1.1.2 培养基
土豆琼脂葡萄糖培养基(PDA)配方:新鲜土豆200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL.
真菌液体培养基配方:葡萄糖20 g,蛋白胨10 g,酵母膏5 g,蒸馏水1 000 mL.
1.2 试验方法
1.2.1 试验设计
于250 mL锥形瓶中加入真菌液体培养基100 mL,称取适量硝酸镉,分别制备镉浓度为20,50,100和200 mg/L的液体培养基,用0.1 mol/L HNO3调节pH为5.0,再接种以上菌悬液1 mL于锥形瓶中,置于150 r/min,25 ℃下摇瓶培养,3 d后取样,8 000 r/min离心10 min,取上清液测定剩余Cd浓度[27].
通过上述试验确定烟曲霉最适镉去除浓度后,进行液体吸附培养条件的优化:首先设置pH为3.0,4.0,5.0,6.0和7.0,参考相关文献[19]其它初始条件设置为转速150 r/min,温度25 ℃,加液量100 mL,菌种接种量1 mL进行摇瓶培养实验,取样测定镉浓度后确定最优pH值,然后采用同种方法逐一对温度(10,20,25,30和37 ℃)、转速(100,120,150,180和200 r/min)、加液量(即液体培养基体积:30,50,70,100和120 mL)、菌悬液加入量(0.1,0.2,0.4,0.6和0.8 mL)开展优化实验,每一步参数优化实验时均采用已经确认优化过参数值,逐步对未优化参数进行考察.最后选定优化的条件再次对不同浓度Cd下的去除效果进行验证.上述不同条件吸附试验均在震荡培养箱中进行,接种3 d后取样,8 000 r/min离心10 min,上清液稀释100倍后于原子吸收光谱仪(AAS)上测定液体培养基中镉的浓度.根据吸附前后镉浓度差计算烟曲霉对镉的去除率:
去除率(%)= (C0-C1)/C0 × 100%
式中:C0为重金属初始浓度;C1为经菌体吸附后剩余重金属浓度.
1.2.2 GSH的测定
取离心后的菌体50 mg,用5 mL无菌生理盐水(0.85% NaCl)仔细冲洗两次,于4 000 r/min下离心10 min,湿菌体用40%乙醇于60 ℃下水浴2.5 h,然后于4 ℃,5 000 r/min下离心20 min,上清液过0.45 μm滤膜,滤液采用紫外分光光度法测定GSH的浓度[28].
1.2.3 抗氧化酶的测定
新鲜菌体用去离子水冲洗2次,然后在滤纸上吸干水,准确称取50 mg菌丝体在液氮上研磨,再在12 000g离心10 min,上清液作为用于酶活性测定的酶液.GR活性参考Smith的测定方法[29],反应混合物1 mL中含100 mmol/L磷酸钠缓冲液(pH 7.0),1 mmol/L GSSG,60 μmol/L NADPH和上清液,反应300 s后于340 nm下测定.GPX活性的测定参考Flohe的测定方法[30],反应体系含0.2 mL 1.0 mmol/L GSH(含2.5 mmol/L NaN3)和酶液0.2 mL,由37 ℃预热的1.5 mmol/L H2O2 0.1 mL 启动反应, 37 ℃水浴中反应180 s,加2 mL 1.67% 的偏磷酸沉淀蛋白质,5 000g离心20 min,取1.25 mL上清液混合0.25 mL DTNB 5,5-二硫代双(2-硝基苯甲酸),反应300 s后于422 nm下测酶活定.每组实验做3次平行取平均值.endprint
2 结果与讨论
2.1 烟曲霉对不同重金属Cd的去除率及其产GSH含量的影响
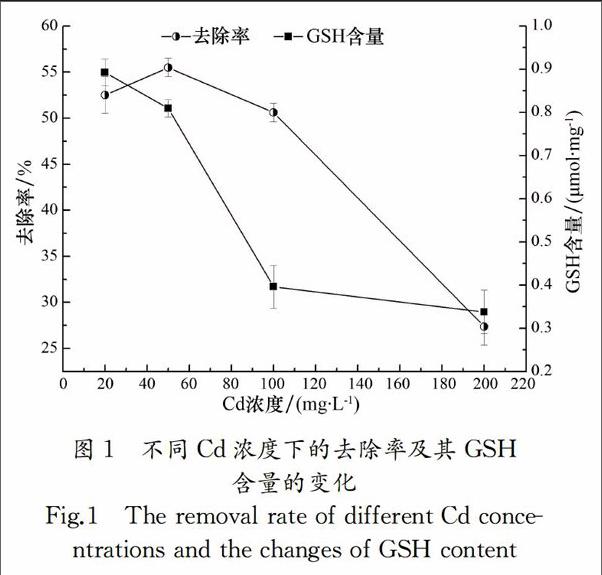
重金属Cd有较强的低离子毒性效应,烟曲霉对不同浓度Cd的去除效果及其GSH含量的变化如图1所示.从图中可以看出除Cd浓度为200 mg/L外,烟曲霉对水体中重金属Cd的去除效果约为50%,且当Cd的浓度为50 mg/L时,去除率最大,为55.5%,而GSH含量为0.89 μmol/mg,在Cd浓度从50 mg/L升高到200 mg/L过程中含量逐渐下降,这与Xu的研究结果类似[31],表明Cd能抑制GSH的总量,Cd浓度越大,这种抑制作用越强.烟曲霉对Cd的较适去除浓度为50 mg/L,高于此浓度,特别是当浓度达到200 mg/L时,去除率明显下降,由于Cd在高浓度时对烟曲霉有毒害作用,且重金属浓度越高,这种毒性作用越强,菌体生长受到抑制,从而产生的GSH含量下降,进而抑制菌体对重金属Cd的去除效果[32].
2.2 pH对烟曲霉去除重金属及其产GSH含量的影响
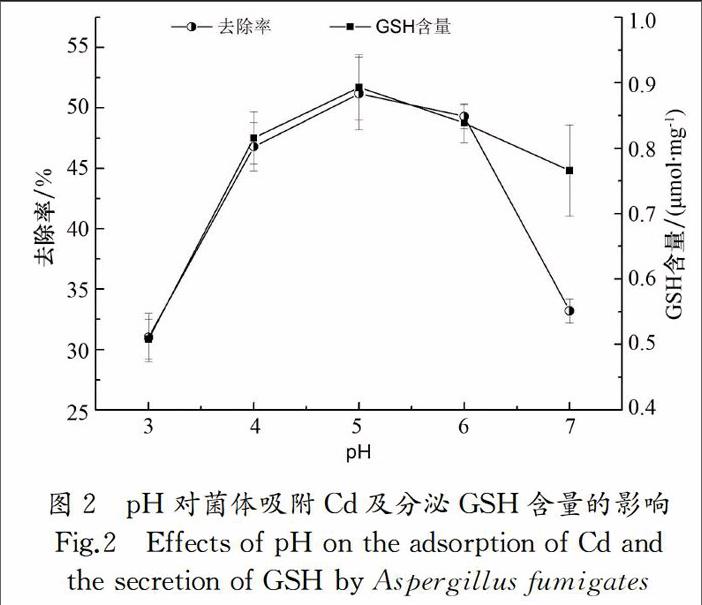
pH能影响细胞表面的金属吸附位点和金属离子的存在形态,对真菌吸附重金属起十分重要的作用[4].不同微生物对不同重金属离子的最佳去除pH不同,如固定化青霉吸附Pb2,Cu2+的最佳pH约为5.5[33],黑曲霉吸附Pb2+的最佳pH为5,吸附Cd2+时则为3[34].图2所示为不同pH下烟曲霉去除Cd和GSH含量的变化,从剩余Cd含量可以看出当pH为5时,去除率和GSH含量均达到最大值,分别为51.2%和0.89 μmol/mg.pH为3时去除效果不佳,可能原因是水合氢离子占据了菌体表面重金属的吸附位点,产生斥力作用阻碍重金属离子接近细胞壁.
当pH为7时,去除效率下降,这可能是此时pH超过了菌体最适生长条件,使得菌体对水体中重金属Cd的去除率呈现下降的趋势.另外,本研究中GSH含量与重金属去除率的变化趋势基本相同,当pH为4~6时,GSH含量均大于0.80 μmol/mg,较低和较高pH时,GSH含量均降低,这可能是因为pH 4~6是烟曲霉的较适生长pH值,在其它pH环境下,菌体的生长都受到了影响,产生的GSH也较少.
2.3 温度对烟曲霉去除Cd及产GSH含量的影响
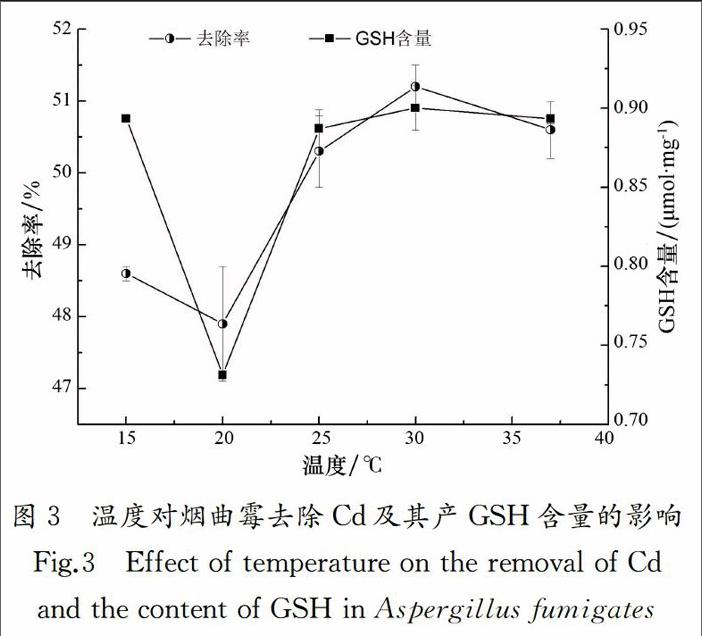
微生物均有最适生长温度,温度过高或者过低都会影响生长,进而影响对重金属的吸附效果.图3为不同温度下烟曲霉对Cd去除率及GSH含量的影响.在15~37 ℃时,烟曲霉对Cd去除率变化不是很大;当温度为30 ℃时,重金属的去除率最大;但在15 ℃时,GSH含量却明显较低,可能是因为在此温度下,真菌活性受到一定程度的抑制,从而GSH含量较低;而当温度高于25 ℃时,GSH含量总体上也维持在0.9 μmol/mg.
2.4 加液量对烟曲霉去除Cd及产GSH含量的影响
加液量也是影响微生物吸附重金属一个重要的参数,图4为不同加液量对烟曲霉吸附水体中Cd及产GSH含量的影响.由图可以看出随着加液量的增加,烟曲霉对重金属的去除率逐渐增加,并在加液量为120 mL时达到最大值,最大去除率为50.4%,在加液量为50和70 mL时,去除率相差不大,但是GSH含量却相差较大,后者比前者GSH增加了18%,可能原因为当加液量为50 mL时,微生物的生长空间受到限制,从而使得微生物生长量较少;相反,当加液量为70 mL时,则有利于微生物生长,微生物的生物量增加,从而分泌的GSH含量也对应增加.本实验设置在250 mL锥形瓶中完成,过高加液量会影响振荡和培养基供氧,综合比较设置所考察的最大加液量为120 mL,实验结果也表明此为最适加液量.
2.5 转速对烟曲霉去除Cd及产GSH含量的影响
转速对烟曲霉去除Cd和产GSH含量的影响如图5所示.随着转速的增加,烟曲霉对Cd的去除先增加后减少,100 r/min条件下的去除率与120 r/min较为接近,去除率约为49%.综合考虑100 r/min培养条件为最佳转速,200 r/min時去除率只有41.5%,相应的产GSH含量也最低,可能是因为剧烈的机械搅拌产生了较强的剪切作用,并且促使涡流显现,破坏了吸附的均质性,影响菌株生长,从而使去除率下降[35].
2.6 不同接种量对烟曲霉去除Cd及其GSH含量的影响
接种量的多少会影响菌体在液态基质中的生长量变化,从而可能间接影响菌体对重金属的吸附效果.本研究中不同接种量下烟曲霉去除Cd及产GSH含量的变化如图6所示.可以看出,烟曲霉对水体Cd的去除率基本稳定在50%左右,当接种量为0.4 mL(1.0×107 CFU/mL)时,GSH含量最大为1.20 μmol/mg,这比接种量为0.1 mL时高57%,而比接种量为0.8 mL时高47%,该接种量下剩余重金属浓度含量最低,表明相应的去除率相对高于其他组,这说明并不是菌悬液接种量越大越好,只有接种适量的菌悬液才能获得最佳的去除效果.造成去除率变化不大的原因是由于培养条件相同下,菌体呈对数快速增长,菌体生物量能在短时间内达到受营养条件控制的稳定水平,因而对溶液中Cd的去除差别不大.而GSH含量在接种量为0.4 mL时达到最大,此时剩余Cd的含量最少,可能是这种接种量条件下,菌体的增值代谢和产生GSH的时机最契合[36].
2.7 优化条件下烟曲霉对重金属的去除与产GSH含量的影响
通过以上分析,可以看出Cd去除率在pH和接种量所考察范围内呈现了先升后降的变化趋势,最佳条件明显.其他因素组合需要进一步确认.考虑到实验量的因素,本次研究中选定了接种量为0.4 mL(1.0×107 CFU/mL),pH为5.0为最优值,在此基础上对其他参数选择去除率较高的水平进行考察,设计了四因素三水平正交实验进行进一步的优化,实验结果如表1所示.
由正交实验的结果可知,温度为30 ℃,转速为100 r/min,Cd为50 mg/L,加液量为120 mL时菌体对水体中Cd的去除率最大,最大去除率为85.2%.选定以上正交实验最优条件,验证烟曲霉对不同浓度重金属Cd的去除效果,结果如表2所示.相对于初始设置下的结果(图1),烟曲霉对Cd的去除率明显提高,在浓度为50 mg/L时,去除率提高了29.80%,GSH含量增加了0.42 μmol/mg,直接观察培养体系发现菌体浓度明显增加,这可能是Cd去除率和GSH含量增加的主要原因,即使在Cd浓度为200 mg/L时,去除率也达到了43.70%,提高了16.30%,此时GSH含量明显低于低浓度Cd下GSH的含量,再次证实高浓度Cd对烟曲霉有明显的抑制作用,且随着重金属浓度增加,这种抑制作用也在逐渐增加.endprint
2.8 优化条件下烟曲霉产GPX和GR酶活变化
优化条件下,烟曲霉在应对Cd胁迫下产GPX和GR活性变化曲线如图7所示.GPX的活性随着Cd浓度增加而先升后降,在培养6 h和Cd为50 mg/L时,最大达到15.62 U/mg,且在Cd浓度为200 mg/L时,GPX活性含量较低,可能由于该高浓度Cd作用下体内积累Cd过多,大量的Cd与Se-Cys结合导致GPX活性中心受到破坏,使酶酶活力下降.GSH在GPX催化作用下可将H2O2转化为水而实现解毒,由表1 可知,二者变化趋势基本吻合.
在培养前期(18 h前),Cd对GR无显著影响(图7);而在此之后,GR活力开始随Cd浓度的增大而下降.GR能将氧化性谷胱甘肽(GSSG)还原成GSH[26],Cd浓度为50 mg/L时GR明显比其他组高,这与GSH变化趋势一致(表2).
2.9 各因素之间的相互关系及与GSH的相互影响
本研究结果综合表明所采用的培养体系下活体烟曲霉对水体Cd有一定的去除效果.由于活体菌体的生长需要控制一定的环境条件,因而包括以上6种因素的环境条件会对菌体生长产生综合影响,既是对菌体正常生长的保证,尽可能多的菌体是对去除效果的基本保证.同时这些因素也是对去除效果的优化,尤其是适度的Cd存在是对活体真菌产生GSH的有效刺激.所以这些因素对于我们的研究目标,是相互关联也是综合作用的.而GSH的产生则依赖于菌体的正常生长而分泌,因而本实验优化培养条件来保障菌体的生长和对Cd浓度的去除.通过逐步筛选试验和正交实验,确定最佳组合条件为温度为30 ℃,转速为100 r/min,Cd浓度为50 mg/L,加液量为120 mL,pH5.0,接种量为0.4 mL(1.0×107 CFU/mL).由于Cd2+对菌体具有一定程度的毒性作用(图1),浓度过高时,甚至会对菌体的生长产生明显的抑制作用[30],不利于环境中Cd的去除.在适量Cd2+(50 mg/L)刺激下,菌体分泌的GSH增多并且不至于对菌体产生过度的抑制作用,更加有利于体系中Cd的去除,这同时也是菌体抵御不利的环境条件的解毒响应[16].通过分析各种环境条件下去除率与GSH含量的变化,发现二者明显正相关.谷胱甘肽体系是生物体内主要的抗氧化系统,因GSH与GSSG之间存在一定循环,之间有GPX和GR之间的相互转化,而GSSG在整个过程中含量几乎可以忽略,因研究主要考察GSH在培养过程中的变化,并且测定了GPX和GR在实验过程中的变化趋势,以进一步了解GSH的解毒机制,由2.8部分可以看出GSH的解毒机制可能是依靠体内GPX和GR将应激产生的氧化性物质去除,进而达到体内的抗氧化效果,维持机体内正常的稳态环境[26].
3 结 论
1)烟曲霉在液态培养生长状态下可以去除培养液中约50%的Cd,且在重金属Cd浓度为50 mg/L时去除效果最好,达到55.5%.选用优化的培养条件可以在Cd浓度为50 mg/L时将去除率提高29.8%.表明烟曲霉在优化的液体培养条件下,其活菌体能以较高效率去除液体中的Cd.
2)烟曲霉在摇瓶中去除液体培养体系中Cd的较优条件为温度30 ℃,pH 5.0,加液量120 mL,转速120 r/min,接种量0.4 mL(1.0×107 CFU/mL).
3)GSH在烟曲霉活性生长状态下对Cd的去除发挥着重要作用,GSH含量的增加与Cd的去除呈正相关,GSH含量越大,去除率越高,反之则越小.GSH解毒是由GPX和GR将胞内过多氧化性物质氧化分解或者与Cd结合成螯合物排出体外来实现.
参考文献
[1] 李华,程芳琴,张秋花,等. 重金属镉污染水体的吸附修研究[J]. 无机盐工业,2005,37(3):43-44.
LI Hua,CHENG Fangqin,ZHANG Qiuhua,et al. Study on adsorption of Cd2+ contaminated water by corn stalk[J]. Inorganic Chemicals Industry,2005,37(3):43-44.(In Chinese)
[2] 刘洋,张玉烛,方宝华,等. 栽培模式对水稻镉积累差异及其与光合生理关系的研究[J].农业资源与环境学报,2014,31(5):450-455.
LIU Yang,ZHANG Yuzhu,FANG Baohua,et al. Relationships between cadmium uptake characteristics and photosynthetic physiology under different cultivation modes of rice[J].Journal of Agricultural Resources and Environment,2014,31(5):450-455.(In Chinese)
[3] 常青. “鎘大米”给人类以警告[J].中国食品,2013,627(11):56.
CHANG Qing.“Cadmium rice”gives warning to mankind[J].China Food,2013,627(11):56.(In Chinese)
[4] 王建龙,陈灿.生物吸附法去除重金属离子的研究进展[J].环境科学学报,2010,30(4):673-701.
WANG Jianlong,CHEN Can. Advances in biological removal of heavy metal ions adsorption[J].Journal of Environmental Science,2010,30(4):673-701. (In Chinese)endprint
[5] GUPTA V K,RASTOGI A. Equilibrium and kinetic modelling of cadmium (II) biosorption by nonliving algal biomass oedogonium sp. from aqueous phase[J]. Journal of Hazardous Materials,2008,153(1): 759-766.
[6] 胡肖容. 藻类对重金属污染水体的生物吸附[J]. 科技信息,2009(4):332-333.
HU Xiaorong. Algae biological adsorption of heavy metals in polluted water[J]. Science and Technology Information,2009(4):332-333. (In Chinese)
[7] ANASTOPOULOS I,KYZAS G Z. Progress in batch biosorption of heavy metals onto algae[J].Journal of Molecular Liquids,2015,209:77-86.
[8] SHI Yan,SUN K,QI Xuebin,et al. The fabrication of bioceramsite for the removal of heavy metals and its toxicity to bacteria[J]. Journal of Wuhan University of Technology:Materials Science Edition,2015,30(3): 649-654.
[9] ARYAL M,LIAKOPOULOU-KYRIAKIDES M. Bioremoval of heavy metals by bacterial biomass[J].Environmental Monitoring and Assessment,2015,187(1):1-26.
[10]DU H H,CHEN W L,CAI P,et al. Cadmium adsorption on bacteria-mineral mixtures: effect of naturally occurring ligands[J].European Journal of Soil Science,2016,67(5): 641-649.
[11]JAIN M,GARG V K,KADIRVELU K,et al. Adsorption of heavy metals from multi-metal aqueous solution by sunflower plant biomass based carbons[J]. International Journal of Environmental Science and Technology,2016,13(2): 493-500.
[12]金慧清,程昌合,徐清泉,等. 煙草内生真菌对烟草生长和烟叶重金属含量的影响[J]. 菌物学报,2017,36(2):186-192.
JIN Huiqing,CHENG Changhe,XU Qingquan,et al. Effects of endophytic fungi on tobacco growth and heavy metal content in leaves[J].Mycosystema,2017,36(2):186-192.(In Chinese)
[13]徐在超,史亚楠,张仁铎,等.三株具重金属抗性油菜内生真菌对镉铅锌富集特性研究[J].中山大学学报:自然科学版,2016,55(6):153-160.
XU Zaichao,SHI Yanan,ZHANG Renduo,et al.Bioaccumulation of Cd,Zn and Pb by three heavy metal-resistant endophytic fungi isolated from rapes[J].Journal of Zhongshan University:Natural Science,2016,55(6):153-160.(In Chinese)
[14]DHAMI N K,QUIRIN M E,MUKHERJEE A. Carbonate biomineralization and heavy metal remediation by calcifying fungi isolated from karstic caves[J].Ecological Engineering,2017,103(7):106-117.
[15]曹勇,王冰菱,张漪蒙,等.生物膜胞外聚合物的提取及其对重金属的吸附机理[J].上海环境科学,2013,32(4):139-142.
CAO Yong,WANG Bingling,ZHANG Yimeng,et al.Extraction of extracellular polymeric substances from biofilm and adsorption mechanism of heavy metals[J].Shanghai Environrntal Scienes,2013,32(4),139-142.(In Chinese)
[16]FAZLI M M,SOLEIMANI N,MEHRASBI M,et al.Highly cadmium tolerant fungi: their tolerance and removal potential[J].Journal of Environmental Health Science & Engineering,2015,13(1):1-9.endprint
[17]YIN Y,HU Y,XIONG F.Biosorption properties of Cd (II),Pb (II),and Cu (II) of extracellular polymeric substances (EPS) extracted from Aspergillus fumigatus and determined by polarographic method[J].Environmental Monitoring and Assessment,2013,185(8):6713-6718.
[18]YIN Y,HU Y,XIONG F.Sorption of Cu (II) and Cd (II) by extracellular polymeric substances (EPS) from Aspergillus fumigatus[J].International Biodeterioration & Biodegr-adation,2011,65(7):1012-1018.
[19]SEH-BARDAN B J,OTHMAN R,ABWAHID S,et al.Column bioleaching of arsenic and heavy metals from gold mine tailings by Aspergillus fumigatus[J].Clean-Soil,Air,Water,2012,40(6):607-614.
[20]杨晓雯,赵宝玉,路浩,等.不同培养条件对甘肃棘豆内生真菌多样性的影响[J].畜牧兽医学报,2013,44(10):1660-1666.
YANG Xiaowen,ZHAO Baoyu,LU Hao,et al.Effect of different culture conditions on diversity of endophytic fungi in oxytropis kansuensis[J].Chinese Journal of Animal and Veterinary Sinica,2013,44(10):1660-1666.(In Chinese)
[21]柴迪迪,郭素娟,孙小兵,等.燕山地区7种板栗外生菌根真菌培养条件的优化[J].西北农林科技大学学报:自然科学版,2014,42(4):109-116.
CHAI Didi,GUO Sujuan,SUN Xiaobing,et al.Optimization of culture conditions for 7 chestnut ectomycorrhizal fungi in Yanshan Area[J].Journal of Northwest A&F University:Natural Science Edition,2014,42(4):109-116.(In Chinese)
[22]刘冬明,袁德义,邹锋,等.3种锥栗外生菌根真菌培养条件的单因素优化[J].西北林学院学报,2016,31(2):195-200.
LIU Dongming,YUAN Deyi,ZOU Feng,et al.Optimization of culture conditions for 3 castanea henryi ectomycorrhizal fungi[J].Journal of Northwest Forestry University,2016,31(2):195-200.(In Chinese)
[23]冯立,郑佳昳.谷胱甘肽与重金属离子的相互作用机制及治疗皮肤损伤的研究进展[J].保健医学研究与实践,2016,13(3):91-92.
FENG Li,ZHENG Jiayi.Mechanism of interaction between glutathione and heavy metal ions and progress in the treatment of skin injury[J].Health Medicine Research and Practice,2016,13(3):91-92.(In Chinese)
[24]PODANYI B,REID R S. NMR study of the conformations of free and lanthanide-complexed glutathione in aqueous solution[J].Journal of the American Chemical Society,1988,110(12):3805-3810.
[25]时萌,王芙蓉,王棚涛.植物响应重金属镉胁迫的耐性机理研究进展[J].生命科学,2016,28(4):504-512.
SHI Meng,WANG Furong,WANG Pengtao.Research advances in the tolerance mechanism of plant response to heavy metal cadmium stress[J].Chinese Bulletin of Life Sciences,2016,28(4):504-512.(In Chinese)
[26]武冬梅,孟紫强,耿红,等.SO2吸入对小鼠组织谷胱甘肽氧化還原系统的影响[J].应用与环境生物学报,2003,9(2):163-166.
WU Dongmei,MENG Ziqiang,GENG Hong,et al.Effects of sulphur dioxide inhalation on gluthione redox system in organs[J].Chinese Journal of Applied and Environmental Biology,2003,9(2):163-166.(In Chinese)endprint
[27]王家强.生物吸附法去除重金属的研究[D].长沙:湖南大学环境科学与工程学院,2010:17-18.
WANG Jiaqiang. Removal of heavy metals by biosorption[D].Changsha:College of Environmental Science & Engineering,Hunan University,2010:17-18. (In Chinese)
[28]LIANG G,LIAO X,DUG,et al.A new strategy to enhance glutathione production by multiple H2O2 -induced oxidative stresses in Candida utilis[J].Bioresource Technology,2009,100(1):350-355.
[29]SMITH I K,VIERHELLER T L,THORNE C A.Assay of glutathione reductase in crude tissue homogenates using 5,5′-dithiobis(2-nitrobenzoic acid)[J].Analytical Biochemistry,1988,175(2):408-413.
[30]FLOHE L,GNZLER W A,SCHOCK H H.Glutathione peroxidase: A selenoenzyme[J].Febs Letters,1973,32(1):132-134.
[31]XU P,LIU L,ZENG G,et al.Heavy metal-induced glutathione accumulation and its role in heavy metal detoxification in Phanerochaete chrysosporium[J].Applied Microbiology & Biotechnology,2014,98(14):6409-6418.
[32]JAECKEL P,KRAUSS G J,KRAUSS G.Cadmium and zinc response of the fungi Heliscus lugdunensis and Verticillium cf. alboatrum isolated from highly polluted water[J].Science of the Total Environment,2005,346(1/3):274-279.
[33]徐雪芹,李小明,楊麒,等.丝瓜瓤固定简青霉吸附废水中Pb~(2+)和Cu~(2+)的机理[J].环境科学学报,2008,28(1):95-100.
XU Xueqin,LI Xiaoming,YANG Qi,et al.Vegetable sponge fixed JianQing mildew Pb~(2+) in waste water adsorption and the mechanism of Cu~(2+)[J].Journal of Environmental Science,2008,28(1):95-100. (In Chinese)
[34]刘云国,冯宝莹,樊霆,等.真菌吸附重金属离子的研究[J].湖南大学学报:自然科学版,2008,35(1):71-74.
LIU Yunguo,FENG Baoying,FAN Ting,et al.Study of fungi adsorption of heavy metal ions[J].Journal of Hunan University:Natural Sciences,2008,35(1):71-74.(In Chinese)
[35]樊霆.真菌对重金属的抗性机制和富集特性研究[D].长沙:湖南大学环境科学与工程学院,2009:91-92.
FAN Ting. Study offungi resistant mechanism and enrichment characteristics of heavy metals[D]. Changsha:College of Environmental Science & Engineering,Hunan University,2009:91-92.(In Chinese)
[36]LIMA A I G,CORTICEIRO S C.Glutathione-mediated cadmium sequestration in Rhizobium leguminosarum[J].Enzyme & Microbial Technology,2006,39(4):763-769.endprint

