全缘马尾藻(Sargassum integerrimum)生殖细胞排放规律及人工促排条件*
欧泽奎 刘东超 谢恩义 吴启藩
(广东海洋大学 湛江 524088)
全缘马尾藻(Sargassum integerrimum)是一种中国特有的大型褐藻, 隶属褐藻门, 墨角藻目, 马尾藻科, 主要产于广东省沿海。藻体雌雄异株, 自然生长于低潮带石沼中(曾呈奎等, 2000)。全缘马尾藻具有很高的营养价值, 富含人体需要的不饱和脂肪酸(卢虹玉等, 2013a)。它还具有多种潜在的药用价值, 研究发现从藻体中提取的多糖类物质有神经保护作用及抗氧化功能。此外, 藻体中还富含具有抗肿瘤、抗氧化效果的褐藻多酚类物质(卢虹玉等, 2013b; Jin et al,2014; 肖为等, 2015)。全缘马尾藻极具开发价值, 但目前全缘马尾藻工厂化育苗程度低, 严重制约了其大规模栽培。
目前, 采苗量低是马尾藻人工育苗中亟需解决的关键问题之一。研究表明, 导致雌雄异株类马尾藻采苗量低的主要原因有两个。一是生殖细胞排放量少、不同步, 导致可用于采苗的受精卵量少(Pang et al,2005; Fu et al, 2014)。二是一些马尾藻的受精卵产生的假根部分会大量分泌“黏液”粘附在生殖托上(Inoh et al, 1932), 呈现“挂卵”的特性, 使得大多数受精卵不能在 24h内脱落到采苗设施上(张婧, 2012), 从而导致受精卵在采苗设施上的附着率低(Pang et al,2005; Fu et al, 2014)。同时, 马尾藻的生殖托从完全成熟到生殖细胞排放完成之间的周期长(徐金根,2013)。据此推测在马尾藻人工育苗过程中可通过提高受精卵的脱落量来提高采苗率, 缩短促排时间和排卵时间来提高育苗效率。国内外已报道了羊栖菜(Hizikia fusiforme)、鼠尾藻(Sargassum thunbergii)、铜藻(Sargassum horneri)的生殖细胞排放规律, 以及通过改变温度、盐度、水流速度等关键环境条件可提高藻体的采苗量(Pang et al, 2005, 2006, 2009; Zou et al,2005; 王增福等, 2007; Liu et al, 2016),且有研究发现温度、盐度等环境因子是引发半叶马尾藻(Sargassumhemiphyllum)、海黍子(Sargassum muticum) 生殖细胞释放的关键因子(Kam et al, 2016; Kerrison et al,2016)。而目前关于全缘马尾藻的生殖细胞排放规律未见报道, 其人工育苗技术的基础研究很少, 仅见报道了温度、水流速度及干出处理对幼孢子体生长的影响(黄苑媚等, 2014; 孙宗红等, 2015; 欧泽奎等,2016)。所以, 本文探究了全缘马尾藻生殖细胞的排放规律以及温度、盐度和水流速度等主要环境因子的改变对排卵量、受精量、脱落卵量、促排时间和排卵时间的影响, 以期找到最适的人工促排条件, 进而为提高人工育苗生产中的采苗率提供依据。
1 材料与方法
1.1 实验材料
观察实验及单因子实验材料: 2014年5月上旬从湛江市徐闻县四塘村的近岸海域(110°08′E, 20°14′N)采集全缘马尾藻成藻, 此时藻体上的生殖托刚开始成熟, 并可通过生殖托形状辨别雌、雄藻体。观察实验使用促熟的生殖托, 促熟条件为在温度29°C、光照强度7000lx, 光照周期18h∶6h[光照(L)∶黑暗(D)]、盐度33条件下充气培养。单因子实验使用暂养成熟的生殖托, 在温度(25±0.5)°C、光照强度(3000±100)lx,光照周期12h∶12h(L∶D)、盐度 33±0.5条件下充气暂养。雌、雄藻体上的生殖托同步达到完全成熟后,挑取托内生殖细胞已成熟的雌、雄生殖托, 并用已消毒的手术刀将生殖托从藻体上取下后用于实验。培养液用已灭菌的PESI培养液, pH值8.2±0.2, 每天更换一次。正交优化实验材料: 2015年5月上旬从同一海域采集并按上述单因子实验采用的方法处理。
论文中PESI培养液为PESI储存液与消毒海水按照体积比 1∶49的比例混合而成的混合液。PESI储存液的组成成分为, NaNO3、NH4Cl、Na2HPO4·12H2O、甘油磷酸钠、EDTA与 Fe按摩尔比 1∶1配制、PII金属液、Tris、KI, 各组分的相应浓度为 3.5g/L、0.5g/L、0.5g/L、0.5g/L、0.025g/L、250ml/L、5g/L、0.001g/L, 该储存液由蒸馏水配制, pH值调节为7.8。PII金属液组分为, EDTA·2Na、FeCl3、H3BO3、MnCl2、ZnCl2、CoCl2, 各组分的相应浓度为1g/L、0.01g/L、0.2g/L、0.04g/L、0.005g/L、0.001g/L, 该金属液由超纯水(Milli-Q Advantage 10, MILLIPORE)配制。消毒海水为经沙滤及暗处理的自然海水煮沸消毒 20min,冷却至常温, 12h后再次煮沸消毒20min, 冷却至常温后即可用。
1.2 暂养条件下观察雌、雄生殖细胞排放规律
观察受精规律, 用量筒准确量取 500mL已灭菌的 PESI培养液加入 500mL烧杯中, 培养液 pH值8.2±0.2, 实验过程中不更换培养液, 实验设置3个平行组。用天平分别准确称取湿重 0.1g雌生殖托以及湿重 5g雄生殖托放入烧杯中, 由于生殖托会下沉,需要用聚乙烯绳将生殖托固定于水面以下 2—3cm。在温度(25±0.5)°C、光照强度(3000±100)lx, 光照周期12h∶12h(L∶D)、盐度 33±0.5条件下静置培养生殖托, 第一批卵细胞排出后, 立即将雌生殖托移出, 并用培养液将卵细胞从生殖托上轻轻冲洗至直径90mm培养皿中, 烧杯中的雄生殖托不被移出。随后立即用一次性吸管吸取 100个卵细胞至原烧杯中, 每隔 1h用吸管将烧杯中所有的卵吸取至5个直径90mm培养皿中, 每个皿中 20个卵, 皿中已加能完全浸没卵的灭菌 PESI培养液, 并用吸管将卵分散以保证各卵不重叠。然后将每个培养皿均在ZEISS体视镜下拍照3次, 拍摄画面保证图像清晰; 每次拍摄完成后, 将取出的卵吸取回原烧杯。在实验完成后选取清晰图片并用photoshopCS6对图片上的受精卵计数, 记录。受精率计算方法: R(%)=Nf·100%。其中, R为受精率(fertilization rates), Nf为记录的受精卵数(fertilized eggs number)。根据已有马尾藻早期发育相关文献(张婧等, 2012; 贾柽等, 2012; 杨彬等, 2013; 赵素芬等,2013; 李健鹏等, 2014)以及观察得出, 刚释放出来的卵细胞具有8个分散的细胞核, 精子与卵中的一个细胞核结合后, 其余的细胞核逐渐与该核融合, 最终在细胞中央形成一个近似圆形的大细胞核, 标志着受精过程完成, 受精卵已形成。受精卵形成后开始第一次分裂, 沿赤道板横裂成2个细胞。随后经过多次横、纵分裂, 形成了类似地雷状的多细胞胚胎。随后, 基部细胞横裂形成囊泡状细胞, 囊泡状细胞继续横裂,逐渐伸长, 形成假根, 假根完全形成意味着已形成完整的幼孢子体; 此后幼孢子体迅速伸长和发育。综上,本文判定卵细胞和受精卵的依据为: 刚排出的8核细胞为卵细胞; 细胞处于受精过程中或者受精卵分裂过程中, 以及处于幼孢子体发育过程中, 均判定为“受精卵”。
观察排放习性, 用量筒准确量取 2L已灭菌的PESI培养液加入 2L烧杯中, 培养液 pH值 8.2±0.2,实验过程中不更换培养液, 实验设置3个平行组。将取下的雌、雄生殖托用天平分别准确称取不同湿重(0.5, 1, 2, 4, 8g), 将等重量的雌、雄生殖托放入同一烧杯中。用聚乙烯绳将生殖托固定于水面以下 2—3cm, 在室内静置暂养条件下培养生殖托。当每个光周期或暗周期结束时以及结束后6h时, 在 90mm培养皿中加入能完全浸没卵的灭菌 PESI培养液后, 用镊子在烧杯中随机取 10个雌生殖托至培养皿中; 并用电子天平上称量放入生殖托前后培养皿的重量,前后的重量差即为取样生殖托的重量。由于雌生殖托呈三棱形, 将其三个面在体视镜下各拍照3次; 同时用玻璃棒搅拌均匀烧杯中的培养液, 然后用吸管随机吸取培养液至10mL量筒中定容5mL, 定容后将量筒中的卵吸出至培养皿中, 向每个培养皿吸入若干卵并用吸管将卵分散以保证各卵不重叠, 在吸入卵之前皿中已加能完全浸没卵的灭菌PESI培养液。每个培养皿均在体视镜下拍照 3次, 每次拍摄完成后,将取出的雌生殖托、卵、培养液均放回原烧杯, 在实验完成后选取清晰图片并用 photoshopCS6对图片上的受精卵、未受精卵计数, 记录, 并计算出排卵量、总受精卵量、脱落的受精卵量。计算方法:
NR(个/g)=[400× (N1+N2)+M1/M2× (M3+M4)]/M1;
NZ(个/g)=(400×N1+M1/M2×M3)/M1;
NE(个/g)=400× (N1+N2)/M1。
其中, NR为排卵量(released eggs number), NZ为总受精卵量(zygotes number), NE为脱落的受精卵量(exutive zygotes number), N1为水样中的受精卵量, N2为水样中的未受精卵量, M1为实验生殖托重量, M2为取样生殖托重量, M3为取样生殖托上的受精卵量, M4为取样生殖托上的未受精卵量。
1.3 温度、盐度及水流速度对全缘马尾藻生殖细胞排放的影响
温度实验, 温度设置25, 27, 29, 31, 33°C五个梯度, 其他条件为光照周期 0h∶24h(L∶D), 盐度 33,pH值8.2, 静置培养。盐度实验, 盐度设置29, 31, 33,35, 37五个梯度, 其它条件为光照周期 0h∶24h(L∶D), 温度 29°C, pH值 8.2, 静置培养。流速实验, 水流速度实验设置0, 3, 6, 9, 12cm/s五个梯度, 其他条件为光照周期 0h∶24h(L∶D), 温度 29°C, 盐度 33,pH值8.2。在单因子实验结果的基础上进行促排正交实验, 正交设计采用34实验设计, 其他条件为光照周期0h∶24h(L∶D), pH值8.2。
温度使用光照培养箱控制; 光照由光照培养箱提供, 并用分体式照度计测定; 盐度使用海水精盐和超纯水调节, 采用便携式盐度计测定; 水流速度由气石充气提供, 将气石固定在与生殖托同一水层面, 通过控制气流大小调整水流速度, 水流速度采用便携式流速测定仪测定, 保证生殖托所在水层面的水流速度。由于水流速度小, 烧杯下层流速近于 0, 脱落的卵细胞和受精卵会逐渐沉降在烧杯底部。
每个实验组量取2L已灭菌的PESI培养液至2L大烧杯中, 培养液pH值8.2, 实验过程中培养液不更换, 每个实验组设置3个平行组。每个烧杯中放入2g等重量的雌、雄生殖托, 用聚乙烯绳将生殖托固定于水面以下 2—3cm。实验在上述实验条件下进行, 实验开始后定时取杯中的雌生殖托在体视镜下观察,判断排卵结束的时间并记录。在排卵结束时以及排卵结束后6h时取杯中的雌生殖托以及搅拌均匀的培养液, 将二者在体视镜下快速拍照, 并利用图片计算排卵量、总受精卵量、脱落的受精卵量, 具体方法如观察排卵习性时所用方法。
1.4 雌、雄生殖托的比例对生殖细胞排放的影响
雌、雄生殖托的重量比值设置 1∶1(2g∶2g),1∶2 (2g∶4g), 1∶4(2g∶8g), 1∶6(2g∶12g), 1∶8(2g∶16g)五个梯度。在温度 31°C, 盐度 33±1, 水流速度(6±1)cm/s, 光照周期 0h∶24h(L∶D)的条件下进行实验。
每个实验组量取2L已灭菌的PESI培养液至2L大烧杯中, 培养液pH值8.2, 实验过程中培养液不更换, 每个实验组设置3个平行组。然后将雌、雄生殖托按比例放入烧杯中, 用聚乙烯绳将生殖托固定于水面以下 2—3cm。实验开始后, 定时取杯中的雌生殖托在体视镜下观察, 判断排卵结束的时间并记录。在排卵结束时以及排卵结束后6h时取杯中的雌生殖托以及搅拌均匀的培养液, 将二者在体视镜下快速拍照, 并利用图片计算排卵量、总受精卵量、脱落的受精卵量, 具体方法如观察排卵习性时所用方法。
1.5 数据处理
实验所得数据用 SPSS18.0进行处理, 结果表示为平均值±标准差。数据比较采用方差分析和 Tukey多重比较法, 以 P<0.05作为显著差异, 并用Origin8.0作图。
2 结果与分析
2.1 卵细胞的受精率与排出时间的关系
当卵细胞排出后(见图1b), 在雄生殖托(见图1c)排出精细胞足够量的条件下受精。由图 2可以得出,卵细胞排出1h后, 受精率为(63±3.06)%, 随着时间的延长, 卵细胞的受精率逐渐升高, 且前 3h之间的受精率差异明显(P<0.05)。受精率在 4h达到最大值(89.7±0.6)%, 受精率在 4h后不再升高, 其原因可能是: 在 4h内无有活性的精子与排出的卵细胞结合,卵细胞将会凋亡。结果表明, 排出的卵细胞在 4h内具有活性, 能够受精。

图1 全缘马尾藻的雄生殖托及受精前、后的雌生殖托Fig.1 The receptacles of male Sargassum integerrimum and the female one before and after fertilization注: 字符1为刚排出的卵细胞; 2为受精卵, 已开始分裂; 3为未受精的卵细胞, 已死亡。子图a和b为雌生殖托, c为雄生殖托。图中标尺均为1mm

图2 全缘马尾藻排卵以后受精率的变化Fig.2 Variation in fertilization rate of S. integerrimum after ovulation注: 误差线表示标准差, 组间不同字母表示差异显著
2.2 在室内暂养条件下雌、雄生殖细胞的排放规律
在室内暂养条件下暂养约 5d后, 雌生殖托开始排卵。从图3可以发现, 雌生殖托排放卵细胞主要在黑暗条件下完成。完成整个排卵过程约需 3d。第 1d的排卵量最多, 为(8473±1065)个/g, 后 2d的排卵量逐渐减少。3d内卵细胞的总排放量可以达到(14431±1288)个/g。由于排出的卵细胞在4h内能完成受精, 研究在每个光周期或暗周期结束后拍照记录用以计算排卵量, 6h再次拍照记录用以计算受精卵量以及脱落的受精卵量。对比图3与图4, 发现受精卵量随卵细胞排出量变化而改变, 且二者数量的变化时间相对一致, 这从侧面说明雄生殖托排放精子与雌生殖托排放卵细胞基本同步。整个排卵过程的受精率为50%—60%, 最终得到的受精卵量为(8358±734)个/g。
受精完成后, 受精卵如图1a“挂卵”, 只有部分受精卵脱落。从图5中可看出在42h内的脱落受精卵量很低, 直到48h才开始大量脱落, 72h内的总脱落的受精卵量为(4283±272)个/g。与排卵过程相似, 受精卵的脱落过程也主要集中在黑暗条件下。72h内总排卵量除去脱落受精卵量得到挂卵量约为 10000个/g,接近48h内的排卵量, 这表明卵脱落的原因可能是雌生殖托表面积有限, 新排出的卵细胞导致“挂卵”脱落。由此可以推测, 在静置条件下, 脱落受精卵量主要与排卵量相关。
2.3 雌生殖托的排卵量与其重量的关系
将表 1中的雌生殖托(见图 1)总排卵量与雌生殖托重量进行一元线性回归分析, 二者回归关系极其显著, 符合回归方程ˆy= –3080.875+17295.056x, 判定系数 R2=0.99。同时对二者进行相关分析, 得到相关性系数r=0.99, 说明雌生殖托的总排卵量与雌生殖托的重量呈正相关, 且相关极其显著。在实际应用中可以依据雌生殖托的重量估算其总排卵量。
2.4 温度、盐度及水流速度对全缘马尾藻生殖细胞排放的影响
从表2可得出, 改变温度对实验组所需促排时间影响较大。29°C组促排需要的时间最长, 33°C组所需促排时间最短。当温度高于或低于 29°C时, 各实验组需要的促排时间都逐渐减少, 且差异显著(P<0.05)。随着温度改变, 排卵时间变化与促排时间变化相一致。改变盐度对实验组所需促排时间影响也较大。盐度33组所需促排时间最长, 29组所需促排时间最短。当盐度高于或低于 33时, 各实验组需要的促排时间逐渐减少, 且差异显著(P<0.05)。随着盐度改变, 各实验组的排卵时间变化与促排时间变化相一致。相比于温度和盐度, 改变水流速度对实验组促排时间影响较小。0cm/s组需要的促排时间最长,12cm/s组所需促排时间最短。当水流速度高于0cm/s时, 需要的促排时间逐渐减少, 除 3和 6cm/s组外,各实验组的促排时间差异显著(P<0.05), 其他各实验组需要的促排时间差异显著(P<0.05)。随着水流速度改变, 排卵时间变化与促排时间变化相一致。

图3 全缘马尾藻的排卵量Fig.3 The amount of S. integerrimum eggs released注: 误差线表示标准差

图4 全缘马尾藻的受精卵量Fig.4 The amount of S. integerrimum zygotes that fertilized注: 误差线表示标准差

图5 全缘马尾藻排卵以后的脱落受精卵量Fig.5 The amounts of exutive eggs of S. integerrimum after eggs release注: 误差线表示标准差

表1 雌生殖托的重量与其排卵量的关系Tab.1 Relationship between the weight of female receptacles and the capacity of its reproduction
从图6可得, 温度改变对雌生殖托的排卵量影响相对较小, 除33°C组外, 其他4组的排卵量差异不显著(P>0.05)。33°C 组的排卵量最少, 为(6422±670)个/g。27°C 组、29°C 组、31°C 组的受精卵量最高(P>0.05)。当温度过高(33°C)或者过低(25°C)时, 实验组的受精卵量明显减少, 与其他三组相比差异显著(P<0.05)。33°C组的受精卵量最低, 为3048±338个/g。各实验组的脱落受精卵量与排卵量都成呈正相关,除 33°C组外, 各组的脱落受精卵量差异不显著(P>0.05)。33°C 组脱落受精卵量最少, 为(334±183)个/g。分析可得, 温度在27—31°C间时得到的受精卵以及脱落受精卵最多。
图7显示, 改变盐度对雌生殖托的排卵量影响较大。盐度 29组的排卵量最少, 为(4214±253)个/g, 与其他 4组差异显著(P<0.05)。随着盐度的升高, 排卵量明显增加, 33组以及 35组的排卵量达到最多(P>0.05)。当盐度高于33时, 排卵量逐渐下降; 盐度越高, 排卵量下降越明显。37组的排卵量与31组的排卵量相近(P>0.05)。但 35组的受精卵量最高, 为(10450±1214)个/g。除33组外, 各实验组的受精卵量与排卵量成正相关, 29组受精量最低, 为(1037±206)个/g。各实验组的脱落受精卵量与排卵量成正相关,且33、35、37组的脱落受精卵量差异显著(P<0.05), 可见盐度比温度对脱落受精卵量的影响更明显。33组的脱落受精卵量最多, 为(3333±376)个/g; 29组的脱落受精卵量最少, 为(366±136)个/g。盐度过高或者过低时受精卵量明显减少, 所以将盐度控制在 35左右可使形成的受精卵量最多; 但是在实际生产中只能收集到脱落的受精卵, 所以盐度控制在 33左右可收集到的受精卵最多。

表2 改变环境因子对促排时间和排卵时间的影响Tab.2 Changes in decorporation time and ovulation time under different environmental condition

图6 改变温度对全缘马尾藻的排卵量、受精卵量、脱落受精卵量的影响Fig.6 Variations of gamete released, zygotes, and exutive eggs of S. integerrimum with temperature注: 误差线表示标准差
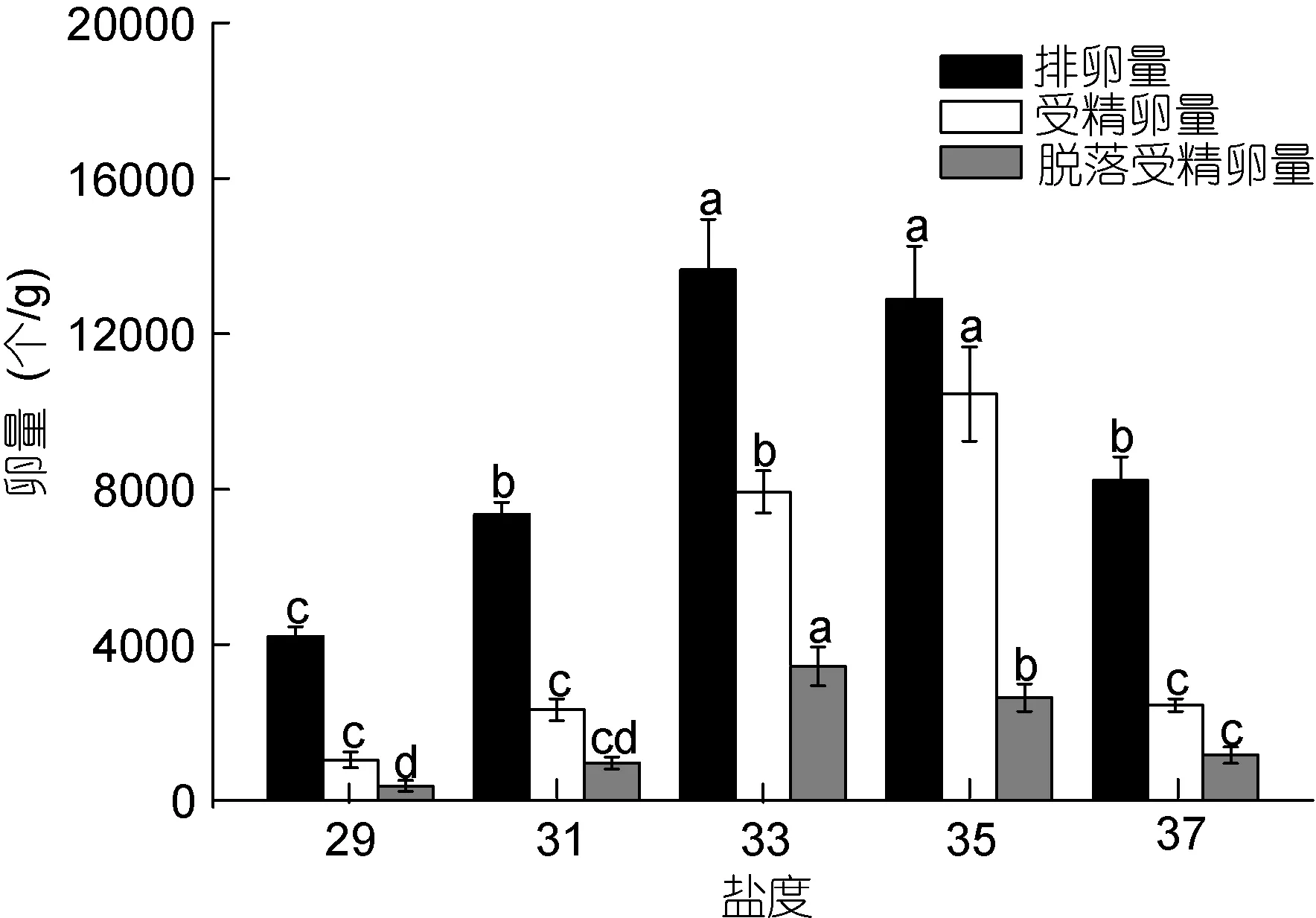
图7 改变盐度对全缘马尾藻的排卵量、受精卵量、脱落受精卵量的影响Fig.7 Variations of gamete released, zygotes, and exutive eggs of S. integerrimum with salinity注: 误差线表示标准差
从图8可得, 当水流速度从0cm/s升高至6cm/s,雌生殖托的排卵量逐渐增多, 3和 6cm/s组的排卵量为最多(P>0.05), 二者与 0cm/s组的排卵量差异显著(P<0.05)。随着水流速度加快, 排卵量开始下降, 流速越高, 下降越明显。9cm/s组的排卵量下降至与0cm/s组相近(P>0.05)。12cm/s组的排卵量最少, 与其他 4组均差异显著(P<0.05), 为(8412±772)个/g。受精卵量与排卵量成正相关, 12cm/s组的受精卵量最低, 为(1548±231)个/g, 6cm/s组的受精卵量最高, 为(11339±1170)个/g。脱落受精卵量与水流速度变化基本相一致,水流速度越多, 受精卵量的脱落率越高, 0、3和6cm/s组脱落受精卵量差异显著(P<0.05), 6cm/s组的脱落受精卵量最高, 为(8044±644)个/g; 但当水流速度高于6cm/s时, 由于卵量影响, 脱落受精卵量逐渐减少(P<0.05), 12cm/s组的脱落受精卵量最少, 为(1468±222)个/g。水流过高或过低都不利于增加受精卵量,所以将水流控制在6cm/s左右可使形成的受精卵量最多, 且在实际生产中只能收集到脱落的受精卵, 所以盐度控制在6cm/s左右可收集到的受精卵最多。

图8 改变水流速度对全缘马尾藻的排卵量、受精卵量、脱落受精卵量的影响Fig.8 Variations of gamete released, zygotes, and exutive eggs of S. integerrimum with flow speed注: 误差线表示标准差
2.5 生殖细胞排放过程中温度、盐度、水流速度条件的优化
对表 3中的脱落受精卵量进行一般线性模型分析, 得到单因素统计量Kn值。三种不同温度对应的K值间差异不显著(P>0.05), 说明温度对脱落受精卵量影响不显著; 三种不同盐度对应的 K值间差异不显著(P>0.05), 说明盐度对脱落受精卵量影响不显著;三种不同水流速度对应的K值间差异不明显(P>0.05),说明水流速度对脱落受精卵量影响不显著。所以, 在温度为(29±2)°C, 盐度为 33±1, 水流速度为(6±1)cm/s的条件下对生殖细胞促排, 实验组得到的脱落受精卵量最多。
排卵时间变化与促排时间的变化呈正相关, 所以仅对促排时间分析, 得到单因素统计量Kn值见表2—3。三种不同温度对应的K值间差异显著(P<0.05),说明温度对所需促排时间影响显著; 三种不同盐度对应的K值间差异不显著(P>0.05), 说明盐度对所需促排时间影响不显著; 三种不同水流速度对应的 K值间差异不明显(P>0.05), 说明水流速度对所需促排时间影响不显著。比较温度的 Kn值, 当温度为 31°C时对应的K值最小, K值越小, 表明此因素在该水平下所需促排时间最短。所以, 在温度为31°C, 盐度为33±1, 水流速度为(6±1)cm/s的条件下对生殖细胞促排, 实验组所需促排时间以及排卵时间最短。
综上分析, 在温度为 31°C, 盐度为 33±1, 水流速度为(6±1)cm/s的条件下, 实验组得到的受精卵量最多, 且所需促排和排卵时间最短, 该条件为最适促排条件。

表3 促排实验正交设计及结果Tab.3 Orthogonal design and results for decorporation experiments
2.6 提高雌、雄生殖托重量比对生殖细胞排放及受精率的影响
从表4中可以得出, 雌、雄生殖托的重量比对促排时间的影响较大, 各实验组所需促排时间差异显著(P<0.05)。随着雌、雄生殖托重量比的降低, 各实验组所需促排时间逐渐减少。当雌、雄生殖托重量比为 1∶6时所需促排时间最少, 比暂养条件下所需促排时间缩短了4d。当雌、雄生殖托重量比低于1∶6时, 所需促排时间不再减少。雌、雄生殖托的比例对排卵时间的影响不大, 随着雌、雄生殖托重量比的降低,各实验组的排卵时间逐渐减少。除1∶6以及1∶8两组外, 其他各组的排卵时间差异不显著(P>0.05)。当雌、雄生殖托重量比为 1∶6时所需排卵时间最少, 排卵时间比暂养条件下的排卵时间缩短了 2d。当雌、雄生殖托重量比低于 1∶6时, 排卵时间不再减少。在最适条件下, 雌、雄生殖托重量比对受精率的影响不大。随着雌、雄生殖托重量比降低, 受精率逐渐升高, 当雌、雄生殖托重量比低于 1∶2时, 各组之间的受精率差异不明显(P>0.05)。雌、雄生殖托重量比为 1∶6时受精率达到最高, 为(94.4± 0.3)%。

表4 不同生殖托比例对生殖细胞排放的影响Tab.4 The effect on discharging gametes for changing ratios of female and male receptacles
3 讨论
3.1 全缘马尾藻生殖细胞的排放规律
在观察中发现, 全缘马尾藻生殖细胞排放集中在凌晨2点—4点完成, 具有夜间排放习性。与全缘马尾藻同属马尾藻科的羊栖菜也具有这一习性(Zou et al, 2005)。此外, 岩藻(Fucus ceranoides)与全缘马尾藻同属墨角藻目, 其生殖细胞排放习性也为夜间排放(Brawley, 1992)。其原因可能是物种在长期进化过程中对环境的适应。黑暗条件有利于生殖细胞的存活, 刚排放出来生殖细胞不能进行光合作用, 没有光照的要求; 如果光照过强, 生殖细胞以及受精卵会因为光刺激而受到一定程度损伤。其次, 自然海区凌晨的温度较低, 有利于提高生殖细胞以及受精卵的存活率。受精卵的“挂卵”特点也可能是全缘马尾藻为适应环境而形成的防御特性。自然海区的风浪较大,“挂卵”有利于受精卵的萌发和生长。而部分受精卵脱落的根本原因可能是由于雌生殖托的表面积有限从而藻体产生的一种繁殖策略。附着能力低的受精卵由于生存能力低将会脱落, 雌生殖托自身会再形成新的受精卵代替这些脱落的受精卵, 这种现象属于MacArthur提出的 r—选择繁殖策略。导致受精卵脱落的主要直接原因可能是雌生殖托通过自身调节减少表面黏性或者分泌物质消解受精卵的黏性分泌物。其次, 新排出的卵细胞产生的物理张力也会加快受精卵脱落。当马尾藻受到环境改变带来的威胁时会产生应激反应提前进行生殖行为(Agrawal, 2012)。本研究小范围改变温度、盐度等非生物因素和生物因素都缩短其促排时间和排卵时间, 说明全缘马尾藻的生物应激性较强, 这一特点也是全缘马尾藻适应多变的海洋环境的体现。本研究中全缘马尾藻排出的卵细胞在4h内具有受精活性。岩藻和羊栖菜与全缘马尾藻同属墨角藻目, 二者的卵细胞排出后分别在 2h内和6h内具有活性( Brawley, 1992; Pang et al, 2006);而全缘马尾藻同属马尾藻属的铜藻, 其卵细胞排出后在48h内具有受精能力(Pang et al, 2009)。比较说明全缘马尾藻的自然繁殖能力在马尾藻属中相对较弱, 从而其雌、雄生殖细胞排放的同步性对其卵细胞的受精率尤其重要。
生物信息素为雌、雄生殖托排放的外激素, 为植物间传递信号的化学物质, 在褐藻门植物的雌、雄生殖托的分化、成熟以及生殖细胞排放过程中都有重要的作用, 各种藻体产生的信息素所含化学物质的种类也不同, 但均源于不饱和脂肪酸。如信息素可首先诱导雄性生殖囊排放精子, 精子排放后有利于雌、雄植株同步排放, 同时也有利于诱导雌性植株排放雌性信息素(Pantke-Böcker et al, 1995)。在生殖细胞排放之前, 生物信息素能诱导生殖托分化, 增强生殖托对强光照的适应能力, 进而促进生殖托成熟。如雄性生殖托较少, 雄性生殖托产生的生物信息素会使雌性生殖托的趋光性减弱, 导致成熟的雌性生殖托个体较小, 说明生物信息素诱导雌、雄生殖托的同步成熟(Togashi et al, 2004)。生殖托成熟后, 雄生殖托产生的生物信息素与雌生殖托细胞表面的受体结合后,经细胞信号转导后作用于细胞结构, 促使卵细胞排放, 其作用强度决定了雌、雄生殖细胞排放的同步性。此前, Pang等(2005)研究发现羊栖菜雌、雄生殖细胞排放不完全同步, 但在其研究中通过改变环境条件使生殖细胞完全同步排放后, 羊栖菜卵细胞的受精率可高达90%。本研究中, 暂养条件下卵细胞的受精率50%—60%, 说明其信息素诱导的排放并不完全同步。
3.2 温度、盐度对生殖细胞排放及受精过程的影响
王增福等(2007)研究发现, 在成熟时的温度的基础上, 升高温度有利于生殖细胞的排放。本研究结果显示, 促排温度为 29°C时全缘马尾藻促排所需时间最长, 温度升高或者降低均使促排所需时间明显减少, 其原因可能为: 29°C为全缘马尾藻卵细胞形成的最适宜温度, 在此温度下已成熟的卵细胞排放最为稳定, 促排所需时间最长; 温度升高或者降低会对卵细胞产生刺激, 产生一系列的生理变化, 从而使卵细胞提前排放。温度对排卵量的影响不大, 温度25—31°C时雌生殖托的排卵量相差不大, 温度高于31°C时排卵量明显减少, 这可能是由于温度过高导致卵细胞活性下降甚至衰亡, 从而使排出的卵细胞减少。温度 27—31°C时得到的受精卵量最多, 且受精率最高, 而当温度高于31°C或者低于25°C时, 得到的受精卵量显著减少以及受精率都明显下降, 其原因可能是温度 27—31°C时信息素信号细胞转导所需酶的活性最高, 从而提高了雌、雄生殖细胞排放的同步性。促排盐度为33时全缘马尾藻促排所需时间最长, 盐度升高或者降低均使促排所需时间明显减少, 其原因可能为: 全缘马尾藻卵细胞形成的最适宜盐度为 33, 在此盐度下已成熟的卵细胞排放最稳定,促排所需时间最长, 盐度升高或者降低会对卵细胞产生刺激, 产生一系列的生理变化, 从而使卵细胞提前排放。本研究中, 盐度为33—35时排卵量最大, 当盐度升高或下降时排卵量都呈下降趋势, 这可能是细胞外盐度改变引起细胞内渗透压过高或者过低,从而导致卵细胞大量衰亡(Agrawal, 2012)。温度对受精卵的脱落过程基本无影响, 而盐度对受精卵的脱落过程有一定的影响, 在盐度为 35时不利于受精卵的脱落, 这可能是由于此盐度条件下, 受精卵表层分泌的的黏性物质较处于其他盐度时增多, 具体机制有待进一步研究。
墨角藻目海藻的卵细胞受精方式多为体外受精。与人类等高等生物相似, 其卵细胞的细胞膜上具有Na+依赖性通道, 可以控制精子进入。在一个精子进入卵细胞后, 通道暂时关闭, 可以防止其他精子进入而造成多精受精。多精受精卵不能正常分裂, 容易死亡。但是随着海水盐度的大幅度改变, 渗透作用使细胞内的 Na+浓度水平不稳定, Na+依赖性通道的保护功能受到破坏, 从而使产生多精受精卵的概率增大(Brawley, 1992)。本研究结果表明盐度在35时的受精率最高, 说明全缘马尾藻卵细胞的 Na+依赖性通道在盐度35时更具稳定性。另外, Na+依赖性通道进行正常生理活动需要能量, 所以温度会通过影响产能所需酶的活性进而影响受精率。参考已有的海洋表面温度(SST)数据, 5月份我国南海海区表层海水的平均温度在 29°C 左右(汤超莲, 2008; Wang et al, 2012), 推测温度在29°C左右时产能所需酶的活性最高, 能较好地维持 Na+依赖性通道的保护功能。所以试验得出温度(29±2)°C 的得到的受精卵量最多, 该结果比较合理。
3.3 水流速度及雌、雄生殖托比例对生殖细胞排放及受精过程的影响
Togashi等(2008)的研究发现自然状态下雄生殖托排放的精子数目远多于雌生殖托排放的卵细胞数目, 卵细胞的受精率与精子数目无明显相关性。而本研究中增加雄生殖托的比例能够提高受精率, 缩短促排时间, 其原因可能是雄生殖托释放的雄性信息素浓度随着雄生殖托数量增多而升高。高浓度的信息素使排卵过程提前, 并使排卵过程与精子排放过程的同步性增强。适当增加水流速度可以使雌、雄信息素在雌、雄生殖托之间充分传递(Pearson et al, 2006)。本研究将水流速度升至6cm/s时, 排卵量以及受精率都达到最高。而当水流速度高于6cm/s时, 排卵量以及卵细胞的受精率都明显下降, 其原因可能是水流速度过高导致信息素的稀释倍数过大, 从而雄性生物信息素对雌性生殖托的作用减弱, 以致排卵量减少及排卵过程滞后。Ladah等(2008)的研究也证明了这一点, 在自然海区, 墨角目海藻一般在水流缓慢的退潮期排放生殖细胞, 生物信息素能充分传递但不会被大量稀释, 能高效作用于生殖托并诱导生殖细胞排放。但Zou等(2005)在研究羊栖菜排放规律时发现, 静置处理组的排卵量比流水处理组的排卵量高,其原因可能为其雄生殖托释放的信息素在水流作用下被稀释。此外, 研究结果也表明脱落卵量与水流速度成正相关。目前马尾藻人工育苗中幼孢子体附着率极低, 对采苗量影响极大, Zhang等(2012)的研究表明鼠尾藻在育苗过程中的自然附着率在 10%以下, 而本研究发现适当提高水流速度可加快受精卵脱落,进而提高附着率, 可增加人工育苗过程中的采苗量。在暂养条件基础上, 改变温度、盐度、水流速度及雌、雄生殖托比例后, 卵细胞的受精率可达到(94.4±0.3)%, 具有实际应用价值。
王增福, 刘建国, 2007. 鼠尾藻(Sargassum thunbergii)有性生殖过程与育苗. 海洋与湖沼, 38(5): 453—457
卢虹玉, 杨小青, 谢恩义等, 2013a. 全缘马尾藻的主要营养成分分析与评价. 食品研究与开发, 34(7): 120—122
卢虹玉, 刘 义, 吉宏武等, 2013b. 全缘马尾藻褐藻多酚的抗氧化和抗肿瘤细胞增殖作用研究. 现代食品科技, 29(4):702—705
汤超莲, 2008. 全球气候变暖背景下近50年华南大陆沿海SST变化特征. 山东: 中国海洋大学硕士学位论文, 7—8
孙宗红, 麦惠欣, 刘志刚等, 2015. 温度对全缘马尾藻幼孢子体生长和生理组分的影响. 广东海洋大学学报, 35(1):51—56
李健鹏, 赵素芬, 孙会强等, 2014. 盐度对灰叶马尾藻排卵及幼孢子体早期发育的影响. 热带海洋学报, 33(1): 97-104
杨 彬, 曲元凯, 谢恩义等, 2013. 莫氏马尾藻有性繁殖和幼孢子体发育的形态学观察. 水产养殖, 34(10): 30—34
肖 为, 陶叶杏, 谷毅鹏等, 2015. 全缘马尾藻提取物对酵母膏诱导小鼠高尿酸血症的拮抗效应. 食品工业科技,36(17): 339—342
张 婧, 2012. 瓦氏马尾藻与铜藻的室内人工培育. 上海: 上海海洋大学硕士学位论文, 13—14
张 婧, 严兴洪, 章守宇, 2012. 铜藻受精卵的早期发生与幼孢子体发育观察. 水产学报, 36(11): 1706—1716
欧泽奎, 刘东超, 麦铭雄等, 2016. 黑暗条件下连续性干出对全缘马尾藻幼孢子体生长和生化成分的影响. 广东海洋大学学报, 36(1): 44—50
赵素芬, 李海娟, 孙会强等, 2013. 光照强度对灰叶马尾藻有性生殖和幼孢子体早期生长的影响. 上海海洋大学学报,22(4): 563—570
贾 柽, 杨 彬, 谢恩义等, 2012. 莫氏马尾藻繁殖生物学初步研究. 水产科学, 31(10): 616—619
徐金根, 2013. 三种马尾藻繁殖的初步研究. 上海: 上海海洋大学硕士学位论文, 19—20
黄苑媚, 刘志刚, 谢恩义等, 2014. 水流速率对全缘马尾藻幼孢子体生长和生理活性的影响. 广东海洋大学学报, 34(6):45—50
曾呈奎, 陆保仁, 2000. 中国海藻志-第三卷, 第二册-褐藻门,墨角藻目. 北京: 科学出版社, 170—171
Agrawal S C, 2012. Factors controlling induction of reproduction in algae-review: the text. Folia Microbiologica, 57(5):387—407
Brawley S, 1992. Fertilization in natural populations of the dioecious brown alga Fucus ceranoides and the importance of the polyspermy block. Marine Biology, 113(1): 145—157
Fu G, Kinoshita N, Nagasato C et al, 2014. Fertilization of brown algae: Flagellar function in phototaxis and chemotaxis. In:Sawada H, Inoue N, Iwano M eds. Sexual Reproduction in Animals and Plants. Japan: Springer: 359—367
Inoh S, 1932. Embryological Studies on Sargassum and Cystohpyllum. Journal of the Faculty of Science, Hokkaido Imperial University. Ser. 5, Botany, 1(4): 125—133
Jin W H, Zhang W J, Wang J et al, 2014. A study of neuroprotective and antioxidant activities of heteropolysaccharides from six Sargassum species. International Journal of Biological Macromolecules, 67: 336—342
Kam Y L K, Ang P O, 2016. Phenology and experimental evaluation of temperature as a triggering factor for reproduction in Sargassum hemiphyllum. Journal of Applied Phycology, 28(4): 2459—2470
Kerrison P, Le H N, 2016. Environmental factors on egg liberation and germling production of Sargassum muticum.Journal of Applied Phycology, 28(1): 481—489
Ladah L B, Feddersen F, Pearson G A et al, 2008. Egg release and settlement patterns of dioecious and hermaphroditic fucoid algae during the tidal cycle. Marine Biology, 155(6):583—591
Liu W, Wu H Y, Liu M X et al, 2016. Improvement of the zygote utilization and reduction of the seedling loss in the early stage of seedling production of Sargassum thunbergii(Fucales, Phaeophyta). Chinese Journal of Oceanology and Limnology, 34(3): 492—497
Pang S J, Chen L T, Zhuang D G et al, 2005. Cultivation of the brown alga Hizikia fusiformis (Harvey) Okamura: enhanced seedling production in tumbled culture. Aquaculture,245(1—4): 321—329
Pang S J, Gao S Q, Sun J Z, 2006. Cultivation of the brown alga Hizikia fusiformis (Harvey) Okamura: controlled fertilization and early development of seedlings in raceway tanks in ambient light and temperature. Journal of Applied Phycology, 18(6): 723—731
Pang S J, Liu F, Shan T F et al, 2009. Cultivation of the brown alga Sargassum horneri: sexual reproduction and seedling production in tank culture under reduced solar irradiance in ambient temperature. Journal of Applied Phycology, 21(4):413—422
Pantke-Böcker S, Pohnert G, Fischer-Lui I et al, 1995. Synthesis and absolute configuration of desmarestene, the gamete-releasing and gamete-attracting pheromone of the brown algae Desmarestia aculeata and D. firma(Phaeophyceae). Tetrahedron, 51(29): 7927—7936
Pearson G A, Serrão E A, 2006. Revisiting synchronous gamete release by fucoid algae in the intertidal zone: fertilization success and beyond? Integrative and Comparative Biology,46(5): 587—597
Togashi T, Bartelt J L, Cox P A, 2004. Simulation of gamete behaviors and the evolution of anisogamy: reproductive strategies of marine green algae. Ecological Research, 19(6):563—569
Togashi T, Nagisa M, Miyazaki T et al, 2008. Effects of gamete behavior and density on fertilization success in marine green algae: insights from three-dimensional numerical simulations.Aquatic Ecology, 42(3): 355—362
Wang X Y, Li B H, 2012. Sea surface temperature evolution in the western South China Sea since MIS 12 as evidenced by planktonic foraminiferal assemblages and Globigerinoides ruber Mg/Ca ratio. Science China Earth Sciences, 55(11):1827—1836
Zhang Q S, Tang Y Z, Liu S K et al, 2012. Zygote-derived seedling production of Sargassum thunbergii: focus on two frequently experienced constraints in tank culture of seaweed. Journal of Applied Phycology, 24(4): 707—714
Zou D H, Gao K S, 2005. Regulation of gamete release in the economic brown seaweed Hizikia fusiforme (Phaeophyta).Biotechnology Letters, 27(13): 915—918

