基于SSR标记的贵州野生白三叶遗传多样性分析
, ,
(1.贵州师范大学生命科学学院, 贵阳 550001; 2.贵州省草原监理站, 贵阳 550001)
白三叶(TrifoliumrepensL.)又名白车轴草、荷兰翘摇,是多年生高产优质豆科牧草,具有固氮能力强,适应性广等特点[1],在中国亚热带及暖温带地区有较广泛分布,是中国西南喀斯特地区畜牧业主推牧草之一,而贵州自然条件和生态类型多样,蕴藏着十分丰富的白三叶草种质资源,是野生白三叶资源最丰富的地区之一[2]。
多样性的研究主要从4个水平开展,即形态学水平、细胞水平、生化水平和DNA分子水平。国内在形态水平[3-5]、细胞水平[6]、生化[7]水平上的白三叶多样性研究已取得一定成果,但分子水平的白三叶遗传多样性研究正在逐步开展与深入。少数学者运用RAPD[8]、SRAP[9],SSR[10]、ISSR[11]分子标记对白三叶进行了遗传多样性研究,但国内用SSR分子标记研究和评价白三叶遗传多样性、形态进化及群落稳定性还未见报道。
表1 实验材料

群体 采样地点纬度(N)经度(E)海拔(m)W1 碧江区川硐镇27°41'26.80″109°10'52.07″258W2 台江县台供镇万亩草场26°40'15.22″108°18'50.57″638W3 松桃县大兴镇27°53'08.32″109°17'45.04″687W4 凤岗县龙泉镇柏梓村27°57'44.88″107°43'02.09″731W5 台江县台供镇大德村26°38'34.97″108°15'06.42″750W6 台江县台供镇南市村26°38'51.79″108°18'06.92″755W7 德江县煎茶镇28°08'59.08″107°58'50.06″820W8 绥阳县27°56'51.95″107°11'28.70″868W9 册亨县秧坝镇秧坝村坝纳组24°53'14.84″105°49'19.43″971W10 黄平县新州镇凉风坳半坡26°55'02.34″107°53'59.92″984W11 汇川区董公市镇27°45'00.85″106°56'03.89986W12 金沙安底乡安底村27°23'29.98″106°26'15.14″1007W13 台江县方召乡李子村到黄毛地段26°39'25.48″108°21'57.56″1127W14 六枝特区平寨镇塔山村26°14'11.7″105°26'48.1″1350W15 黔西林泉王正沟村27°00'50.97″105°50'21.49″1353W16 兴仁县真武山街道办事处三村叉河组25°26'01.38″105°11'10.01″1355W17 望谟县打易镇毛坪村上打闹湾组25°21'46.07″106°06'28.72″1364W18 七星关区历阳山27°17'54.97″105°08'18.56″1509W19 晴隆县莲城镇五一村南山组25°49'19.21″105°12'44.78″1527W20 施秉县城关镇小河村26°49'09.73″108°20'09.39″1596W21 赫章县妈姑村27°12'43.08″105°08'44.16″1748W22 威宁县板底村27°22'16.71″104°18'48.90″2198
SSR(Simple Sequence Repeat),即简单重复序列,又称微卫星。微卫星DNA在真核生物的基因组中广泛存在,SSR重复基序数目及位置的变化而显示出较强的多态性[12]。同时,SSR分子标记技术具有较高的多态性、标记位点覆盖整个基因组且分布均匀、DNA样品用量少、技术稳定性好等优点[13]。本研究收集贵州野生白三叶种质材料,采用SSR分子标记技术,对其多样性进行分析与鉴定,为白三叶种质资源的开发利用及培育优良栽培新品种奠定基础。
1 材料与方法
1.1 实验材料
2013年5—8月在贵州省范围内收集野生白三叶种子进行温室培养。
实验试剂:DNA提取试剂盒(购自大连宝生物公司),26对SSR引物(由大连宝生物公司合成)。
1.2 白三叶总DNA提取
取野生白三叶新生叶片提取总DNA。用0.75%的琼脂糖凝胶电泳检测其质量。
1.3 SSR-PCR扩增体系与程序
参考牟彤[14]及张婧源[9]白三叶SSR分析体系,通过单因素梯度组合试验,得到优化后最优的白三叶20μL反应体系:模板20 ng,10×PCR Bufer 2μL,Mg2+(25 mmol/L)2.4μL,dNTP(2.5 mmol/L)1.6μL,TaqDNA聚合酶(2.5 U/μL)0.1μL,上、下游引物均为0.6μL(0.1 mmol/μL),灭菌水补足20μL,覆盖矿物油。
SSR-PCR扩增程序参见Li[15]和张婧源[9]的程序做以下优化:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火1 min, 72 ℃延伸1 min,重复40个循环;72 ℃延伸5 min,最后4 ℃保存。用6%的聚丙烯酰氨凝胶(PAGE)电泳分析PCR扩增产物。电泳条件:电压630 V,电泳时间依据不同引物的扩增片段大小酌情而定。0.15% AgNO3染色10 min,1.5% NaOH 显影,晾干后读带。
1.4 引物筛选
参照Zietkiewicz[16]与Kölliker[17]研究,挑选出多样性较高的26对SSR引物,由大连宝生物公司合成。从供试材料中选出质量较高而形态性状差异较大的W 16及W 17对26对引物进行剔选,最终选出20对多态性好、稳定性高、条带清晰的引物对全部材料进行PCR扩增,引物序列见表2。
1.5 数据处理
对凝胶电泳后获得清晰稳定的DNA扩增条带进行统计,记在相同迁移的位置上的谱带,有带赋值“1”,无带赋值“0”,建立遗传相似矩阵。通过该矩阵,统计SSR-PCR扩增产物总条带数和具有多态性的条带数,用Excel计算多态性位点百分率PPB(PPB=NPB/TNB,TNB为SSR-PCR扩增的总条带数,NPB为具多态性的条带数)[18]、标记指数MI(MI=NPB×PIC)[10]、引物多态性信息含量PIC(PIC=2fi(1-fi),PICi表示引物多态性信息含量;fi表示有带所占的频率)。用NTSYS-PC 2.02软件计算Dice遗传距离GD(GD=[1-2Nij/ (Ni+Nj)],Ni是指材料i中出现的扩增片段数,Nj是指材料j中出现的扩增片段数,Nij指的是材料i和j共有的扩增片段数),用以估计各白三叶种质间的遗传多样性[18-19]。根据UPGMA法进行遗传相似性聚类分析[20]。
表2 SSR引物名称及其序列

引物 引物序列(5'-3')引物 引物序列(5'-3')POI01AGAAAGGTGAATGATGAAATCTAATTCTTCCAATAGGGPOI14TTCAGGCTTCGTAACAACATCATTGGAGCCGCCAACTTCATPOI02TTTTCGCATTGTTTCAGACCCCCTTTCTCAACCCACATCPOI15TATACATGCCTTTGTTAAATGTGACTAATACTCGAGAAGCCTCAAGAGPOI03TGGCTATTACAACTTGGAGACGAGGCATACTTGATGATGGPOI16TGTCAGATGTCATGCATATTTCAGTTGAAGTGATTAACGAAGAAGGAGPOI04TATGCTGGTAGATAAACTTAAATGCTCTGGAGATTGATGGPOI17ACATTTGAACATGACATCACCGAATTCTACTTTGAGGGTGAGCTTTGGPOI05AAGTGTTGGACAAGGAAACTAGGTCTCTAGATCACCGGCATTGPOI18TTTTGTCTAATTGCAGAACCATGGTTTAAGTAACAGGTTGATGCGTACPOI06CAGTAAAGGAATCTGTTCAAACTAAACACCAATCAGACCGAAAPOI19ACGGGAGATAATTCATTTCTGAAGGGTCGAGAAATACAACATGCATACPOI07GTACCTGGAAATGTTGATTGAGCAGCCATGACCTCTGPOI20ACATGTCTTTGGATTTATTACAGGTCAGGGCACTATAAAATTAGTGTTPOI08AGAAAGGTGAATGATGAAATCTAATTCTTCCAATAGGGPOI21GAAAATCCATGCTTGTAGCACATCTTTCATGGTTTCAGAAAAGCGATCPOI09TGAAATTGAGATTTAGGATGAAAATCCCTCTGCATATCAAAGPOI22CATATTGTGATGGAAACAGATAATAACCATTGTATCATTGATGAPOI10AGGGAAGTAGCATTAAGACAACATTCTGCGATAACATTGACPOI23ATCAGTCAGAAATCCGTGGGCTCGACGCGGAATTGGATAAGPOI11AGAAAAGAAGAACACCCAGAACTTTAAGGACATGTTTGGCPOI24TGGAGTGATGAAGCACAGACACTAATGCCCAAATTGAATAATGATGTCPOI12CACTTCTCAATATCATAGCGTGTTTCTGAAACAGTTTCCCATPOI25ACCTTTCTTCTCATTGCGTTTCTCTAGAATTTCTCGTTTTCATCPOI13CCACAACTACAAGTAGGTTTCGTGAATGGTGTTCTATTCTPOI26AGACCTAAACCAGGGTCCTAATGAGTCTTGCTGCTTCTCAACATTCTG
2 结果与分析
2.1 贵州野生白三叶总DNA纯度检测
0.75%的琼脂糖凝胶电泳对提取的22份野生白三叶基因组DNA进行了纯度检测(结果见图1),DNA的完整度较好,蛋白质、RNA或其它杂质较少。

图1 22份野生白三叶基因组DNA电泳结果
2.2 贵州野生白三叶SSR扩增产物多态性分析
对26对引物进行筛选,最终确定扩增条带清晰、稳定且多态性好的20对引物作为遗传多态性标记引物(见表3)。用20对引物对22份野生白三叶材料进行SSR-PCR扩增,引物扩增结果见表3。共扩增出202条带,其中169条带具有多态性,多态性位点的百分率为83%,引物POI 05多态性最好,达92.31%,POI 11多态性最低,仅62.50%。每对引物的多态性条带数为5~12条,平均每对引物产生8.3条多态性带。引物POI 02扩增出的条带最多,为17条,其扩增出的多态性条带数也最多,有15条,而引物POI 26扩增出的条带数最少,仅有6条。20对引物的多态信息含量范围在0.387 3~0.499 0之间,平均为0.474 7,引物POI 14最高,而POI 02最低。不同SSR引物的标记指数在2.485 5~5.809 5之间,平均为3.96。其中POI 17、POI 05、POI 10和POI 02的标记指数值较高,说明这4对引物对白三叶具有较高的扩增效率。由此可知,SSR-PCR分子标记可以较好地检测白三叶遗传位点,通过SSR分子标记PCR扩增可获得的较好结果。

图2 引物POI 02 22份野生白三叶种质SSR扩增电泳图
表3 白三叶种质资源SSR分析各引物扩增结果
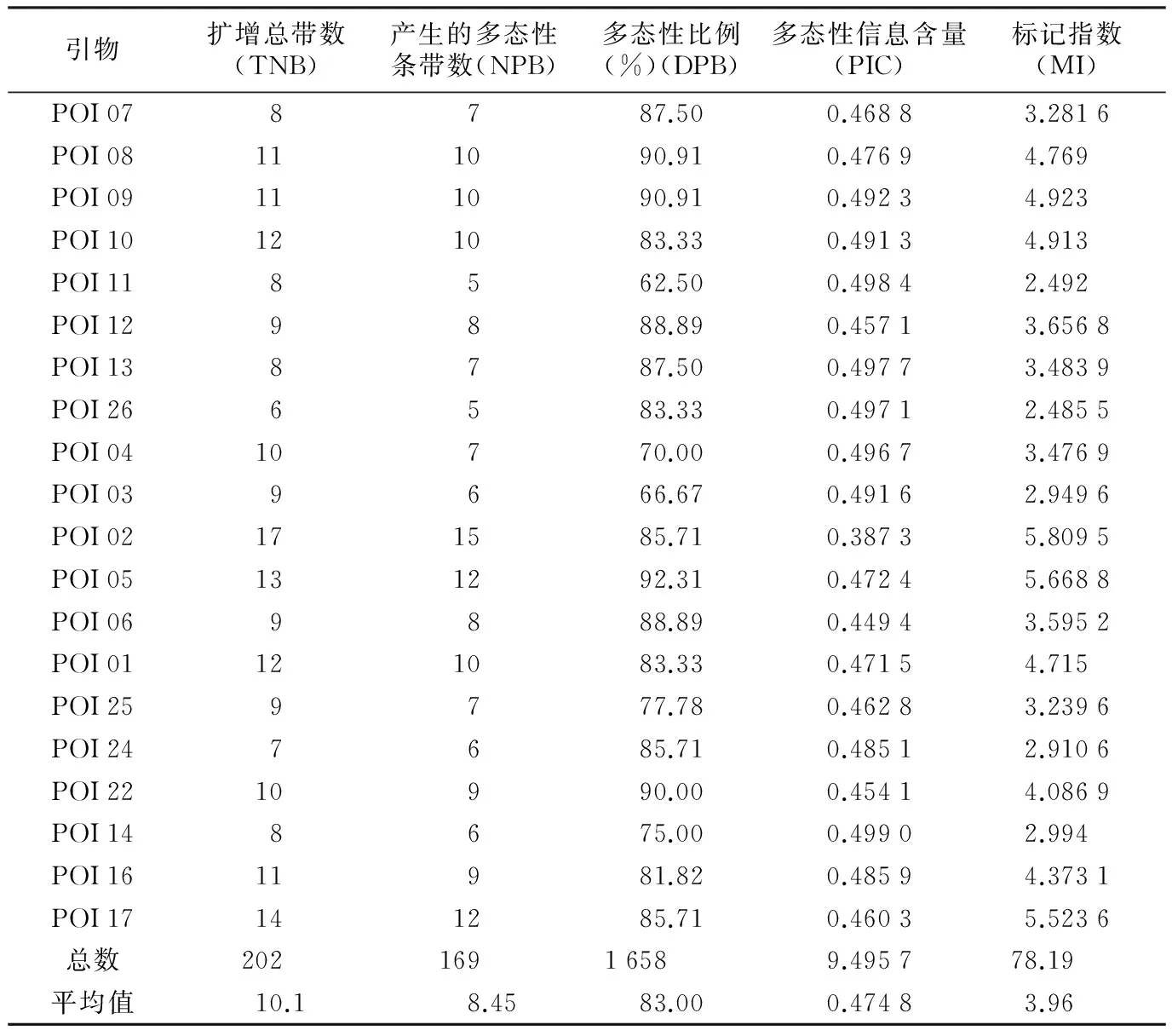
引物扩增总带数(TNB)产生的多态性条带数(NPB)多态性比例(%)(DPB)多态性信息含量(PIC)标记指数(MI)POI078787.500.46883.2816POI08111090.910.47694.769POI09111090.910.49234.923POI10121083.330.49134.913POI118562.500.49842.492POI129888.890.45713.6568POI138787.500.49773.4839POI266583.330.49712.4855POI0410770.000.49673.4769POI039666.670.49162.9496POI02171585.710.38735.8095POI05131292.310.47245.6688POI069888.890.44943.5952POI01121083.330.47154.715POI259777.780.46283.2396POI247685.710.48512.9106POI2210990.000.45414.0869POI148675.000.49902.994POI1611981.820.48594.3731POI17141285.710.46035.5236总数20216916589.495778.19平均值10.18.4583.000.47483.96
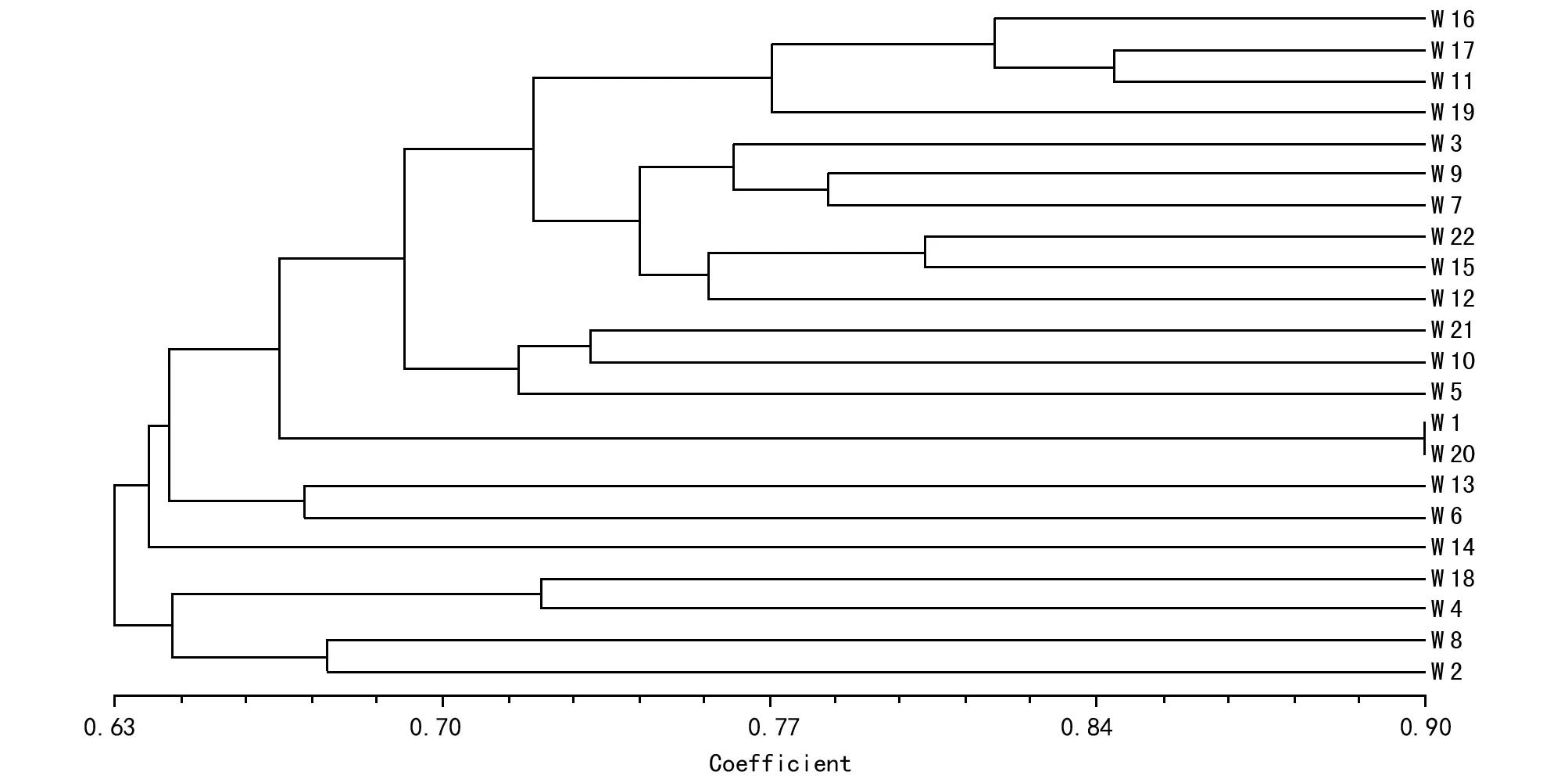
图3 22份野生白三叶种质SSR分子标记基于Nei-Li的相似系数的UPGMA聚类图
2.3 贵州野生白三叶UPGMA法聚类结果
根据白三叶种质间Nei-Li相似系数进行聚类分析(图3)。当相似系数为0.64时,22份贵州野生白三叶被分成3类:第1类是W 14(六枝特区平寨镇塔山村),从SSR 标记来看,W 14与其余材料的遗传距离较远,最早被分开独立成一类。第2类包括W 2、W 4、W 8、W 18,即来自台江县台供镇万亩草场、凤岗县龙泉镇柏梓村、绥阳县及七星关区历阳山品种间遗传距离较近,表明这4个品种差异不大。第3类为剩下的17个品种,品种间有着复杂的遗传关系。当相似系数在0.67时,可将第3大类细分成3个聚类,W 1和W 20的遗传距离较小,聚为一小类。W 6和W 13聚为一类,其余的聚为一类。由表4可知,22份白三叶Nei-Li相似系数进行聚类与遗传距离具有较好的一致性。
3 讨 论
3.1 SSR分子标记在白三叶种质资源多态性研究中的应用
遗传多样性研究是生物多样性的重要组成部分,也是种质资源合理开发利用的理论基础,因此,开展白三叶遗传资源的多样性分析可为培育优良品种提供基础数据。由于SSR分子标记可检测到DNA分子结构上的变异,从本质上反映研究材料的差别,具有共显性、稳定性好、灵敏度高及操作简单等优点[21],已广泛应用于生物进化、分子标记辅助育种及生物遗传多样性等研究领域[22-23]。
表4 贵州22份野生白三叶基于SSR分析遗传距离

W1W2W3W4W5W6W7W8W9W10W11W12W13W14W15W16W17W18W19W20W21W22W10W20.18890W30.16370.21490W40.18310.40010.14060W50.34040.38230.33640.25440W60.29720.35270.36140.31540.27700W70.22930.26810.26590.24390.36110.28840W80.24390.18490.31130.34610.32010.32260.21830W90.26110.31310.30580.26310.36540.32880.24500.40430W100.3530.35580.31290.27900.22740.30940.22160.38610.32530W110.21280.30540.28490.32570.36120.34890.32240.32150.28820.35960W120.28060.24420.25840.22830.36360.32160.25120.42420.39750.43850.25630W130.24950.28340.28750.32140.35700.18310.24920.37240.42730.49620.2640.21160W140.47440.31620.55580.46630.48250.36850.52820.45270.41430.56230.63040.56820.5280W150.32410.32330.28150.33930.43250.43940.37510.37150.33030.36290.32680.24520.32260.46540W160.31270.33750.31010.27650.3570.35650.34170.32890.30050.35540.38050.2520.15980.43910.36480W170.22970.24320.32010.32010.42310.37240.37070.37060.38760.31840.40530.27060.29190.47970.29780.26920W180.34450.36350.32560.22560.37810.41230.32730.39520.39140.46940.43620.33980.32230.44170.41870.43590.34410W190.22710.26010.29450.30580.41810.49260.42730.32460.38010.33900.40170.27920.35970.39490.37970.39710.29920.39140W200.17210.45290.41790.34800.48710.44810.33820.35580.35120.33470.42260.24350.28480.47310.32610.29620.36720.37140.3390W210.32450.30120.31790.28590.15670.28590.25150.39470.40270.35110.41110.31450.32160.43210.31570.38630.38130.35670.45260.32250W220.32450.32790.30880.28020.46470.43500.31720.36800.38410.43180.39270.30350.31520.39650.32310.33910.40710.36120.39690.27190.39840
SSR分子标记可以运用于白三叶种质资源材料的识别、区分,且多态性较高。本研究筛选出20对多态性较高的SSR引物,平均扩增出的多态性比率为83.0%,高于安晓珂[24]利用RAPD标记引物扩增出的多态性比率(75%)和李润芳[25]利用SRAP标记得到的引物多态性比率(53.8%),而牟彤[14]利用SSR标记对经秋水仙素诱变的白三叶突变体进行扩增的多态性比率高达92.1%。可用SSR标记位点的平均PIC值来评价白三叶群体的遗传多样性水平,PIC值越高则群体的SSR标记位点变异程度越大,群体的遗传多样性也越丰富。本研究中,22份贵州野生白三叶的SSR标记位点的平均PIC值为0.474 8,较张婧源[9]研究的70份白三叶材料的SSR标记位点的平均PIC值(0.334 2)高,表明贵州野生白三叶种质资源的遗传多样性十分丰富,这可能与贵州特殊的喀斯特生境及复杂多样的小气候有关,可开展进一步研究。
3.2 供试材料间的亲缘关系分析
亲本材料的选择是育种工作的重要基础,遗传基础狭窄将阻碍着突破性品种的培育。在白三叶的遗传改良和变异筛选工作中,可优先选择遗传多样性较丰富的材料作为亲本,并优先考虑在含特有等位基因的材料中进行优良变异单株的选择。因此研究亲本材料的遗传多样性,比较分析材料相互间亲缘关系,对于培育优质品种具有重要的指导意义。
本研究中,聚为第3大类的17份材料的遗传距离小,亲缘关系较近,遗传基础狭窄,不适合进行亲本杂交,需引入新材料,拓展亲本遗传基础。而W 14与其余材料的亲缘关系较远,可以考虑将其作为杂交亲本。张婧源[9]曾用SRAP和SSR标记分析70份白三叶材料间遗传多样性,测得其相似系数平均值分别为0.730 7和0.661 3。李润芳等[26]对7份白三叶进行SRAP标记分析,平均遗传相似系数为0.854。以上结果表明,所用遗传标记不同或供试材料不同,所获得的白三叶遗传多样性的结论也存在一定的差异。为此,若想更准确、全面地了解白三叶遗传多样性,应对比分析多种不同的遗传标记。
4 结 论
本研究筛选出20对多态性较好的SSR引物,平均扩增出的多态性比率较高(83.0%),表明贵州野生白三叶种质的遗传多样性十分丰富。在育种工作中,因W14与其余材料的亲缘关系较远,可以考虑将其作为杂交亲本,培育新的优良性状的杂交品种。
[1]吴永洁,王元素,李莉.国内白三叶研究进展[J].种子,2015,34(7):46-51.
[2]贵州野生白三叶草资源调查组.贵州野生白三叶草资源调查总结[J].四川草原,1982(2):29-31.
[3]吴永洁,张俞,池永宽,等.贵州省岩溶地区野生白三叶形态多样性研究[J].江苏农业科学,2016,44(2):291-296.
[4]李州,彭燕,张婧源,等.白三叶种质资源形态变异与地理起源的关系[J].草业科学,2012,29(11):1 706-1 714.
[5]王玉祥,张博.新疆野生白三叶表型性状变异研究[J].草地学报,2012,20(6):1 163-1 168.
[6]黄帆,王明玖,何丽君.高加索三叶草、白三叶及其杂种F1的形态学和细胞学研究[J].中国草地学报,2013,35(3):18-23.
[7]何俊,周康,张莉,等.白三叶草种质资源同工酶的遗传多样性分析[J].贵州农业科学,2010,38(3):22-24.
[8]李莉,王元素,洪绂曾.喀斯特地区白三叶形态和遗传多样性研究[J].生态环境学报,2010,19(7):1 532-1 536.
[9]张婧源.世界范围野生白三叶种质资源的遗传多样性研究[D].雅安:四川农业大学,2013:41-61.
[10]George J,Dobrowolski M P,Van-Zijil-De-Jong E,et al.Assessment of genetic diversity in cultivars of white clover (TrifoliumrepensL.)detected by SSR polymorphisms[J].Genome,2006,49(8):919-930.
[11]黄帆,王明玖,何丽君,等.高加索三叶草、白三叶及其杂种F1代的ISSR分析[J].中国草地学报,2012,34(6):107-112.
[12]Weber J L,May P E.Abundant class of human DNA polymorphisms which can be typed using the polymerase chain reaction[J].Am J Hum Genet,1989,44(3):388-396.
[13]朱四元,陈金湘,刘爱玉,等.利用SSR标记对不同类型抗虫棉品种的遗传多样性分析[J].湖南农业大学学报,2006,32(5):469-472.
[14]牟彤.白三叶化学诱变后代遗传变异的研究[D].哈尔滨:东北农业大学,2013:28-58.
[15]Li G,Quiros C F.Sequence-reiatde amplified polymorphism(SRAP),a new marker system based on a simple PCR reation:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,103(2):455-461.
[16]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR) anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[17]Kölliker R,Jones E S,Drayton M C,et al.Development and characterization of simple sequence repeat (SSR) markers for white clover(TrifoliumrepensL.)[J].Theor Appl Genet,2001,102(2):416-424.
[18]车永和,李立会,何蓓如.冰草属植物遗传多样性取样策略基于醇溶蛋白的研究[J].植物遗传资源学报,2004,5(3):216-221.
[19]Ruiz I,Dendauw J,Van B E,et al.AFLP markers reveal high polymorphic rates in ryegrasses (Loliumspp.)[J].Molecular Breeding,2000,6(2):125-134.
[20]Rohlf F J.NTSYS-pc.Numerial Taxonomy and Multivariate Analysis System (Version 2.0)[M].New York:Exter Softwere,1994.
[21]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR) anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[22]Roques S,Sévigny J M,Bernatchez L.Evidence for broadscale introgressive hybridization between two redfish (genus Sebastes)in the North-west Atlantic:a rare marine example[J].Mol Ecol,2001,10(1):149-165.
[23]李晓辉,李新海,李文华,等.SSR标记技术在玉米杂交种种子纯度测定中的应用[J].作物学报,2003,29(1):63-68.
[24]安晓珂.三叶草属三种植物遗传多样性的RAPD分析[D].北京:中国农业科学院,2008:30-32.
[25]李润芳.三叶草的细胞学、分子标记及多倍体诱导研究[D].武汉:华中农业大学,2007:48-49.
[26]李润芳,惠荣奎,邓瑞宁.三叶草遗传多样性的SRAP分析[J].草业科学,2010,27(12):53-57.

