血管内皮生长因子165b对人肝癌HepG2细胞生物学特性的影响
赵燕颖,王秀岩,秦国涛,孙远杰,刘志忠,李然伟
(1.吉林大学第四医院消化内科,吉林 长春130011;2.吉林大学第二医院泌尿外科,吉林 长春130041)
肿瘤转移是导致肿瘤患者死亡的一个重要因素。肿瘤血管形成是肿瘤细胞转移的重要因素。肿瘤血管形成受多种细胞因子调节,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF) 是最重要的调节因子之一[1-2],其中VEGF165是体内含量最多和最为重要的的亚型,而新发现的VEGF变构体VEGF165b具有抑制VEGF165的血管内皮细胞增殖和迁移的作用[3]。目前国内外尚无关于VEGF165b对于肝癌HepG2细胞生物学特性影响的报道。本研究拟观察人肝细胞癌HepG2细胞转染表达VEGF165b的质粒后VEGF165b和VEGF165 mRNA和蛋白的表达情况,以及肝癌细胞生存率和迁移能力的变化,进一步探索VEGF165b对肝癌生物学特性的影响,为临床肝癌的靶向治疗提供实验依据。
1 材料与方法
1.1 主要试剂可表达VEGF165b的合成质粒PcDNA-VEGF165b由吉林大学第二医院李然伟教授惠赠。胎牛血清和IMDM培养基购自美国Gibco公司,RT-PCR试剂盒购自宝生物工程(大连)有限公司。LipofectamineTM2000转染试剂购自美国Invitrogen公司,VEGF165b和VEGF165一抗购自英国Abcam公司,二抗、Western blotting Luminol Reagent和PVDF 膜购自美国Santa Cruz 公司。引物由上海生工生物工程公司合成。Matrigel和Transwell小室购自美国BD公司。
1.2 细胞培养及转染HepG2人肝癌细胞购自中国科学院上海细胞生物学研究所。细胞在IMDM培养液(含10%胎牛血清,青霉素100 mg·L-1,链霉素100 mg·L-1)中,5%CO2孵箱内37℃培养。取对数生长期的细胞经胰酶消化后接种于孔板或培养瓶后再用无抗生素IMDM培养,细胞融合率达80%~95%时可以转染。细胞分为空白组(只加转染试剂)、对照组(转染阴性对照PcDNA3.0表达载体)和PcDNA-VEGF165b组(转染PcDNA-VEGF165b表达载体)。操作按LipofectamineTM2000试剂说明书进行,转染后6~24 h换液1次,继续培养。
1.3 MTT法检测HepG2细胞的增殖按照5×103个细胞/孔将对数生长期细胞接种于96孔板,培养至细胞80%融合后分为空白组、对照组和PcDNA-VEGF165b组,分别转染LipofectamineTM2000、PcDNA3.0和PcDNA-VEGF165b(终浓度均为50 nmol·L-1)。分别于转染后24、48和72 h,每孔加入15 μL MTT(5 g·L-1)继续培养 4 h,再加入DMSO(150 μL/孔),振荡10 min后采用酶标仪(570 nm)测定吸光度(A)值。根据公式计算细胞生存率:细胞生存率=(实验组A值/空白组A值)×100%。每组设3个平行孔,实验重复3次。
1.5 Western blotting法检测VEGF165b和VEGF165蛋白表达水平收集转染48 h后各组HepG2细胞(分组同上),用PBS洗1次,按1×107个细胞加入100 μL预冷至4℃的裂解液,超声粉碎细胞,低温离心后取上清液-80℃冻存。为确保蛋白上样量一致,样品中蛋白经Bradford定量,然后加入2×SDS凝胶加样缓冲液100℃煮沸变性,样品中蛋白通过12%SDS-PAGE分离后转至PVDF膜上,脱脂奶粉封闭4℃过夜;分别加入兔抗人VEGF165b、VEGF165和β-actin抗体(1∶500),4℃过夜;用TBST洗膜10 min,3次,加入1∶2 000稀释的羊抗兔二抗,振摇1 h,TBST洗膜,DAB显色,拍照。分析系统测定各条带灰度值,计算蛋白表达水平。
1.6 细胞迁移实验取对数生长期HepG2细胞调整细胞浓度至1×106L-1,Transwell小室内加入200 μL细胞悬液,分组同上。常规培养24 h后用0.1%结晶紫细胞染色,染色后可用33%醋酸脱色,将结晶紫完全洗脱下来,洗脱液可在酶标仪上570 nm处测其A值,间接反映细胞数,计算细胞迁移率。
2 结 果
2.1 各组HepG2细胞生存率空白组、对照组和PcDNA-VEGF165b组HepG2细胞生存率,24 h时分别为100.0%、(98.1±4.8)%和(96.9±3.7)%,48 h时分别为100.0%、(97.5±5.1)%和(93.1±4.3)%,72 h时分别为100.0%、(96.1±5.0)%和(91.8±4.9)%,各个时间点组间两两比较差异均无统计学意义(P>0.05)。
2.2 各组HepG2细胞中VEGF165b和VEGF165 mRNA表达水平与空白组(0.319±0.049和0.881±0.052)比较,对照组HepG2细胞中VEGF 165b和VEGF165 mRNA表达水平(0.401±0.055和0.798±0.049)无明显变化(P>0.05)。与空白组比较,PcDNA-VEGF165b组VEGF165b mRNA表达水平(0.998±0.081)明显升高(P<0.01),VEGF165 mRNA表达水平(0.278±0.024)明显降低 (P<0.01)。见图1。
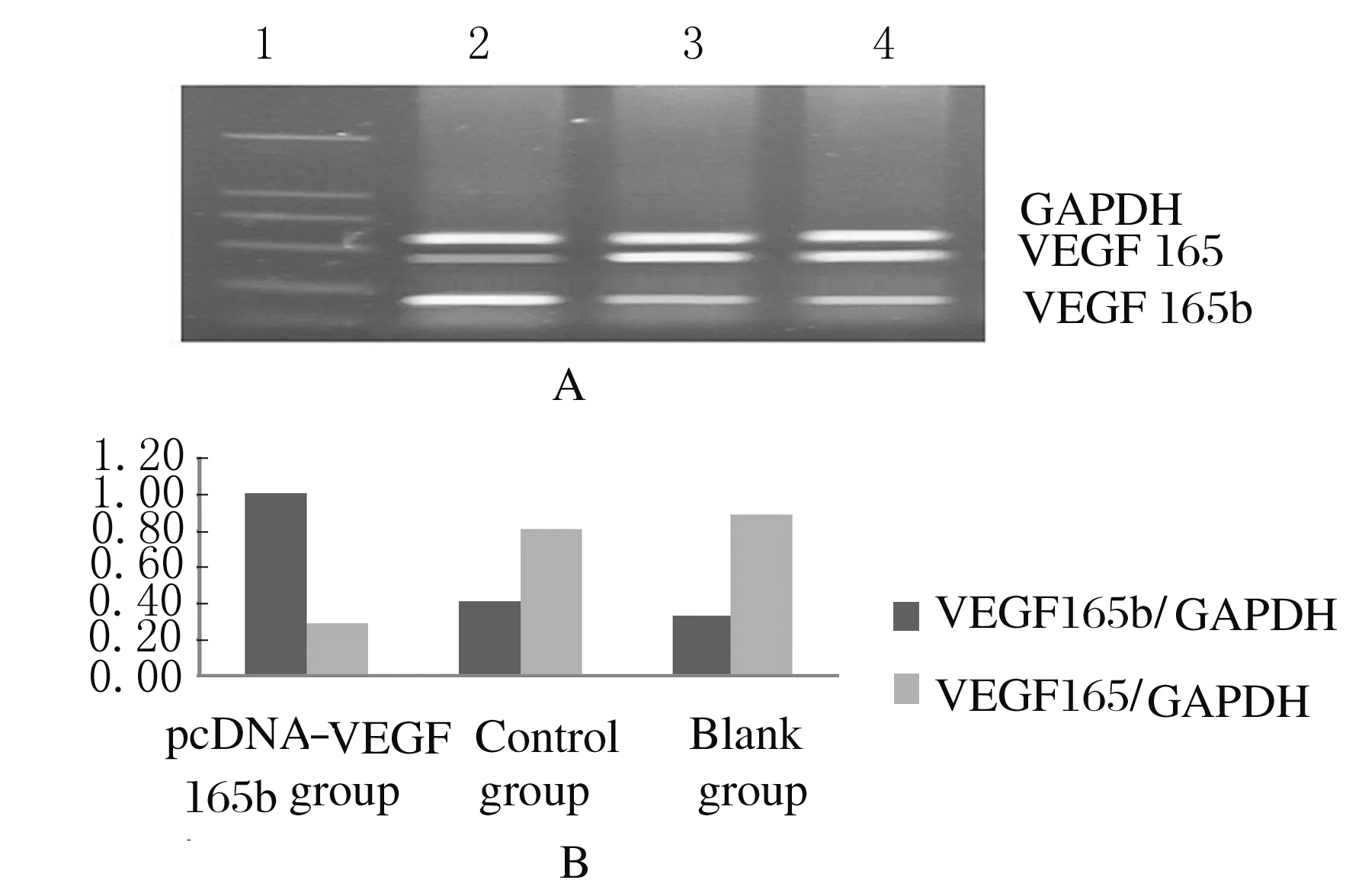
Lane 1:DNA marker;Lane 2: PcDNA-VEGF165b group;Lane 3:Control group;Lane 4:Blank group.
2.3 各组细胞中VEGF165b和VEGF165 蛋白表达水平与空白组(0.266±0.029和0.791±0.043)比较,对照组HepG2细胞中VEGF165b和VEGF165 蛋白表达水平(0.331±0.041和0.698±0.049)无明显变化(P>0.05)。与空白组比较, PcDNA-VEGF165b组VEGF165b蛋白表达水平(0.969±0.081)明显升高(P<0.01),VEGF165蛋白表达水平(0.202±0.024)明显降低 (P<0.01)。见图2。
2.4 各组细胞迁移率与空白组(100.0%)比较,对照组HepG2细胞迁移率(98.1%±1.9%)无明显变化(P>0.05)。与空白组和对照组比较,PcDNA-VEGF165b组HepG2细胞迁移率 (60.2%±9.1%)明显降低(P<0.05)。
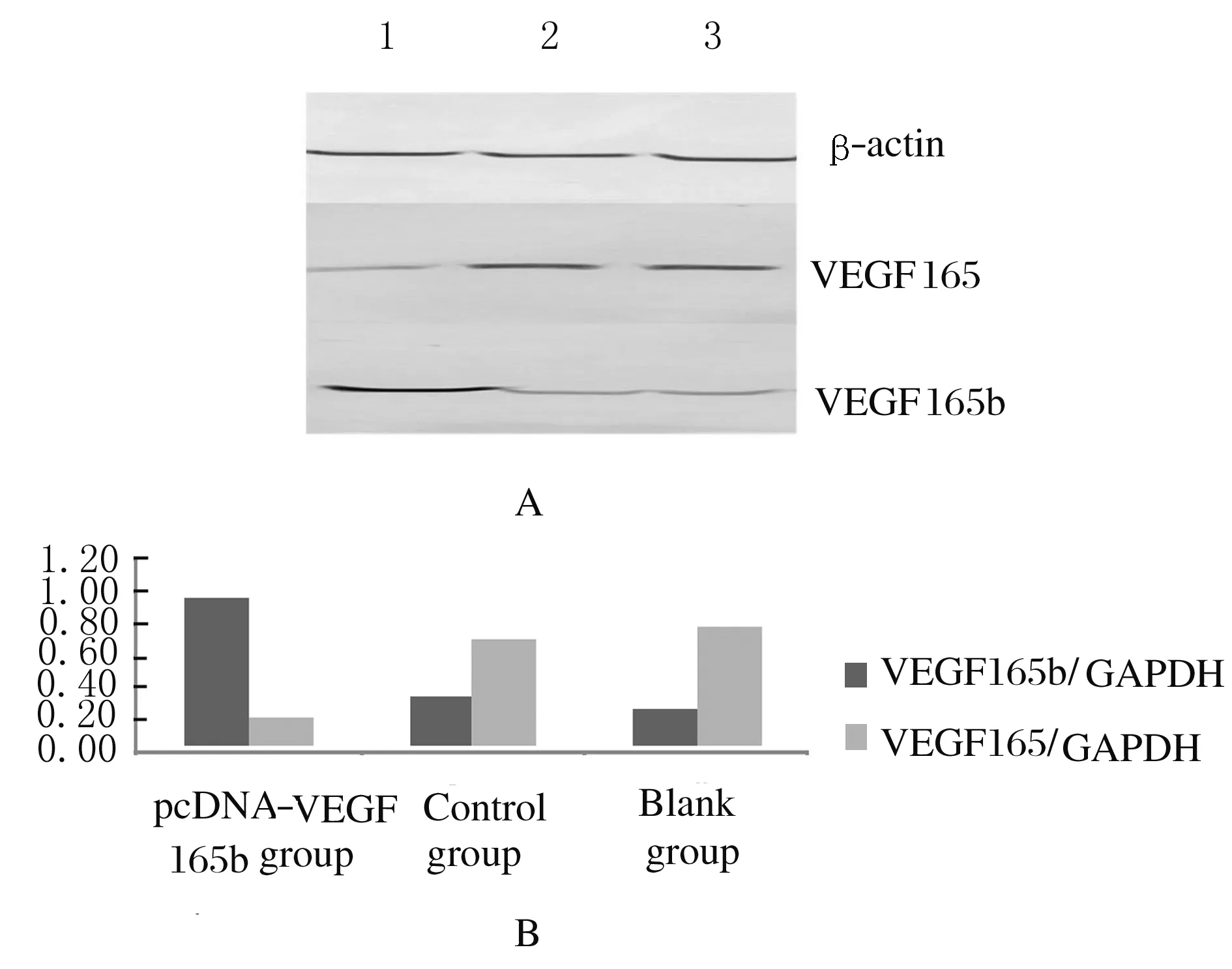
Lane 1: PcDNA-VEGF165b group;Lane 2:Control group;Lane 3:Blank group.
3 讨 论
肿瘤的生长主要靠新生血管的生成,已经有大量研究[4]报道:肝癌组织中VEGF过度表达,且其过度表达与肿瘤的侵袭和转移有密切关联。VEGF有多种形式的剪接变异体:有促进血管生成的VEGFxxx 家族和抑制血管生成的VEGFxxxb家族[5],在VEGFxxxb家族中,VEGF165b在功能和体内分布上都占有主导地位[6-7]。
VEGF165b可以抑制VEGF165介导的促进内皮细胞增殖、迁移和血管生成作用。VEGF165 通过激活血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2),促使细胞通过细胞外基质迁移和凋亡[8-9]。VEGF165b 和VEGF165 具有相同的VEGFR-2结合亲和力,但VEGF165b 竞争性结合了VEGFR-2后可以抑制VEGFR-2激活,进而抑制VEGF165 介导的血管生成。研究[10]发现:VEGF165b在结肠直肠癌、肾癌、食管癌、前列腺癌和乳腺癌组织中的表达水平明显低于正常组织,VEGF165b 表达下调可能成为判断肿瘤预后的一个新指标[11]。
本课题组前期研究[12]显示:肝癌组织中VEGF165b表达明显低于正常肝组织,而肝癌组织中VEGF165表达明显高于正常肝组织,表明VEGF165b与肝癌的发生和发展具有密切关系。本研究合成了外源性重组VEGF165b,成功转染至肝癌细胞,通过PCR、Western blotting和MTT等方法探讨其对肝癌细胞的作用。本研究结果显示:成功转染构建的PcDNA-VEGF165b 表达载体到HepG2细胞中,可以使VEGF165b mRNA和蛋白表达水平明显增高,而VEGF165 mRNA和蛋白表达水平明显降低。VEGF165b表达增高可以抑制HepG2细胞的迁移。本研究中MTT法检测结果显示:VEGF165b表达增高虽然可以使HepG2细胞的生存率有所降低,但与空白组比较差异无统计学意义。这与既往研究结果相似,但仍需大量实验进一步验证VEGF165b对HepG2细胞及其他肿瘤细胞增殖的影响。本课题组既往已经证明VEGF165b在正常肝组织中有大量的表达,而其在肝癌组织中表达较正常肝组织中明显减少,且已证明VEGF165b对肝癌细胞有生长抑制作用。VEGF165b 可以抗血管生成和肿瘤转移,从而发挥抑制肿瘤生长的作用[13],可以通过提高表达VEGF165b、给予外源性重组VEGF165b 或促进VEGF 外显子8b选择性剪接[14-16],从而达到治疗肿瘤的目的。本研究为肿瘤的生物治疗和靶向治疗提供了实验依据和数据。
综上所述,VEGF165b对VEGF165有抑制作用,VEGF165b表达增加对肝癌细胞的侵袭具有抑制作用。VEGF165b有希望成为判断肝癌预后的指标,并成为治疗肝癌的靶向药物。
[1] Zhang L,Wang JN,Tang JM,et al.VEGF is essential for the growth and migration of human hepatocellular carcinoma cells[J].Mol Biol Rep,2012,39(5):5085-5093.
[2] Simonetti O,Lucarini G,Rubini C,et al.Clinical and prognostic significance of survivin,AKT and VEGF in primary mucosal oral melanoma[J].Anticancer Res,2015,35(4):2113-2120.
[3] Nagasaki M,Kondo S,Mukudai Y,et al.Clinicopathological implications of vascular endothelial growth factor 165b expression in oral squamous cell carcinoma stroma[J].Oncol Rep,2016,36(1):573-581.
[4] Amouzadeh Tabrizi M,Shamsipur M,Farzin L.A high sensitive electrochemical aptasensor for the determination of VEGF(165) in serum of lung cancer patient[J].Biosens Bioelectron,2015,74:764-769.
[5] Wang D,Hu L,Su M,et al.Preparation and functional characterization of human vascular endothelial growth factor-melittin fusion protein with analysis of the antitumor activityinvitroandinvivo[J].Int J Oncol,2015,47(3):1160-1168.
[6] Hua J,Spee C,Kase S,et al.Recombinant human VEGF165b inhibits experimental choroidal neovascularization[J].Invest Ophthalmol Vis Sci,2010,51(8):4282-4288.
[7] 尹 健,张斯棋,张 钰,等.外源性表达VEGF165b对顺铂诱导人膀胱癌T24细胞损伤的影响及其机制[J].吉林大学学报:医学版,2015,41 (5) :937-940.
[8] Carter JJ,Wheal AJ,Hill SJ,et al.Effects of receptor tyrosine kinase inhibitors on VEGF165 a- and VEGF165 b-stimulated gene transcription in HEK-293 cells expressing human VEGFR2[J].Br J Pharmacol,2015,172(12):3141-3150.
[9] Ganta VC,Choi M,Kutateladze A,et al.VEGF165b modulates endothelial VEGFR1-STAT3 signaling pathway and angiogenesis in human and experimental peripheral arterial disease[J].Circ Res,2017,20(2):282-295.
[10]Shi C,Gao F,Gao X,et al.A novel anti-VEGF165 monoclonal antibody-conjugated liposomal nanocarrier system:physical characterization and cellular uptake evaluationinvitroandinvivo[J].Biomed Pharmacother,2015,2(69):191-200.
[11]Panoilia E,Schindler E,Samantas E,et al.A pharmacokinetic binding model for bevacizumab and VEGF165 in colorectal cancer patients[J].Cancer Chemother Pharmacol,2015,75(4):791-803.
[12]赵燕颖,李亚刚,颜波群,等.VEGF165b在肝细胞癌中的表达及其作用机制[J].世界华人消化杂志,2016,24 (3) :355-361.
[13]Bunni J,Shelley-Fraser G,Stevenson K,et al.Circulating levels of anti-angiogenic VEGF-A isoform (VEGF-Axxxb) in colorectal cancer patients predicts tumour VEGF-A ratios[J].Am J Cancer Res,2015,5(6):2083-2089.
[14]Rennel ES,Hamdollah-Zadeh MA,Wheatley ER,et al.Recombinant human VEGF165b protein is an effective anti-cancer agent in mice[J].Eur J Cancer,2008,44(13):1883-1894.
[16]莫晓丽,刘 洁,诸佳瑜,等.TGFβ1对原发性肝癌诊断价值的Meta分析[J].临床肝胆病杂志,2017,33(5):864-868.

