铜绿微囊藻与小球藻对低温和黑暗的响应与恢复
岳 红 李巧玉 喻 燚 张红波 董聪聪 施军琼 吴忠兴
(西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
近年来, 水体富营养化导致的蓝藻水华已在世界各地广泛报道[1], 蓝藻水华的发生, 不仅引起水质的恶化, 影响生态环境, 而且部分种类能够释放毒素影响了人类身体健康[2,3]。在已报道的蓝藻水华中, 微囊藻水华最为普遍。研究表明池塘中微囊藻水华发生率为30%—50%, 主要是铜绿微囊藻与水华微囊藻[4], 而大中型水库大部分水体优势种主要是微囊藻, 占水华总数的75%以上[5,6]。因而, 研究微囊藻水华生态过程具有重要的现实意义。
先前的研究表明, 微囊藻通常在春末迅速生长,夏季进入稳定期并占据主体地位, 秋季、冬季进入水体底层或沉积物越冬, 到第二年的春天开始新一轮的循环[7]。许多蓝藻形成休眠孢子或厚壁孢子来渡过冬季的逆境条件, 而微囊藻仍以营养细胞形式来应对冬季低温黑暗条件[8]。休眠孢子具有休眠和极强的抗逆性特征, 因此, 它具有很好的抵御冬季胁迫环境的能力, 然而, 微囊藻营养细胞如何适应冬季逆境条件, 其作用机理尚不明确, 这也是揭示微囊藻水华形成过程的重要生态问题。因此, 本实验中以铜绿微囊藻(Microcystis aeruginosa PCC 7806)为研究对象, 将其与小球藻(Chlorella sp.FACHB-31)进行对比实验, 探究其在低温黑暗条件下它们的响应机制, 为揭示蓝藻水华形成提供重要的依据。
1 材料与方法
1.1 藻种及培养条件
实验所采用的铜绿微囊藻和小球藻均由中国科学院水生生物研究所淡水藻种库提供。采用MA培养基在(25±1)℃, 光照强度为25 μE/(m2·s) (光暗比12h鲶12h)交替培养[9]。当2种藻生长到对数期后, 对其进行离心, 并用新鲜的MA培养基进行清洗3次, 清洗后的藻样接种到250 mL锥形瓶中(细胞密度为1.0×106cells/mL)。用黑布和锡箔纸将锥形瓶包扎且不透光后, 放置4℃的冷柜中, 保持低温黑暗培养。平均每5天取样1次进行测定, 持续30d。
1.2 恢复培养
在适应实验进行30d后, 将培养条件恢复到正常情况[温度为(25±1)℃, 光照强度为25 μE/(m2·s)],再平均2d取样一次进行测定, 实验持续10d。
1.3 生物量及色素含量测定
细胞数量采用浮游植物计数法进行测定[10]。样品中叶绿素a与胡萝卜素含量测定采用90%的丙酮过夜提取, 离心, 取上清液于663、645和450 nm处测定吸收值[11]。叶绿素含量采用Chl.a(mg/L)=12.72×A663[10]; 而类胡萝卜素含量Carotenoids(mg/L)=4.1×A450-0.0435×Chl.a[12]。
1.4 最大可变荧光(Fv/Fm)测定
利用Phyto-PAM(Phyto-PAM, ED, Walz, Effeltrich, Germany)测定, 具体测定方法参见吴晓东等[13]研究。
1.5 丙二醛(MDA)含量及过氧化氢酶活性(CAT)测定
脂质过氧化产物丙二醛(MDA)含量采用硫代巴比妥酸比色法进行测定[14], 过氧化氢酶(CAT)采用比色法在240 nm处进行测定[15]。
1.6 细胞存活率
所有处理30d的样品通过FDA (Fluorescein diacetate)染料染色。FDA荧光用Epics Altra流式细胞仪(Coulter, Beckman, USA)进行检测。FCM输出功率为15 mW, 激发光为488 nm。FDA染色的细胞所发出的荧光在505—545 nm被检测, 根据荧光点的位置和密度判断细胞存活率[16]。
1.7 统计方法
所有实验数据均设置3个重复。Control(对照)表示正常处理30d的各项指标, 而低温+黑暗表示在低温黑暗处理条件下的各项指标, 数据表达形式均为Means±SD, 并采用ANOVA进行显著性分析, 显著性水平设置为P<0.05。统计分析应用SPSS22.0软件, 图形采用Origin8.6软件绘制。
2 结果
2.1 叶绿素浓度
低温黑暗培养30d后, 铜绿微囊藻PCC 7806的叶绿素a浓度下降了55.88%, 小球藻FACHB-31的叶绿素a浓度下降52.07%。在低温黑暗条件下, 类胡萝卜素与叶绿素的比值(Car/Chl.a)均高于对照组,微囊藻PCC 7806增加了0.61倍, 小球藻FACHB-31增加了3.23倍(图1)。然而, 在正常条件培养下, 微囊藻和小球藻的叶绿素1.48倍和3.58倍。
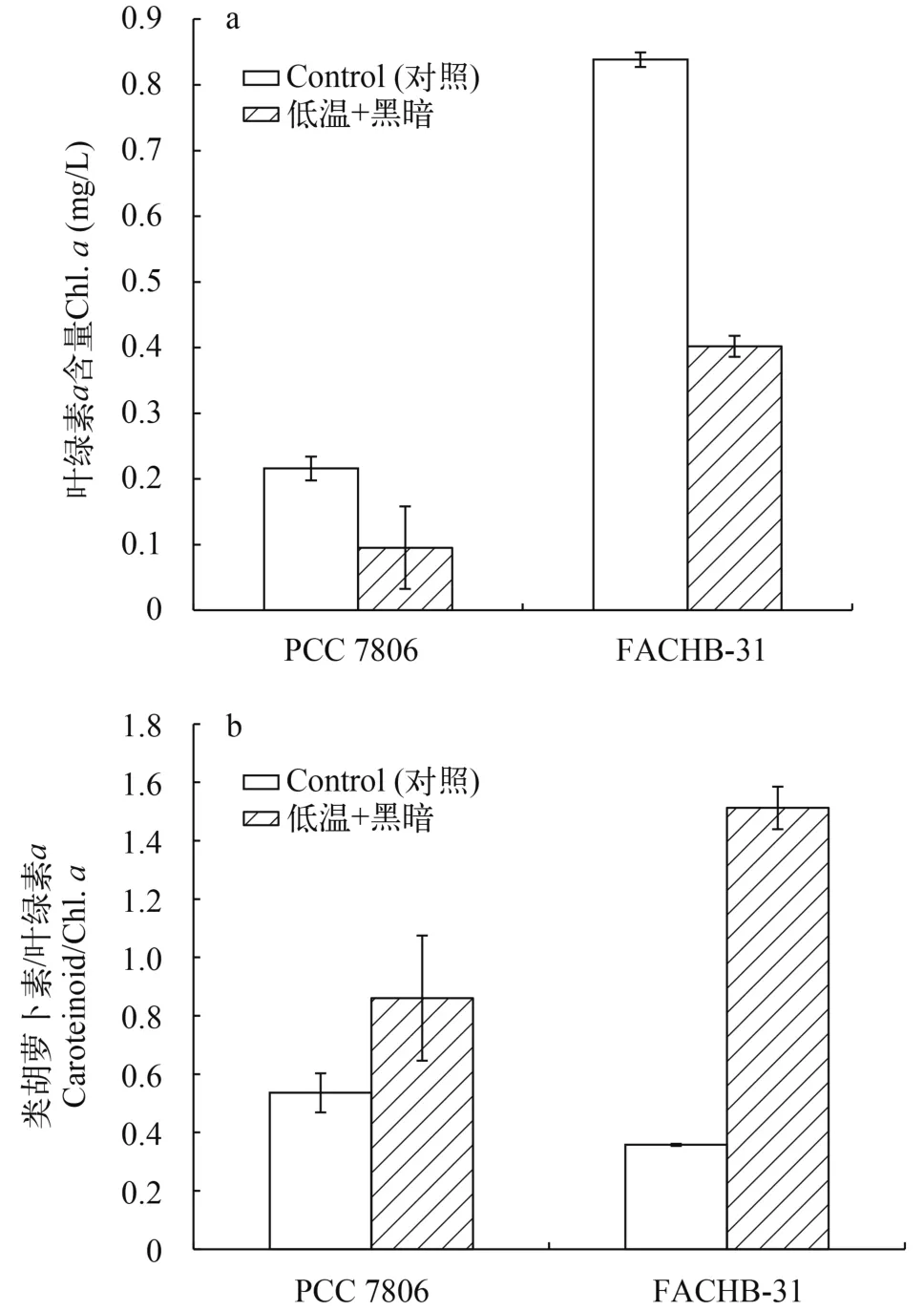
图1 铜绿微囊藻与小球藻的叶绿素a及类胡萝卜素相对含量Fig. 1 Chlorophyll a contents and the relative contents of carotenoids in Microcystis aeruginosa PCC 7806 and Chlorella sp.FACHB-31 after 30 days under darkness and low temperature incubation
2.2 最大光化学效率(Fv/Fm)
低温黑暗培养30d后, 2种藻的最大光化学效率(Fv/Fm)均呈现下降的趋势, 微囊藻PCC 7806的对照处理组差异不显著, 小球藻FACHB-31对照组在15d增加到0.67后, 开始缓慢下降, 但整体均高于低温黑暗处理组(图2)。

图2 低温低光对微囊藻PCC 7806和小球藻FACHB-31 Fv/Fm的影响Fig. 2 Effects of darkness and low-temperature on Fv/Fm of Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 during 30 days incubation
2.3 存活率比较
低温和黑暗抑制了两种藻的生长(图3), 在正常培养和低温黑暗条件下培养30d后, 铜绿微囊藻存活率分别为(81.6±0.04)%和(54.6±2.9)%, 降幅为33.09%; 而小球藻分别为(74.5±0.04)%和(31.3±1.2)%, 降幅为57.99%。与对照相比, 2种藻存活率均显著降低(P<0.05, ANOVA)。
2.4 丙二醛含量(MDA)及过氧化氢酶(CAT)活性
在30d正常和低温黑暗条件下培养, 铜绿微囊藻的丙二醛(MDA)含量(图4a)分别为4.7和37.5 μmol/mg protein, 与正常对照组相比, 在低温黑暗条件培养下MDA具有显著变化(P<0.05, ANOVA); 而小球藻MDA含量分别为0.5和2.5 μmol/mg protein, 变化显著(P<0.05, ANOVA)。PCC 7806及FACHB-31的过氧化氢酶(CAT)在低温黑暗培养过程分别上升44.8%和5.5%(图4b)。铜绿微囊藻在培养前后差异显著(P<0.05, ANOVA), 且2种藻之间具有显著性差异(P<0.05, ANOVA)。然而, 在正常对照培养条件下, 微囊藻和小球藻的MDA含量和CAT活性均未显著性变化。
2.5 恢复实验
在30d的低温黑暗培养后, 将2种藻放置正常温度及正常光照条件继续培养10d, 研究2种藻的生长恢复能力。结果表明2种藻均能迅速恢复生长(图5),铜绿微囊藻PCC 7806细胞数由原来的0.1195(×107/mL)增加到0.55 (×107cell/mL), 上升6.5倍, 变化显著(P<0.05, ANOVA)。小球藻FACHB-31细胞数则上升8.6倍, 达到0.6365 (×107/mL), 显著增加(P<0.05, ANOVA), 而2种藻之间差异不显著(P>0.05, ANOVA)。
3 讨论

图3 铜绿微囊藻(PCC 7806)与小球藻(FACHB-31)存活率Fig. 3 Comparison of metabolic activities between Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 by flow cytometry(FCM) after 30 days of darkness and low-temperature incubation
在自然水体中, 浮游植物必须面对昼夜和季节交替的过程, 这使得它们可能会长期或周期性地处于一个不利的环境中, 在这种情况下, 藻类需要具备能够长期耐受不利条件并能在有利条件下及时恢复的能力。对蓝藻生活史的研究发现, 一部分时间是以休眠的形式存在于底泥中, 剩余的时间是以漂浮状态存在[17]。这种底栖-漂浮的生活史不仅影响不同浮游植物种类的演替[18], 也直接影响了水体某些种类的优势度[19]。然而, 藻类如何应对底栖中的低温、黑暗条件以及它们的机制研究甚少。Wu等[8]研究发现与栅藻相比, 铜绿微囊藻在低温黑暗条件下培养30d后, 细胞数量及叶绿素a含量变化不显著, 表现出更强的适应能力, 使得其能在这样的逆境条件下生存更长的时间。谢晓玲等[20]研究也表明, 当气温较低时, 蓝藻较绿藻更占优势。本研究结果也发现了低温黑暗培养下铜绿微囊藻叶绿素a含量变化不显著(图1a), 表明铜绿微囊藻能够适应低温黑暗条件并保持色素的稳定性。然而,与微囊藻相比, 本研究发现小球藻的叶绿素a含量经过低温黑暗培养呈显著降低(图1b), Zhang等[21]对黑暗处理条件下小球藻(Chlorella pyrenodosa)的研究也获得了类似的结果, 即黑暗条件对小球藻细胞色素的合成有显著影响。

图4 铜绿微囊藻与小球藻的丙二醛含量和过氧化氢酶活性Fig. 4 Effects of darkness and low-temperature on Malodialdehyde content (MDA) and catalase activity (CAT) in Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 after 30 days incubation

图5 适应期(黑暗低温)与恢复期(正常条件)细胞数量Fig. 5 Change of cell numbers in Microcystis aeruginosa PCC 7806 and Chlorella sp. FACHB-31 in response to darkness and low-temperature conditions
最大可变荧光(Fv/Fm)是衡量光化学效率的重要参数, 常用来表征PSⅡ反应中心内禀光能转换效率。在正常生理状态下,Fv/Fm处于稳定状态[22]。本研究发现铜绿微囊藻与小球藻在低温黑暗条件下培养Fv/Fm呈现逐步下降趋势(图2), 表明2种藻随着低温黑暗培养时间的增加, 最大可变荧光均受到影响。然而, 相比于小球藻, 铜绿微囊藻下降更加明显。Wu等[8]对微囊藻和栅藻的研究也发现类似的结论。Jochem[23]研究发现, 在面对着黑暗胁迫下, 不同的浮游植物呈现可能呈现出2种不同的机制, 即减少代谢活性或仍保持稳定的代谢活性。本研究发现小球藻Fv/Fm值一直维持在一个稳定的水平, 这表明当遭受低温、黑暗胁迫时, 微囊藻和小球藻表现出不同的机制来应对胁迫, 即微囊藻可能通过降低自身的光合活性, 而小球藻则保持较高的、稳定的光合活性。
丙二醛(MDA)是膜质过氧化的产物, 是表征膜受损程度及抗逆性的重要参数, MDA含量越高则表示细胞受损程度越大[24]。过氧化氢酶是细胞内分解有害产物过氧化氢重要的酶类。本研究发现铜绿微囊藻MDA含量高于小球藻(图3a), 表明与小球藻相比, 铜绿微囊藻受到更大的氧化损伤。类胡萝卜素是一种广泛存在于生物的天然色素, 更是1种保护细胞免受活性氧, 强光等有害因素影响的天然抗氧化剂[25]。它是植物光合作用的辅助色素,具有捕获光能并将其传递到叶绿素a的功能[26], 小球藻单位类胡萝卜素含量的增加(图1b), 表明类胡萝卜素参与保护小球藻使其免受氧化损伤。过氧化氢酶(CAT)通过将H2O2歧化为H2O和O2的方式来维持生物体内的氧化还原平衡[27]。本研究发现与小球藻相比, 铜绿微囊藻CAT显著增加(图3b), 表明铜绿微囊藻通过CAT清除氧化损伤。由于抗氧化系统酶对于机体内活性氧自由基及过氧化氢的清除存在1个阈值, 当细胞内氧自由基浓度超过一定范围, 抗氧化体系酶不能及时清除, 导致细胞进一步受到损伤[28]。因此, 本研究发现低温黑暗培养30d后, 铜绿微囊藻与小球藻的存活率分别为54.9%和31.3% (图4b、图4d)。这表明2种藻均受到细胞的损伤。Wu等[8]表明铜绿微囊藻通过降低自身的代谢活性, 降低了细胞的死亡率。相比铜绿微囊藻,由于小球藻一直保持较高的光合活性, 导致存活率降低。当恢复光照与温度后, 2种藻细胞数量增加,铜绿微囊藻与小球藻均显著增加(P<0.05, ANOVA,图5)。然而, 小球藻则表现出较快的生长恢复。陈曦等[29]研究提出小球藻对温度具有极强的适应能力, 且在富含有机质的水域中生活良好, 因此在恢复温度和光照的后便能更快的进行生长。
综上所述, 低温黑暗培养, 铜绿微囊藻存活率高于小球藻, 2种藻细胞数量差异显著; 为了应对外界胁迫环境, 2种藻采用不同的代谢策略, 即铜绿微囊藻通过降低代谢活性, 而小球藻则采取保持较高代谢活性来应对不良环境。
[1]Qin B Q, Yang G J, Ma J R,et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China [J].Chinese Science Bulletin, 2016,61(7): 759—770 [秦伯强, 杨桂军, 马健荣, 等. 太湖蓝藻水华“暴发”的动态特征及其机制. 科学通报, 2016,61(7): 759—770]
[2]Codd G A, Metcalf J S, Morrison L F,et al. Susceptibility of flamingos to cyanobacterial toxins via feeding [J].Veterinary Record, 2003, 152(23): 722—723
[3]Ding Y, Gan N Q, Liu J,et al. Survival, recovery and microcystin release ofMicrocystis aeruginosain cold or dark condition [J].Chinese Journal of Oceanology and Limnology, 2017, 35(2): 313—323
[4]Paerl H W, Fulton R S, Moisander P H,et al. Harmful freshwater algal blooms, with an emphasis on cyanobacteria [J].The Scientific World Journal, 2001, 1(1): 76—113
[5]Dong J, Gao Y N, Li G B. A review: responses of phytoplankton communities to eutrophication and climate warming in freshwater lakes [J].Acta Hydrobiologica Sinica, 2016, 40(3): 615—625 [董静, 高云霓, 李根保. 淡水湖泊浮游藻类对富营养化和气候变暖的响应. 水生生物学报, 2016, 40(3): 615—625]
[6]Wang C H, Lin S J, Han B P,et al. Distribution ofMicrocytinsin typical water supply reservoirs and lakes in Guangdong province [J].Acta Hydrobiologica Sinica,2007, 13(3): 307—311 [王朝晖, 林少君, 韩博平, 等. 广东省典型大中型供水水库和湖泊微囊藻毒素分布. 水生生物学报, 2007, 13(3): 307—311]
[7]Lewis J, Jones K J, Edmonds R L,et al. Long-term survival of marine planktonic diatoms and dinoflagellates in stored sediment samples [J].Journal of Plankton Research, 1999, 21(2): 343—354
[8]Wu Z X, Song L R. Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacteriumMicrocystisand a green algaScenedesmus[J].Hydrobiologia, 2008, 596(1): 47—55
[9]Watanabe M M, Hiroki M. NIES-collection. List of strains, fifth edition [M]. Tsukuba, Japan. National Institute for Environmental Studies. 1997, 140
[10]Zhou B, Bi Y H, Hu Z Y,et al. Effects of temperature on the buoyancy ofMicrocystis aeruginosa[J].China Environmental Science, 2014, 34(7): 1847—1854 [周贝, 毕永红, 胡征宇, 等. 温度对铜绿微囊藻细胞浮力调控机制.中国环境科学, 2014, 34(7): 1847—1854]
[11]Xie L J, Yu D Z, Zeng C,et al. The response of bacterial community composition to the decomposition ofMicrocystisblooms [J].Journal of Lake Sciences, 2016, 28(1):22—30 [谢丽娟, 余得昭, 曾诚, 等. 细菌群落组成对微囊藻水华分解过程的响应. 湖泊科学, 2016, 28(1):22—30]
[12]Nusch E A. Comparison of different methods for chlorophyll and phaeopigment determination [J].Archiv fur Hydrobiologie Beiheft Ergebnisse der Limnologie, 1980, 14:14—36
[13]Wu X D, Kong F X, Cao H S,et al.In situstudy on the photochemical vitality of overwintering phytoplankton[J].Journal of Lake Sciences, 2007, 19(2): 139—145 [吴晓东, 孔繁翔, 曹焕生, 等. 越冬浮游植物光合作用活性的原位研究. 湖泊科学, 2007, 19(2): 139—145]
[14]Choo K S, Snoeijs P, Pedersén M. Oxidative stress tolerance in the filamentous green algaeCladophora glomerataandEnteromorpha ahlneriana[J].Journal of Experimental Marine Biology and Ecology, 2004, 298(1):111—123
[15]Uchimaya M, Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test [J].Analytical Biochemistry, 1978, 86(86): 271—278
[16]Endo H, Nakayama J, Hayashi T. Application of flow cytometry to environmental control in marine aquaculture [J].Materials Science and Engineering C, 2000,12(1—2): 83—88
[17]Cirés S, Wörmer L, Agha R,et al. Overwintering populations ofAnabaena,AphanizomenonandMicrocystisas potential inocula for summer blooms [J].Journal of Plankton Research, 2013, 35(6): 1254—1266
[18]Misson B, Latour D. Influence of light, sediment mixing,temperature and duration of the benthic life phase on the benthic recruitment ofMicrocystis[J].Journal of Plankton Research, 2012, 34(2): 113—119
[19]Head A M, Jones R I, Bailey-Watts A E. An assessment of the influence of recruitment from the sediment on the development of planktonic populations of cyanobacteria in a temperate mesotrophic lake [J].Freshwater Biology,1999, 41: 759—769
[20]Xie X L, Zhou R, Deng Z F,et al. Overcompensation and competitive effects ofMicrocystis aeruginosaandScenedesmus obliquusafter low temperature and light stresses[J].Acta Ecologica Sinica, 2014, 34(5): 1224—1234 [谢晓玲, 周蓉, 邓自发. 光、温限制后铜绿微囊藻和斜生栅藻的超补偿生长和竞争效应. 生态学报, 2014, 34(5):1224—1234]
[21]Zhang M, Kong F X, Shi X L,et al. Differences in responses to darkness betweenMicrocystis aeruginosaandChlorella pyrenoidosa[J].Journal of Freshwater Ecology, 2007, 22(1): 93—99
[22]Tang J, Song L R, Zhang S S,et al. Recruitment ability ofMicrocystis aeruginosaunder low light-low temperature combination [J].Environmental Science, 2012, 12(31):2932—2937 [汤俊, 宋立荣, 张松松, 等. 低光低温联合作用对铜绿微囊藻复苏能力的影响. 环境科学, 2012,12(31): 2932—2937]
[23]Jochem F J. Dark survival strategies in marine phytoplankton assessed by cytometric measurement of metabolic activity with fluorescein diacetate [J].Marine Biology, 1999, 135(4): 721—728
[24]Liu H, Chen X Q, Pei Y S. Acute toxic effects of boron compounds onChlorella vulgaris[J].Research of Environmental Sciences, 2015, 28(12): 1887—1894 [刘欢, 陈雪晴, 裴元生. 硼彭化合物对普通小球藻的急性毒性效应. 环境科学研究, 2015, 28(12): 1887—1894]
[25]Liu R, Bai F, Ran X F,et al. Effect ofN-phenyl-2-Naphthylamine on the growth, antioxidative enzyme and PSⅡinCylindrospermopsis raciborskii[J].Acta Hydrobiologica Sinica, 2015, 39(4): 774—781 [刘瑞, 白芳, 冉小飞,等. N-苯基-2-萘胺对拟柱胞藻生长、抗氧化酶及光合系统Ⅱ的影响. 水生生物学报, 2015, 39(4): 774—781]
[26]Wan L, Shao L L, Lu K H,et al. Effects of ultrasound wave on the ultrastructure and physiological characteristics of blue-green algae (Microcystis aeruginosa) [J].Acta Hydrobiologica Sinica, 2014, 38(3): 516—524 [万莉, 邵路路, 陆开宏, 等. 超声波对铜绿微囊藻超微结构和生理特性的影响. 水生生物学报, 2014, 38(3): 516—524]
[27]Deng S P, Zhao Y T, Zhu C H,et al. Effect of cadmium on the antioxidant enzyme activity and lipid peroxidation inSanguinolaria acuta[J].Acta Hydrobiologica Sinica,2012, 36(4): 689—695 [邓思平, 赵云涛, 朱春华, 等. 镉对尖紫蛤抗氧化酶活性及脂质过氧化的影响. 水生生物学报, 2012, 36(4): 689—695]
[28]Liu L, Yan H, Xia W T,et al. Toxic effect of cadmium onMicrocysis aeruginosaandScenedesmus obliquus[J].China Environmental Science, 2014, 34(2): 478—484 [刘璐, 闫浩, 夏文彤, 等. 镉对铜绿微囊藻和斜生栅藻的毒性效应. 中国环境科学, 2014, 34(2): 478—484]
[29]Chen X, Liu R Y, Wang Y F,et al. Research on algal diversity in Zoige Alpine Wetland [J].Environmental Science, 2012, 33(3): 201—209 [陈曦, 刘如铟, 王艳芬, 等.若尔盖高原湿地藻类多样性研究. 环境科学, 2012,33(3): 201—209]

