不同光质对线形硬毛藻生理生化指标的影响研究
马 瑞,李常军,李文涛,张秀梅
(中国海洋大学水产学院,山东青岛 266003)
线形硬毛藻Chaetomorpha linum隶属于绿藻门Chlorophyta、绿藻纲Chlorophyceae、刚毛藻目Cladophorales、刚毛藻科Cladophoraceae、硬毛藻属Chaetomorpha,主要繁殖方式包括有性繁殖、无性繁殖和营养繁殖[1]。线形硬毛藻在富营养化水体中常占据优势地位,形成大规模草丛[2],同时其较高的光合作用速率可以提高水体溶解氧水平,腐败分解后释放多种元素,影响水体的化学过程和物质组成[3]。线形硬毛藻作为绿潮藻类的优势种之一,国内外学者对它的研究多集中在营养盐吸收方面[4]。如MCGLATHERY,et al[5]研究表明,在氮限制的情况下,线形硬毛藻会加快对NH4+的吸收速度,而对NO3-的吸收滞后;在氮充足的情况下,会优先吸收NH4+而抑制对NO3-的吸收;KRAUSE-JENSEN,et al[6]研究表明线形硬毛藻在高光照强度条件下比在低光照强度条件下可以更有效地阻止NH4+向上层水中扩散,光期比暗期吸收量更大。另外,有关线形硬毛藻的生长和物质积累方面也有一些报道,如XU,et al[7]研究了温度、盐度和光照强度对于线形硬毛藻生长影响的最佳组合。
光是调控植物生长发育的关键生态因子之一,而光质是光的重要属性[8-9]。藻类对光质的吸收具有选择性,光质对藻类的生长发育、形态建成、光合作用和物质代谢等具有重要的调控作用[10-14],直接影响藻类的生长和发育。目前,对于线形硬毛藻的研究多集中在营养盐吸收[15]、温度[7]、盐度[7]和光照强度[16]等方面,而关于光质对于线形硬毛藻生长发育及其理化指标的影响研究甚少。鉴于此,本文利用发光二极管(LED)作为光源,探讨红光(R)、蓝光(B)、红光:蓝光=3:1(3RB)、红光:蓝光=1:1(RB)、红光:蓝光=1:3(R3B)和红光:绿光:蓝光=1:1:1(RGB)2种单色光及4组混合光对线形硬毛藻生理生化指标的影响,为绿潮藻类的后续研究提供理论参考。
1 材料与方法
1.1 样品采集
实验用线形硬毛藻于2016年11月采自山东省荣成市天鹅湖(37°21′N,122°34′E),测得天鹅湖实时水温13.5℃,盐度31.76、DO 8.2 mg/L。挑选色泽艳丽,生长状态良好的线形硬毛藻,伴随少量海水置于保温箱内低温避光保存,并于采样当天将样品运回实验室。
1.2 藻体暂养
将运回实验室的藻体用过滤海水反复清洗以去除藻体表面的附生生物及杂质,将挑选健康且生长状态一致的藻体置于实验室循环水槽(70 cm×40 cm×50 cm)内培养 7~10 d,期间光照强度为 60 μmol·m-2·s-1,光周期为12 L:12 D,同时,保持每天1℃的速度给水槽内海水升温,每天更换1次全部海水。
1.3 实验设计
使用1 000 mL烧杯作为实验用培养瓶,随机称量4份相同鲜重(3.0±0.1 g)的藻体,分别置于不同培养瓶中,并向培养瓶中注入800 mL灭菌的PES培养液。用保鲜膜将培养瓶封口,并用细针在保鲜膜上穿孔20个,既防止培养液蒸发盐度升高,又保持了气体的交换。将培养瓶置于一不透光的纸箱(60 cm×60 cm×75 cm)内,不同纸箱内设有不同光质(R、G、B、3RB、RB、R3B、RGB)的 LED 排灯照射,通过气泵向每个培养瓶注入空气,注入空气的速度以藻体可以在培养瓶中缓慢移动为好。
实验用光源为11 W的LED排灯,其中红光波长700 nm,蓝光波长450 nm,绿光波长550 nm,通过调整排培养瓶与光源之间的距离,保证照着到培养瓶处的光照强度为60 μmol·m-2·s-1,光照强度使用LI-250 A便携式光照仪进行测定。培养期间温度恒定于25℃,光周期12 L:12 D,培养时间为10 d。
1.4 样品测定
1.4.1 特定生长率(SGR)
实验结束后,称量每组藻体的湿重,运用以下公式计算藻体的特定生长率(SGR)。

式中,Wt为实验结束时藻体的湿重(g);Wo为实验开始时藻体的湿重(g);t为实验时间(d)。
1.4.2 叶绿素a含量
实验开始前称取4份湿重为0.3±0.01 g的藻体置于-80℃冰箱内冷冻保存,用于藻体叶绿素a的初始值测定;实验结束时,每个培养瓶随机称取0.3±0.01 g的藻体,用于测定实验后藻体的叶绿素a含量[17]。测量方法采用可见光法,公式如下:
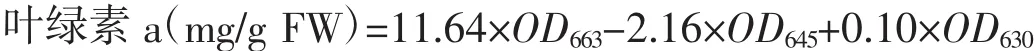
式中:OD663为663 nm波长处的浑浊度校正值;OD645为645 nm波长处的浑浊度校正值;OD630为630 nm波长处的浑浊度校正值。
1.4.3 抗氧化酶及丙二醇的测定
实验开始前随机取部分藻体于-80℃冰箱内冷冻保存,用于抗氧化酶及丙二醇初始值的测定。总超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醇(MDA)的测定均采用南京建成生物工程公司生产的总超氧化物岐化酶(SOD)、过氧化氢酶(CAT)和丙二醇(MDA)试剂盒进行测定。
1.5 数据处理
采用SPSS 19.0和Excel 2010软件对数据进行处理分析,采用单因素方差分析(One-Way ANOVA)检验不同光质处理对线形硬毛藻各生理生化指标的差异显著性,将P<0.05设为差异显著水平,P<0.01设为差异极显著水平,图中数据以平均值±标准误差表示。
2 结果与分析
2.1 特定生长率及单位长度细胞数量
培养10 d结束后,各光质处理下线形硬毛藻的特定生长率存在极显著差异(P<0.01)(图1)。总体来看,在复合光质下培养的藻体要比在单色光质下培养的藻体生长的更快;在复合光质中,随着蓝光比例的增加,藻体的特定生长率在不断上升,呈现出显著性差异(P<0.05)。其中,RGB光质组培养下藻体生长最快(6.63%),R3B光质组次之(6.44%),而红光处理下的藻体生长最慢(4.11%)。观察RB和RGB培养组可发现,绿光的加入对藻体的生长有明显的促进作用(P<0.05),RGB光质组藻体增重是RB组的1.09倍。
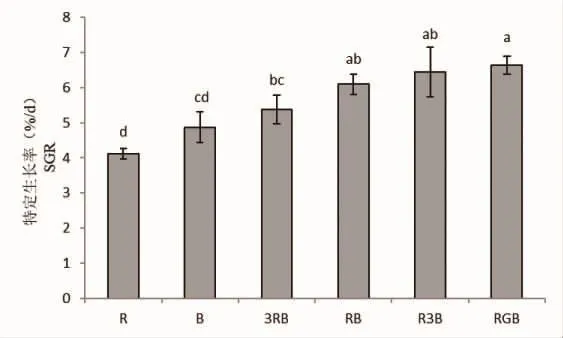
图1 线形硬毛藻在不同光质下的特定生长率Fig.1 The SGR of C.linum under different light qualities

图2 不同光质培养条件下线形硬毛藻的叶绿素a含量Fig.2 The contents of Chl a of C.linum under different light qualities
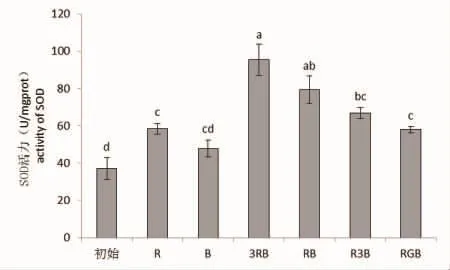
图3 不同光质条件下线形硬毛藻的SOD活力Fig.3 SOD activity of C.linum under different light qualities
2.2 光合色素叶绿素a含量
不同光质处理下线形硬毛藻体内叶绿素a含量存在极显著性差异(P<0.01)。从图2可以看出,RB、R3B、RGB光质处理组藻体内叶绿素a含量大于实验培养前的初始值,而R、B、3RB光质处理组藻体内叶绿素a含量小于初始值,RB光质组培养下的藻体叶绿素a含量显著高于其他各处理组(P<0.05),是初始值的1.44倍,是红光处理组的2.78倍。加入绿光的RGB光质处理组相较于RB光质处理组来说,叶绿素a含量略低,说明绿光的加入不利于线形硬毛藻叶绿素a的累积。
2.3 抗氧化酶活力
不同光质处理下线形硬毛藻体内SOD活力存在极显著性差异(P<0.01)。从图3可看出,各组光质处理培养的藻体,其体内的SOD活力均高于初始值,其中复合光质组的SOD活力要高于单色光质组,但无论在红、蓝单色光质中比较,还是在复合光质中按光质的比例来看,随着红光所占比例的增加,藻体内SOD的活力在不断增强,说明红光有利于线形硬毛藻体内SOD活力的提升。比较RB光质组和RGB光质组可以看出,绿光的加入不利于藻体SOD活力的提升。
总体来看,藻体内CAT活力的变化规律与SOD活力的变化规律基本一致,但经单因素方差分析检验,不同光质处理对藻体内CAT活力无显著影响(P>0.05)。
2.4 丙二醛
不同光质处理下线形硬毛藻体内MDA含量存在极显著性差异(P<0.01)(图5)。从总体来看,单色光质组培养的藻体内MDA含量要高于复合光质组培养的藻体,单色光质组MDA含量高于初始值,复合光质组MDA含量低于初始值(图5)。从图5还可以看出,无论在红、蓝单色光质中比较,还是在复合光质中按光质的比例来看,随着蓝光所占比例的增加,藻体内MDA含量在不断增强,说明蓝光可以促进线形硬毛藻体内MDA的累积。比较RB光质组和RGB光质组可以看出,绿光的加入不利于藻体MDA的累积。

图4 不同光质条件下线形硬毛藻的CAT活力Fig.4 CAT activity of C.linum under different light qualities

图5 不同光质培养条件下线形硬毛藻的MDA含量Fig.5 The contents of MDA of C.linum under different light qualities
3 讨论
光作为最重要的生态因子之一,不仅给植物的光合作用提供了必要的能源,同时也对植物的形态建成起调控作用[18]。光质作为光的重要属性,是通过被植物体内的光敏色素感知,从而影响植物的生长发育、光合作用、形态建成和生理代谢[19]。大量研究证实,光质对藻类的生长繁殖、光合色素的含量组成[20-24]以及酶活性[25]均有一定的影响。本研究表明,相较于单色光质组(R、B)来说,复合光质组(3RB、RB、R3B、RGB)更有利于线形硬毛藻生物量的积累,这一结果与中肋骨条藻Skeletonema costatum[26]和草莓[27]的研究结果一致,说明各种光质相互协调,共同作用更有利于植物的生长发育。在复合光质组中,蓝光比例的增加明显有利于线形硬毛藻体的生长,这与坛紫菜自由丝状体[9]、扁浒苔Ulva compressa[14]的研究结果类似。但也有研究发现,红光对江蓠Gracilaria fisheri[23]和角叉菜Chondrus ocellatus[28]的促生长作用明显优于蓝光,作者认为造成这种差异的原因可能是不同藻体内所含光合色素的含量和组成不同,使其对于可见光各个波段的吸收率和利用率不同。
光合色素是藻类进行光合作用的物质基础,能够吸收、传递和转换光能,而在光合作用的过程中,叶绿素a直接参与光反应阶段[9],因此叶绿素a的含量是反应植物光合作用能力的重要指标。本研究表明,复合光质组的叶绿素a含量明显高于红、蓝单色光,说明复合光更有利于线形硬毛藻光合色素的累积。RB光质组叶绿素a含量最高,显著高于RGB光质组(P<0.05),说明绿光的加入不利于线形硬毛藻光合色素的累积。
SOD和CAT是生物体内抗氧化酶系统的重要组成部分,会对植物产生一定程度的保护作用[29],其中SOD能催化超氧化物阴离子自由基发生歧化反应,将活性氧代谢维持在平衡水平,保护膜结构[30],CAT则可以分解代谢产生的H2O2,从而有效地清除自由基[31]。植物体内的光敏色素会对不同的光质作出响应,从而影响植物的抗氧化系统[32]。研究表明,光能吸收与利用的平衡常常会被逆境条件打破,从而导致吸收光能过剩以及氧自由基的产生,而这些活性氧会损害植物的生理功能,破坏SOD、CAT等抗氧化酶的含量、结构,影响膜系统的稳定性,最终导致膜脂过氧化,破坏膜的结构,对植物产生极其严重的伤害[29,33]。本研究表明,实验中经过各组光质培养的藻体内SOD活力均高于初始值,可能是实验光质均对藻体的生长发育产生了胁迫,抗氧化酶系统发挥保护作用,使得SOD活力上升。复合光质组SOD活力高于单色光质组,结合藻体在各组光质培养下的生长情况,分析认为,虽然各组光质均对藻体的生长产生胁迫,但单色光质组(R、B)产生的胁迫较强,严重影响了藻体内的抗氧化酶系统的正常水平,使得SOD活力下降。本研究发现,实验光质组对藻体内CAT活力的影响不显著(P>0.05)。分析认为,SOD可将藻体内O2-转化为H2O2,CAT进一步将H2O2转化为无毒性的H2O和O2从而起到保护膜结构的作用,而CAT活力的定义为每mg组织蛋白每秒分解1 μmol的H2O2的量为一个活力单位,但实验中藻体培养时间较短,不同光质照射仅对藻体SOD活力产生影响,未达到对CAT影响的培养时间。
丙二醛(MDA)是膜脂过氧化的重要产物之一,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度以及植物的抗逆性[34]。MDA的测定常常与SOD的测定相互配合,SOD的活力高低间接反应了机体清除氧自由基的能力,而MDA的高低又间接反应了机体细胞受自由基攻击的严重程度。大量研究证明,植物在受到严重胁迫的情况下,其体内的MDA含量有明显的升高。本研究表明,复合光质组的藻体内MDA含量均低于初始值,单色光质组的藻体内MDA含量高于初始值,结合各组光质对藻体SOD和CAT活力的影响,表明红、蓝单色光相比于复合光对藻体产生了更大的胁迫,SOD、CAT的活力下降导致活性氧的积累,过量的活性氧加剧了膜脂过氧化作用,这与番茄[35]和水稻[36]的研究结果一致。
[1]曾呈奎.中国黄渤海海藻[M].北京:科学出版社,2009.
[2]McCOMB A J,HUMPHRIES R.Loss of Nutrients from Catchments and Their Ecological Impacts in the Peel-Harvey Estuarine System,Western Australia[J].Estuaries,1992,15(4):529-537.
[3]GAO Li,ZHANG Luhua,HOU Jinzhi,et al.Decomposition of macroalgal blooms influences phosphorus release from the sediments and implications for coastal restoration in Swan Lake,Shandong,China[J].Ecological Engineering,2013,60(7):19-28.
[4]MENÉNDEZ M,MARTÍNEZ M,COMÍN F A.A comparative study of the effect of pH and inorganic carbon resources on the photosynthesis of three floating macroalgae species of a Mediterranean coastal lagoon[J].Journal of Experimental Marine Biology and Ecology,2001,256(1):123-136.
[5]McGLATHERY K J,PEDERSEN M F,BORUM J.Changes in intracellular nitrogen pools and feedback controls on nitrogen uptake in Chaetomorpha linum(Chlorophyta)[J].Journal of Phycology,1996,32(3):393-401.
[6]KRAUSE-JENSEN D,McGLATHERY K,RYSGAARD S,et al.Production within densemats of the filamentous macroalga Chaetomorpha linum in relation to light and nutrient availability[J].Marine Ecology Progress Series,1996,134(1):207-216.
[7]XU Yongjian,LIN Junda.Effect of Temperature,Salinity,and Light Intensity on the Growth of the Green Macroalga,Chaetomorpha linum[J].Journal of the World Aquaculture Society,2008,39(6):847-851.
[8]韩军军,钟晨辉,何培民,等.不同光质LED光源对坛紫菜自由丝状体生长和生理特性的影响[J].水产学报,2017,41(2):230-239.
[9]洁 郑,胡美君,郭延平.光质对植物光合作用的调控及其机理[J].应用生态学报,2009,19(7):1 619-1 624.
[10]WANG Wenjun,SUN Xiutao,WANG Feijiu.Effect of blue light on early sporophyte development of Saccharina japonica(Phaeophyta)[J].Marine Biology,2010,157(8):1 811-1 817.
[11]WANG Wenjun,SUN Xiutao,WANG Guangce,et al.Effect of blue light on indoor seedling culture of Saccharina japonica(Phaeophyta)[J].Journal of Applied Phycology,2010,22(6):737-744.
[12]TSEKOS I,NIELL F X,AGUILERA J,et al.Ultrastructure of the vegetative gametophytic cells of Porphyra leucosticta(Rhodophyta)grown in red,blue and green light[J].Phycological Research,2002,50(4):251-264.
[13]KUWANO K,ABE N,NISHI Y,et al.Growth and cell cycle of Ulva compressa(Ulvophyceae)under LED illumination[J].Journal of Phycology,2014,50(4):744-752.
[14]ZHANG Xu,LI Dapeng,HU Hanhua,et al.Growth Promotion of Vegetative Gametophytes of Undaria pinnatifida by Blue Light[J].Biotechnology Letters,2005,27(19):1 467-1 475.
[15]MENÉNDEZ M,HERRERA J,COMĬN F A.Effect of nitrogen and phosphorus supply on growth,chlorophyll content and tissue composition of the macroalga Chaetomorpha linum(O.F.Müll.)Kütz in a Mediterranean coastal lagoon[J].Scientia Marina,2002,66(4):355-364.
[16]McGLATHERY K J,KRAUSE-JENSEN D,RYSGAARD S,et al.Patterns of ammonium uptake within dense mats of the filamentous macroalga Chaetomorpha linum[J].Aquatic Botany,1997,59(1):99-115.
[17]张 宇.线形硬毛藻的生理生态学特性的初步研究[D].青岛:中国海洋大学,2014.
[18]高荣孚,张鸿明.植物光调控的研究进展[J].北京林业大学学报,2002,24(5):236-243.
[19]胡 阳,江 莎,李 洁,等.光强和光质对植物生长发育的影响[J].内蒙古农业大学学报:自然科学版,2009,30(4):296-303.
[20]LÍPEZ-FIGUEROA F,NIELL F X.Effects of light quality on chlorophyll and biliprotein accumulation in seaweeds[J].Marine Biology,1990,104(2):321-327.
[21]GODÓNEZ-ORTEGA J L,SNOEIJS P,ROBLEDO D,et al.Growth and pigment composition in the red alga Halymenia floresii cultured under different light qualities[J].Journal of Applied Phycology,2008,20(3):253-260.
[22]JAYASANKAR R,KULANDAIVELU G.Influence of different wavelengths of light on photosy nthesis and pigment constituents and absorption spectra of Gracilaria spp.[J].Journal of Aquaculture,2001,16(4):359-371.
[23]NGUYEN P T,RUANGCHUAY R,LUEANGTHUWAPRANIT C.Effect of shading colours on growth and pigment content of Gracilaria fisheri(Xia&Abbott)Abbott,Zhang&Xia(Gracilariales,Rhodophyta)[J].Aquaculture Research,2017,48(3):1 119-1 130.
[24]SÁNCHEZ-SAAVEDRA M P,VOLTOLINA D.Effect of photon fluence rates of white and blue-green light on growth efficiency and pigment content of three diatom species in batch cultures[J].Ciencias Marinas,2002,28(3):273-379.
[25]STEINBRENNER J,LINDEN H.Light induction of carotenoid biosynthesis genes in the green alga Haematococcus pluvialis:regulation by photosynthetic redox control[J].Plant Molecular Biology,2003,52(2):343-356.
[26]苗洪利,孙丽娜,田庆震,等.LED单色光谱及复合光谱对赤潮优势种中肋骨条藻生长的作用[J].中国海洋大学学报:自然科学版,2011,41(10):107-110.
[27]王丽娟,白义奎,王铁良.不同光质处理对草莓生理特性的影响[J].河南农业大学学报,2017,51(1):25-28.
[28]JU Qing,XIAO Hui,WANG You,et al.Effects of UV-B radiation on tetraspores of Chondrus ocellatus Holm(Rhodophyta),and effects of red and blue light on repair of UV-B-induced damage[J].Chinese Journal of Oceanology and Limnology,2015,33(3):650-663.
[29]曾韶西,王以柔,刘鸿先.低温光照下与黄瓜子叶叶绿素降低有关的酶促反应[J].植物生理学报,1991,17(2):177-182.
[30]秦 健,刘 洋,方升佐,等.光质和光强对青钱柳生长和抗氧化酶活性的影响[J].南京林业大学学报:自然科学版,2017,41(4):13-18.
[31]杨青珍.猕猴桃果实采后冷害发生生理机制及调控作用[D].杨凌:西北农林科技大学,2013.
[32]任 锦.光质和CO2浓度对紫背天葵生长及其抗氧化成分合成的影响[D].西安:西北工业大学,2015.
[33]赵天宏,孙加伟,付 宇.逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J].作物杂志,2008,3(6):10-13.
[34]张春平.不同外源物质提高盐胁迫下黄连种子及幼苗抗逆性机理研究[D].重庆:西南大学,2012.
[35]多 林,魏毓棠,王世刚.番茄耐低温研究进展[J].沈阳农业大学学报,2000,31(6):585-589.
[36]聂先舟,刘道宏,徐竹生.水稻旗叶脂质过氧化作用与叶龄及Ni2+,Ag+的关系[J].植物生理学通讯,1989(2):32-34.

