中国猪繁殖与呼吸综合征病毒流行历史及现状
郭振华,陈鑫鑫,李 睿,乔松林,郭军庆,张改平,2*
(1.河南省农业科学院动物免疫学重点实验室 农业部动物免疫学重点实验室,郑州 450002;2.河南农业大学,郑州 450002)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)于1987年在美国首次报道,随后欧洲(德国、荷兰等)和亚洲(日本、中国)等地区陆续报道了本病的发生[1]。1991年荷兰学者Terpstra和美国学者Collins先后分离和确定了本病的病原为一种带囊膜的病毒,后来将这种导致猪繁殖与呼吸综合征的病毒统一称为猪繁殖与呼吸综合征病毒(PRRS virus,PRRSV)[2]。PRRSV为有囊膜的单股正链RNA病毒,属于套式病毒目(Nidovirales),动脉炎病毒科(Arteriviridae),同属于本科的病毒还包括马动脉炎病毒(equine arteritis virus,EAV)、乳酸脱氢酶增高病毒(lactate dehydrogenase-elevating virus,LDV)和猴出血热病毒(simian hemorrhagic fever virus,SHFV)。PRRSV基因组大小约15 kb,包含至少12个开放阅读框,从5′端到3′端依次为5′UTR-ORF1a(ORF1a′-TF)-ORF1b-ORF2a-ORF2b-ORF3-ORF4-ORF5/ORF5a-ORF6-ORF7-3′UTR;在病毒自身编码的蛋白酶——Nsp1α、Nsp1β、Nsp2、Nsp4的剪切作用下,编码产生至少16个非结构蛋白和8个结构蛋白[3]。
目前,PRRSV分为两个基因型——genotype 1和genotype 2。Genotype 1也称为欧洲型(European type),代表性毒株为Lelystad Virus,genotype 2也称为美洲型(North American type),代表性毒株为ATCC VR2332。两种基因型的核苷酸相似性在55%~70%,氨基酸相似性在50%~80%[4]。PRRSV一个显著的特点是基因组具有很高的遗传多样性。M. Shi等在分析了8 500余条genotype 2ORF5序列的基础上,建立了全球genotype 2流行毒株的分类系统,将全球范围内流行的毒株分为至少9个谱系(lineage 1~9)和37个亚谱系(sublineage),为全球范围内genotype 2 PRRSV流行毒株的遗传多样性和分子进化研究提供了很好的参考体系[5];T. Stadejek等对欧洲PRRSV流行毒株的分子流行病学研究显示,genotype 1至少可以分为3个亚型——subtype 1~3,每个亚型又可分为若干个谱系,subtype 1又称为泛欧洲型(Pan-European types),在欧洲和全球其他地区流行,subtype 2和subtype 3属于东欧型(Eastern European types),主要局限于东欧各国和俄罗斯地区流行;欧洲型毒株的一个显著的特点是其N蛋白具有多态性,N蛋白编码的氨基酸在124~132 aa不等,一般来说,subtype 1、subtype 2和subtype 3对应的N蛋白编码长度分别为128 aa(偶见126/129/132 aa)、125 aa(偶见124/131 aa)、124 aa(偶见128 aa)[6]。N蛋白多态性的生物学意义还有待进一步的研究。
1 PRRSV在我国的发现
我国有关PRRS的描述最早见于1995年,随后郭宝清等(1996年)、杨汉春等(1997年)、姜平等(1997年)学者先后分离确定了引起本次疫病流行的病原——PRRSV,代表性的分离毒株分别为CH-1a、BJ-4和J1,均为美洲型毒株[7-9]。关于我国PRRSV的来源并不十分清楚,陈博文等(1996年)从加拿大进口的种猪中成功分离到了PRRSV——CDJ9512毒株,提示我国的早期引种操作中存在PRRSV输入性传播的可能[10],并且我国早期分离株BJ-4与美国早期流行毒株VR-2332的全基因组相似性为99.6%;关于欧洲型毒株的描述最早见于赵耘等(1999年)对B13毒株的相关研究,但对于B13的来源并没有明确的文献报道,仅显示B13毒株是由大连动植物检疫局保存馈赠[11]。总之,自1995年有明确报道以来,PRRSV在我国猪群中一直呈流行状态,并不断发生着广泛的变异。2006年,以JXA1毒株为代表的高致病性毒株的出现,是我国PRRSV遗传变异过程中一个标志性事件,高致病性毒株在致病性、遗传多样性方面均出现了很大的变化,虽然之后开发了相应的商品化疫苗,但一直未能改变我国PRRSV广泛流行和PRRS广泛发病的现状,且新的变异毒株也不断出现[12-15]。为更好地了解我国PRRSV的流行情况,基于已发表的相关文献及GenBank数据库中序列信息,我们选取了120株genotype 2和43株genotype 1的流行毒株及参考毒株,进行系统的分子流行病学分析,系统进化树的构建(neighbor-joining method)和序列比对(clustal W method)均使用MEGA 6.0进行处理;基因组序列的同源性分析使用DNAstar-MegAlign(clustal W method)软件进行分析处理。
2 美洲型PRRSV在我国的流行情况
基于genotype 2 PRRSV的全球流行毒株分类系统,参照已发表文献及GenBank数据库中的ORF5序列信息,我们选取了120株中国流行毒株及参考毒株序列,系统进化树分析显示(图1),我国的流行毒株总体分属于四个谱系:lineage 1、lineage 3、lineage 5(sublineage 5.1)、lineage 8(sublineage 8.7)。其中sublineage 8.7是我国流行毒株的优势谱系,代表性毒株为经典毒株CH-1a和高致病性毒株JXA1等;其次是lineage 1谱系,2013年以来呈现快速的扩散和流行,代表性毒株为HENAN-XINX、JL580等[16-17];Sublineage 5.1则是以经典毒株VR2332和BJ-4毒株为代表的谱系,虽然很早在我国就有流行,但是一直不是田间流行的优势毒株,其致病性也相对较弱;Lineage 3虽然也有流行,但是一直处于偶发的状态,且流行区域有限,未在猪群中广泛流行,代表性毒株有FJFS和QYYZ等[18-19]。
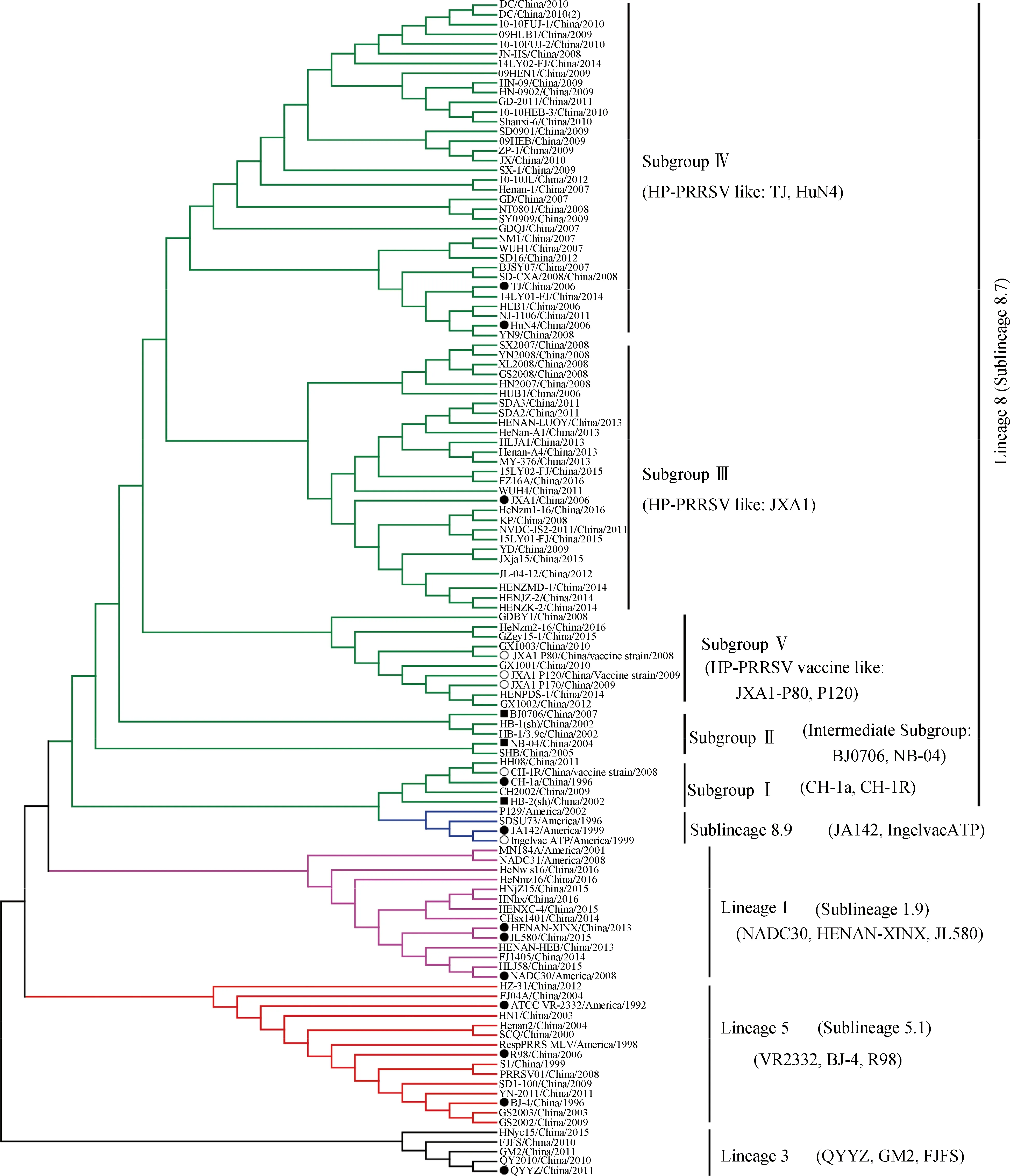
图1 美洲型参考毒株基于ORF5基因的进化树分析Fig.1 The phylogenetic assay of North American genotype 2 based on ORF5 gene sequence
2.1 Lineage 8在我国的流行
Sublineage 8.7是我国PRRSV的优势流行谱系,其代表性毒株CH-1a是我国最早分离的PRRSV毒株,全基因组序列同源性分析显示,CH-1a与美洲早期分离毒株JA142和SDSU73(均属于sublineage 8.9)相似性为94.5%,而与VR2332(sublineage 5.1)的相似性为91.5%。根据我国流行的sublineage 8.7谱系的ORF5基因序列的遗传进化分析,sublineage 8.7又可以分为五个亚群——subgroupⅠ~Ⅴ。SubgroupⅠ以早期分离毒株CH-1a为代表,是与我国最早分离毒株遗传关系最为接近的一个群体;SubgroupⅡ是我国PRRSV由经典毒株向高致病性毒株演化过程中的一个过渡群体,其代表性毒株BJ0706和NB-04与CH-1a和JXA1的全基因组核酸相似性分别为95.1%~95.8%和97.1%~98%,且非结构蛋白Nsp2上481位首次出现了1个氨基酸的缺失[20]。而subgroupⅢ~Ⅴ主要是高致病性毒株及疫苗衍生毒株。2006年,PRRS疫情首先从我国南方地区暴发,随后疫情迅速在全国范围内传播,田克恭(K. G. Tian)等确定了本次疫情是由PRRSV突变株——高致病性猪繁殖与呼吸综合征病毒(highly pathogenic PRRSV,HP-PRRSV)引起,基因组序列分析显示,HP-PRRSV具有独特的分子标志,其Nsp2蛋白存在不连续的30 aa(481 aa+533~561 aa)的缺失[12]。代表性毒株JXA1、TJ、HuN4与经典毒株CH-1a的全基因组相似性约为95.3%,而与BJ-4的全基因组相似性约为89.6%,目前比较一致的观点是HP-PRRSV是由我国CH-1a-like毒株在流行过程中不断变异而产生的[5]。HP-PRRSV自2006年在我国出现流行以来,其遗传多样性在不断增大,表现出不同的进化关系,subgroupⅢ主要是与JXA1遗传关系更近的亚群,称为JXA1-like亚群;SubgroupⅣ主要是和TJ、HuN4遗传关系更近的亚群;SubgroupⅤ则是与高致病毒株制备的弱毒疫苗(JXA1-P80)遗传关系更近的亚群,称为HP-PRRSV vaccine-like亚群[21],因为缺少TJM-F92和HuN4-F112疫苗毒株的序列信息,所以无法确定二者是否也存在类弱毒疫苗的亚群。根据目前PRRSV弱毒疫苗特点,疫苗的大量使用产生类疫苗的亚群是一个必然的结果。
2.2 Lineage 5和lineage 3在我国的流行
Sublineage 5.1在我国存在的时间也很长,但是临床检出率却并不高,特别是HP-PRRSV在我国流行以来,属于sublineage 5.1的PRRSV毒株流行率很低,代表性毒株BJ-4在1997年由杨汉春等分离得到。全基因组序列同源性分析显示,BJ-4与VR2322和RespPRRS MLV(Boehringer Ingelheim, Germany)的相似性分别为99.6%和99.8%,提示BJ-4极有可能是早期北美地区流行毒株的输入性感染或者疫苗衍生的毒株。Lineage 3在我国出现的时间相对较晚,最初认为是一个新的谱系(novel lineage),后来基于美洲型PRRSV全球分类系统,发现属于lineage 3[19-20],代表性毒株GM2和QYYZ与VR2332、CH-1a、BJ-4、JXA1的全基因组相似性在86.2%~88.7%,临床检出率很低,主要局限在福建、广东地区流行。
2.3 Lineage 1在我国的流行
Lineage 1是最近在我国猪群中新流行的一个谱系,2013以来,PRRS在我国猪群中呈现再度流行的趋势,一些稳定的猪场出现母猪的流产和保育猪严重的呼吸道疾病,现有的商品化疫苗免疫后基本无临床保护效果。周峰等首先描述了这一类毒株在河南省猪群中的存在,发现这一类毒株的Nsp2基因存在不连续的393个核苷酸(131 aa)的缺失[16];2014—2015年,这类毒株迅速在我国猪群中流行扩散开来,北京、天津、黑龙江、吉林、山西、安徽、湖南、浙江、福建等10余个地区省份均报道了本类毒株的流行[15, 22-23]。目前,NADC30-like毒株在河南地区的临床检出率在50%左右[24]。代表性毒株HENAN-XINX和JL580的全基因组序列与美国2001年分离株MN184A的相似性为86.7%~87.8%,与2008年分离株NADC30的相似性为92.8%~95.4%,与CH-1a、BJ-4、JXA1、QYYZ的相似性在82.2%~87.2%,同时与MN184A和NADC30一样,其非结构蛋白Nsp2均存在不连续的131 aa的标志性缺失。因此将这一类毒株统称为NADC30-like毒株或者类NADC30毒株,并明确了NADC30-like毒株的出现和流行是我国2013年以来PRRS再度流行的主要原因。目前比较一致的观点是NADC30-like毒株很有可能是通过种猪贸易从北美地区输入到我国的[17,23],并且在我国猪群中发生了较大的遗传变异,和我国流行毒株发生了广泛的基因重组,包括和经典毒株重组的毒株,如HNyc15、Chsx1401[15,25];和高致病性毒株重组的毒株,如JL580、FJ1402[17,26];和弱毒疫苗毒株重组毒株,如FJW05、TJnh1501[19,27]。不同毒株的临床致病性呈现较大的差异,整体上分为两大类——即与高致病性毒株相当的,如JL580毒株和FJ1402毒株[17,26];或者低于高致病性毒株,属于中等毒力的毒株,如HNjz15毒株和CHsx1401毒株[28-29];NADC30是一个中等毒力的毒株,为何在我国呈现如此大的毒力差异性,比较合理的解释是NADC30和我国流行毒株发生了广泛的基因重组,不同毒株的不同基因片段的插入,赋予了新毒株不同的生物学特性,比如致病力或者关键抗原的改变等。
3 欧洲型PRRSV在我国的流行情况
3.1 临床流行情况
因为临床检出率很低,有关欧洲型毒株的流行情况、遗传变异情况和致病力等方面的研究也相对较少。我国关于欧洲型毒株的最早描述见于1999年,赵耘等对B13毒株的ORF5基因进行了克隆和序列分析,但是对于B13的来源依然不清楚,文献中仅显示该毒株由大连动植物检疫局保存馈赠[13],从其与欧洲型代表毒株Lelystad virus的ORF5基因的相似性来看(99.7%,仅有两个核苷酸的不同),该毒株很可能是由早期进口的种猪中分离或者来自于相关国家作为标准毒株的馈赠。N. H. Chen等对我国欧洲型毒株流行情况的调查显示,最早可以从2006年保存的病料中检测到欧洲型毒株的存在[30],之后Z. Zhou等、J. K. Liu等研究者也相继报道了欧洲型毒株在其他地区的流行,目前主要存在于内蒙古、北京、福建、贵州和香港等地区,猪场阳性率在5%左右[31-32]。目前关于我国欧洲型流行毒株的研究主要还集中在分子流行病学层面,对于不同毒株的致病性、引起机体免疫应答的情况、疫苗的保护效果等,还缺少系统的深入研究。X. C. Wang等评估了GZ11-G1株对仔猪的致病性,发现其可以引起仔猪发热、高的病毒血症和肺部、淋巴结的损伤等[33]。
3.2 基于ORF5的遗传进化及多样性分析
基于ORF5序列的遗传进化分析显示,我国流行的欧洲型毒株均属于subtype 1,即泛欧洲型(Pan-European),目前尚未发现东欧型subtype 2和subtype 3。我国流行毒株根据其进化分支,又大致可以分为3个亚群:subgroupⅠ~Ⅲ(图2)。全基因组序列分析显示,我国流行毒株与Lelystad virus的相似性在85.9%~92.7%,我国本土流行的毒株序列相似性在82.7%~93.8%,不同毒株间的遗传差异很明显;需要注意的是,SHE株为实验室构建毒株,是从Amervac PRRS 疫苗毒株拯救的感染性克隆,而NVDC-FJ、NVDC-NM2、NVDC-NM3彼此间的相似性在99.6%以上,提示这三株可能是在同一猪场同一病例中分离得到的。ORF5序列分析显示,我国流行毒株核酸序列相似性为81.7%~98%,我国流行毒株与Lelystade virusORF5的核酸序列相似性为83.5%~99.7%。与Lelystade virus序列相比,第8、56、60、63、106位氨基酸属于高变异的氨基酸位点,每个位点都有3~7种氨基酸的突变存在,且主要分布在信号肽区和高突变区;而37位(N/DLV)、100位(V/TLV)、101位(T/ALV)、112位(S/CLV)、123位(L/FLV)、155位(I/VLV)、173位(G/DLV)、175位(D/NLV)则发生了非常保守的突变,是中国流行毒株较为特异的突变位点(图3)。

图2 欧洲型参考毒株基于ORF5基因的进化树分析Fig.2 The phylogenetic assay of European genotype 1 based on ORF5 gene sequence

1—32 aa为信号肽序列,33—67和89—110 aa为高变区。190—202 aa为ES13序列。高变区框线区域为潜在的N-糖基化位点。“●”代表高度变异的氨基酸位点,“*”代表中国流行株保守的突变位点The signal sequence (1-32 aa) and hypervariable domains (33-67 aa, 89-110 aa) were indicated (solid boxes); Potential N-glycosylation sites were shown in the boxes at hypervariable domains; “●” means the hypervariable mutation sites; “*” represents the conserved mutation sites in Chinese genotype 1 PRRSV图3 Genotype 1 ORF5蛋白氨基酸序列比对结果Fig.3 The alligment result of ORF5 amino acid sequence of genotype 1
3.3 N蛋白的多态性分析
如图4所示,N蛋白一般认为是一个高度保守的蛋白,其N端(1~57 aa)主要与RNA的结合有关,其C端主要与核衣壳的形成相关。Genotype 1和genotype 2的N蛋白长度分别为128和123 aa,随后的研究显示,genotype 1的N蛋白在长度上具有较大的差异性,其氨基酸长度在124~132 aa[6]。N蛋白序列分析显示,我国流行毒株的N蛋白氨基酸相似性86%~99.2%,N蛋白长度为128 aa,除了NVDC-NM2毒株外,其N蛋白长度为129 aa,在87位氨基酸之后插入了一个丝氨酸,这与subtype 1的N蛋白长度一致。与Lelystade virus毒株相比,我国流行毒株的第13(N/SLV)、100(G/SLV)、128(N/SLV)位氨基酸发生了较为保守的突变,N蛋白的序列和长度多态性的生物学意义有待进一步的研究。
4 小结与展望
本文从分子流行病学的角度分析了我国PRRSV的流行历史及现状。我国同时存在genotype 1和genotype 2两种基因型的流行,genotype 2是田间主要流行的基因型。我国PRRSV流行之初,毒株就呈现较大的遗传差异性,如CH-1a属于sublineage 8.7,而BJ-4则属于sublineage 5.1,且BJ-4与北美流行毒株VR2332的全基因组序列相似性为99.6%,提示BJ-4可能是来自北美的输入性毒株。目前我国美洲型田间流行毒株分属于4个谱系,lineage 1、lineage 3、lineage 5和lineage 8,其中lineage 1(NADC30-like)和lineage 8(HP-PRRSV)是当前田间主要的流行毒株,现有疫苗针对NADC30-like毒株的临床保护效果很差,仅能提供有限的或者部分保护,虽然可以降低病毒血症和缩短排毒时间,但是从临床表现来看免疫组和未免疫组没有显著的差异[28,34]。我国已有9个以上的省市报道了欧洲型毒株的流行,目前分离株均属于subtype 1,通过对GP5蛋白和N蛋白的序列分析,发现了我国流行毒株特有的氨基酸突变位点,考虑到目前我国还没有针对欧洲型毒株的疫苗,因此需要格外关注欧洲型毒株的流行,做好临床监测工作。
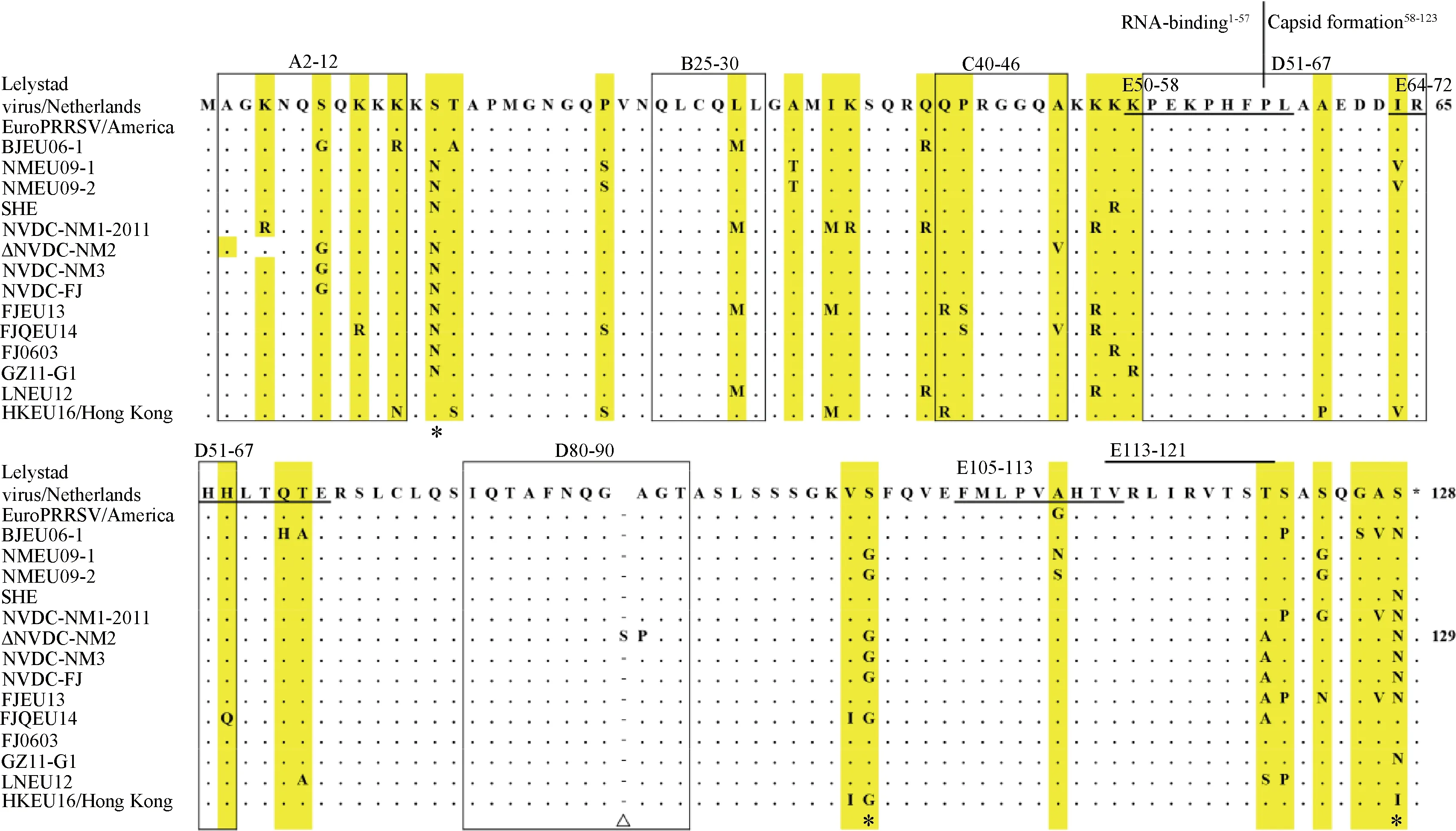
A2—12、B25—30、C40—46、D51—67、D80—90为N蛋白上的抗原表位;E50—58、E64—72、E105—113、E113—121表示N蛋白上4个T细胞抗原表位;“Δ”表示插入氨基酸的位置;“*”表示中国流行株N蛋白保守的突变位点A2-12, B25-30, C40-46, D51-67 and D80-90 represent known epitopes in N protein; E50-58, E64-72,E105-113 and E113-121 indicate four porcine T-cell epitopes; “Δ” means the insertion site of amino acid; “*”represents the conserved mutation sites in Chinese genotype 1 PRRSV图4 Genotype 1 N蛋白氨基酸序列比对结果Fig.4 The alligment result of N protein amino acid sequence of genotype 1
从美国1987年首次报道PRRS以来,PRRSV在世界范围内的流行已接近30年,最初我们将其称为神秘猪病(mystery swine disease,MSD),30年来,虽然我们对PRRSV的临床发病特点、分子流行病学、复制增殖的过程、致病机制、诱导机体产生免疫应答的机制和免疫逃逸机制有了很深的认识,也开发出了一系列的疫苗,但离我们最终控制该病还相距甚远,临床发病率也没有明显的改善,可以说PRRSV对我们来说依然是“神秘的”。我们依然有许多问题要进一步探究,如:1)PRRSV基因组发生高突变和高重组事件的分子机制是什么?2)PRRSV广谱性的中和抗原和中和抗原表位有待进一步的解析。3)决定不同毒株毒力差异的分子机制有待进一步阐明。4)寻求新的疫苗开发策略,能否获得安全、高效、对不同毒株具有广谱保护性的疫苗等。这些问题的进一步阐明将为PRRSV的最终控制提供极大的帮助和支撑。
[1] WHITWORTH K M, ROWLAND R R, EWEN C L, et al. Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus[J].NatBiotechnol, 2016, 34(1): 20-22.
[2] COLLINS J E, BENFIELD D A, CHRISTIANSON W T, et al. Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2332) in North America and experimental reproduction of the disease in gnotobiotic pigs[J].JVetDiagnInvest, 1992, 4(2): 117-126.
[3] LUNNEY J K, FANG Y, LADINIG A, et al. Porcine reproductive and respiratory syndrome virus (PRRSV): pathogenesis and interaction with the immune system[J].AnnuRevAnimBiosci, 2016, 4: 129-154.
[5] SHI M, LAM T T Y, HON C C, et al. Phylogeny-based evolutionary, demographical, and geographical dissection of North American type 2 porcine reproductive and respiratory syndrome viruses[J].JVirol, 2010, 84(17): 8700-8711.
[6] STADEJEK T, STANKEVICIUS A, MURTAUGH M P, et al. Molecular evolution of PRRSV in Europe: current state of play[J].VetMicrobiol, 2013, 165(1-2): 21-28.
[7] 郭宝清, 陈章水, 刘文兴, 等. 从疑似PRRS流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病, 1996(2): 1-5.
GUO B Q, CHEN Z S, LIU W X, et al. Isolation and identification of porcine reproductory and respiratory syndrome (PRRS) virus from aborted fetuses suspected of PRRS[J].ChineseJournalAnimalPoultryInfectionsDiseases, 1996(2): 1-5. (in Chinese)
[8] 姜 平, 简中友, 马志永, 等. 猪繁殖和呼吸综合征病毒分离与鉴定[J]. 南京农业大学学报, 1997, 20(3): 82-86.
JIANG P, JIAN Z Y, MA Z Y, et al. Isolation and identification of porcine reproductive and respiratory syndrome (PRRS) virus in China[J].JournalofNanjingAgriculturalUniversity, 1997, 20(3): 82-86. (in Chinese)
[9] 杨汉春, 管山红, 尹晓敏, 等. 猪繁殖与呼吸综合征病毒的分离与初步鉴定[J]. 中国兽医杂志, 1997, 23(10): 9-10.
YANG H C, GUAN S H, YIN X M, et al. Isolation and identification of porcine reproductive and respiratory syndrome[J].ChineseJournalofVeterinaryMedicine, 1997, 23(10): 9-10. (in Chinese)
[10] 陈博文, 孙颖杰, 罗长保, 等. 猪繁殖和呼吸系统综合征的血清学检测及病毒的分离和鉴定(初报)[J]. 中国兽医杂志, 1996, 22(5): 6-8.
CHEN B W, SUN Y J, LUO C B, et al. Isolation and identification of porcine reproductive and respiratory syndrome (PRRS) virus: a preliminary report[J].ChineseJournalofVeterinaryMedicine, 1996, 22(5): 6-8. (in Chinese)
[11] 赵 耘, 罗长宝, 林志雄, 等. 猪生殖和呼吸综合征病毒中国分离株B13株ORF5基因在杆状病毒系统中的表达[J]. 农业生物技术学报, 2000, 8(3): 211-215.
ZHAO Y, LUO C B, LIN Z X, et al. Expression of ORF5gene of porcine reproductive and respiratory syndrome virus B13strain in a baculovirus expression system[J].JournalofAgriculturalBiotechnology, 2000, 8(3): 211-215. (in Chinese)
[12] TIAN K G, YU X L, ZHAO T Z, et al. Emergence of fatal PRRSV variants: unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoSOne, 2007, 2(6): e526.
[13] ZHOU L, YANG X R, TIAN Y, et al. Genetic diversity analysis of genotype 2 porcine reproductive and respiratory syndrome viruses emerging in recent years in China[J].BiomedResInt, 2014, 2014: 748068.
[14] ZHOU L, YANG H C. Porcine reproductive and respiratory syndrome in China[J].VirusRes, 2010, 154(1-2): 31-37.
[15] LI X D, BAO H Y, WANG Y, et al. Widespread of NADC30-like PRRSV in China: another Pandora’s box for Chinese pig industry as the outbreak of highly pathogenic PRRSV in 2006?[J].InfectGenetEvol, 2017, 49: 12-13.
[16] 周 峰, 常洪涛, 赵 军, 等, 2012―2013年猪繁殖与呼吸综合征病毒河南流行株的分离鉴定及分子流行病学调查[J]. 中国兽医学报, 2014, 34(9): 1398-1404, 1410.
ZHOU F, CHANG H T, ZHAO J, et al. Identification and molecular epidemiology of porcine reproductive and respiratory syndrome virus prevailing in Henan province from 2012 to 2013[J].ChineseJournalofVeterinaryScience, 2014, 34(9): 1398-1404, 1410. (in Chinese)
[17] ZHAO K, YE C, CHANG X B, et al. Importation and recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].JVirol, 2015, 89(20): 10712-10716.
[18] LU W H, WEI Z Y, ZHANG G Q, et al. Complete genome sequence of a novel variant porcine reproductive and respiratory syndrome virus (PRRSV) strain: evidence for recombination between vaccine and wild-type PRRSV strains[J].JVirol, 2012, 86(17): 9543.
[19] LIU J K, ZHOU X, ZHAI J Q, et al. Genetic diversity and evolutionary characteristics of type 2 porcine reproductive and respiratory syndrome virus in southeastern China from 2009 to 2014[J].ArchVirol, 2017, 162(9): 2603-2615.
[20] HAN J, ZHOU L, GE X N, et al. Pathogenesis and control of the Chinese highly pathogenic porcine reproductive and respiratory syndrome virus[J].VetMicrobiol, 2017, 209: 30-47.
[21] JIANG Y F, XIA T Q, ZHOU Y J, et al. Characterization of three porcine reproductive and respiratory syndrome virus isolates from a single swine farm bearing strong homology to a vaccine strain[J].VetMicrobiol, 2015, 179(3-4): 242-249.
[22] ZHANG Q Y, XU X J, YOU S M, et al. Emerging of two new subgenotypes of porcine reproductive and respiratory syndrome viruses in Southeast China[J].MicrobPathog, 2016, 97: 27-33.
[23] ZHOU L, WANG Z C, DING Y P, et al. NADC30-like strain of porcine reproductive and respiratory syndrome virus, China[J].EmergInfectDis, 2015, 21(12): 2256-2257.
[24] WANG L J, XIE W T, CHEN X X, et al. Molecular epidemiology of porcine reproductive and respiratory syndrome virus in Central China since 2014: the prevalence of NADC30-like PRRSVs[J].MicrobPathog, 2017, 109: 20-28.
[25] LI Y Y, JI G B, WANG J, et al. Complete genome sequence of an NADC30-like porcine reproductive and respiratory syndrome virus characterized by recombination with other strains[J].GenomeAnnounc, 2016, 4(3): e00330-16.
[26] ZHANG Q Y, JIANG P, SONG Z B, et al. Pathogenicity and antigenicity of a novel NADC30-like strain of porcine reproductive and respiratory syndrome virus emerged in China[J].VetMicrobiol, 2016, 197: 93-101.
[27] BIAN T, SUN Y F, HAO M, et al. A recombinant type 2 porcine reproductive and respiratory syndrome virus between NADC30-like and a MLV-like: Genetic characterization and pathogenicity for piglets[J].InfectGenetEvol, 2017, 54: 279-286.
[28] ZHOU L, YANG B N, XU L, et al. Efficacy evaluation of three modified-live virus vaccines against a strain of porcine reproductive and respiratory syndrome virus NADC30-like[J].VetMicrobiol, 2017, 207: 108-116.
[29] SUN Z, WANG J, BAI X F, et al. Pathogenicity comparison between highly pathogenic and NADC30-like porcine reproductive and respiratory syndrome virus[J].ArchVirol, 2016, 161(8): 2257-2261.
[30] CHEN N H, CAO Z, YU X L, et al. Emergence of novel European genotype porcine reproductive and respiratory syndrome virus in mainland China[J].JGenVirol, 2011, 92(4): 880-892.
[31] ZHOU Z, LIU Q, HU D M, et al. Complete genomic characterization and genetic diversity of four European genotype porcine reproductive and respiratory syndrome virus isolates from China in 2011[J].VirusGenes, 2015, 51(3): 375-384.
[32] LIU J K, WEI C H, DAI A L, et al. Complete genomic characterization of two European-genotype porcine reproductive and respiratory syndrome virus isolates in Fujian province of China[J].ArchVirol, 2017, 162(3): 823-833.
[33] WANG X C, YANG X R, ZHOU R, et al. Genomic characterization and pathogenicity of a strain of type 1 porcine reproductive and respiratory syndrome virus[J].VirusRes, 2016, 225: 40-49.
[34] BAI X F, WANG Y Z, XU X, et al. Commercial vaccines provide limited protection to NADC30-like PRRSV infection[J].Vaccine, 2016, 34(46): 5540-5545.

