中华鳖源粘质沙雷氏菌分离、鉴定及药敏特性研究
杨移斌,艾晓辉,曹海鹏,杨先乐,姚嘉赟,沈锦玉
(1.中国水产科学研究院长江水产研究所,武汉 430223; 2.农业部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室, 浙江省淡水水产研究所,浙江湖州 313001;3.上海海洋大学,上海 201306)
中华鳖(Trionyxsinensis)又名甲鱼、水鱼、团鱼等,其分类地位为龟鳖目(Testudines)鳖科(Trionychidae),鳖属(Trionyx)。中华鳖野生种群在国内广泛分布,同时也是国内重要淡水养殖品种,深受广大消费者喜爱。由于市场需求不断增大,国内养殖范围不断扩大,中华鳖养殖业在国内快速发展。但也因其养殖规模及集约化程度不断提高,中华鳖养殖环境急剧恶化,病害频发,尤其是细菌性病害常引起较大经济损失。目前已经报道的中华鳖细菌性病原主要有嗜水气单胞菌(Aeromonashydrophila)[1]、温和气单胞菌(A.sobria)[2]、豚鼠气单胞菌(A.caviae)[3]、迟缓爱德华菌(Edwardsiellatarda)[4]、弗氏柠檬酸杆菌(Citrobacterfreundii)[5]、格氏乳球菌(Lactococcusgarvieae)[6]、摩氏摩根菌(Morganellamorganii)[7]、肺炎克雷伯氏菌(Klebsiellapneumoniae)[8]及蜡样芽孢杆菌(Bacilluscereus)[9]。
2015年7-8月,湖北荆门某规模化养殖场中华鳖暴发大规模死亡。中华鳖发病死亡率高,但发病周期较长,引起了较大经济损失。经临床诊断及取样,本研究在发病濒死中华鳖体内分离到1株优势菌,进行了人工感染及鉴定实验,确定了分离菌株的种类,并对其药物敏感特性进行了测定,以期为该病的有效防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验鱼
具备典型症状的患病中华鳖10只取自湖北荆门中华鳖养殖场;感染用中华鳖(50±1.5) g购于湖北荆门中华鳖原种场,所购中华鳖体格健壮,无伤病,活力强,暂养于实验室玻璃缸中7 d后无异常用于试验。
1.1.2 试验试剂
MH琼脂、脑心浸出液培养基、营养琼脂、营养肉汤、革兰氏染色液、药敏纸片及细菌微量生化管均购自杭州微生物试剂有限公司;PCR反应体系、细菌基因组DNA提取试剂盒均购自天根生化;测序服务及引物合成均由武汉擎科提供。
1.2 方法
1.2.1 临床诊断
对中华鳖养殖场环境进行调查,统计中华鳖发病死亡率,确定病害主要危害对象规格;对发病死亡中华鳖进行临床诊断,确定典型病症,并通过光学显微镜镜检确定有无寄生虫感染等,取具典型症状濒死中华鳖回实验室进一步分析。
1.2.2 病原菌分离
在无菌条件下,取患病中华鳖的肝脏、肾脏、脾脏及腹水划线于BHI平板上,置于28 ℃恒温培养箱中24 h,挑取形态、大小及颜色基本一致的菌落进行细菌再纯化,获得的细菌纯培养物加入25%的甘油混匀后置于-80 ℃保存。分离菌株暂命名为HD01。
1.2.3 人工感染及LD50测定
人工感染 将分离菌株HD01划线于脑心浸出液琼脂培养基上,置于28 ℃恒温培养箱中24 h,用无菌生理盐水洗下菌苔,并参照麦氏比浊法调整菌悬液浓度为2.6×108CFU/mL。
将感染用中华鳖分为试验组和对照组,每组均设置3个重复,每个重复30只中华鳖。连续充氧,水温控制在26~29 ℃。实验组中华鳖腹腔注射分离菌株菌液0.1 mL/尾,对照组相同部位注射等量无菌生理盐水。每8 h观察中华鳖活动状况,及时记录发病死亡中华鳖数量,并对死亡中华鳖进行解剖观察,进行细菌再分离。
细菌LD50测定 将HD01株菌液稀释成浓度为9.0×1010、9.0×109、9.0×108、9.0×107、9.0×106CFU/mL的菌悬液,分别注射到不同组中华鳖体内,每只中华鳖注射0.1 mL,相当于不同组每尾注射分离菌株HD01的剂量9.0×109、9.0×108、9.0×107、9.0×106、9.0×105CFU,进行攻毒实验,对照组中华鳖相同部位注射等量无菌生理盐水,每组中华鳖各30只。持续观察试验中华鳖的活动情况,及时记录发病死亡数量,并用概率单位图解法[10]计算半致死剂量(LD50)。
1.2.4 形态学及生理生化特性测定
将分离菌株在营养琼脂平板上划线,分别置于28 ℃及37 ℃恒温培养24 h后,观察菌落大小、形态特征及其颜色,并进行革兰氏染色,采用细菌微量生化鉴定管参照《常见细菌系统鉴定手册》[11]测定分离菌株生理生化指标。
1.2.5 16 S rRNA基因序列测定及系统发育分析
将菌株HD01接种于脑心浸出液培养基中,置于28 ℃震荡培养24 h,高速离心后收集菌体,提取DNA作为PCR扩增反应模板。细菌16S rRNA序列扩增引物为27F:5′-AGAGTTTGATC(C/A)TGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′。参照董婷等[12]方法进行PCR反应扩增目的基因。扩增产物确定为目的片段后送武汉擎科生物公司纯化及序列测定。
将测序结果放到美国国家生物技术信息中心基因库中进行比对,根据比对结果下载同源性较高的序列采用Clustal X软件进行多序列匹配分析,通过MEGA5.1软件Neighbor-Joining法构建系统进化树,1 000次Bootstrap检验置信度。
1.2.6 药敏特性分析
分离菌株药敏特性分析参照NCCLS抗微生物药物敏感性实验执行标准采用K-B法进行[13]。将分离菌株HD01接种于BHI液体培养基中,经28 ℃震荡培养24 h,用无菌生理盐水制成浓度为107CFU/mL的菌悬液,取200 μL菌液均匀涂于MH琼脂平板上,贴上不同种类的药敏纸片,置于28 ℃培养24 h后测量不同药敏纸片的抑菌圈直径。
2 结果
2.1 临床诊断
发病养殖场规模较大,养殖面积达67 hm2,其中发病约占30%。池塘养殖的中华鳖发病率约20%,死亡率却高达90%,从发病到死亡约1个月,周期较长,发病规格为400~600 g,引起较大经济损失。经对养殖环境调查发现,其养殖用水氨氮在0.2~0.5 mg/L,亚硝酸盐在0.02~0.06 mg/L,pH7.2,溶氧6.5~8.2 mg/L,水温25~29 ℃;经镜检未发现寄生虫,其典型症状主要为摇头晃脑,离水上岸不久即死亡,解剖后腹腔有大量腹水,重要组织器官如肾脏等有充血,肝肾脾肿大,肝脏鲜红色,脾脏发紫,肾脏发黑,肠道无明显病变,但无食物。
2.2 细菌分离
从患病中华鳖肝、肾、脾及腹水中分离到一株优势菌HD01。经人工回归感染实验,注射浓度为2.6×108CFU/mL HDO1的实验组中华鳖死亡26.67%,而对照组未出现异常。感染发病死亡中华鳖与自然发病的中华鳖病症基本一致,经细菌再分离实验获得了与菌株HD01形态及理化特征一致的菌株,表明分离菌株HD01是本养殖场中华鳖的病原菌。根据表1建立实验鱼死亡率(%)与细菌剂量对数[lg(CFU)]的关系曲线:y=0.25x-1.587 5(图1),分离菌株HD01对中华鳖半数致死剂量LD50=2.24×108CFU/尾,即4.48×106CFU/g。

表1 分离株对中华鳖LD50试验结果Tab.1 Results of LD50 of isolation strain in T.sinensis
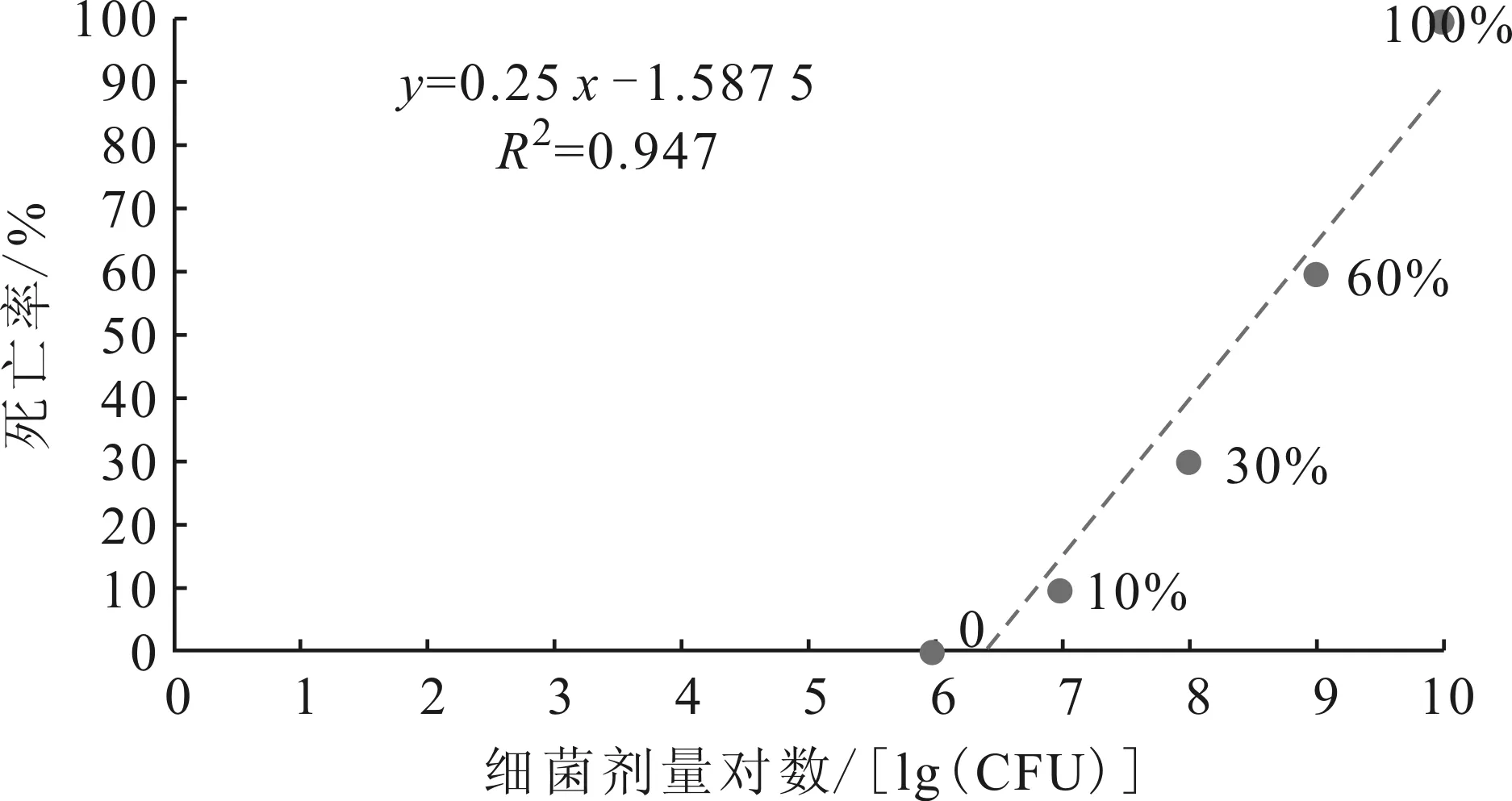
图1 中华鳖死亡率(%)与细菌剂量对数 [lg (CFU)]的关系曲线Fig.1 The relation curve of T.sinensis mortality with logarithm of bacteria dose
2.3 细菌鉴定
经培养发现,分离菌株HD01在28 ℃条件下,在营养琼脂培养基上呈现鲜红色,而在37 ℃条件下呈现无色,而其形态大小均无明显不同。分离菌株HD01为革兰氏阴性菌,具体生理生化指标见表2,生理生化指标初步确定菌株HD01为粘质沙雷氏菌。将分离菌株HD01的16S rRNA基因序列与基因库中已有序列进行比对,结果显示HD01株与沙雷菌属种类同源性最高,选取同源性高的沙雷菌属序列及水产常见病原菌的16S RNA系列,构建系统发育树(图2),结果显示分离菌株HD01与粘质沙雷氏菌(Serratiamarcescens)聚为一支,同源性最高,为99%。因此综合生理生化特性判定HD01株为粘质沙雷氏菌。
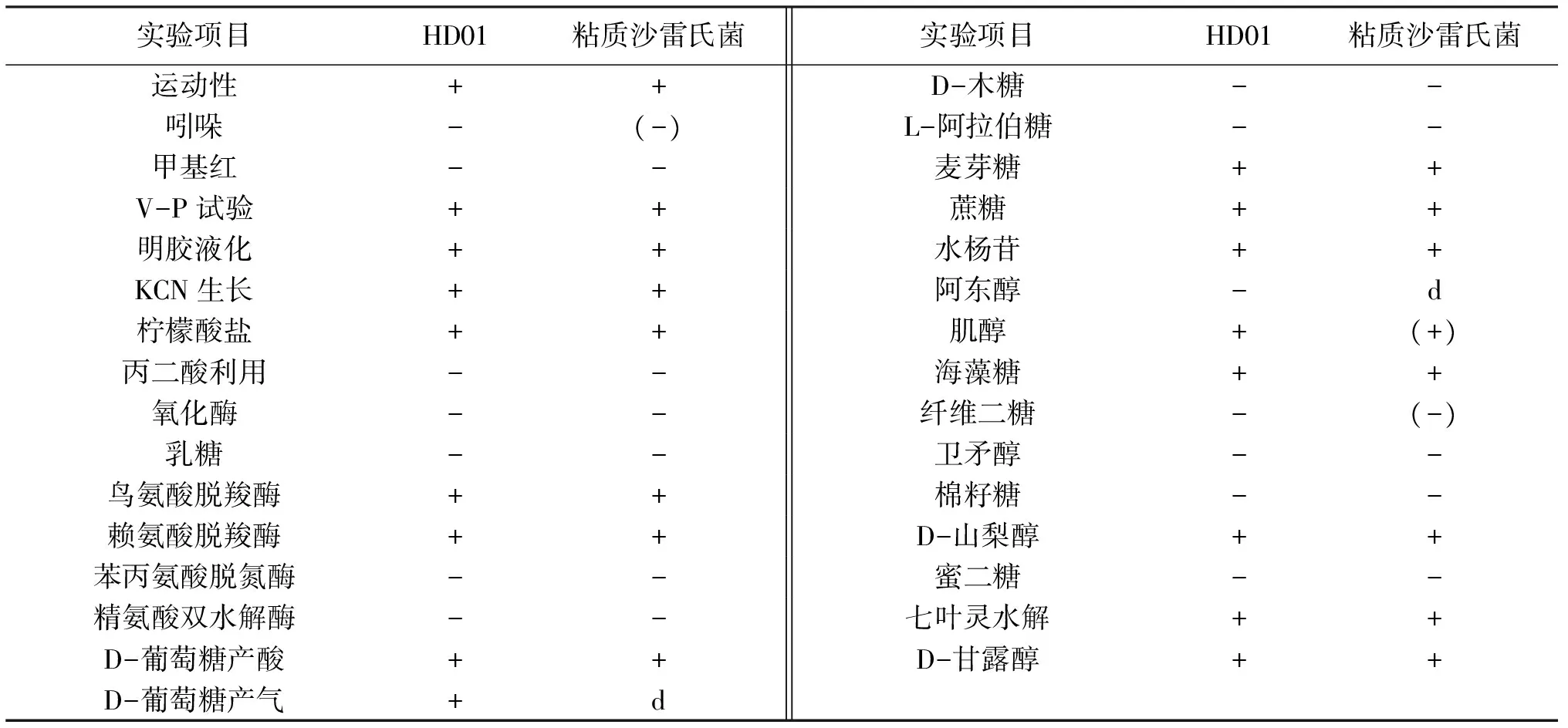
表2 菌株HD01的生理生化试验结果Tab.2 Results of biochemical characteristics of strain HD01
注:“+”:阳性;“-”:阴性;“(+)”:阳性反应超过24 h,“(-)”:阴性反应超过24 h;“d”:11%~89%菌株为阳性。
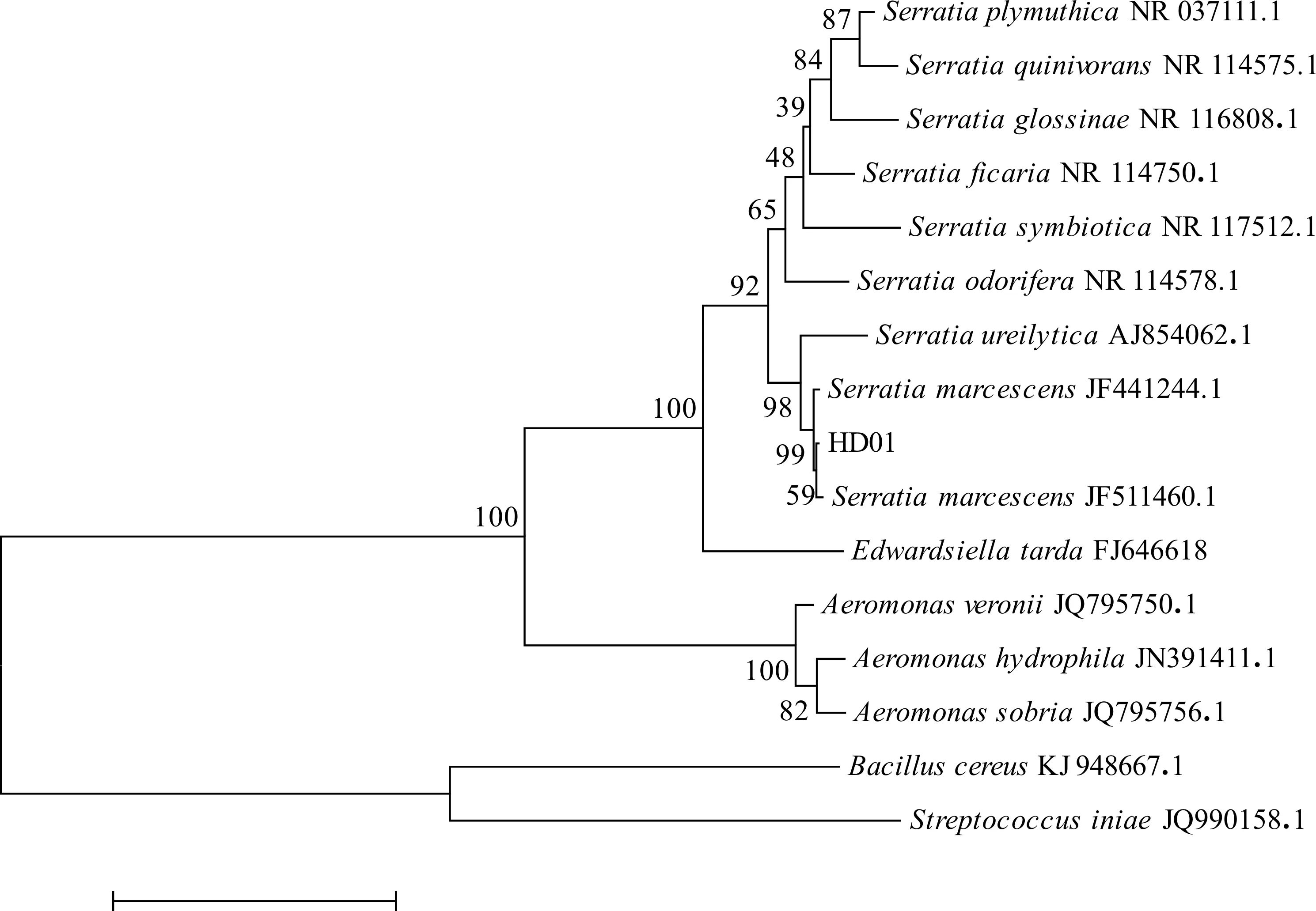
图2 HD01株 16S rRNA 基因序列与相关菌株的系统发育树Fig.2 Phylogenetic tree of HD01 16S rRNA gene sequence and its relatives
2.4 药敏特性
药敏实验结果(表3)显示分离菌株HD01对氟苯尼考、多西环素、庆大霉素、苯唑西林、磺胺异恶唑及氯霉素等14种抗生素高度敏感;对阿莫西林中度敏感;对青霉素、头孢拉定及痢特灵等7种抗生素耐药。
3 讨论
3.1 粘质沙雷氏菌的鉴定
粘质沙雷氏菌隶属于变形菌门(Proteobacteria)肠杆菌目(Saccharomycetales)肠杆菌科(Enterobacteriaceae)沙雷氏菌属(Serratia),是革兰氏阴性杆菌[14]。本研究通过革兰氏染色,形态学观察及微量生化鉴定管测定分离菌株HD01,结果显示HD01为革兰氏阴性杆菌,生化特征与粘质沙雷氏菌一致,并且在28 ℃培养产生红色色素,而在37 ℃培养则不产生[15],亦符合粘质沙雷氏菌的基本特性。
注:S:高度敏感; I:中度敏感;R:耐药。
细菌的16S rRNA 基因片段保守性很高,其片段长度约1 500 bp,但也存在相对变异区,即在不同科属种间存在一定的变异[16],通过测定菌株16S rRNA能快速、准确、高效区分不同菌株,目前16S rRNA基因序列分析成为微生物鉴定的良好工具[17]。通过对分离菌株HD01的16S rRNA序列进行测序,在NCBI中进行比对后,并构建系统发育树,分离菌株与粘质沙雷氏菌聚为一支,同源性达99%。因此综合形态学、生理生化特性测定及16S rRNA系列分析,判定分离菌株HD01为粘质沙雷氏菌,鉴定结果科学、准确、高效。
3.2 粘质沙雷氏菌的危害
粘质沙雷氏菌在自然环境广泛存在,是水和土壤中的正常种群[18],但大量研究证实,其也是临床上的条件致病菌。目前已经报道粘质沙雷氏菌对多种昆虫具备一定的致病性,如对棉铃虫、菜青虫、蝗虫、黄曲条跳甲幼虫和成虫、甜菜夜蛾等[18],另外粘质沙雷氏菌还能引起家蚕的大规模死亡[14];在人体免疫机能下降时,粘质沙雷氏菌会引起肺炎、关节炎、尿道感染、水型肠胃炎,甚至暴发败血症等严重疾病[19-21]。而关于粘质沙雷氏菌对水生动物致病报道相对较少,仅Cao等[22]报道了其引起西伯利亚鲟出现红嘴病,导致西伯利亚鲟出现死亡。而本研究中中华鳖感染粘质沙雷氏菌导致摇头晃脑及重要器官严重充血,与西伯利亚鲟发病症状有类似处。经回归感染,试验组中华鳖出现与自然发病相同症状,粘质沙雷氏菌对中华鳖半致死剂量LD50=4.48×106CFU/g,表明粘质沙雷氏菌是中华鳖的病原菌。
3.3 中华鳖粘质沙雷氏菌病的药物防治
本研究测定了分离菌株HD01对22种抗生素的敏感性,实验结果显示,菌株HD01对氟苯尼考、多西环素、庆大霉素、苯唑西林、磺胺异恶唑及氯霉素等14种抗生素高度敏感;对阿莫西林中度敏感;对青霉素、头孢拉定及痢特灵等7种抗生素耐药。药敏实验结果与Cao等[22]研究有差异,可能是因为菌株来源、地理环境及用药情况等不同造成的。经挑选高度敏感药物氟苯尼考,参考水产用商品药说明书使用,配合黄芪多糖伴饵投喂3 d后停止死亡,一个疗程7 d后中华鳖恢复正常,不再出现异常活动个体,取得了很好的治疗效果。
虽然目前在水生动物病害治疗时,药物主要是抗生素治疗仍然是首选有效手段之一,但细菌病害频发,药物滥用不仅导致病害防控失败,也易引起环境问题,故研制高效预防技术如免疫防治等势在必行。
[1] 郑杰夫,张一柳,钟 蕾.中华鳖源嗜水气单胞菌的研究进展[J].水产科学,2016,35(2):191-198.
[2]马有智,舒妙安.中华鳖温和气单胞菌病的病原研究[J].浙江大学学报(理学版),2000,27(3):329-333.
[3]余旭平,马有智.甲鱼病原性豚鼠气单胞菌的分离鉴定[J].中国兽医学报,1997,(5):460-462.
[4]潘晓艺,郝贵杰,姚嘉赟,等.中华鳖爱德华菌病病原菌的分离鉴定及致病因子研究[J].淡水渔业,2010,40(6):40-45.
[5]林启存,朱丽敏,李忠全,等.中华鳖弗氏柠檬酸杆菌败血症病原分离鉴定与药敏试验[J].水产科学,2008,27(1):42-43.
[6]胡广洲,李登峰,苏秀榕,等.患暴发性败血症中华鳖体内细菌的分离与鉴定[J].中国水产科学,2010,17(4):859-868.
[7]孔 蕾,朱凝瑜,贝亦江,等.中华鳖(Pelodiscussinensis)摩氏摩根菌(Morganellamorganii)的鉴定及致病性研究[J].海洋与湖沼,2013,44(3):722-727.
[8]徐海圣,舒妙安.中华鳖肺炎克雷伯氏菌病的病原研究[J].浙江大学学报(理学版),2002,29(6):702-706.
[9]谭爱萍,赵 飞,姜 兰,等.中华鳖致病性蜡样芽孢杆菌的分离鉴定与特性分析[J].广东农业科学,2011,38(20):115-119
[10]徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,2002.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12]董 婷,景 波,李 伟,等.产玫瑰红色素粘质沙雷氏菌的分离鉴定及抑菌活性[J].浙江农业学报,2016,28(2):252-258.
[13]Wikler M A.Performance standards for antimicrobial susceptibility testing [M].19th ed.Clinical Laboratory Standards Institute,2009.
[14]李精华.家蚕病原粘质沙雷氏菌无色素突变株的鉴定及致病性的研究[D].重庆:西南大学,2015.
[15]徐 虹,徐美娟,杨套伟,等.温度对粘质沙雷氏菌合成灵菌红素的影响[J].微生物学报,2014,54(5):517-524.
[16]Kim M S,Jeong H D.Development of 16S rRNA targeted PCR methods for the detection and differentiation ofVibriovulnificusin marine environments[J].Aquacuhure,2001,193(3-4):199-211.
[17]Jonas D,Rosenbaumr A,Weyrich S,et al.Enzyme-linked immunoassay for detection of PCR-amplified DNA of legionellae in bronchoalveolar fluid[J].J Clinic Microbiol,1995,33(5):1247-1252.
[18]黄 敏,吴毅歆,何鹏飞.人和动物条件致病菌环境菌株侵染植物的研究进展[J].微生物学报,2016,56(2):188-197
[19]江 艳,李 珂,何 萍.粘质沙雷菌医院感染现状及耐药性分析[J].热带医学杂志,2014,14(12):1610-1612.
[20]Turgut N,Akgul T,Arzu U,et al.A rare pathogen for subacute osteomyelitis in adolescent:Serratiamarcescens[J].Int J Surg Case Rep,2015,8(6):171-174.
[21]Leng P,Huang W L,He T,et al.Outbreak ofSerratiamarcescenspostoperative infection traced to barbers and razors[J].J Hosp Inf,2015,89(1):46-50.
[22]Cao H P,Yang Y B,He S,et al.Control by herbal extract ofSerratiamarcescensfrom cultured siberian sturgeonAcipenserbaeriibrandt[J].The Isr J Aquacult Bamidgeh,2014,66:1-11.

