欧洲乔木花楸组织培养快速繁殖体系建立研究
朱 虹
(辽宁省干旱地区造林研究所,朝阳 122000)
欧洲乔木花楸(Sorbus aucuparia)属蔷薇科花楸属落叶乔木,原产欧洲和亚洲西部。喜光稍耐荫、喜凉爽湿润的气候。适应于多种土壤类型,喜湿润且排水较好的酸性或微酸性土壤。树干端直,树形魁梧,枝条伸展性好,冠幅呈卵圆形,树形美观。夏季叶色翠绿,秋季叶色为橙红。花白色,果实橙色或红色,扁球形,冬季宿存具四季皆宜的观赏效果,可作庭院、公园、广场、小区绿化,在欧洲已被广泛应用于园林绿化中。其果实中含有糖、维生素、黄酮、花青素等物质,具有强抗氧化、抗癌、抗辐射、止咳平喘等药用功效,具有极佳的市场前景。[1-3]
欧洲乔木花楸繁殖方法单一,繁殖速度慢,实生育苗种苗变异大,嫩枝扦插育苗成活率不到20%,且国内目前还没有形成较大规模的繁育基地。利用组织培养技术繁殖欧洲乔木花楸可在短时间内获得大量优质种苗,本试验结合欧洲乔木花楸生物学特性,利用组织培养技术,完善了欧洲乔木花楸组培技术流程,以期能为欧洲乔木花楸规模化栽培提供一定的技术支撑。
1 材料与方法
1.1 试验材料
试验所选用的外植体是本所林地经济课题组欧洲乔木花楸培养圃内当年新萌发欧洲乔木花楸带侧芽茎段。采集季节为5月末至6月中旬,采集时间为晴朗天气的上午10点以后。以自配的MS为基本培养基,各试验阶段分别使用不同浓度的植物生长调节剂6-BA、NAA、IBA。
1.2 研究方法
1.2.1 外植体的取得
外植体取材的季节、位置直接影响无菌体系的建立,需选取生长旺季,最具母株特性的一段植株或者其他部位。本试验在5月末~6月中旬,在生长健壮的欧洲乔木花楸优良母树上剪取长势良好的当年萌发新梢作为外植体材料,剪下枝条后去除叶片,留取有用茎段,修剪好的茎段,按老嫩程度差别的不同分别放在不同的容器内,便于后期清洗与消毒的时间把握。
1.2.2 外植体的清洗与灭菌
将老嫩程度不同的供试外植体材料分别切成约10 cm的小段,放在洗衣粉溶液中不断摇晃,充分清洗,去除表面灰尘杂质,如灰尘杂质太多,可用洁净的软毛刷仔细刷洗干净,但要注意不要碰坏嫩芽。用洗衣粉清洗完后,将外植体放在水流下冲洗干净,不要残留泡沫。冲洗干净后的茎段放入传递窗中,置于接种室备用。转接前先用75%酒精将外植体材料消毒30 s,无菌水冲洗2~3次,再根据茎段老嫩程度不同,放在0.1%升汞溶液中浸泡4~8 min,然后用无菌水冲洗5~6次,每次冲洗2~3 min,冲洗净升汞溶液后放入超净工作台中准备接种。
1.2.3 培养基的配制及培养条件
试验腋芽诱导及分化增殖采用MS为基本培养基,生根采用1/2MS为基本培养基,蔗糖浓度为3%,琼脂含量0.8%,用HCl或NaOH调解pH至5.5~5.8,在高温灭菌前为各阶段培养基分别加入不同质量的6-BA、NAA、IBA等植物生长调节剂,高压灭菌条件为121℃20 min。培养室温度为(25±3)℃,光照强度 3 000 lx,光周期为 16 h/d。
1.2.4 芽诱导
将清洗、消毒后获得的无菌外植体材料在超净工作台中切成2~3 cm的带2~3个腋芽的小茎段,接种到不同处理组合组成的培养基中(表1)。6-BA采用3个浓度处理,分别为1.0、1.5、2.0 mg/L;NAA 3 个浓度处理,分别为 0.6、0.8、1.0 mg/L。每处理各接种60瓶,每瓶接种1个外植体材料,观察并记录丛生芽诱导情况,35天后统计萌芽数、萌芽率(萌芽率=萌芽数/接种外植体株数×100%)、生长情况。
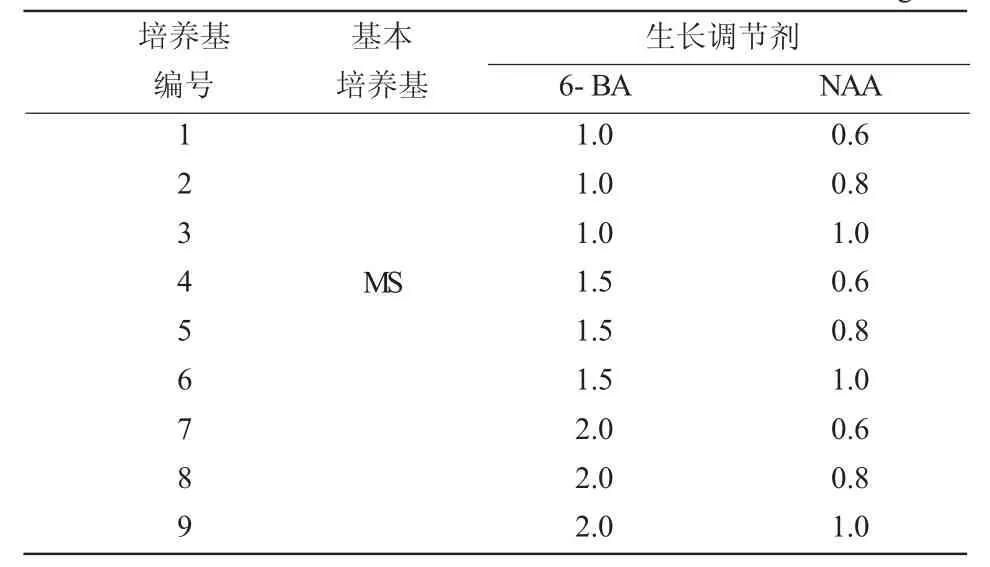
表1 欧洲乔木花楸腋芽诱导培养基配方设计
1.2.5 继代增殖
将初代培养产生的芽转接到继代增殖培养基中(表2),6-BA采用3个浓度处理,分别为1.0、2.0、2.5 mg/L;NAA 3个浓度处理,分别为 0.2、0.4、0.6 mg/L,每处理各接种20瓶,每瓶接种4个芽。35天后统计增殖系数(增殖系数即单个外植体再生形成的芽的平均数)与生长情况。
1.2.6 生根培养
将获得的不定芽切成长2~3 cm,留2~3片叶片的小段接种到生根培养基中(表3),IBA采用3 个浓度处理,分别为 0、0.4、0.8 mg/L;NAA 3 个浓度处理,分别为0、0.6、0.8 mg/L,每处理各接种20瓶,每瓶接种4株。30天后统计生根率(生根率=生根株数/接种株数)、根数、根长、株高,筛选出最佳生根培养基配方。

表2 欧洲乔木花楸继代增殖培养基配方设计
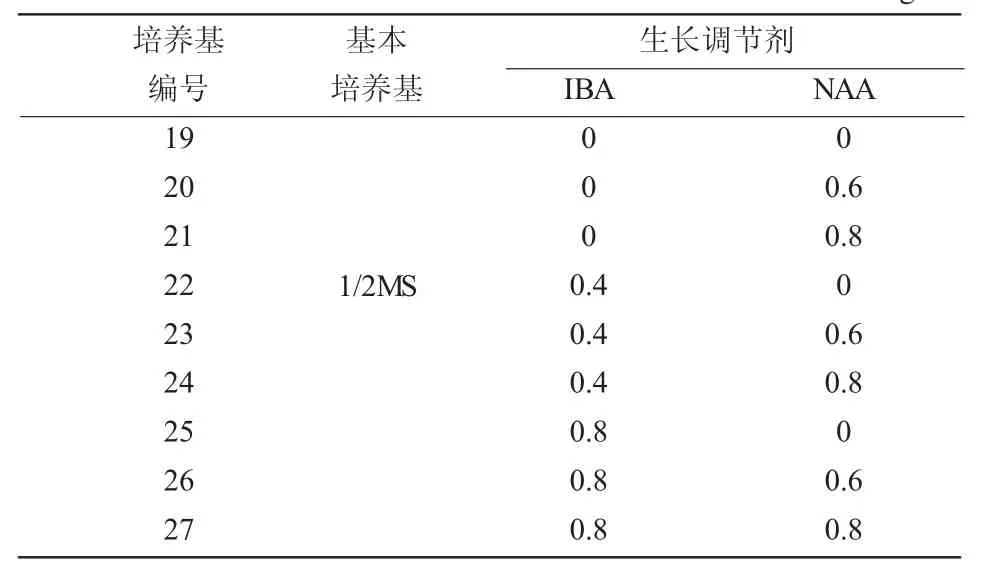
表3 欧洲乔木花楸生根培养基配方设计
1.2.7 移栽
本试验将在生根培养中培养30天后,单苗长出洁白的正常的短根,苗高4~5 cm的欧洲乔木花楸组培生根苗在温室大棚进行日光锻炼后,移栽至沙子、熟表土、草炭土按不同比例充分混匀并已消毒的移栽基质中,对移栽在大棚中的小苗要时刻根据温度、湿度、光照的变化及时喷水,保湿、控温、施肥、防病害,尽可能地创造适宜的生存环境,促进试管苗缓苗,提高成活率。
2 试验结果与分析
2.1 芽诱导
将消毒灭菌后的外植体分别接入到编号为1~9的培养基中,7天时即可见到培养基中的外植体有芽萌动;10天后4号、6号培养基中的外植体开始分化出小叶片;15天后其他培养基中的外植体开始分化出小叶片。由表4可知,9种处理组合培养基均能促进欧洲乔木花楸初代外植体萌芽,在4号培养基中的腋芽诱导效果最好,反应快,长势强,叶片平展,诱导率达68.33%。在5号培养基中的腋芽诱导可达65%,易落叶导致植株死亡。其他处理培养基中的外植体长势均不理想,因此欧洲乔木花楸最适诱导培养基为MS+6-BA1.5 mg/L+NAA0.6 mg/L。
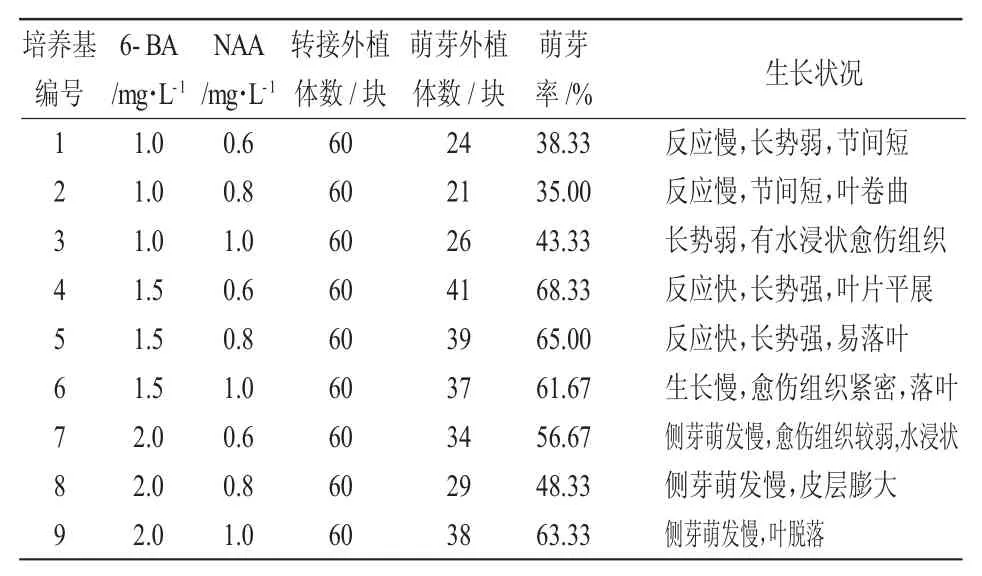
表4 不同激素浓度对欧洲乔木花楸腋芽诱导的影响
2.2 继代增殖
将欧洲乔木花楸的带芽茎段转接到编号10~18的继代增殖培养基中,培养基以MS为基础培养基,添加不同浓度的植物调节剂6-BA和NAA,培养35天后统计增殖系数和生长情况。由表5可知,在添加了6-BA2.0 mg/L和NAA0.2 mg/L的14号培养基中的不定芽增殖系数为5.23,虽稍低于16号培养基欧洲乔木化楸的增殖系数,但长势好、苗粗壮,苗高5.26 cm,高于其他处理。16号培养基中的不定芽增殖系数虽最高,为5.35,但苗细弱、叶黄化、脱落,不适合进行下一步的生根培养,因此继代增殖的最适培养基为MS+6-BA2.0 mg/L+NAA0.4 mg/L。
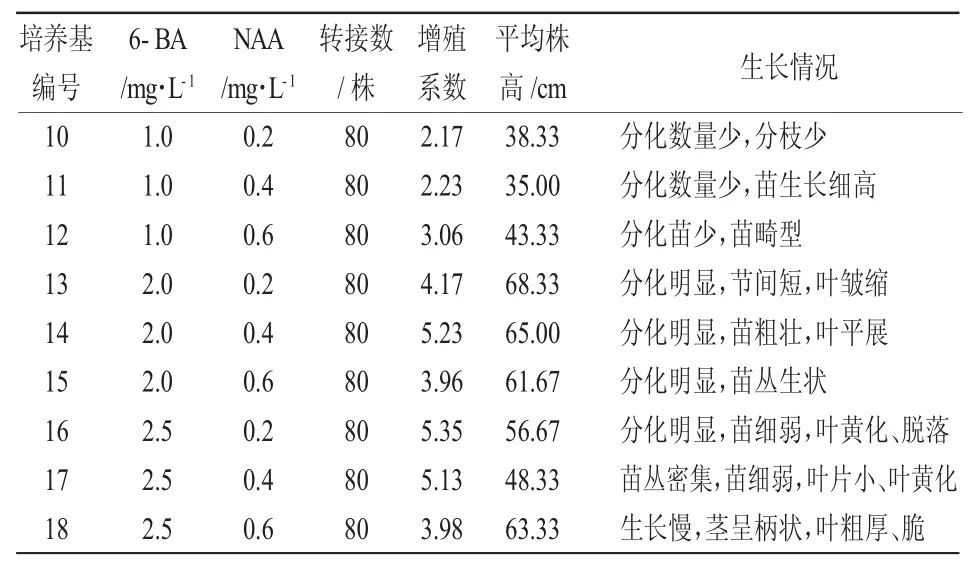
表5 不同激素浓度对欧洲乔木花楸继代增殖的影响
2.3 生根
欧洲乔木花楸生根所需植物调节剂为IBA和NAA,以1/2MS为基本培养基,IBA和NAA进行不同浓度、配比处理组合,30天后统计生根情况(表6)。9种处理组合的培养基均可诱导根的发生,IBA和NAA均对根的发生有促进作用,但二者配合使用效果更好,在促进生根、提高生根率的同时,还能促进苗的生长。添加了IBA0.4 mg/L、NAA 0.6 mg/L的23号培养基中的培养苗长势壮、叶片平展、浓绿,主根粗壮、须根较多,平均生根率达95.6%。所以,欧洲乔木花楸最适生根培养基为1/2MS+IBA0.4+NAA0.6。
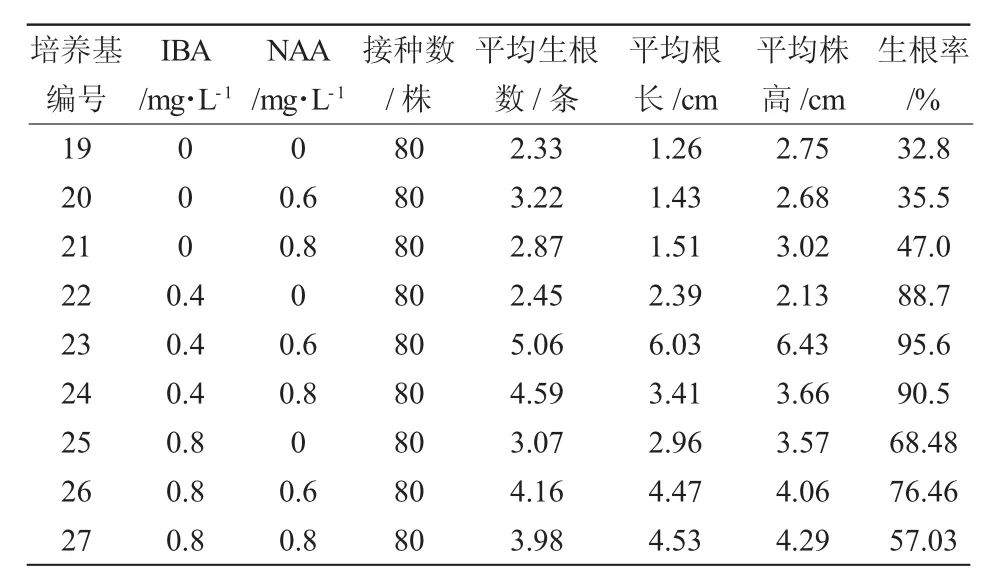
表6 不同激素浓度对欧洲乔木花楸生根的影响
2.4 移栽
经过诱导启动和继代增殖在生根培养基中培养30天后,欧洲乔木花楸试管苗已生根成为完整的再生植株,这时可出瓶移栽。移栽过程中要根据当地的气候环境特点、移栽季节、设备条件,分析并改善幼苗的种植环境,使其能有一个逐步锻炼和适应的过程。这就要求在移栽时要选择适宜的介质,移栽后保持小苗的水分供需平衡,给予适宜的光照、温度管理。
2.4.1 苗木移栽前驯化炼苗
将欧洲乔木花楸组培苗从培养室内取出,放在炼苗温室大棚内闭瓶炼苗10~20天,遮荫度为50%~70%,然后打开瓶口,逐渐降低湿度,并逐渐增强光强,通过驯化,新叶逐渐形成蜡质、产生皮毛,恢复气孔功能,适应环境5~7天后即可移栽。
2.4.2 苗木移栽
苗木移栽应在早、晚或阴天进行。用镊子将组培苗取出,放入清水盆中洗净根部琼脂,将根系在1 000倍的多菌灵溶液中消毒处理,消毒后用清水漂洗。移栽时动作要轻,不能损伤根系和茎,以免引起污染。移栽不可过深,埋住根系即可。随栽随用喷雾器喷水保湿,移栽后的组培苗要搭建塑料拱棚以便控温、保湿。
2.4.3 移栽基质
疏松通气、透水保湿是组培苗对基质的基本要求。生产上常用的移栽基质有园田土、草炭土、细河沙,或者将它们以一定比例混合应用。基质要混匀过筛,移栽前基质要进行灭菌处理,移栽苗管理过程中在保证高湿度前提下,基质不可浇水过多,以利根系的呼吸,促进生根成活。对移栽苗进行最适移栽基质试验发现,移栽在混合基质沙子∶熟表土∶草炭土=3∶4∶3中的欧洲乔木花楸成活率可达91%以上,成活率最高,为最适移栽培养基。
2.4.4 水分管理
欧洲乔木花楸组培苗在出瓶前是在100%相对湿度条件下生长的,茎叶表面几乎没有防止水分散失的角质层,并且根系不发达,种植后难以保持水分平衡,尤其是刚移栽3~7天时组培苗对水分十分敏感。采取移栽后淋透水、加盖塑料拱棚保湿、用喷雾器往叶面喷洒清水等措施减少叶面蒸腾,使拱棚内的空气湿度保持在95%以上,尽量接近培养瓶中的条件,7天后成活的组培苗开始生根,此时要逐渐减少叶面喷水次数,延长每天塑料拱棚的打开时间,恢复气孔调节功能,逐渐适应移栽环境。
2.4.5 光照与温度
根据试验,将欧洲乔木花楸在4月末至5月中旬移栽至温室大棚,加盖塑料小拱棚,移栽基质温度保持在15℃以上,移栽后应注意遮光控温,白天温度控制在(25±5)℃,夜间温度控制在(15±5)℃,保证苗木生长所需温度,遇到连续低温气候,适当延长塑料薄膜覆盖时间,温度高于30℃时,应打开拱棚或喷洒清水降温。移栽后的容器苗要避免阳光直射,采用散射光,或在遮阴条件下进行,一般可用70%黑色遮阳网,挡住直射光,避免伤苗。1周后,移栽苗成活并长出新根,此时可逐渐撤掉遮阳网,将日光逐渐增强到50%~60%,促进苗木木质化程度,到了生长后期要全光照,成活率一般都可达到90%以上。
3 结论与讨论
本试验立足于欧洲乔木花楸工厂化育苗,选取欧洲乔木花楸当年生新萌发的带侧芽茎段为外植体,筛选出腋芽诱导、继代增殖及生根的最适培养基,欧洲乔木花楸诱导培养与分化增殖培养阶段对外源生长调节剂比较敏感,6-BA与NAA配合使用效果最好。最佳诱导培养基为MS+6-BA1.5 mg/L+NAA0.6 mg/L,诱导率达68.33%;最佳继代增殖培养基为MS+6-BA2.0 mg/L+NAA0.4 mg/L,继代增殖系数为5.23。在生根阶段,IBA与NAA配合使用的生根效果优于单独使用NAA,1/2MS+IBA0.4 mg/L+NAA0.6 mg/L为欧洲乔木花楸最佳生根培养基,生根率达95.6%。移栽过程中通过选择疏松透气的移栽基质、移栽后加强水分、温度、光照管理使其逐渐由异养状态过渡到自养状态,提高炼苗移栽成活率,成活率一般都可达到90%以上。欧洲乔木花楸组织培养快速繁殖体系的建立,为欧洲乔木花楸种质资源保护及快速繁殖开辟了新的途径,可从根本上解决欧洲乔木花楸引种数量少、繁殖困难等问题,为良种苗木的快繁扩繁奠定了坚实基础。
[1] 谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1999.
[2] 黄立华,王占龙,朱虹,等.红醋栗组培快繁技术研究[J].辽宁林业科技,2012(2):15-17.
[3] 杨玲,刘虹男,张冬平,等.紫叶白桦组培苗叶片花青素含量影响因素分析[J].森林工程,2017,33(2):33-40.

