大蒜素对慢性肾衰大鼠氧化应激和炎症反应的影响
杨雅楠
0 引言
慢性肾功能衰竭(Chronic renal failure,CRF)是各种肾脏疾病终末期的共同表现,病程不可逆且进行性加重[1],目前尚无法治愈,临床上主要采取透析、降脂、抗聚、抗凝等治疗措施以缓解CRF症状并延缓病情发展[2-3],因此,CRF一直是医药研究者关注的热点与难点。既往Locatelli等[4]和杨婧等[5]研究发现,氧化应激损伤和炎症反应是慢性肾病发生发展的重要因素,并且与患者预后密切相关。大蒜素是一种具有抗氧化、抗凋亡等多种药理学作用的二烯丙基三硫化物,但其对CRF大鼠氧化应激损伤和炎症反应是否具有抑制作用尚未见文献报道。本研究通过制备CRF大鼠模型并给予大蒜素进行干预治疗,探讨大蒜素对CRF大鼠氧化应激损伤和炎症反应的影响。
1 材料与方法
1.1 实验动物、药物与试剂 SD大鼠,清洁级,雄性,180~220 g,河北省实验动物中心提供[SCXK(冀):2013-1-003]。大蒜素注射液(黑龙江江世药业有限公司,规格:2 mL∶30 mg);H&E试剂盒和SOD、CAT、MDA、T-AOC、AOPPs、CRP、IL-1、IL-6、TNF-α、sICAM-1、VCAM-1试剂盒(北京博奥森生物技术有限公司);BUN、SCr、UA试剂盒(深圳迈瑞生物医疗电子股份有限公司);腺嘌呤(国药集团化学试剂有限公司)。
1.2 动物分组、模型制备与给药 100只实验用大鼠,随机分为正常对照组、模型对照组、大蒜素(5、10、20 mg/kg)组,每组20只。参照杜卉莲等[8]研究报道的实验方法制备CRF大鼠模型:25%腺嘌呤溶液250 mg/(kg·d),连续灌胃21 d,制备CRF大鼠模型,正常对照组给予正常饮食、水。造模完成后,大蒜素5、10、20 mg/(kg·d)组腹腔注射治疗,正常对照组与模型对照组腹腔注射0.9%氯化钠注射液,疗程为28 d。
1.3 检测指标 ①收集24 h尿量,通过生化分析仪测定24 h尿蛋白量。②血清肾功能指标检测:腹主动脉取血(不抗凝),离心取血清,通过生化分析仪测定血清BUN、SCr、UA含量。③肾脏指数的计算:实施麻醉后取肾脏,称量左侧肾脏重量,肾脏指数=左侧肾脏重量/体重。④肾脏组织病变的观察:取称量后左侧肾脏置于4%多聚甲醛溶液固定72 h,然后行石蜡包埋、切片、展片和脱蜡水化处理,行常规H&E染色后,通过倒置光学显微镜观察肾脏组织形态结构变化。⑤肾脏组织抗氧化酶活性和MDA含量测定:取右侧肾脏、加入适量冷裂解液行研磨匀浆,离心(3 000 r/min,10 min)取上清液,按试剂盒说明,通过化学比色法测定肾脏组织SOD、CAT活性和MDA含量。⑥血清中T-AOC和AOPPs水平的测定:腹主动脉取血(不做抗凝处理),离心(1 500 r/min,10 min)取血清,采用化学比色法测定血清中T-AOC和AOPPs水平。⑦血清中炎症因子含量测定:参照各指标ELISA检测试剂盒操作说明,通过酶标仪检测血清中AOPPs、CRP、IL-1、IL-6、TNF-α、sICAM-1、VCAM-1含量水平。

2 结果
2.1 大蒜素对CRF大鼠24 h尿量、24 h尿蛋白量的影响 与正常对照组比较,模型对照组大鼠24 h尿量显著增加、24 h尿蛋白量显著升高(P<0.01)。经大蒜素10、20 mg/(kg·d)治疗28 d后,CRF大鼠24 h尿量和24 h尿蛋白量显著降低(P<0.05或P<0.01)。结果见表1。
2.2 大蒜素对CRF大鼠体重、肾脏指数的影响 与正常对照组比较,模型对照组大鼠体重和肾脏指数均升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d后,大鼠体重升高(P<0.05),肾脏指数降低(P<0.01)。见表1。
2.3 大蒜素对CRF大鼠血清肾功能指标的影响 与正常对照组比较,模型对照组大鼠血清肾功能监测指标(BUN、SCr、UA含量)升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d,上述指标降低(P<0.05或P<0.01)。见表2。
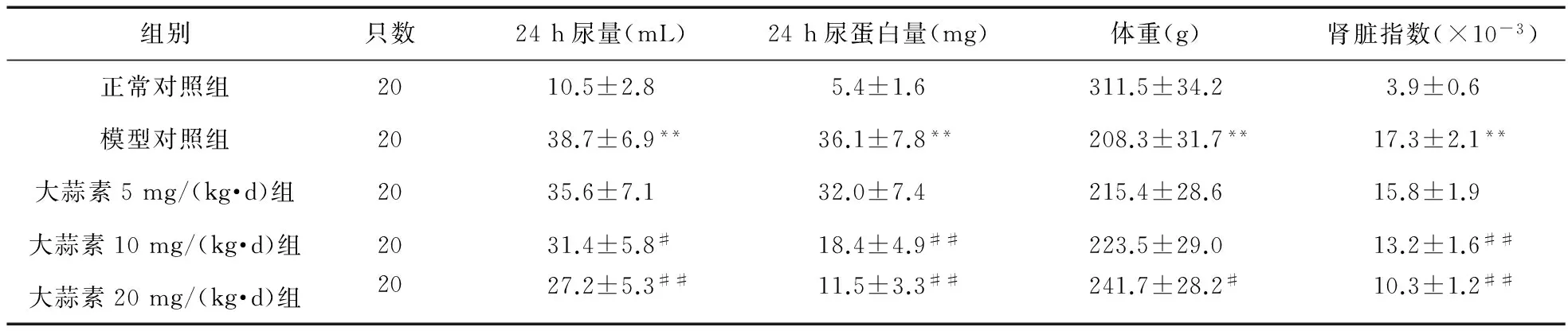
表1 各组大鼠24 h尿量、24 h尿蛋白量、体重、肾脏指数比较
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
2.4 大蒜素对CRF大鼠肾脏组织病变的影响 观察各组大鼠肾脏HE染色病理切片:正常对照组大鼠肾小球、肾小管及间质区组织结构和细胞形态均未见异常;模型对照组呈现肾小球变性、数量减少、球囊黏连、囊腔和管腔扩大,肾小管内结晶、坏死处可见大量炎症细胞和少量中性粒细胞浸润;与模型对照组比较,经大蒜素5、10、20 mg/(kg·d)治疗28 d,CRF大鼠肾脏组织病变明显改善,以20 mg/(kg·d)组最为显著。见图1。
2.5 大蒜素对CRF大鼠肾脏组织抗氧化酶活性和MDA含量的影响 与正常对照组比较,模型对照组大鼠抗氧化酶活性显著降低,MDA含量显著升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d,CRF大鼠SOD活性升高,降低MDA含量(P<0.05或P<0.01),经20 mg/(kg·d)治疗,能够升高CAT活性(P<0.01)。结果见表3。
2.6 大蒜素对CRF大鼠血清T-AOC、AOPPs水平的影响 与正常对照组比较,模型对照组大鼠血清T-AOC水平降低(P<0.01),AOPPs水平升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d,CRF大鼠AOPPs水平降低(P<0.05或P<0.01);经大蒜素20 mg/(kg·d)治疗,T-AOC水平升高(P<0.05)。结果见表4。

表2 各组大鼠血清肾功能监测指标
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
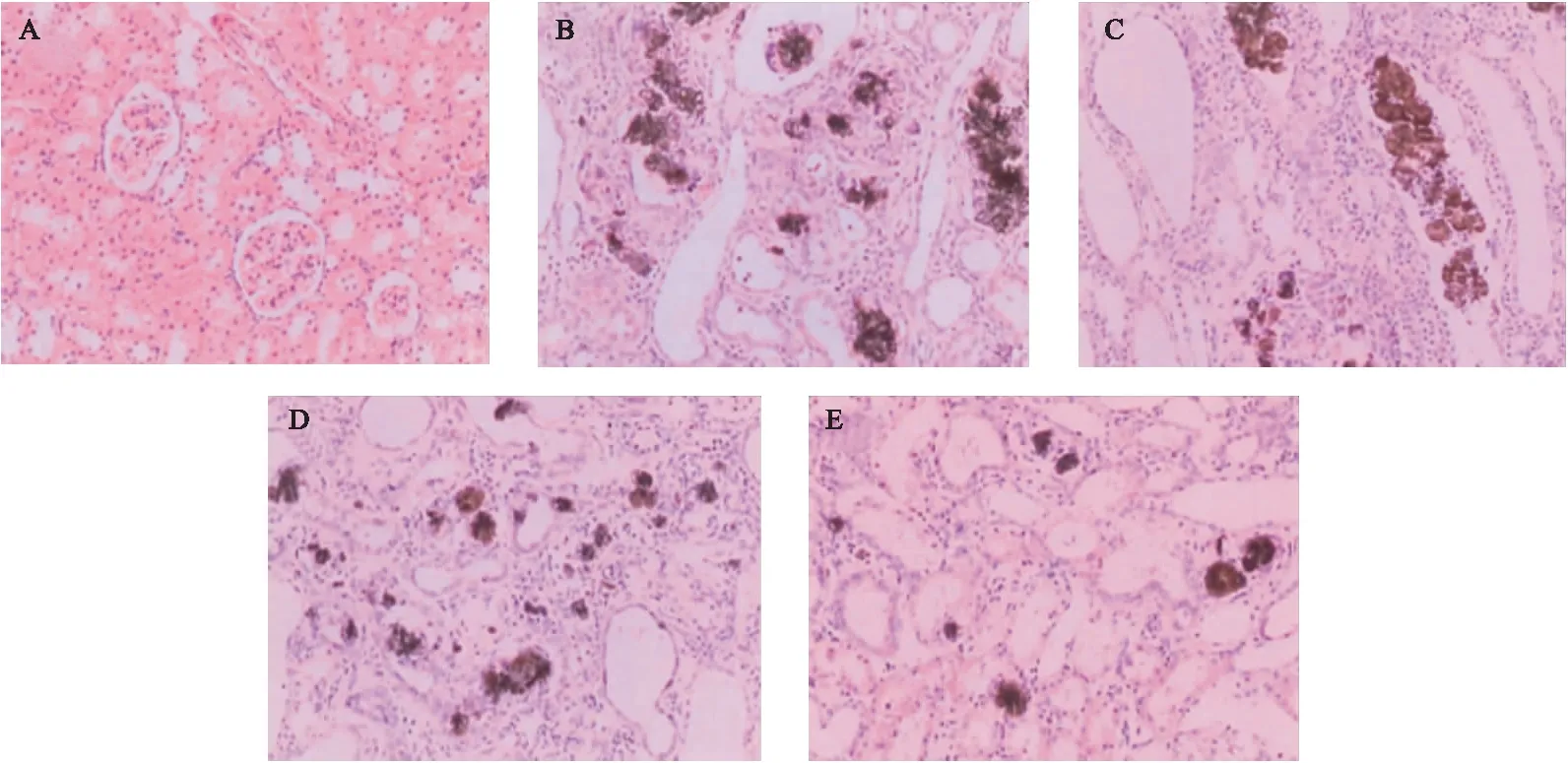
图1 各组大鼠肾脏组织病变(HE,400×)

组别只数SOD(U/mgprot)CAT(U/mgprot)MDA(nmol/mgprot)正常对照组2013.1±1.82.5±0.64.6±1.1模型对照组206.4±1.0**1.2±0.4**15.2±2.3**大蒜素5mg/(kg·d)组207.1±1.31.5±0.313.0±2.7大蒜素10mg/(kg·d)组208.9±1.5#1.6±0.48.1±1.6##大蒜素20mg/(kg·d)组2011.2±1.6##1.9±0.6##6.3±1.2##
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
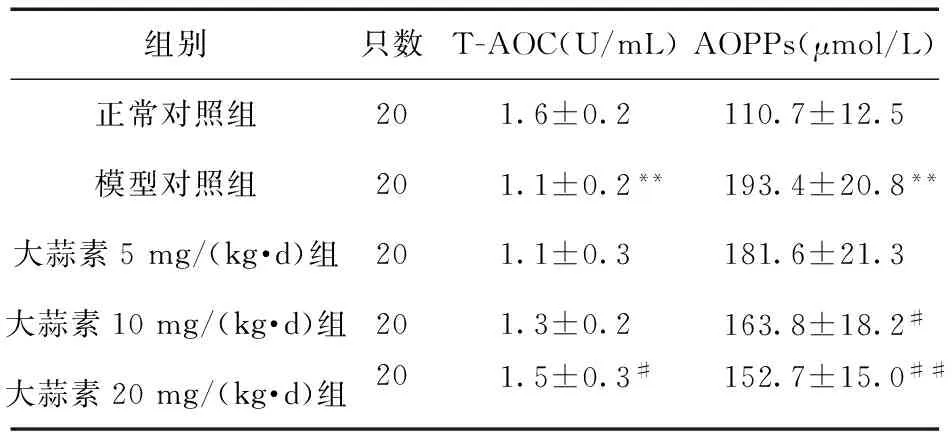
表4 各组大鼠血清T-AOC、AOPPs水平比较
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
2.7 大蒜素对CRF大鼠血清sICAM-1、VCAM-1含量的影响 与正常对照组比较,模型对照组大鼠血清sICAM-1、VCAM-1含量升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d,CRF大鼠血清sICAM-1、VCAM-1含量显著降低(P<0.05或P<0.01)。见表5。

表5 各组大鼠血清sICAM-1、VCAM-1含量比较
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
2.8 大蒜素对CRF大鼠血清CRP、IL-1、IL-6、TNF-α含量的影响 与正常对照组比较,模型对照组大鼠血清hs-CRP、IL-1、IL-6、TNF-α含量升高(P<0.01);经大蒜素10、20 mg/(kg·d)治疗28 d,CRF大鼠血清CRP、TNF-α含量降低(P<0.05或P<0.01);经大蒜素20 mg/(kg·d)治疗,CRF大鼠血清IL-1、IL-6含量降低(P<0.05或P<0.01)。见表6。
3 讨论
在已知CRF发生发展的病理机制中,氧化应激和炎症反应发挥着关键作用[6-8],这也为新型抗CRF药物的研究提供了新的思路。大蒜素是一种具有多种生物学活性的二烯丙基三硫化物[4-5],本实验研究发现,经大蒜素治疗28 d,能够有效减少CRF大鼠排尿量,降低24 h尿蛋白量,降低血清BUN、SCr、UA含量,抑制CRF大鼠肾脏组织病变,降低肾脏指数,提示大蒜素对CRF大鼠肾脏具有一定的保护作用。
既往Locatelli等[4]研究发现,氧化应激损伤与慢性肾病发生发展及患者预后密切相关。机体组织抗氧化酶活性降低是导致氧自由基(ROS)过剩的主要原因,肾脏组织SOD、CAT含量丰富,是清除ROS而抑制氧化应激损伤的重要屏障[9]。韩海燕等[10]研究显示,抗氧化酶活性降低将导致ROS蓄积而引发脂质过氧化损伤,MDA含量升高。T-AOC水平能够反映机体整体抗氧化能力;AOPPs是一种氧化修饰蛋白,为常用体内氧化应激标志物[11]。Li等[12]报道,持续静脉注射AOPPs,能够加重慢性肾病动物氧化应激损伤,此外,既往研究发现,AOPPs能够介导机体炎症反应[13]。本研究发现,经大蒜素治疗28 d,能够有效改善CRF大鼠肾脏组织抗氧化酶(SOD、CAT)活性并降低MDA含量,提高血清T-AOC水平并降低AOPPs水平,提示大蒜素具有抑制CRF大鼠氧化应激损伤的作用。
血清炎症细胞因子(CRP、IL-1、IL-6、TNF-α)含量水平是临床监测机体炎症反应的常用指标,而sICAM-1、VCAM-1含量与炎性细胞浸润密切相关[14]。本研究发现,经大蒜素治疗28 d,能够有效降低CRF大鼠血清CRP、IL-1、IL-6、TNF-α、sICAM-1、VCAM-1含量水平,进而起到抑制炎症反应的作用。
综上所述,大蒜素能够有效改善CRF大鼠肾功能,抑制肾脏组织病变,改善抗氧化酶活性、降低氧化应激损伤,调节炎症因子水平、抑制炎症反应,提示大蒜素可能通过降低氧化应激损伤和抑制炎症反应,对CRF大鼠起到一定的保护作用。

表6 各组大鼠血清CRP、IL-1、IL-6、TNF-α含量比较
注:与正常对照组比较,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01
[1] 吴鑫洪,丁国明,韩颖敏.肾衰宁联合包醛氧淀粉治疗慢性肾功能衰竭的临床疗效观察[J].求医问药,2011,9(9):260-261.
[2] 冯青,万毅刚,蒋春明,等.中药延缓肾功能衰竭进展的机制和效果[J].中国中药杂志,2011,36(9):1122-1128.
[3] 王磊.血液透析治疗慢性肾功能衰竭的临床疗效观察[J].中国实用医药,2011,6(25):52-53.
[4] Locatelli F,Canaud B,Eckardt KU,et al.Oxidative stress in end-stage renal disease:an emerging threat to patient outcome[J].Nephrol Dial Transplant,2003,18:1272-1278.
[5] 杨婧,严睿俊,王琛,等.肾衰II号方对慢性肾脏病患者肾功能及炎症因子的影响[J].中国中医药信息杂志,2014,21(12):15-18.
[6] 王明娟,耿永芝,刘景华,等.白藜芦醇对抗酒精诱导的SH-SY5Y细胞损伤作用:氧化应激与凋亡[J].世界华人消化杂志,2014,22(36):5594-5601.
[7] 张宏睿,林永廉.大蒜素对糖尿病大鼠CRP、TNF-α、PAI-1及IL-6的影响[J].辽宁中医药大学学报,2008,10(2):34-35.
[8] 杜卉莲,傅晓晴.慢性肾衰动物的模型制备及临床应用[J].中医研究,2005,18(12):53-57.
[9] Lartigue A,Burlat B,Coutard B,et al.The megavirus chilensis Cu,Zn-superoxide dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[10]韩海燕,路建饶,王新华,等.肾衰方对5/6肾切除大鼠的氧化应激和微炎症的作用与机制[J].时珍国医国药,2015,26(10):2391-2394.
[11]文志勇,毛萍,金召英,等.复方黄甘提取物对慢性肾衰大鼠氧化应激的影响[J].中药材,2012,35(6):957-961.
[12]Li HY,Hou FF,Zhang X,et al.Advanced oxidation protein products accelerate fibrosis in a remnant kidney model[J].J Am Soc Nephrol,2007,18(2):5232-5238.
[13]Witko-Sarat V,Friedlander M,Nguyen-Khoa T,et al.Advanced oxidation protein products as novel mediators of inflammation and monocyte activation in chronic renal failure[J].J Immunol,1998,161(5):2524-2532.
[14]王兴红,常陆林,王丽菲.槲皮素对糖尿病大鼠肾脏氧化应激和血清炎症相关因子的影响[J].中药药理与临床,2014,30(4):39-42.

