蓝圆鰺腌干工艺中组织蛋白酶与游离氨基酸和滋味形成的关系
吴燕燕,曹松敏,2,李来好,杨贤庆,林婉玲,陈胜军
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306)
传统咸鱼加工主要采用高盐即20%~30%食盐腌制鱼,由于产品风味独特,耐贮藏,一直深受消费者喜欢,但高盐食品不利于人体健康。近年来,开发具有传统咸鱼风味但低盐的腌制产品越来越受到重视。腌制类制品的风味物质生成比较复杂,主要来源于脂肪降解及氧化、蛋白降解、美拉德反应等。腌制品加工过程中[1-2]蛋白质能降解形成大量的小肽和游离氨基酸[3-4],其中部分游离氨基酸[5]能直接呈现出苦味、甜味或鲜味,另有部分氨基酸及小肽是腌制品风味物质的前体物质。腌制品中能将蛋白质降解为多肽和游离氨基酸的内源性蛋白酶主要为组织蛋白酶、钙蛋白酶。钙蛋白酶和组织蛋白酶D在火腿腌制过程中活力基本丧失,组织蛋白酶B、L、H则在整个加工过程中均能检测到活力[6-8],其中组织蛋白酶B、L的活力尤其稳定[9]。目前与蛋白降解及滋味物质形成相关的内源性蛋白酶类的研究主要集中在对腌制火腿加工过程中,高瑞昌等[9]利用响应面预测方法研究了腌干鲢鱼加工过程中组织蛋白酶B、L活力变化规律,但未对组织蛋白酶与蛋白降解及滋味物质形成的关系进行深入探究。
为改善传统法腌制咸鱼加工工艺,本实验在前期研究低盐乳酸菌法腌制鱼工艺的基础上,以蓝圆鰺为原料,采用传统高盐(traditional high-salted fish,HS)和低盐乳酸菌(low-salted and lactic acid bacteria-fermented fish,LS)腌干方法对其进行加工,测定出各个加工阶段(A鲜鱼、B腌制、C浸泡脱盐、D烘干、E成品)的组织蛋白酶活力(B、L、H)、蛋白水解率(protein degradation rate,PI)及主要游离氨基酸的含量和组成变化,分析探究不同蓝圆鰺腌干工艺加工过程中组织蛋白酶B、L、H的变化规律,以及各酶活同蛋白降解及游离氨基酸含量变化之间的关系。本研究旨在揭示蓝圆鰺不同腌干过程中的蛋白降解规律及滋味物质(游离氨基酸)的形成同各组织蛋白酶之间的关系,为蓝圆鰺腌干鱼制品的实际加工生产及品质控制和工艺改进提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝圆鰺:冰鲜,每条鱼质量约为80~100 g;海水晒制粗盐 广东台山李贵记水产有限公司。
植物乳杆菌(Lactobacillus plantarum,Lp)、肠膜明串珠菌(Leuconostoc mesenteroides,Lm)和戊糖片球菌(Pediococcus peutosaceus,Pp),分离自台山市广海镇李贵记水产品加工厂腌制大黄鱼 (Pseudosciaena crocea);嗜酸乳杆菌(L. acidophilus,La)、短乳杆菌(L. brevis,Lb)分离自腌制三牙鱼(Otolithes ruber)。
NaAc、NaCl、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、聚乙二醇辛基苯基醚(TritonX-100)、KH2PO4、Na2HPO4、Na2EDTA、L-Cys、ClCH2COONa、30% Brij 35、β-ME、DMSO、HAc(均为分析纯) 广州化学试剂厂;二硫苏糖醇(dithiothreitol,DTT)、7-氨基-4-甲基香豆素(7-amido-4-methylcoumarin,AMC)、Z-Arg-Arg-AMC、L-Arg-AMC、L-Phe-Arg-AMC 美国Sigma-Aldrich公司;MRS肉汤培养基 广州环凯微生物科技有限公司。
1.2 仪器与设备
BS224S分析天平 美国Sartorius公司;3k30冷冻离心机 美国Sigma公司;UV-2550紫外分光光度计、QP2010 plus气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 日本岛津公司;T25均质机 德国IKA公司;HH-4快速恒温数显水浴箱 常州澳华仪器公司;RC-5型热泵干燥机 广东省农业机械研究所干燥设备制造厂。
1.3 方法
1.3.1 样品制备
1.3.1.1 HS腌干鱼工艺[10]
冰鲜蓝圆鰺去内脏后洗净,放入腌渍池中,层鱼层盐(20%盐/鱼),后灌入饱和食盐水至淹没全部鱼体,4 ℃条件下腌制36 h,取出并清水浸泡3~4 h(0.5~1 h换水1 次),浸泡脱盐结束后置于晒网上晾干水分,再移入(28±2)℃ 热泵干燥机中烘干至鱼体水分质量分数约为30%,包装即为成品。
1.3.1.2 LS腌干鱼工艺[11]
冰鲜蓝圆鰺去内脏后洗净,放入腌渍池中,层鱼层盐(10%盐/鱼),后灌入饱和食盐水至淹没全部鱼体,4 ℃腌制24 h,取出并清水浸泡3~4 h(0.5~1 h换水1 次),浸泡脱盐结束后置于晒网上晾干水分,接种混合乳酸菌液(Lp∶Pp∶Lm∶La∶Lb=4∶4∶2∶3∶4),菌液浓度109CFU/mL,接种量为10mL/100g,接种完成后置于RC-5型热泵干燥机中调节温度至(26±1)℃,恒温发酵17 h,然后调节温度至(28±2)℃烘干至鱼体水分质量分数为30%,包装即为成品。
两种腌制加工工艺在加工过程分5 个阶段取样:样品A(鲜蓝圆鰺)、样品B(腌制后)、样品C(脱盐后)、样品D(烘干中期)、样品E(烘干后成品)。每个阶段取样阶段均取样5~8 条样品鱼,去除可见脂肪及鱼皮,用绞肉机将样品鱼肉均匀绞碎,密封保存于-30 ℃冰箱中。
1.3.2 组织蛋白酶活力测定[12]
1.3.2.1 粗酶液的提取
称取5.000 g样品鱼肉与20 mL预冷缓冲液(包含50 mmol/L NaAc、100 mmol/L NaCl、1 mmol/L EDTA、0.2%聚乙二醇辛基苯基醚(TritonX-100);pH 5.0)均匀混合,均浆(15 000 r/min,6×10 s),4 ℃、10 000×g离心40 min,过滤,取上清液即为组织蛋白酶B、H、L粗酶液。
1.3.2.2 组织蛋白酶B、B+L活力的测定
0.5 mL粗酶液与0.25 mL反应缓冲液(B:pH 6.0,352mmol/L KH2PO4,4 mmol/L Na2EDTA,48 mmol/L Na2HPO4,使用前配制成8 mmol/L L-Cys溶液;B+L:pH 5.5,340 mmol/L NaAc,4 mmol/L Na2EDTA,60 mmol/L HAc,使用前配制成8 mmol/L DTT溶液)均匀混合,将混合液于40 ℃水浴中预热 5 min,后加入0.5 mL预热5 min的酶反应底物(B:Z-Arg-Arg-AMC、B+L:Z-Phe-Arg-AMC;20μmol/L)混合均匀后于40 ℃水浴环境中反应15 min,反应完成后加入2 mL终止试剂(pH 4.3,100 mmol/L ClCH2COONa,70 mmol/L HAc,30 mmol/L NaAc;对照组:先加入终止试剂再加其他),10 000 r/min离心10 min,荧光分光光度计(λex=340 nm,λem=440 nm)测定上清液荧光值。组织蛋白酶L活力=组织蛋白酶B+L活力-组织蛋白酶B活力。
1.3.2.3 组织蛋白酶H活力的测定[13]
L-Arg-AMC可以同时被氨肽酶和组织蛋白酶H水解,半胱氨酸蛋白酶专一不可逆抑制剂(E-64)可抑制组织蛋白酶H活力,以L-Arg-AMC为底物的样品组实际测得的总酶活力与添加E-64抑制剂样品组所测得的酶活之差即为组织蛋白酶H真实活力值。步骤如下:添加E-64组(A):20 μL E-64(1 mmol/L)与0.5 mL粗酶液和0.25 mL反应缓冲液混合均匀后40 ℃水浴环境中放置60 min;未添加E-64组(B):0.5mL粗酶液与0.25 mL反应缓冲液混合均匀后40 ℃水浴环境中放置5 min;最后吸取0.5 mL预热5 min后的酶反应底物(L-Arg-AMC;20μmol/L)添加至A、B两组,于40 ℃水浴环境中反应15 min,之后步骤同组织蛋白酶B活力测定方法。
用AMC制作标准曲线,标准曲线法计算酶活力。一个酶活力单位(U)仍定义为每克鱼肉中1min产生1 nmol AMC所需要的组织蛋白酶(B、B+L、H)的数量(40 ℃)。
1.3.3 蛋白降解率(proteolysis index,PI)的测定[14-15]
非蛋白氮(nonprotein nitrogen,NPN)测定:准确称取样品2.000 g,与20 mL超纯水,40 ℃振荡2 h,完成后加入20 mL 10% TCA溶液连续振荡40 min,10 000 r/min离心15 min,过滤,取上清液于消化管中,加入催化剂(Cu2SO4·5H2O与K2SO4质量比1∶9)3 g和12 mL浓硫酸,消化,冷却后用蛋白质自动分析仪测定NPN含量。总氮(total nitrogen,TN)测定:准确称取样品1.000 g,于消化管中,加入3 g催化剂和12 mL浓硫酸,消化,冷却后用蛋白质自动分析仪测定TN含量。PI值计算公式如下:

1.3.4 游离氨基酸的测定
依照GB/T 22729—2008《海洋鱼低聚肽粉》中的方法进行样品前处理,再根据GB/T 5009.124—2003《食品中氨基酸的测定》规定的方法,利用氨基酸自动分析仪进行测定。
1.4 数据处理
本实验设计的所有指标均设计3 个平行,并用Excel计算各指标s。利用Origin 7.0软件作图,JMP 7.0软件分析方法中的Tukey HSD检验进行数据的显著性分析。利用SPSS软件进行组织蛋白酶与蛋白降解和游离氨基酸之间的皮尔逊相关系数分析。
2 结果与分析
2.1 蓝圆鰺腌干工艺加工过程中内源性蛋白酶类活力变化分析
组织蛋白酶B、L活力相比鲜鱼中酶的活力在HS法成品中和LS法成品中分别提升了46.91%、113.11%和27.16%、100%;HS法中组织蛋白酶H活力下降了7.37%,LS法中组织蛋白酶H活力提升了10.53%。3 种组织蛋白酶B、L、H在HS法和LS法蓝圆鰺加工过程中变化趋势不相同:成品中组织蛋白酶B、L活力相比于鲜鱼均呈现出增高趋势,HS法成品中组织蛋白酶H活力低于鲜鱼中组织蛋白酶H活力,而LS法中组织蛋白酶H活力高于鲜鱼中组织蛋白酶H活力。李敏等[16]发现腊鱼风干末期B、L酶活力相对鲜鱼中活力略有增高与本实验结论一致,而Toldrá等[17]则发现火腿加工结束时组织蛋白酶B、B+L的残余活力仅为原料肉中酶活力的5%~15%。Flores等[18]在使用冰冻过后的原料肉加工Iberian火腿过程中发现成品火腿中组织蛋白酶B的活力较原料肉中活力呈现出增高趋势,组织蛋白酶B+L活力则呈现出降低趋势(降低趋势不显著,P>0.05),组织蛋白酶H活力则出现降低趋势。赵改名等[19]发现金华火腿加工过程中温度、盐分含量、pH值对组织蛋白酶B、B+L的活力具有复杂复合作用,酶活力并非由单一因素的变化而产生变化,受到多种环境因素的共同作用而产生相应的变化。由此可见,原料以及加工方式不同导致的加工过程中加工环境各异,将对腌干鱼类制品中蛋白酶活力的变化具有不同的激活或抑制作用。
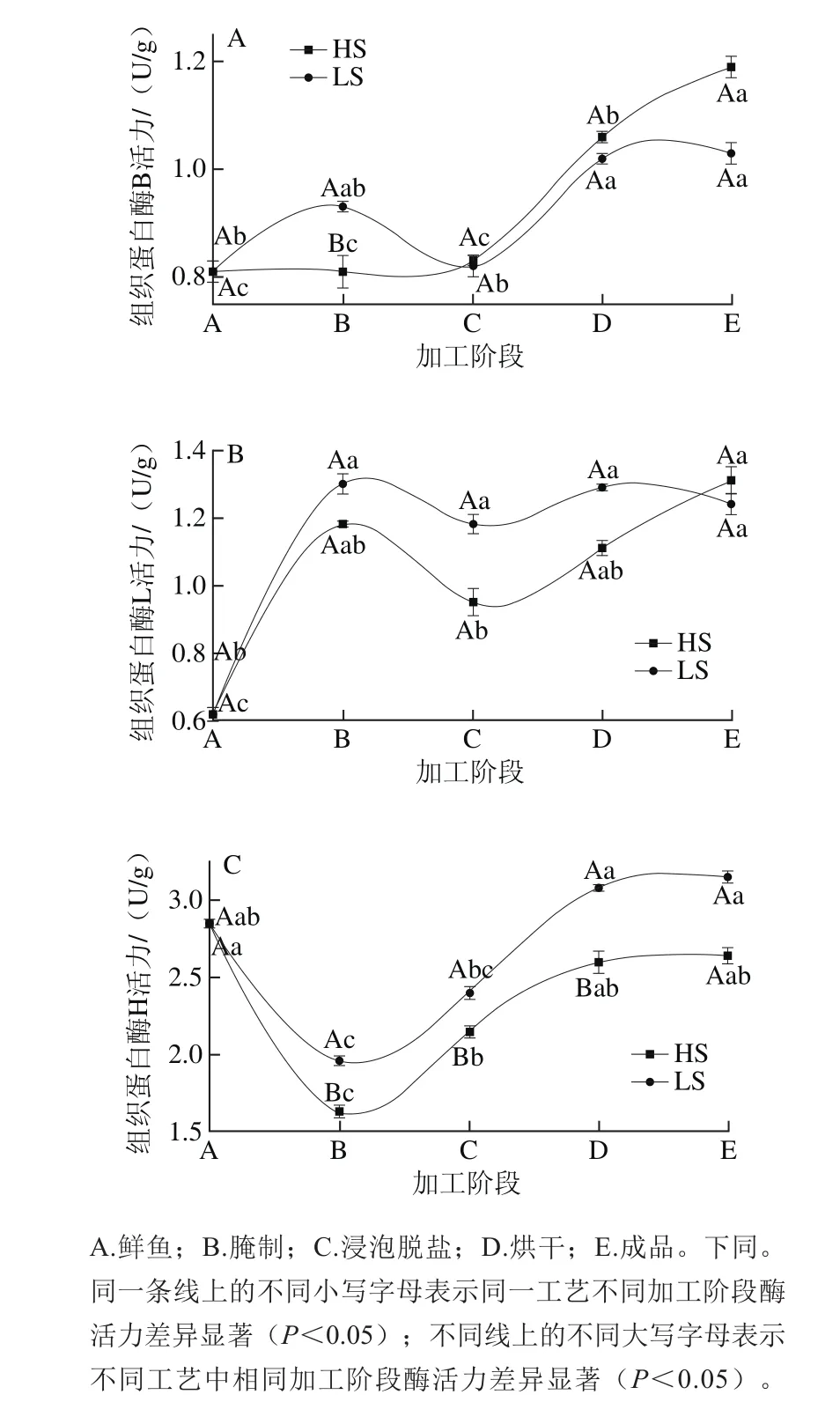
图1 蓝圆鰺腌干工艺加工过程中组织蛋白酶H活力变化情况Fig. 1 Changes in cathepsin activities during dry-salted fish processing
由图1可见,2 种蓝圆鰺腌干工艺加工过程中组织蛋白酶B、L、H的变化趋势相似,HS法中组织蛋白酶B的活力在腌制、脱盐阶段变化不显著(P>0.05),烘干阶段活力显著增高(P<0.05),到烘干末期活力达到最大值;LS法中组织蛋白酶B的活力在腌制阶段略有增加,脱盐阶段活力出现回落趋势,烘干阶段活力显著提升(P<0.05),在烘干中后期活力达到最大值。组织蛋白酶H活力在腌制阶段呈现出显著降低的趋势(P<0.05),之后活力显著增强至烘干阶段达到最大值(与新鲜鱼中活力值大小相仿),整个加工阶段LS法中组织蛋白酶H和L活力大于HS法中酶的活力(P<0.05)。李树红[20]在鲢鱼加工过程中发现,当NaCl含量在0~0.2 mol/L范围内时,组织蛋白酶B活力随食盐含量的增高而增强,大于0.2 mol/L时蛋白酶B活力受到一定的抑制。由此可见食盐含量对组织蛋白酶影响较大,食盐含量较低时有利于激活组织蛋白酶活力,食盐含量较高时会抑制组织蛋白酶活力;由于HS法中食盐含量较LS法高,所以在腌制阶段LS法的组织蛋白酶活力大于HS法。而烘干阶段组织蛋白酶B、L、H活力均显著提升(P<0.05),在烘干中后期活力达到最大值,说明烘干过程的温度是组织蛋白酶的最适合温度,所以活力增强。
2.2 蓝圆鰺腌干工艺加工过程中蛋白降解情况分析对比

图2 蓝圆鰺腌干工艺加工过程中PI值变化情况Fig. 2 Changes in PI values aduring dry-salted fish processing
图2体现了不同加工工艺腌干蓝圆鰺加工过程中PI值的变化规律,研究人员在火腿加工过程中发现火腿特征风味与肽类[21]成分及含量具有密切的相关性,部分带有亲脂性侧链的小肽导致火腿呈现出苦味[3],蛋白质水解最严重。由图2可见,PI值在HS法和LS法腌干蓝圆鰺加工过程中变化趋势相同:PI值随加工的进行同样呈现出逐渐增高的趋势。图2中两种加工工艺各加工阶段中样品PI值在腌制、脱盐阶段LS法大于HS法(差异不显著,P>0.05),烘干中期及成品中则为HS法大于LS(差异不显著,P>0.05),说明HS法生产的腌干鱼制品蛋白降解程度略高于LS法制备的腌干蓝圆鰺,LS法利于减轻腌干鱼制品的蛋白降解程度。Careri等[5]在研究帕尔玛火腿中发现,若PI值小于22说明火腿蛋白质水解不够,导致火腿缺乏应有香气和滋味;若PI值大于30则火腿表现出蛋白质水解过度,导致火腿质地过软,呈现出明显苦味或金属后味。本研究中HS法和LS法生产的腌干蓝圆鰺PI值分别为23.99和23.08,PI值在22~30之间,说明均不会产生明显的苦味或者金属后味。
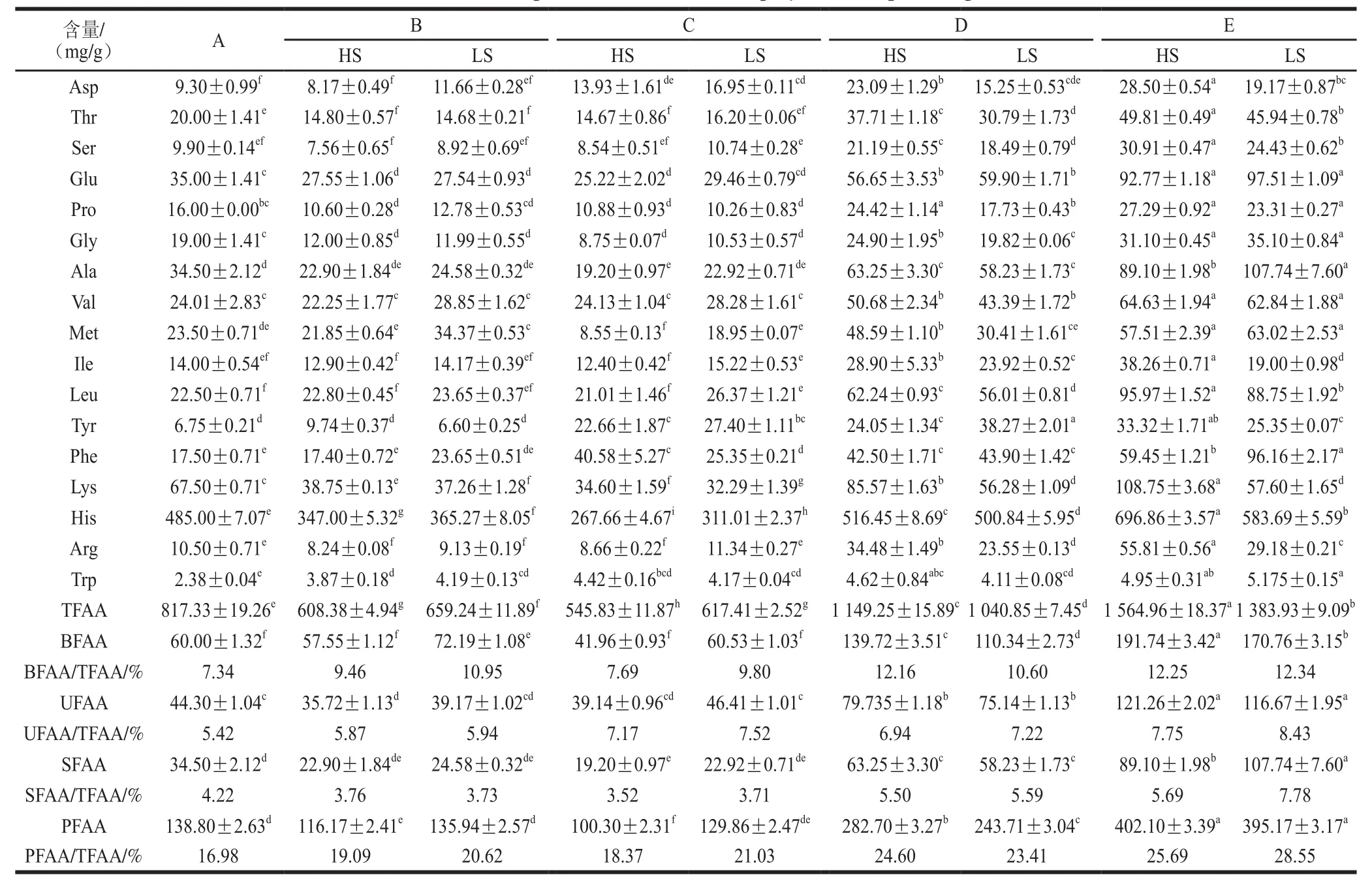
表1 蓝圆鰺不同腌干工艺加工过程中游离氨基酸变化情况分析Table1 Changes in free amino acids during dry-salted fish processing
2.3 蓝圆鰺腌干工艺加工过程中游离氨基酸变化与滋味形成的分析对比
由表1可见,随着加工进程的不断推进,HS法和LS法生产过程中TFAA含量变化趋势相同:腌制、脱盐阶段均出现显著下降趋势(P<0.05),主要原因是水溶性游离氨基酸随水分逐渐流失;烘干阶段TFAA含量显著增加(P<0.05),说明腌干咸鱼中游离氨基酸主要生成于烘干阶段。TFAA含量在腌制、脱盐阶段HS法<LS法,而烘干阶段HS法>LS法。Toldra等[22]在火腿的研究中发现游离氨基酸主要由多肽和蛋白质在氨肽酶的作用下水解产生。在腌制、脱盐两阶段中,由于LS法中组织蛋白酶B、L活力略大于HS法中活力,使得LS法中多肽含量较高,在氨肽酶做用下产生较多的游离氨基酸;但烘干阶段2 种组织蛋白酶活力则是HS法大于LS法,促进了HS法中多肽的生成,使得烘干阶段TFAA含量为HS法大于LS法。TFAA对腌制品的滋味影响较大,研究发现游离氨基酸是火腿酸味、甜味和苦味的前体物,与火腿风味的形成具有巨大相关性[3,5,23-24]。丙氨酸能产生甜味[23],苦感的产生与高浓度的蛋氮酸、亮氨酸和异亮氨酸有关[25],谷氨酸和天冬氨酸具有鲜味[3]。由表1可见,两种腌干蓝圆鰺加工过程中PFAA含量百分比的变化趋势相同,均随着加工的进行百分含量逐渐增高,虽然HS法加工制作的腌干蓝圆鰺中TFAA含量高于LS法,但PFAA含量百分比为LS法大于HS法;BFAA(与苦味前体物质相关的氨基酸)含量百分比在HS法中主要增高阶段为腌制、烘干前期,LS法主要增高阶段为腌制、烘干末期,这可能与LS法中复合乳酸菌的发酵作用相关性较高有关;UFAA含量百分比在脱盐、烘干期间均逐渐增高,特别是烘干末期,成品中UFAA含量百分比为LS法大于HS法,这是由于复合乳酸菌的发酵降解产生较多UFAA的原因;SFAA含量百分比主要在烘干前期增加较明显,且成品中SFAA含量百分比为LS法大于HS法;由以上分析可见,LS法更有利于腌干鱼滋味物质的产生。
2.4 蓝圆鰺腌干工艺加工过程中组织蛋白酶与蛋白降解和游离氨基酸的相关性分析
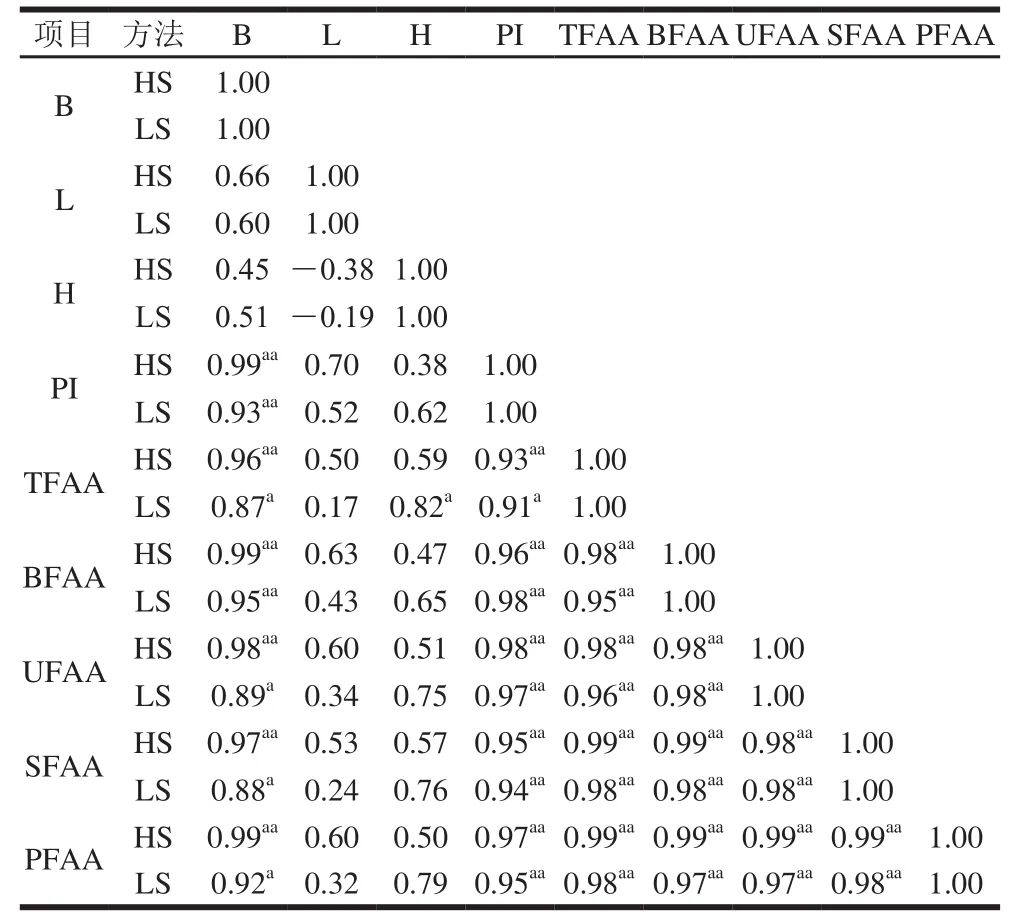
表2 蓝圆鰺腌干工艺加工过程中蛋白降解与组织蛋白酶活力之间的皮尔逊相关系数Table2 Pearson’s correlation coefficients between PI and cathepsin activities during dry-salted fish processing
将2 种蓝圆鰺腌干工艺加工过程中组织蛋白酶活力与PI值及游离氨基酸含量通过SPSS软件中的皮尔逊相关系数进行相关性分析,结果见表2。HS法中组织蛋白酶B与PI值、TFAA、BFAA、UFAA、SFAA、PFAA均呈现出正相关性,且相关性极显著(P<0.01),LS法中组织蛋白酶B与PI值呈现出极显著正相关性(P<0.01),TFAA、BFAA、UFAA、SFAA、PFAA均呈现出显著相关性(P<0.05),说明组织蛋白酶B在两种腌干工艺中均发挥较大作用。HS法和LS法中组织蛋白酶L、H与PI值、BFAA、UFAA、SFAA、PFAA均呈现出正相关性,但相关性均不显著(P>0.05);这说明腌干蓝圆鰺加工过程中组织蛋白酶L、H对蛋白降解的作用较小。组织蛋白酶L在LS法中与TFAA呈现出显著正相关性(P<0.05),但HS法中正相关性不显著(P>0.05),组织蛋白酶H对蛋白的降解作用为LS法>HS法,由此可推测在蓝圆鰺腌干过程组织蛋白酶B对蛋白降解及滋味物质的产生的作用大于组织蛋白酶L和H。
火腿加工过程中蛋白质水解产生的游离氨基酸和小分子多肽是其滋味物质的主要组成部分,多肽一般呈苦味,亲脂性残基增强其苦味感。部分游离氨基酸本身具有特殊滋味,另一部分能够通过降解反应或美拉德反应生成火腿的特殊风味物质,其中带侧链的化合物一般是由游离氨基酸参与形成[26]。赵改名等[27]发现火腿中组织蛋白酶发挥降解作用使得蛋白质降解形成多肽,多肽再通过一系列内源性酶类降解为游离氨基酸。Virgili等[28]发现Parma火腿加工过程中非蛋白氮含量与组织蛋白酶B活力相关性较大,且Garcia-Garrido等[29]在Spanish火腿加工中发现组织蛋白酶B+L与非蛋白氮含量具有较大相关性,非蛋白氮含量与PI值呈正相关性,Quali等[30]研究发现组织蛋白酶H对肌原纤维的降解作用非常有限。综合上述研究人员的研究结论及本实验中各酶与PI值及PFAA之间的关系推断组织蛋白酶B、L在腌干蓝圆鰺加工过程中蛋白降解的过程中发挥一定作用,其中组织蛋白酶B发挥主要作用。
3 结 论
2 种蓝圆鰺腌干工艺均利于组织蛋白酶B、L活力的提升,且组织蛋白酶B、L活力均在烘干末期达到最大值;整个加工过程组织蛋白酶H活力是LS法大于HS法,在腌制阶段组织蛋白酶H活力均显著下降(P<0.05),在脱盐和烘干阶段活力显著提高,但总体活力较鲜鱼中活力变化不显著(P>0.05)。TFAA、PFAA含量均在烘干阶段显著增加,成品中:PI值为HS法大于LS法,TFAA含量为HS法大于LS法;PFAA含量百分比为LS法大于HS法。LS法能够在减少PI值的同时提升制品中PFAA含量百分比,相对于HS法来说LS法更利于丰富制品中的滋味物质。HS法和LS法加工过程中:组织蛋白酶B活力较组织蛋白酶L活力稳定;在蛋白降解及游离氨基酸的生成过程中组织蛋白酶发挥的作用大小为组织蛋白酶B大于组织蛋白酶L,组织蛋白酶B对蛋白降解的作用是HS法大于LS法;组织蛋白酶H对制品中蛋白降解及游离氨基酸的生成的作用较小。
以上研究表明,可以从控制加工过程中内源性蛋白酶类活力入手改进传统腌干鱼加工工艺,通过适当方法控制组织蛋白酶B、L活力促进制品中PFAA含量百分比的增加,减少或者消除不适宜的产品风味。同时本研究发现虽然腌干鱼中的组织蛋白酶B在HS法中发挥的活力作用大于LS法,使得PI值LS法小于HS法,增加了HS法中TFAA含量,但PUFA含量百分比并未增加,因此LS法由于复合乳酸菌的发酵作用更利于腌干鱼营养价值的保存及滋味物质的形成。LS法更符合人们对于低盐食品的要求,此腌干工艺具有巨大的可开发空间,可以用于其他腌制肉制品中,以提升更多其他肉制品产品的风味和营养价值。
[1] MARTÍN L, CÓRDOBA J J, ANTEQUERA T, et al. Effects of salt and temperature on proteolysis during ripening of Iberian ham[J]. Meat Science, 1998, 49(2): 145-153. DOI:10.1016/S0309-1740(97)00129-0.
[2] MOLINA I, TOLDRA F. Detection of proteolytic activity in microorganisms isolated from dry-cured ham[J]. Journal of Food Science, 1992, 56(6): 1308-1310. DOI:10.1111/j.1365-2621.1992.tb 06843.x.
[3] STEFANO S, ALESSANDRO P, MAURIZIO M, et al. Oligopeptides and free amino acids in Parma hams of known cathepsin B activity[J].Food Chemistry, 2001, 75(3): 267-273. DOI:10.1016/S0308-81 46(01)00224-2.
[4] BUSCAILHON S, MONIN G, CORNET M, et al. Time-related changes in nitrogen fractions and free amino-acids of lean tissue of french dry-cured ham[J]. Meat Science, 1994, 37(3): 449-456.
[5] CARERI M, MANGIA A, BARBIERI G, et al. Sensory property relationships to chemical data of Italian-type dry-cured ham[J].Journal of Food Science, 1993, 58(5): 968-972. DOI:10.1111/j.1365-2621.1993.tb06090.x.
[6] TOLDRE F, CERVERO M C, PART C. Porcine aminopeptidase activity as affected by curing agents[J]. Journal of Food Science, 1993,58(4): 724-726. DOI:10.1111/j.1365-2621.1993.tb09344.x.
[7] SÁRRAGA C, GIL M, GARCÍA-REGUEIRO J A. Comparison of calpain and cathepsin (B, L and D) activities during dry-cured ham processing from heavy and light large white pigs[J]. Journal of the Science of Food and Agriculture, 1993, 62(1): 71-75. DOI:10.1002/jsfa.2740620110.
[8] MATILDE P, ROSER C M G, CARMEN S, et al. Development of cathepsin B, L and H activities and cystatin-like activity during two different manufacturing processes for Spanish dry-cured ham[J]. Food Chemistry, 1994, 49(1): 15-21.
[9] 高瑞昌, 苏丽, 黄星奕, 等. 腌干鲢鱼组织蛋白酶B、L活力变化的响应面法预测研究[J]. 食品科学, 2012, 33(17): 136-140.
[10] 任中阳, 吴燕燕, 李来好, 等. 腌干鱼制品热泵干燥工艺参数优化[J]. 南方水产科学, 2015, 11(1): 81-88. DOI:10.3969/j.issn.2095-0780.2015.01.012.
[11] 游刚, 吴燕燕, 李来好, 等. 添加复合乳酸菌再发酵对腌干鱼肉微生物、亚硝酸盐和亚硝胺的影响[J]. 南方水产科学, 2015, 11(4): 109-115. DOI:10.3969/j.issn.2095-0780.2015.04.016.
[12] THOMAS A R, GONDOZA H, HOFFMAN L C, et al. The roles of the proteasome, and cathepsins B, L, H and D, in ostrich meat tenderisation[J]. Meat Science, 2004, 67(1): 113-120.DOI:10.1016/j.meatsci.2003.10.001.
[13] ARANISHI F, HARA K, OSATOMI K, et al. Substrate specificity of carp Cyprinus carpio cathepsin H with methylcoumarylamide substrates[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 1997, 116B(2): 203-208.DOI:10.1016/S0305-0491(96)00249-0.
[14] 赵改名, 周光宏, 柳艳霞, 等. 肌肉非蛋白氮和游离氨基酸在金华火腿加工过程中的变化[J]. 食品科学, 2006, 27(2): 33-37.DOI:10.3321/j.issn:1002-6630.2006.02.001.
[15] 张会丽, 余翔, 张弘, 等. 鲈鱼风干成熟工艺及对蛋白质水解和感官品质影响[J]. 食品科学, 2010, 31(16): 47-51.
[16] 李敏. 腊鱼腌制过程中内源蛋白酶的变化及其对品质的影响[D].武汉: 华中农业大学, 2014.
[17] TOLDRÁ F, RICO E, FLORES J. Cathepsin B, D, H and L activities in the processing of dry-cured ham[J]. Journal of the Science of Food and Agriculture, 1993, 62(2): 157-161. DOI:10.1002/jsfa.2740620208.
[18] FLORES M, ARISTOY M C, ANTEQUERA T, et al. Effect of prefreezing hams on endogenous enzyme activity during the processing of Iberian dry-cured hams[J]. Meat Science, 2009, 82(2):241-246. DOI:10.1016/j.meatsci.2009.01.017.
[19] ZHAO G M, ZHOU G H, WANG Y L, et al. Time-related changes in cathepsin B and L activities during processing of Jinhua ham as a function of pH, salt and temperature[J]. Meat Science, 2005, 70(2):381-388. DOI:10.1016/j.meatsci.2005.02.004.
[20] 李树红. 鳞鱼背肌组织蛋白酶B、L的纯化鉴定及水解肌球蛋白的研究[D]. 北京: 中国农业大学, 2004.
[21] HANSEN-MLLER J, HINRICHSEN L. Evaluation of peptides generated in Italian-style dry-cured ham during processing[J].Journal of Agricultural and Food Chemistry, 1997, 45(8): 3123-3128.DOI:10.1021/jf960743x.
[22] TOLDRÁ F, FLORES M, SANZ Y. Dry-cared ham flavour-enzymatic generation and process influence[J]. Food Chemistry, 1997, 59(4):523-530. DOI:10.1016/S0308-8146(97)00013-7.
[23] GARCÍA I, DÍEZ V, ZUMALACÁRREGUI J M. Changes in nitrogen fractions and free amino acids during ripening of Spanish dried beef “cecina”[J]. Journal of Muscle Foods, 1998, 9(3): 257-266.DOI:10.1111/j.1745-4573.1998.tb00659.x.
[24] TOLDRÁ F, ARISTOY M C, FLORES M. Contribution of muscle aminopeptidases to flavor development in dry-cured ham[J]. Food Research International, 2000, 33(3): 181-185. DOI:10.1016/S0963-9 969(00)00032-6.
[25] VIRGILI R, SCHIVAZAPPA C, PAROLARI G, et al. Proteases in fresh pork muscle and their influence on bitter taste formation in drycured ham[J]. Journal of Food Biochemistry, 1998, 22(1): 53-63.DOI:10.1111/j.1745-4514.1998.tb00230.x.
[26] SABIO E, VIDAL-ARAGON M C, BERNALTE M J, et al. Volatile compounds present in six types of dry-cured ham from south European countries[J]. Food Chemistry, 1998, 61(4): 493-503. DOI:10.1016/S0308-8146(97)00079-4.
[27] 赵改名. 肌肉蛋白水解酶在金华火腿加工过程中作用的研究[D].南京: 南京农业大学, 2004.
[28] VIRGILI R, PAROLARI G, SCHIVAZAPPA C. Sensory and texture quality of dry-cured ham as affected by endogenous cathepsin b activity and muscle composition[J]. Journal of Food Science, 1995,60(6): 1183-1186. DOI:10.1111/j.1365-2621.1995.tb04551.x.
[29] GARCIA-GARRIDO J A, QUILES-ZAFRA R, TAPIADOR J, et al. Activity of cathepsin B, D, H and L in Spanish dry-cured ham of normal and defective texture[J]. Meat Science, 2000, 56(1): 1-6.DOI:10.1016/S0309-1740(00)00005-X.
[30] OUALI A, GARREL N, OBLED A, et al. Comparative action of cathepsins D, B, H, L and of a new lysosomal cysteine proteinase on rabbit myofibrils[J]. Meat Science, 1987, 19(2): 83-100.DOI:10.1016/0309-1740(87)90014-3.

