大承气汤对急性重症胰腺炎大鼠血清IL-6 sIL-2R诱导胰腺腺泡细胞凋亡的研究*
张明敏,杜建文(.贵阳中医学院,贵州贵阳55000;.贵阳中医学院第二附属医院急诊科,贵州贵阳 55000)
急性重症胰腺炎(SAP)起病迅速,发展快,并发症严重,预后不良,病死率高,近年来,相关文献报道其发病率为10%~30%[1-2]。一直以来,SAP均是急腹症领域研究的热点,对于SAP的发病原因也在不断探索中。本实验以中医基础理论为指导,对临床治疗SAP的经典方剂——大承气汤进行研究。大承气汤来自仲景的《伤寒论》,其组方(大黄、厚朴、枳实、芒硝)简单而精妙。本实验采用腹腔注射L-精氨酸方法造模,对造模成功的SD大鼠进行口腔灌胃大承气汤,股动脉采血并开腹取胰腺组织进行相关血清学及胰腺腺泡细胞凋亡分析,观察大鼠血清白细胞介素-6(IL-6)、可溶性白细胞介素-2受体(sIL-2R)水平变化对胰腺腺泡细胞凋亡的影响,探讨大承气汤治疗SAP的可能作用机制,特别是对胰腺腺泡细胞凋亡的作用,为临床用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 一般材料 采用成年SD大鼠66只,均为雌性,大鼠平均体重为(230±20)g,由四川大学华西医学中心实验动物中心供给。许可证号:scxk(川)2016-09。按照随机数字表法、完全随机分组法将66只大鼠分为空白组、模型组、大承气汤组,其中空白组6只,模型组和大承气汤组各30只。模型组及大承气汤组分别再按时间点 2、6、12、24、48 h 进行分组,每组 6 只。在造模成功后分别将模型组和大承气汤组大鼠按照对应时间点处死并进行分批股动脉取血及手术取胰腺组织。空白组大鼠于腹腔注射生理盐水后3 h采样,模型组造模成功后不再灌胃大承气汤。
1.1.2 试剂及仪器 主要试剂:L-精氨酸(索莱宝公司);生理盐水(科伦药业股份有限公司);大承气汤(北京同仁堂)。中药煎药机(恒延鑫密闭压榨煎药机)由贵阳中医学院第二附属医院提供;12号灌胃针头;主要酶联免疫吸附试验(ELISA)试剂盒:IL-6、sIL-2R由伊来瑞特生物科技有限公司提供,产品编号:E-EL-R0015c。凋亡试剂盒(美国BD公司,货号:551302,规格:MITOSCREEN JC-1 KIT 100TST)由成都百态生物科技有限公司提供。流式细胞仪由贵阳中医学院第一附属医院实验室研究平台提供(药物临床试验机构)。
1.2 方法
1.2.1 动物模型建立 动物适应性喂养不禁食、禁饮5 d后,进行实验造模,空白组6只大鼠不做处理,造模前24 h禁食、禁饮。模型组及大承气汤组分别进行SAP造模,采用腹腔注射L-精氨酸方法进行造模,用生理盐水配置,pH值为7.0腹腔注射制作大鼠SAP模型,采用1.148 mmol/L(10%)L-精氨酸溶液,每次 3.0 mg/g,1 h 后重复注射1次,3 h后即为造模成功[3]。模型组与大承气汤组造模方法相同。空白组:采用等量生理盐水腹腔注射。
1.2.2 给药方法及试剂 药物:(1)方剂采用《方剂学》5版教材剂量。大承气汤:大黄12 g,芒硝9 g,枳实12 g,厚朴15 g。(2)大承气汤煎剂制作:先将中药用清水浸泡 2 h,再用煎药机煎 2 h,煎成每剂 200 mL。(3)大承气汤组所有大鼠均采用口腔灌胃的方法给药,于造模成功后3 h灌胃,采用12号灌胃针头及中药浓度为43.2%的大承气汤溶液(剂量按人与大鼠体表面积换算,即100 mL 溶液中含大承气汤 43.2 g)灌胃(1 mL/200 g)[4]。(4)模型组采用等量生理盐水灌胃。各组SD大鼠灌胃每次均 12 h,在 2、6、12、24、48 h 分批处死 6 只 SD 大鼠并采集血清及胰腺组织。
1.2.3 标本采集 空白组大鼠于腹腔注射生理盐水后3 h采样,模型组及大承气汤组大鼠于造模成功后2、6、12、24、48 h采样。采样方法:断头处死后,股动脉取血及时进行离心、分离,取上层血清,并立即于-80℃低温冰箱保存血清,以便检测IL-6、sIL-2R水平;立即开腹取出胰腺组织,将取出的胰腺组织立即保存于液氮中,以便进行细胞悬液制备,检测胰腺腺泡细胞凋亡率。
1.2.4 血清IL-6、sIL-2R水平测定 依据大鼠的标记号及相应分组,对分离所得血清采用ELISA检测IL-6、sIL-2R水平,检测方法严格按照试剂盒说明书进行。
1.2.5 胰腺腺泡细胞凋亡检测 将液氮保存的胰腺组织用眼科剪将组织细胞分离,进行细胞悬液的制备。采用Annexin V法检测细胞凋亡率,凋亡的胰腺腺泡细胞定量用BD凋亡细胞试剂盒检测,且严格按BD公司凋亡试剂盒说明书进行。将Annexin-V进行荧光素藻红蛋白(PE)标记,以标记了Annexin-V作为荧光探针,使用流式细胞仪检测细胞凋亡发生情况。
1.3 统计学处理 应用SPSS17.0统计软件进行数据分析,计量资料以x±s表示,各组间同一指标比较采用单因素ANOVA方差分析,同组内同一指标治疗前后变化比较采用自身配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组各时间点血清IL-6、sIL-2R水平比较 大承气汤组及模型组大鼠组内2、6 h的血清IL-6、sIL-2R水平比较,差异均无统计学意义(P>0.05),但2 h与12、24、48 h时的血清IL-6、sIL-2R水平比较,差异均有统计学意义(P<0.05)。大承气汤组大鼠2、6 h时的血清IL-6、sIL-2R水平与模型组比较,差异均无统计学意义(P>0.05),大承气汤组48 h IL-6水平明显低于模型组,12、24 h IL-6水平均明显高于模型组,差异均有统计学意义(P<0.05),大承气汤组 24、48 h sIL-2R 水平均明显低于模型组,12 h sIL-2R水平明显高于模型组,差异均有统计学意义(P<0.05)。见表 1。
2.2 各组胰腺腺泡细胞凋亡率比较 经检测,空白组及模型组大鼠的胰腺腺泡细胞凋亡率较低,大承气汤组大鼠 2、6、12、24、48 h 的胰腺腺泡细胞凋亡率均显著高于模型组,差异均有统计学意义(P<0.05);模型组组内各时间点的细胞凋亡率比较,差异均无统计学意义(P>0.05);大承气汤组组内各时间点的细胞凋亡率比较,差异均有统计学意义(P<0.05)。见表 2。
表1 各组各时间点IL-6、sIL-2R水平比较(±s,pg/mL)
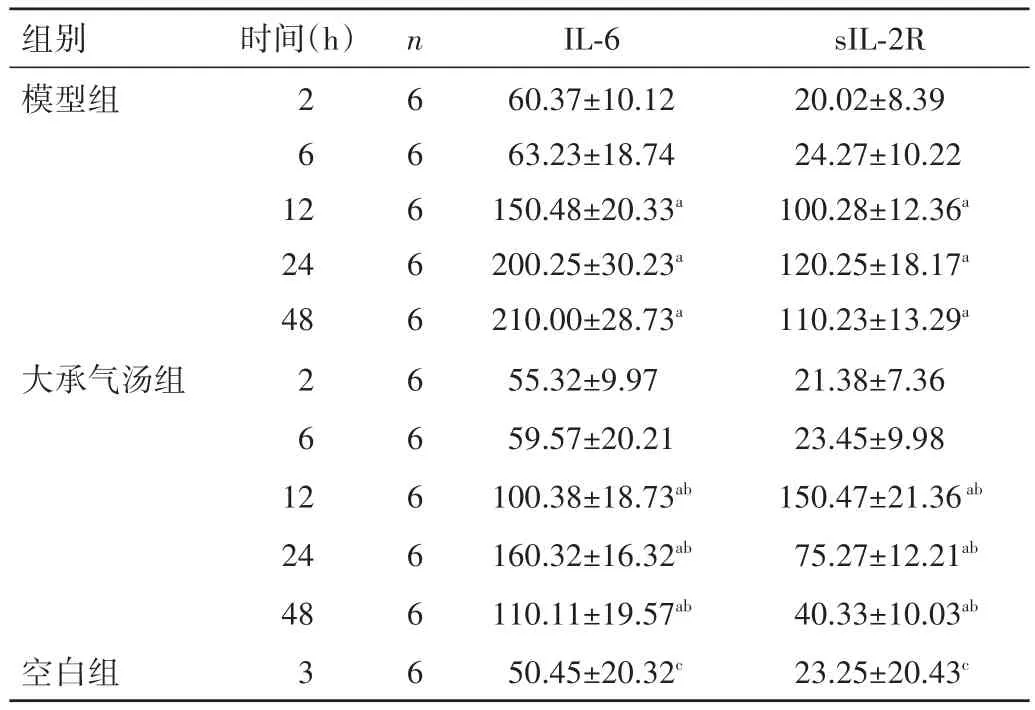
表1 各组各时间点IL-6、sIL-2R水平比较(±s,pg/mL)
注:与同组 2 h 比较,aP<0.05;与模型组同时间点比较,bP<0.05;与模型组及大承气汤组比较,cP<0.05
sIL-2R 20.02±8.39 24.27±10.22 100.28±12.36a 120.25±18.17a 110.23±13.29a 21.38±7.36 23.45±9.98 150.47±21.36ab 75.27±12.21ab 40.33±10.03ab 23.25±20.43c组别模型组时间(h)2 6 1 2 24 48大承气汤组2 6 1 2空白组24 48 3 n 6 6 6 6 6 6 6 6 6 6 6 IL-6 60.37±10.12 63.23±18.74 150.48±20.33a 200.25±30.23a 210.00±28.73a 55.32±9.97 59.57±20.21 100.38±18.73ab 160.32±16.32ab 110.11±19.57ab 50.45±20.32c
表2 各组胰腺腺泡细胞凋亡率比较(±s)
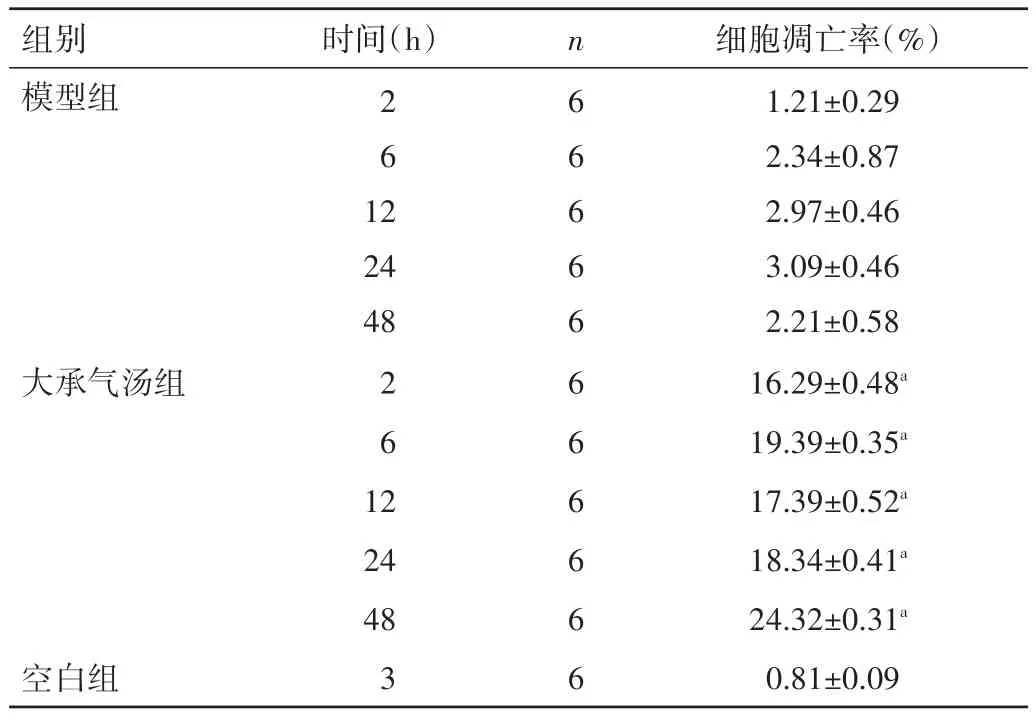
表2 各组胰腺腺泡细胞凋亡率比较(±s)
注:与模型组同时间点比较,aP<0.05
组别模型组24 48时间(h)2 6 1 2大承气汤组2 6 1 2空白组细胞凋亡率(%)1.21±0.29 2.34±0.87 2.97±0.46 3.09±0.46 2.21±0.58 16.29±0.48a 19.39±0.35a 17.39±0.52a 18.34±0.41a 24.32±0.31a 0.81±0.09 24 48 3 n 6 6 6 6 6 6 6 6 6 6 6
3 讨 论
有研究证实,SAP的发生与肠道细菌移位有着密切的关系,SAP患者的肠黏膜屏障受到破坏,大量体液会丢失,从而导致肠道缺血、缺氧[5-6]。同时胃肠道功能减弱,肠道细菌移位导致内毒素产生,进而体内炎症介质被激活;胰腺细胞的坏死、溶解,细胞坏死增加而细胞凋亡减少[7]。IL-6是重要的促炎性细胞因子之一,能直接激活炎症细胞,催化和放大炎性反应,并能损伤血管内皮细胞,与SAP病情严重程度呈正相关[8];sIL-2R是一种重要的免疫抑制剂,可中和、活化T细胞周围的IL-2,减弱机体的内分泌效应,抑制已活化的T细胞的克隆化扩增。同样与SAP病情严重程度呈正相关。
本研究发现,SAP大鼠血清IL-6、sIL-2R水平的变化和胰腺细胞凋亡之间存在着线性关系。造模成功后,模型组及大承气汤组大鼠的血清IL-6、sIL-2R水平在2、6、12、24、48 h 各时间点均有不同程度的升高,具体为模型组IL-6水平在造模后6 h开始上升,在48 h达到峰值;sIL-2R在造模后6 h开始上升,在24 h达到峰值。大承气汤组IL-6水平在造模后6 h开始升高,24 h达到峰值,随后下降,sIL-2R水平在造模后6 h开始升高,12 h达到峰值,随后下降,但模型组峰值明显高于大承气汤组。大承气汤组的峰值提前出现,并且峰值水平下降,这表明大承气汤发挥了减少T细胞及巨噬细胞等炎症细胞炎症介质的释放,阻断了炎症介质引起的“瀑布”式反应,起到了治疗效果。有研究表明,IL-6能够降低肝脏对于细胞内毒素的清理,使炎症致病因子进入血液循环,从而加快其他脏器的损害,加重SAP的病情[9]。在相对应的时间点胰腺腺泡细胞凋亡率水平来看,模型组各时间点的细胞凋亡率均低于大承气汤组,差异均有统计学意义(P<0.05),说明大承气汤可以通过拮抗炎性因子的释放,减轻周围组织炎性反应,并提高胰腺腺泡细胞凋亡率,凋亡的细胞可以将细胞内的酶原释放到细胞外,从而减轻组织周围的炎性反应[10],达到减轻SAP症状的目的。
祖国医学虽然没有明确的急性胰腺炎病名,但从急性胰腺炎的症状和体征上来讲,当归属于“胃脘痛”范畴。唐喜玉等[11]指出,急性胰腺炎是由于各种病因导致胰腺组织所分泌的消化酶在胰腺内被激活,从而对胰腺自身组织进行消化的胰腺急性化学性炎症,属中医学“里证”“实证”“热证”,治宜通腑泄热、活血化瘀、行气止痛。其代表方剂——大承气汤是《伤寒论》的经典方剂,针对SAP腹满胀痛,大便不通,集合中医“通则不痛”的理论,具有通里攻下、清热解毒、泻下逐满的功效。大承气汤组方(大黄、厚朴、枳实、芒硝)简单,但其实际临床使用方便,效果较好,绝大部分患者在西医治疗的基础上运用大承气汤后,起到了增效的作用。为探求其有效成分,有研究发现,大承气汤中大黄等可以消食导滞,通里攻下,清除肠道内的细菌和内毒素,具有保护和恢复肠道黏膜的屏障作用,减少SAP休克的发生率并能够缩短病程[12]。早期运用大承气汤可以改善肠道功能,抑制细菌移位,加快SAP的恢复[13]。大黄能有效促进胃肠功能恢复,增加肠蠕动及肠张力,避免胰腺和全身的继发感染,有效改善SAP患者因肠功能衰竭导致的细菌移位,同时抑制胰蛋白酶、胰脂肪酶和胰淀粉酶,防止胰酶引起胰腺组织自身消化[14]。枳实、厚朴行气活血止痛,具有抗菌、抗病毒、清除内毒素及炎性因子作用,刺激消化道黏膜,引起反射性兴奋,增加小肠蠕动,调整胃肠功能,促进胃排空以减轻腹胀;芒硝清热泻下,可清除肠道燥热实积,减少胃肠道压力,与大黄协同达到通腑泄浊的功效[15],提高机体的免疫力。但大承气汤治疗SAP的确切机制还有待广大学者进一步研究及阐明,本实验仅对IL-6、sIL-2R及细胞凋亡率进行了探索,在临床上起到了佐证大承气汤治疗SAP有效的结果。作者认为,在临床上加用大承气汤治疗SAP较单纯西医治疗所取得的效果更加显著。
[1]中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].胰腺病学,2005,24(3):190-192.
[2]董涛,栾春艳,金伟,等.简易腹腔灌洗联合早期血液滤过治疗重症急性胰腺炎[J].中华胰腺病杂志,2011,11(1):8-10.
[3]刘君君,陈垦,龙友明,等.L-精氨酸诱导大鼠急性坏死性胰腺炎模型的建立[J].中国药理学通报,2009,25(10):1392-1394.
[4]吕冠华,王长洪,王立新,等.大承气汤对重症急性胰腺炎大鼠细胞因子及外周血γδT细胞的影响[J].中国中西医结合消化杂志,2008,16(6):355-358.
[5]梁兴梅,田旭,傅思武.肠道细菌移位的研究进展[J].中国微生态学杂志,2012,24(5):470-471.
[6]赵宏贤,杨晓红,李昌平,等.重症急性胰腺炎对大鼠小肠平滑肌细胞凋亡的影响[J].世界华人消化杂志,2014,22(28):4231-4236.
[7]林旭红,李永渝.急性胰腺炎发病机制及相关治疗的研究进展[J].中国病理生理杂志,2010,26(5):1029-1032.
[8]YAGCI G,GUL H,SIMSEK A,et al.Beneficial effects of N-acetylcysteine on Sodium taurocholate-induced pancreatitis in rats[J].J Gastroenterol,2004,39(3):268-276.
[9]王晶,孟宪梅,任丽梅.IL-6在急性胰腺炎中与肝功能损害的关系[J].中国现代医生,2013,51(34):150-151.
[10]SALUJA A,HOFBAUER B,YAMAGUCHI Y,et al.Induction of apoptosis reduces the severity of caerulein-induced pancreatitis in mice[J].Biochem Biophys Res Commun,1996,220(3):875-878.
[11]唐喜玉,查景园,许奎,等.急性胰腺炎早期中药干预治疗的时机选择探讨[J].中医药临床杂志,2013,25(7):588-590.
[12]钦丹萍,魏霞,方国栋,等.全程应用大承气汤加味方对重症急性胰腺炎模型大鼠肠黏膜屏障的影响[J].中国中西医结合杂志,2015,35(12):1482-1489.
[13]魏霞,钦丹萍,赖登攀,等.大承气汤加味方对重症急性胰腺炎大鼠肠功能衰竭的干预作用[J].中医杂志,2013,54(16):1407-1411.
[14]潘杰锋,张剑杰,方剑俊.中药三联疗法治疗重症急性胰腺炎32例[J].中国药业,2010,19(22):86-87.
[15]孙运萍.大承气汤对重症急性胰腺炎细胞因子TNF-α、IL-6、IL-8、PAF 的影响[J].实用中西医结合临床,2009,9(1):1-4.

