不同品质浓香型窖泥的酶活与微生物群落的相关性
吴树坤,刘梅,邓杰,卫春会,黄治国
(四川理工学院,酿酒生物技术及应用四川省重点实验室,四川 自贡,643000)
窖池作为中国白酒的发酵场所,窖泥的品质尤为重要,直接关乎着白酒的质量。窖泥中微生物对酒质的影响是通过多种酶促反应实现的,分析窖泥酶活性是鉴定窖泥质量的一个重要方面[1]。窖泥微生物群落经长期的富集与驯化并改善着窖泥的品质,由于用理化指标来反映窖泥的品质具有一定的局限性,而窖泥中的酶是由窖泥微生物代谢释放于窖泥中,因此用窖泥的酶活指标反映窖泥菌群结构从而表征窖泥质量能很好地弥补前者的不足。但目前对窖泥中酶的相关报道还较少,且单个样品研究的酶种类少。土壤是制作窖泥的主要原料,因此窖泥中酶的研究主要参考土壤学中酶的研究方法。本项目以不同品质的浓香型窖泥为样品,应用高通量测序技术研究窖泥中微生物群落的多样性,并分析测定了5种对白酒酿造具有重要作用酶系的活力,再利用SPSS软件和Mothur软件将不同品质窖泥的微生物多样性与窖泥酶活进行相关性分析以得到其规律。
1 材料与方法
1.1 材料
1.1.1 实验材料
窖泥样品,四川地区某浓香型白酒厂生产窖池,且窖池连续生产使用在5年以上,根据酒厂常年的生产情况,将全厂窖池分为一等、二等、三等3个质量等级进行取样。取样部位为每口窖池窖底中心部位,相同品质的窖泥样品取3个平行样,并按照窖泥等级由高到低的顺序依次进行1~9编号。取回的窖泥样品分成两部分保藏,一部分用于测定酶活,4 ℃冷藏;另一部分用于提取DNA,-20 ℃冷冻保存。
1.1.2 主要试剂
苯酚、甲醇、次氯酸钠、尿素、硫酸铵、甘氨酸、茚三酮、酪素、无水乙醇、磷酸苯二钠(分析纯,成都科龙化工),氯代二溴对苯醌亚胺(分析纯,贝斯特试剂),甲苯、高锰酸钾、过氧化氢、三羟甲基氨基甲烷、连二亚硫酸钠(分析纯,中国医药集团),亚硫酸钠、氯化三苯基四氮唑、甲醛(分析纯,重庆川东化工集团)。DNA提取纯化试剂:PowerSoil DNA Isolation Kit(MOBIO,美国),Gel Extraction Kit(康为世纪,中国),Quant-iT PicoGreen DNA Kit(Invitrogen,美国);PCR试剂:buffer、MgCl2、EXTaq酶、dNTPs、DNA Marker(Takara,日本),正反向引物(上海生工,中国);高通量测序试剂由美国Roche公司提供。
1.1.3 主要仪器
高速低温离心机(Thermo,美国),酶标仪(Thermo,美国),高速离心机(Eppendorf,德国),电泳仪(Bio-rad,美国),均质机(SCILOGEX,美国),荧光分光光度计(Promaga,美国),高通量测序仪(Roche,美国)。
1.2 实验方法
1.2.1 窖泥酶活测定方法
采用靛酚比色法测定脲酶活性[2];采用茚三酮比色法测定酸性蛋白酶活性[3];采用磷酸苯二钠比色法测定窖泥中酸性磷酸酶活性[4];采用高锰酸钾滴定法测定窖泥中过氧化氢酶活性;采用TTC(氯化三苯基四氮唑)法测定窖泥中脱氢酶酶活[5]。
1.2.2 微生物群落结构检测方法
1.2.2.1 窖泥总DNA的提取
窖泥中的腐殖酸是干扰DNA提取及后续PCR扩增反应的主要因素,因此采用MOBIO公司PowerSoil DNA Isolation Kit提取窖泥微生物总DNA,提取后的DNA样品取5 μL于1%的琼脂糖凝胶电泳检测其完整性。DNA样品于-20 ℃保存。
1.2.2.2 窖泥DNA PCR扩增
选用通用引物968F-1401R。PCR反应体系为25 μL,体系包括:2.5 μL 10×Buffer,2 μL 25 mmol/L dNTP,2 μL MgCl2,正反向引物10 μmol/L各0.5μL,0.5 μL 5 U/μL的EXTaq酶,DNA模板用量为0.3 μL(原液DNA稀释 20倍),最后用双蒸水补充至25 μL。反应程序为:94 ℃ 3 min;30个循环:94 ℃ 15 s,56 ℃ 30 s,72 ℃ 90 s;72 ℃ 10 min。对扩增后DNA进行琼脂糖凝胶电泳,检测有无PCR产物。
1.2.2.3 PCR扩增产物纯化及定量
采用康为世纪Gel Extraction Kit对PCR扩增目的产物进行回收纯化以除去引物二聚体,回收后取5 μL产物用1%琼脂糖凝胶电泳检测。经纯化后的产物浓度是否满足测序要求,测序前需采用Quant-iT PicoGreen Kit对纯化后对PCR产物进行定量。
1.2.2.4 高通量测序
由于涉及对微生物群落定量分析,因此测序前需对DNA样品进行均一化;微乳滴PCR使DNA在独立反应空间进行扩增,以降低外界条件的干扰。emPCR反应条件为:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 4.5 min,68 ℃ 30 s,反应循环50次;10 ℃保温;将emPCR扩增产物从微乳滴中分离出来,将准备好的PicoTiterPlate反应板装入高通量测序仪进行测序。
1.3 数据分析
酶活指标的测定结果用x±Sd表示。高通量测序数据分析:利用Mothur软件对测序数据进行总体分析后,再用测序序列与Silva数据库进行比对,获得OTU(Operational Taxonomic Units)分类,确定序列对应微生物的分类学地位。利用SPSS 20软件对窖泥酶活数据进行方差分析,并将其和微生物群落结构进行相关性分析。
2 结果分析与讨论
2.1 窖泥酶活测定结果与分析
本试验研究了脲酶、蛋白酶、酸性磷酸酶、过氧化氢酶、脱氢酶的活性。结果发现:不同品质的窖泥各酶活指标呈现不同趋势和差异。如图1所示,不同等级窖泥的脲酶活性差异显著(p<0.05),随窖泥品质的提升而呈现出降低的趋势。一级窖泥的脲酶平均活性分别比二级和三级窖泥低50.0%和77.0%,这表明品质越好的窖泥,尿素越不易被催化分解,而尿素作为有机氮源可能有利于某些窖泥微生物的生长代谢。蛋白酶、酸性磷酸酶、过氧化氢酶的酶活随窖泥品质的提升而升高。
图1 脲酶测定结果Fig.1 Result of urease determination 注:不同字母表示差异显著(p<0.05)图2~图5与此相同。
如图2所示,一级品质窖泥中蛋白酶酶活显著高于另外两个等级的窖泥,其中一级窖泥蛋白酶酶活比二级窖泥高61.8%,二级窖泥蛋白酶活性比三级窖泥高70%。品质越好的窖泥蛋白酶酶活越高,可能意味着窖泥微生物能有更多的由蛋白质分解带来的营养物质。

图2 蛋白酶测定结果Fig.2 Result of protease determination
如图3所示,一、二级窖泥中的酸性磷酸酶酶活显著(p<0.05)高于三级窖泥。一级窖泥酸性磷酸酶酶活分别比二级窖泥、三级窖泥高35.5%和250.0%。

图3 酸性磷酸酶测定结果Fig.3 Result of acid phosphatase determination
如图4所示,一级窖泥过氧化氢酶酶活分别比二级窖泥、三级窖泥高93.8%和689.3%,过氧化氢酶酶活随窖泥品质的升高而呈现出上升趋势。有研究表明[6],过氧化氢酶的活性与pH密切相关,pH值越接近中性,过氧化氢酶活性越高,而一级窖泥的过氧化氢酶酶活高是否是由于窖泥pH更接近中性,需进一步验证。
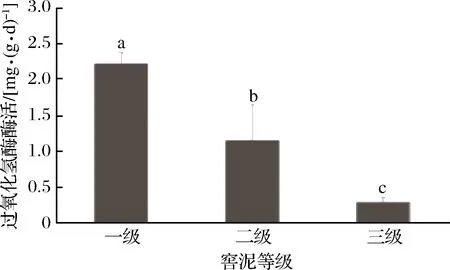
图4 过氧化氢酶测定结果Fig.4 Result of catalase determination
如图5所示,一级窖泥中脱氢酶活与二、三级窖泥差异显著(p<0.05),且酶活明显低于其他两种品质的窖泥,表明其氧化还原反应的强度明显较弱。一级窖泥脱氢酶酶活分别比二、三级窖泥低80.5%和80.9%。白酒发酵的过程,特别是产香阶段,是一个缓慢的过程,而王秀菊[7]认为脱氢酶活性高低与有机质降解速率呈正相关,表明优质窖泥脱氢酶活性上的特点较一般窖泥而言可能更有利于香气成分的生成。

图5 脱氢酶测定结果Fig.5 Result of dehydrogenase determination
2.2 微生物群落结构检测结果
2.2.1 窖泥总DNA提取及PCR扩增结果
MIBIO公司的PowerSoil DNA Isolation Kit能有效除去窖泥中的腐殖酸和蛋白质等杂质,获得纯度较高的DNA。所得窖泥总DNA均采用1 %的琼脂糖凝胶电泳检测,结果如图6所示。使用2%的琼脂糖凝胶获取PCR扩增产物,以便后续纯化。PCR扩增结果如图7所示。纯化后的DNA使用1%的琼脂糖凝胶电泳进行检测,结果如图8所示。

图6 窖泥总DNA电泳图Fig.6 Electrophoretogram of total DNA samples

图7 窖泥DNA PCR扩增电泳图Fig.7 Electrophoretogram of PCR products

图8 纯化后PCR扩增产物电泳图Fig.8 Electrophoretogram of purified PCR products
2.2.2 窖泥微生物群落多样性分析
2.2.2.1 窖泥样品中细菌OTU分类
通过Mothur软件对测序数据处理,在基于3%的非相似度条件下,一共分成了2 050个可操作分类单元(OTU)分类。8号样品的测序序列数在2 000条左右。5号样品的测序序列最多,超过了5 200条。窖泥样品的OTU数量方面,一级窖泥样品1、2、3号OTU数分别是249、297、492个;二级窖泥样品4、5、6号OTU数分别是195、61、305个;三级窖泥样品7、8、9号OTU数分别是178、63、210个。其中一级窖泥获得的OTU数占总OTU数的50.6%,其中二级窖泥的OTU数占总OTU数的27.4%,三级窖泥的OTU数占总OTU数的22.0%。不难发现,窖泥中细菌OTU数随着窖泥品质的提升而呈现出上升趋势。
2.2.2.2 窖泥中细菌门的分类
将窖泥样品的OTU用Mothur软件进一步分析处理,获得微生物不同的门分类。如图9所示,在9个窖泥样品中一共划分出了9个门,分别是Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Chlorflexi(绿弯菌门)、Synergistetes(互养菌门)、Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Tenericutes(无壁菌门)、Spirochaetes(螺旋体门)、Lebtisphaeria。这几个门中既有厌氧菌,又有好氧菌,也有兼性厌氧菌,说明白酒发酵并不是处在一个单一的严格厌氧环境中。

图9 不同品质窖泥微生物群落门分类Fig.9 Phylum of microbial community in pit mud of different qualities
在所有对比出的细菌序列中(除去unclassified)可以发现,每个窖泥样品细菌群落中,占主导地位的都是Firmicutes(厚壁菌门),这类菌具有细胞壁结构,并且大多数能够产生内生孢子抵抗极端环境。其中一级窖泥样品(1、2、3号)厚壁菌门占50%~55%,二级窖泥样品(4、6号)厚壁菌门占41%~43%,三级窖泥样品(7、9号)厚壁菌门占21%~31%。可见,随着窖泥品质的提升,厚壁菌门所占比例也有所增大。而拟杆菌门、无壁菌门和螺旋体门所占比例随着窖泥品质的提升有一定程度减少。绿弯菌门是一类通过光合作用产生能量的细菌,是兼性厌氧微生物。在一级窖泥中未发现有绿弯菌门的存在,而在二、三级窖泥中绿弯菌门约占2%~3%。互养菌门有降解氨基酸能力,部分为专性厌氧,且能耐60 ℃的高温[8]。互养菌门在一级窖泥中所占比例为4%~6%,比二、三级窖泥高许多,这与优质窖泥能促进提高酒质是相对应的。变形菌门是细菌中最大的一门,大多数具有固氮能力,兼性或专性厌氧,也包括很多病原菌。其在品质较低的窖泥中变形菌门所占比例较高。放线菌门大多数为好氧,在不同品质窖泥中所占比例差异较大,尤其在一级窖泥中的比例颇高。Lebtisphaeria在不同品质窖泥中所占比例比较一致,都在1%左右。
2.2.2.3 窖泥中细菌属的分类
在获得窖泥中细菌门的分类基础上,进一步对窖泥中细菌进行属的分类。如图10所示,9个窖泥样品中一共获得39个属。利用SPSS软件对窖泥样品的菌属进行主成分分析,提取出对窖泥品质划分有较大影响的菌属,对其随窖泥品质的变化情况进行研究分析。

图10 不同品质窖泥微生物群落属分类Fig.10 Genus of microbial community in pit mud of different qualities
选取特征值大于5的成分,如表1所示,成分1、成分2、成分3、成分4特征值分别为10.414、10.094、7.634、5.446,累积贡献达到83.97%,说明成分划分合理。如图11所示,散点图中窖泥样品1、2、3号,4、6号,7、9号分别聚为一组,基本按窖泥品质一级、二级、三级划分,5、8号窖泥样品聚为一组原因是测序序列都较少,微生物覆盖率较低的缘故。因此按照成分1和成分2对窖泥中细菌的属进行分析。成分1中,载荷值较高的细菌属为Sporobacter、Coriobacterineae、Clostridium、Cellulomonadaceae、Sedimenlibacter、Aminobacterium、Corynebacterineae、Sporosarcina,载荷值分别为0.974、0.924、0.919、0.913、0.856、0.855、0.814、-0.808。成分2中,载荷值较高的细菌属为Mollicutes、Dehalobacter、Acetobacter、Syntronhus、Psychrobacter,载荷值分别为0.970、0.970、0.970、0.970、0.881。
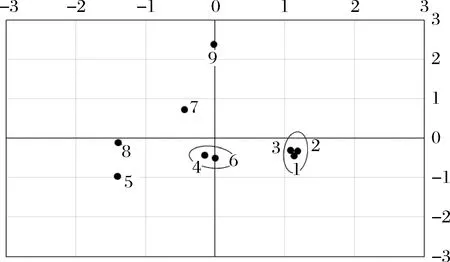
图11 按成分1和成分2划分的窖泥样品分布图Fig.11 Distribution map of pit mud samples according to PCA
各个菌属在不同品质窖泥中的分布有以下特点。从成分1看:Sporobacter、Coriobacterineae、Clostridium、Cellulomonadaceae、Sedimenlibacter、Aminobacterium、Corynebacterineae在窖泥中所占比例与窖泥品质呈现出一定的正相关关系。由于Sporobacter能在厌氧条件下代谢产生有机酸和芳香族化合物[9-10];Clostridium(梭菌属)是一类严格厌氧菌,能在发酵过程中代谢产生有机酸和醇类[11];Cellulomonadaceae(纤维素单胞菌)能够产生纤维素酶[12],能够提高酿酒原料的利用率;Aminobacterium(氨基杆菌属)能够在厌氧条件下降解氨基酸[13];故品质越高的窖泥越有利于白酒发酵过程,提高酒质。而Sporosarcina在窖泥中所占比例却与窖泥品质呈现出一定的负相关关系。成分2看:Mollicutes(柔膜菌属)、Dehalobacter(脱卤素杆菌属)、Acetobacter(醋酸杆菌属)、Syntronhus、Psychrobacter(嗜冷菌属)几类菌都只在三级窖泥中发现有一定比例的分布,而在一、二级窖泥中均未检测出。

表1 细菌的主成分特征值
2.3 窖泥酶活与微生物群落的相关性分析
窖泥微生物群落与酶活性相关性分析结果如表2所示,放线菌门、变形菌门、互养菌门、厚壁菌门、绿弯菌门与窖泥中酶活性关系较为密切。说明这些菌门更多地参与了窖池中的生化反应。厚壁菌门分别与蛋白酶、酸性磷酸酶的活性呈显著正相关。绿弯菌门与脱氢酶活性呈显著正相关(p<0.05),互养菌门分别与蛋白酶活性和过氧化氢酶活性呈显著正相关(p<0.05),与脱氢酶活性呈显著负相关(p<0.05)。变形菌门分别与蛋白酶活、磷酸酶性呈显著负相关(p<0.05)。放线菌分别与蛋白酶和过氧化氢酶的活性呈极显著正相关(p<0.01),与酸性磷酸酶呈显著正相关(p<0.05),与脱氢酶呈极显著负相关(p<0.01)。窖泥中微生物和脲酶活性的相关性都没有达到显著水平(p>0.05)。

表2 窖泥微生物群落与酶活相关性分析
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
脲酶是土壤中重要的酶类,分解尿素为微生物提供氮源,而相关性分析结果表明窖泥中微生物氮源来自于蛋白酶作用。窖泥原料虽来源于土壤,但经过酿酒环境的长时间驯化,窖泥中微生物的群落结构和生理活动特点相对于土壤中的微生物已经发生了一定的变化。窖泥品质的优劣主要是因为窖泥中微生物群落结构的差异,进而表现出不同的酶活力。通过进行相关性分析,得到不同酶的活力与微生物群落的相关性,在一定程度上能反映出窖泥酶活与微生物群落之间的关系进而表征窖泥的品质。故本研究对于更深入地进行窖泥品质的划分与评定具有一定的意义。
3 小结
本试验通过测定不同品质窖泥的酶活,了解了蛋白酶、酸性磷酸酶等酶在不同品质窖泥中酶活力的变化趋势;利用高通量测序技术对不同品质窖泥的微生物群落进行研究,表明了不同品质窖泥中细菌种类的多样性及其规律性。通过对窖泥酶活指标与微生物群落结构的相关性分析,发现窖泥微生物群落结构与蛋白酶、酸性磷酸酶、过氧化氢酶、脱氢酶活性的相关性达到了显著或者极显著的水平。由此可以得出,不同品质窖泥的酶活力和微生物群落结构都呈现一定的规律性,窖泥的酶活可作为反映窖泥品质的指标以做深入研究。
[1] 张强,沈才洪,刘清斌,等.窖泥质量评价研究进展[J].酿酒科技,2013(7):84-86.
[2] 黄娟,李稹,张健.改良靛酚蓝比色法测土壤脲酶活性[J].土木建筑与环境工程,2012,34(1):106-111.
[3] 蔡红,沈仁芳.改良茚三酮比色法测定土壤蛋白酶活性的研究[J].土壤学报,2005,42(2):131-138.
[4] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986:376.
[5] 戴濡伊,吴季荣,徐剑宏,等.小麦根际土壤脱氢酶活性测定方法的改进[J].江苏农业学报,2013,29(4):88-92.
[6] 朱铭莪,白红英,代伟.陕西几种土壤过氧化氢酶的动力学和热力学特征[J].西北农林科技大学学报,1989(1):20-26.
[7] 王秀菊.脱氢酶与产氢微生物之间关系的研究[D].昆明:云南师范大学,2007.
[8] 黄晓艳.高含固率高氮污泥厌氧消化工艺的研究[D].青岛:中国海洋大学,2014.
[9] JEONG H, LIM Y W, YI H, et al.Anaerosporobactermobilisgen. nov. sp. nov. isolated from forest soil[J]. International Journal of Systematic & Evolutionary Microbiology, 2007, 57(8):1 784-1 787.
[10] GRECHMORA I, FARDEAU M L, PATEL B K C, et al. Isolation and characterization ofSporobactertermitidisgen. nov. sp. nov. from the digestive tract of the wood-feeding termiteNasutitermeslujae[J]. International Journal of Systematic Bacteriology, 1996, 46(2):512-518.
[11] 张善亭,史燕,张淑丽,等.丁酸梭菌的研究应用进展[J].生物技术通报,2013(9):27-33.
[12] 郭爱莲,杨琳,刘梅,等.产黄纤维单胞菌纤维素酶的培养条件[J].西北大学学报,1999,29(6):575-577.
[13] BAENA S, FARDEAU M L, LABAT M, et al.Aminobacteriummobilesp. nov. a new anaerobic amino-acid-degrading bacterium[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50(1):259-264.

