添加普鲁兰酶对啤酒酵母生长的影响
汪裕强
(黔南州食品药品检验所,贵州都匀 558000)
普鲁兰酶能够专一性切开α-1,6糖苷键并形成直链淀粉[1-2],该酶符合联合国粮农组织和世界卫生组织要求的食品级酶制[3],但普鲁兰酶在食品加工方面的应用甚少。经研究发现,普鲁兰酶能够增加啤酒中的风味物质和提高发酵度[4-5],而啤酒酵母与啤酒发酵密切相关[6-9]。
本文通过添加0、60、90、120 U/kg普鲁兰酶,观察啤酒酵母菌落形态和生长曲线,研究普鲁兰酶对啤酒酵母的影响,希望为普鲁兰酶作用的开发和提高啤酒酵母的利用率提供理论依据。
1 材料与方法
1.1 材料
普鲁兰酶(酶活力为1 000 U/mL,最适pH 4.5~5.5,最适温度55~60℃)、安琪啤酒干酵母、酵母膏、琼脂、二棱大麦。
1.2 仪器与设备
超净工作台、721分光光度计、水浴恒温振荡器、微生物培养箱、可调式移液器、接种环、高压灭菌锅。
1.3 方法
1.3.1 制备麦芽汁固体培养基
大麦经制麦、发芽等过程获得麦芽,粉碎麦芽,加水于60℃糖化2~3 h,搅拌至糖化完全,糖化液经12层纱布过滤后获得麦芽汁。取1 000mL锥形瓶,加入麦芽汁800mL、琼脂16 g、酵母膏72 g,用棉花封瓶,置于灭菌锅灭菌1.05 kg/cm2,20 min;在培养基灭菌后倒平板25mL且未凝固前添加不同浓度的普鲁兰酶,混匀备用。制作麦芽汁斜面培养基:取15mm×150mm试管,加入4mL麦芽汁,用棉花封好试管口,用报纸包裹好置于灭菌锅灭菌1.05 kg/cm2,20 min。
1.3.2 观察啤酒酵母菌落
将啤酒酵母活化后,从瓶子中接种到10mL麦芽汁斜面培养基中复壮最少4支,于25℃培养25 h。按照无菌操作从4支斜面培养基中选出生长良好的进行斜面划线3个,于25℃培养48 h。按照无菌操作挑选健壮、饱满的4~5个啤酒酵母分别接种到添加不同浓度普鲁兰酶的麦芽培养基上于25℃培养。分别于4 d后和11 d后,在麦芽汁培养基上观察啤酒酵母菌落。
1.3.3 测定啤酒酵母的生长曲线
麦芽汁液体培养基配制:取1 000mL锥形瓶,加入麦芽汁800mL、酵母膏72 g,用棉花封瓶,置于灭菌锅灭菌1.05 kg/cm2,20 min。用接种环从斜面培养基上挑取1环菌;接种于10mL麦芽汁液体培养基,于25℃恒温培养48 h,作为种子液。取种子液10mL接种于100mL麦芽汁液体培养基,在28℃恒温200 r/min振荡培养20 h,此时培养液浑浊。将721型分光光度计波长调整至560 nm,预热30 min。取盛有90mL无菌麦芽汁液体培养基的250mL锥形瓶5个,各加入振荡培养20 h的酵母培养液10mL,于25℃下恒温振荡培养,培养6 h后每瓶分别加入0、6、9、12 μL普鲁兰酶。于0、4、8、12、16、20、24、28、32 h和36 h分别用无菌移液管从各瓶吸取培养液2mL,经过一系列梯度稀释后,以未接种的麦芽汁液体培养基校正比色计的零点,在光密度为560 nm条件下测定吸光值(A)记录于表格中,每个吸光值测3次(n=3),以时间(h)为横坐标,吸光值(A560)×稀释倍数为纵坐标绘制成酵母生长曲线[8-10]。
1.3.4 数据分析
利用DPS数据处理系统对实验数据进行F检验。
2 结果与分析
2.1 普鲁兰酶对啤酒酵母菌落的影响
将啤酒酵母通过无菌操作培养在添加4种不同浓度(0、60、90、120 U/kg)普鲁兰酶的麦芽培养基上,于4 d后观察啤酒酵母菌落的形态,如图1A~1D所示;于11 d后观察啤酒酵母菌落的形态,如图2A~2D。

图1 添加普鲁兰酶4 d后啤酒酵母的菌落形态
在添加普鲁兰酶4 d后,啤酒酵母都在麦芽培养基上出现明显的白色菌落(图1),此时经4种不同普鲁兰酶浓度处理的啤酒酵母菌落颜色都很暗,菌落呈现的差异不明显。
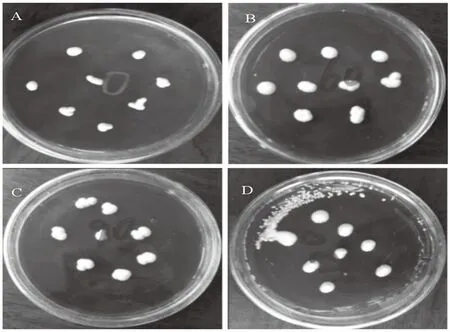
图2 添加普鲁兰酶11 d后啤酒酵母的菌落形态
添加普鲁兰酶11 d后),啤酒酵母在麦芽汁培养基上都形成差异明显的乳白色菌落。在普鲁兰酶的添加量为0 U/kg的条件下(图2A),啤酒酵母的菌落小且不饱满,表明啤酒酵母在未添加普鲁兰酶的条件下,生长缓慢不够发达。在普鲁兰酶的添加量为60 U/kg的条件下(图2B),啤酒酵母的生长得到促进,菌落比未添加普鲁兰酶的大、饱满且有光泽。啤酒酵母在普鲁兰酶的添加量为90 U/kg的条件下(图2C),较添加60 U/kg普鲁兰酶而言,体积、饱满程度相差不大。当普鲁兰酶的添加量为120 U/kg时(图2D),啤酒酵母的生长状况有明显的促进作用,菌落颜色呈乳白色、有光泽、最饱满,且生长旺盛的孢子散落在其他未点样的地方。结合啤酒酵母在麦芽培养基的生长状况(图1和图2),随着普鲁兰酶添加量的增多和时间的推移,啤酒酵母在麦芽汁培养基的生长状况出现了明显的变化,对啤酒酵母生长的促进作用随着普鲁兰酶浓度的升高而增加。这系由于在啤酒酵母代谢过程中,普鲁兰酶将麦芽汁中的使α-1,6糖苷键脱支,促进糖化分解,且普鲁兰酶本身无毒无害,不会对啤酒酵母产生质的变化,则啤酒酵母能充分利用培养基中的单糖以补充自身生长所需的碳源,充足的酵母膏为啤酒酵母提供生长所需的氮源,因而啤酒酵母在添加普鲁兰酶的培养基上形成的菌落更大更饱满。综上所述,普鲁兰酶对啤酒酵母的生长有良好的促进作用。
2.2 普鲁兰酶对啤酒酵母生长的影响
将啤酒酵母培养在添加4种不同普鲁兰酶浓度的麦芽汁液体培养基中,于0、4、8、12、16、20、24、28、32 h和36 h分别用无菌移液管从各瓶吸取培养液2mL,经过一系列梯度稀释后,以未接种的麦芽汁液体培养基校正比色计的零点,利用DPS数据处理系统,在光密度为560 nm的条件下测定吸光值,见表1,每个吸光值测3次(n=3),并进行方差分析(表2)。最后以时间(h)为横坐标,吸光值(A560)×稀释倍数为纵坐标制作出四条酵母生长曲线,如图3所示。
根据方差分析表(表2)可知,时间处理的F值为28.592 6,普鲁兰酶浓度处理的F值为2 171.846 6,则普鲁兰酶的影响效果更为显著,且P值均小于0.001,因此本研究的结果有极显著差异。本研究的误差项很小,说明本研究的精确度高。
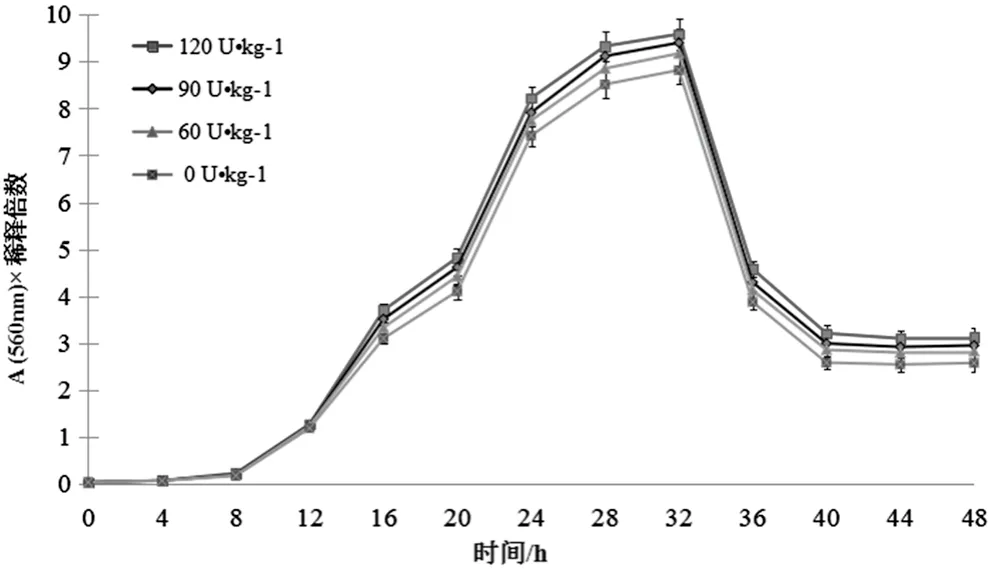
图3 不同普鲁兰酶浓度下啤酒酵母的生长曲线
表1 添加四种浓度普鲁兰酶后啤酒酵母在不同时间培养液的吸光度(±S)
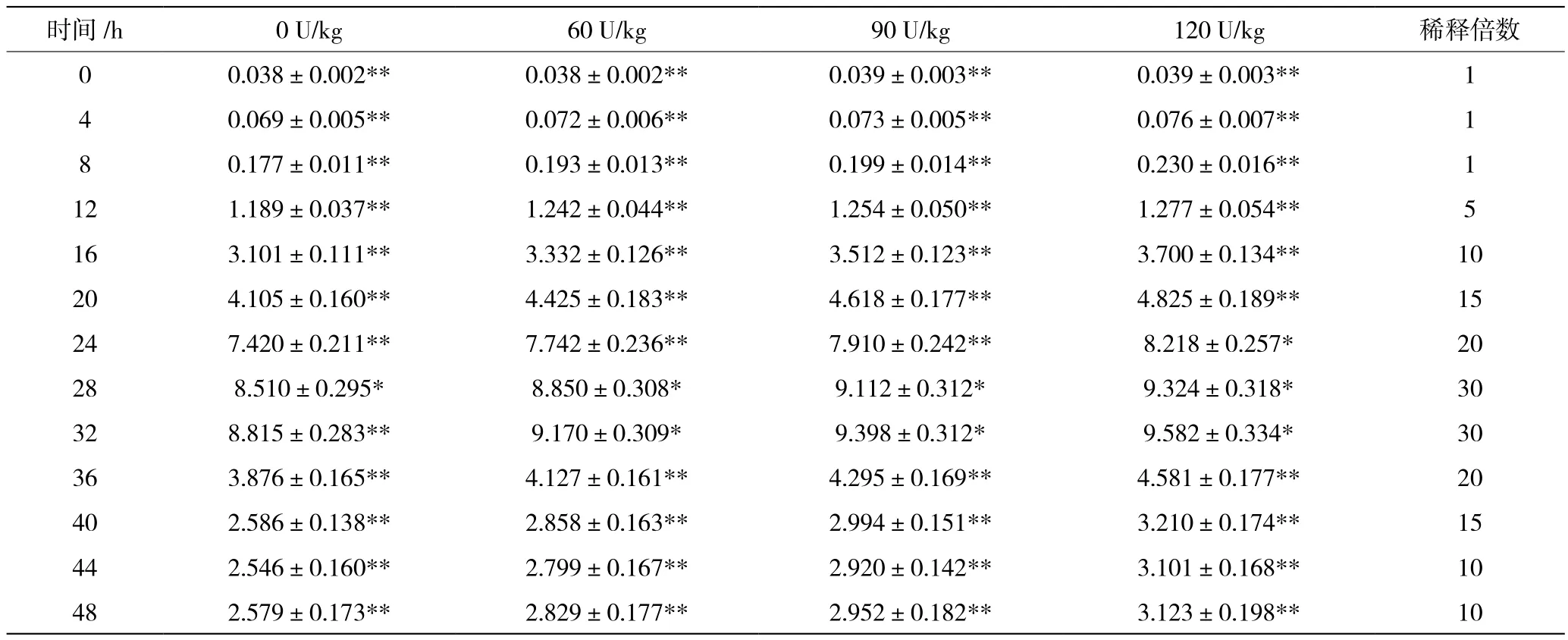
表1 添加四种浓度普鲁兰酶后啤酒酵母在不同时间培养液的吸光度(±S)
注:1.吸光度为3次重复的平均值±标准差;2.同列数字旁星号表示有显著差异(*表示P<0.05,**表示P<0.01)。
时间/h 0 U/kg 60 U/kg 90 U/kg 120 U/kg 稀释倍数0 0.038±0.002** 0.038±0.002** 0.039±0.003** 0.039±0.003** 14 0.069±0.005** 0.072±0.006** 0.073±0.005** 0.076±0.007** 18 0.177±0.011** 0.193±0.013** 0.199±0.014** 0.230±0.016** 1 12 1.189±0.037** 1.242±0.044** 1.254±0.050** 1.277±0.054** 5 16 3.101±0.111** 3.332±0.126** 3.512±0.123** 3.700±0.134** 10 20 4.105±0.160** 4.425±0.183** 4.618±0.177** 4.825±0.189** 15 24 7.420±0.211** 7.742±0.236** 7.910±0.242** 8.218±0.257* 20 28 8.510±0.295* 8.850±0.308* 9.112±0.312* 9.324±0.318* 30 32 8.815±0.283** 9.170±0.309* 9.398±0.312* 9.582±0.334* 30 36 3.876±0.165** 4.127±0.161** 4.295±0.169** 4.581±0.177** 20 40 2.586±0.138** 2.858±0.163** 2.994±0.151** 3.210±0.174** 15 44 2.546±0.160** 2.799±0.167** 2.920±0.142** 3.101±0.168** 10 48 2.579±0.173** 2.829±0.177** 2.952±0.182** 3.123±0.198** 10

表2 方差分析表
本研究采用比浊计数法,经一系列梯度稀释后,根据测定的吸光值(表1)绘制成4条生长曲线(图3),啤酒酵母在不同普鲁兰酶浓度处理下均出现了4个阶段:啤酒酵母的生长在0~8 h为迟缓期,8~24 h为指数期,24~36 h为稳定期,36 h后进入衰亡期,这也是4条生长曲线的共性,在30 h时生长最为旺盛,菌株活力很强,吸光值×稀释倍数达到9以上,十分适合菌种采样,生长曲线反映了啤酒酵母在培养繁殖过程中的生长规律,则普鲁兰酶不会对酵母细胞的生长周期产生影响。但从纵向观察四条生长曲线,当加入不同浓度的普鲁兰酶后,吸光值A(代表样品菌液浓度)随着普鲁兰酶浓度的升高而增加,根据朗伯比尔定律(A=Kbc),在摩尔吸光吸收系数K与吸收层厚度b不变的条件下,吸光度A只与物质的浓度c有关,因此经4种浓度处理后的啤酒酵母在液体培养基中的吸光值(A560)与细菌悬浊液成正比关系,通过分光光度计测量后就掌握了酵母细胞的浓度变化。当添加普鲁兰酶浓度为60 U/kg时,R2(决定系数)=0.183 3。当添加普鲁兰酶浓度为60 U/kg时,酵母细胞浓度从指数期开始比添加0 U/kg普鲁兰酶时高,增幅较大,R2=0.196 9。当添加普鲁兰酶浓度为90 U/kg时,酵母细胞浓度从指数期开始比添加60 U/kg普鲁兰酶时高,增幅较小,两条曲线之间的间隙也较小,R2=0.201 6。当添加普鲁兰酶浓度为120 U/kg时,酵母细胞浓度从指数期开始比添加90 U/kg普鲁兰酶时高,而增幅非常小,R2=0.212 1。由于四条酵母生长曲线R2都趋近于0,因此吸光度A与时间的线性关系很小。
由于在啤酒酵母代谢过程中,普鲁兰酶将麦芽汁中的使α-1,6糖苷键脱支,促进糖化分解,且普鲁兰酶本身无毒无害,啤酒酵母能充分利用培养基中的单糖以补充自身生长所需的碳源,充足的酵母膏为啤酒酵母提供生长所需的氮源。啤酒酵母在添加普鲁兰酶的液体培养基中细胞分化就很旺盛,酵母细胞浓度也就高,表明普鲁兰酶对啤酒酵母的生长有良好地促进作用,确保后续能够在发酵时添加普鲁兰酶的条件下进行良好地生长代谢。
3 结论
本研究在麦芽汁培养基中添加(0~120 U/kg)普鲁兰酶,普鲁兰酶使麦芽汁中的使α-1,6糖苷键脱支,促进糖化分解,经过观察啤酒酵母菌落形态和生长曲线,当添加普鲁兰酶浓度为120 U/kg时,酵母细胞浓度最高。这是由于普鲁兰酶本身无毒无害,啤酒酵母能充分利用培养基中的单糖以补充自身生长所需的碳源,充足的酵母膏为啤酒酵母提供生长所需的氮源,有利于其对糖类物质的利用,促进啤酒酵母产生更多的酒精和CO2。该结果不仅具有重要的理论意义,扩宽普鲁兰酶的应用领域,还能提高啤酒酵母的利用率,对强化食品发酵及风味改善有积极作用。
[1]甄杰,胡政,李树芳,等.一个新型耐热普鲁兰酶的结构与功能[J].生物工程学报,2014,30(1):110-128.
[2]Y Zhang,Y H Liu,Y Li,et al.Extracellular expression of pullulanase from Bacillus naganoensis in Escherichia coli[J].Annals of Microbiolo gy,2013,63(1):289-294.
[3]Nair S U,Singhal R S,Kamat M Y.Induction of pullulanase production in bacillus cereus FDTA-213[J].Bioresour Technol,2007,98(4):856-859.
[4]桑戈,田德雨.普鲁兰酶对大麦酿酒性能的影响[J].啤酒科技,2015(7):31-32.
[5]汪裕强,张明生,莫龙久.普鲁兰酶处理麦芽对啤酒中风味物质的影响[J].科学技术与工程,2017,17(7):204-207,223.
[6]周广田.啤酒酵母与工厂卫生[M].北京:化学工业出版社,2008.
[7]何英英,尹花,缪锦来,等.乙醇胁迫对啤酒酵母生长及蛋白表达的影响[J].食品工业科技,2015,36(12):147-151.
[8]孟庆伟,杨梅龙.菊花对啤酒酵母生长的影响[J].轻工科技,2009,25(5):6.
[9]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005.

