冬季太湖草、藻型湖区N2O的生成与排放特征
郑小兰 ,刘 敏,文帅龙,刘德鸿,钟继承 (1.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008;2.中国科学院大学,北京 100049;3.河南科技大学农学院,河南 洛阳 471003;4.南京师范大学地理科学学院,江苏 南京 210023)
氧化亚氮(N2O)是一种非常重要的温室气体,在大气中停留时间可达140a之多,且其在对流层中发生光化学反应对臭氧层产生极大破坏作用,百年增温势(GWPs)是CO2的310倍.诸多研究已证明N2O的排放与人类活动密切相关,受人类影响较大的内陆水生态系统因受到不断增加的氮负荷约有0.68g/a转化为N2O,使其成为N2O排放的热点[1].国内外已有众多针对不同生态类型水体N2O浓度及释放通量的研究[2],但现有的研究还仅限于为数不多的湖泊[3].目前我国湖泊受人为影响较重,普遍具有较高的氮负荷,更加重了N2O由水体释放进入大气,因此研究富营养化湖泊中N2O的释放规律以及影响因素对于估算水体温室气体排放具有极重要的现实意义.
研究者们试图量化在不同水环境条件下N2O的排放通量[4-5],而多生态类型湖泊N2O的生成与排放的空间异质性给准确估算湖泊N2O通量带来了很大的不确定性.现有的研究表明水柱中藻类的存在会对N2O的生成与排放特征产生重要的影响,藻类的存在会增加N2O的生成与排放[6].同时有研究表明大型水生植物如芦苇、水葫芦对于N2O的生成与排放产生重要的影响,水生植物可以改变氧化还原条件及通过自身的导流作用促进N2O生成与排放[7].由此可见不同生态类型湖区N2O的生成与排放受多种因素影响,因此对不同生态类型湖区N2O生成与排放的对比研究尤为必要;另外,现有的研究鲜有将水-气界面,水体溶存以及泥-水界面N2O释放通量共同研究;N2O生成与排放具有明显的季节性特征,因此开展N2O生成与排放季节性研究,并探讨在不同季节影响N2O生成与排放的关键环境因子,对于更好的理解多生态类型湖区N2O生成与排放的空间异质性具有重要的意义.
太湖是我国第三大湖泊,是典型的大型浅水富营养化湖泊,并有着复杂的生态系统类型.根据太湖的自然环境特征和沉积物类型[8-9],太湖大致可以分为3个区域:北部,主要包括五里湖和梅梁湾,污染相对比较严重,也是蓝藻水华暴发最严重的区域,底部沉积有较多的淤泥;南部主要是东山岛以及东部沿岸区,以挺水植物及沉水植物为主,沉积物为含较多有机碎屑的软泥,及中部过渡区域[10].在不同的生态系统类型湖区沉积物类型不同,水柱及沉积物中氮形态及其含量,及水柱中DO、pH值、Eh、浊度差异显著[8,11],这些因素势必会影响到水柱和沉积物中氮的迁移转化过程,从而影响N2O的生成、消耗和迁移,最终影响N2O的排放通量.本研究拟以太湖典型藻型湖区及草型湖区为研究对象,通过野外原位定点观测及实验室微环境试验来研究草、藻型湖区N2O排放的差异及其关键影响因素,以了解多生态类型湖泊N2O的生成与排放差异.从而为我国湖泊N2O通量估算及全球评估湖泊N2O排放的重要性提供数据支持,且对我国富营养化湖泊减排措施的制定具有重要的现实意义.
1 材料与方法
1.1 采样点概述
本研究选取太湖典型的草型湖区胥口湾及典型的藻型湖区梅梁湾(31°31′43.02N,120°12′32.92E)为研究对象,其中胥口湾草型湖区又分为沉水植物区(胥口湾1:31°08′51.35N,120°25′31.63E)及挺水植物区(胥口湾2:优势种为芦苇,31°06′54.28N, 120°25′31.64E).藻型湖区夏季时蓝藻水华暴发严重,冬季藻类在沉积物表层腐败堆积,故该湖区有机质含量较高;草型湖区水草茂盛,冬季时沉水植物区水草较少,而挺水植物区有大量芦苇生长.
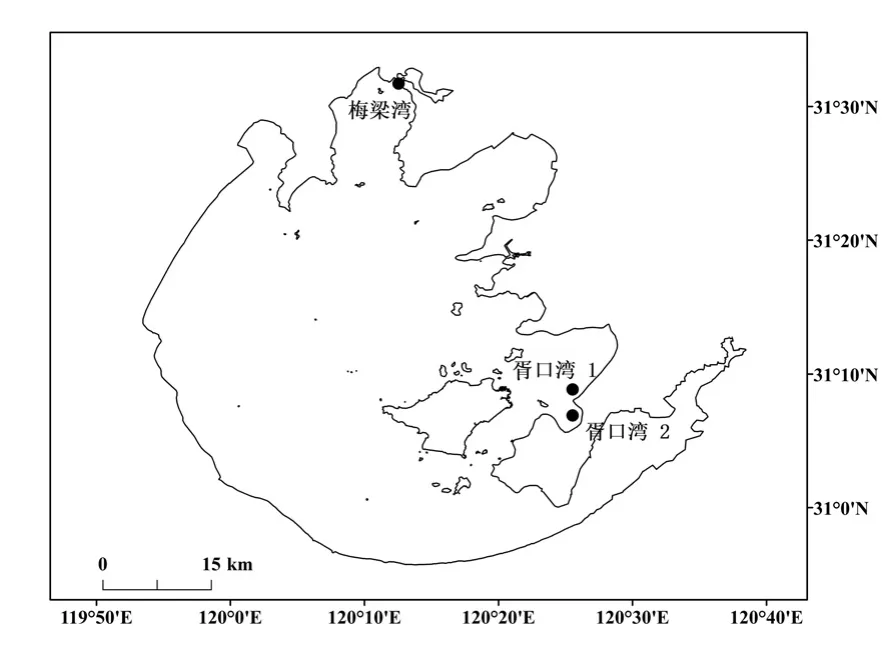
图1 太湖采样点位示意Fig.1 Sampling-sites in Lake Taihu
1.2 样品采集及分析
采样工作于2017年2月份进行,用漂浮通量箱采集水-气界面通量样品.漂浮通量箱用直径20cm的PVC管制成(高度为100cm),其中一端开口,另一端用PVC材料制作的盖子密封,盖子下方通量箱内部装有风扇,采样时可使箱内气体混合均匀.盖子上方留有3个小孔,其中一个起平衡气压的作用,采样时封闭,一个孔安装温度计监测箱体内温度,另外一个孔安装PU采样管(外径6mm,内径3mm).通量箱外面距离密封端30cm处安装一个圆周挡板,用来固定漂浮轮胎.采样前,提起箱体,使箱体内与周围空气混合均匀,然后垂直放入水体,塞紧橡胶塞.漂浮通量箱约70cm位于水柱中,约30cm长度位于水气界面上,形成一个采样顶空.用连接三通阀的医用注射器采集0时刻的气体样品保存于预先抽成真空的20mL玻璃瓶内,采集样品前先抽取一次气体弃掉,可以消除采样管死体积带来的误差,分别在0、20、40、60min时刻采集气体样品[12],每个位点3组重复,同步记录箱体内温度.样品采集后尽快运回实验室分析.气体样品采用配有十通阀反吹装置和电子捕获器(ECD)的气相色谱仪(Agliet7890B)测定.条件:柱温55℃、后检测器(ECD)温度300℃,载气为高纯氮气流速为30mL/min,燃气为氢气,流速为45mL/L.进样时用带有三通阀的注射器吸取5mL气样注入进样口分析,所采气体样品可直接测定,记录N2O的摩尔分数值(×10-6).
气体样品采集时用虹吸法同步采集水样于20mL顶空瓶中,加入甲醛溶液0.2mL以抑制微生物活性,水样溢出瓶口,塞紧瓶塞.为避免气泡产生,在用橡胶瓶塞封口时,在橡胶塞上插入注射器针孔,使多余水样从注射器中流出.水柱中N2O溶存浓度用顶空-气相色谱技术进行分析,先用注射器将约10mL的高纯氮气注射进20mL血清瓶中,置换出等体积的水,室温下剧烈震荡1min后静置隔夜,使目标气体在玻璃瓶的液相和气相中达到动态平衡,然后用气相色谱仪进行色谱分析.此外用500mL聚乙烯塑料瓶采集表层水样,冷藏运回实验室用于水质常规指标测定.水样经0.45µm碳酸纤维滤头过滤用于、、、分析.采用紫外分光光度法测定,浓度采用α-萘胺比色法测定,浓度采用纳式试剂比色法测定;原水样中TN和TP采用过硫酸钾消解法测定.沉积物样品用2mol/L KCl提取后测定、及;用多参数水质仪(YSI,Yellow Springs)记录环境参数,如现场测定表层水水温、pH值、盐度及DO浓度等.
沉积物柱样由便携式沉积物柱样采样器采集,上下密封后无扰动带回实验室,用玻璃棒将上层水混匀采集沉积物柱表层水样于20mL血清瓶,将沉积物切片取表层2cm沉积物离心取上清液于血清瓶,测定沉积物表层水体及沉积物表层间隙水中N2O浓度,用于计算沉积物-水界面N2O释放通量[13].沉积物理化性质测定参照《土壤农化分析》第三版[14].沉积物经80℃烘干,经100目筛分后,用过硫酸钾消解法测定TN和TP的测定;沉积物含水率测定通过105℃烘干至恒重时的失重获得.
1.3 环境因子对N2O生成影响的微环境实验
根据本课题组在太湖的前期研究基础及太湖水质实际情况,主要探讨无机氮浓度、碳源、盐度及温度这些主要的环境因子对N2O生成的影响,环境因子及各处理如表1所示.环境因子对N2O生成影响的微环境试验采用泥浆法,在已有研究的方法上经过改善[15],具体步骤如下:称约3g混合均匀的表层沉积物样于50mL血清瓶中,加入10mL用原位湖水配置的培养水,用高纯氮气吹扫10s,赶走顶空的氧气来维持厌氧环境[16],氮气吹扫后立即塞进橡皮塞确保不漏气.采集0时刻样品于真空瓶后,用氮气平衡瓶内气压,然后将培养瓶放入摇床中振荡(70r/min,原位温度)避光培养4h后剧烈地晃动血清瓶以使顶空气体达到平衡,用20mL 3mol/L NaCl溶液[17]置换同体积顶空气体,为4h时刻气体样品,尽快使用气相色谱仪进行分析.
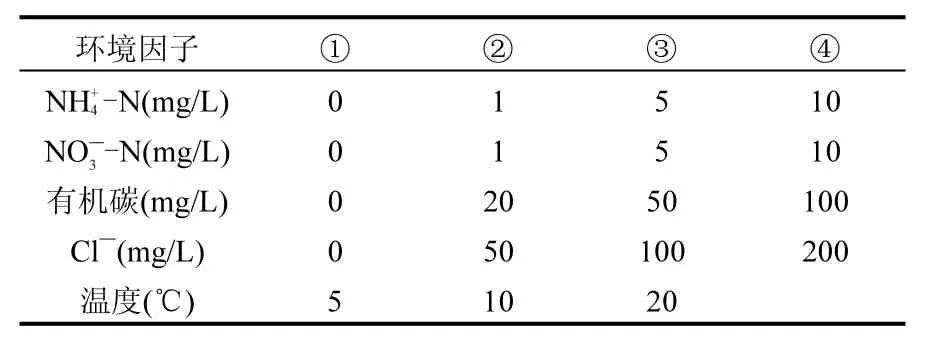
表1 环境因子及各试验处理Table 1 Environmental factors and test treatments
1.4 通量计算
1.4.1 水-气通量的计算方法N2O的释放通量是指在单位时间内单位面积上温室气体浓度的变化量,正值表示N2O气体从水体向大气中排放,即“源”;负值表示水体吸收N2O气体,即“汇”.N2O通量采用下式计算:

式中:Fg为水-气通量,µg/(m2·h);ρ为N2O密度,g/L;V为通量箱体积,m3;A为通量箱口面积,m2;dG/dt为通量箱内N2O气体浓度随时将变化的斜率;T为通量箱内温度,℃.
1.4.2 水体浓度计算方法 ①顶空气体浓度的计算:将顶空气体视为理想气体,顶空气体组分浓度由Dalton分压定律计算:
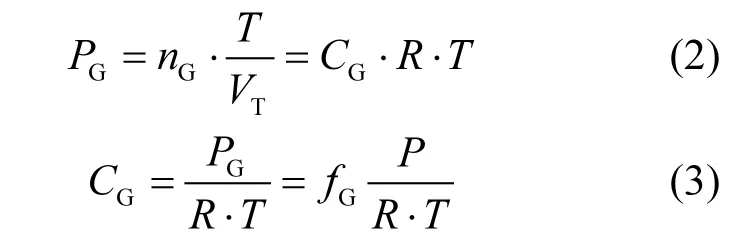
式中:PG为体系内某气体组分的分压值,Pa;nG为该气体组分的物质的量;R为理想气体常数,8.314×103Pa/L/(mol·K);T表示体系内的热力学温度,K;VT为气体总体积,L;CG为最终要求得的该气体组分的浓度,µmol/L;fG为该气体组分的物质的量分数,气相色谱测定得到,×10-6;P为体系内气压值,Pa.
②培养体系内水体浓度计算:假设水样瓶中顶空气体与水体达到溶解平衡,瓶内水体溶存气体的浓度根据改善后的Weiss气体溶解度公式计算[18],顶空内总压强是1atm,则水体溶存N2O浓度可由下式计算:

式中:C为N2O水体溶存气体浓度,µmol/L,fG为N2O的物质的量分数,气相色谱测定得到,×10-6;F为换算系数,相当于溶解度系数, mol(L·atm);T是热力学温度,K;S为水体盐度,‰; A1(-165.8810),A2(222.8743), A3(92.0920), A4(-1.4842), B1(-0.056235),B2(0.031619), B3(-0.004847)是常数.
③培养体系内气体累积浓度计算:培养产生的气体包括水体溶存的及顶空内的N2O,换算为水体累计浓度CG为(µmol/L):
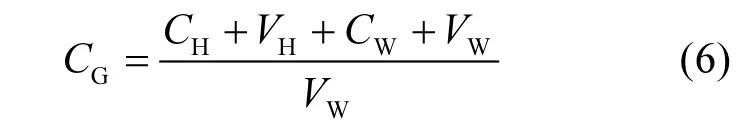
式中:CH和CW分别为顶空和水体内N2O浓度VH和VW分别为顶空和水体体积,L.
1.4.3 泥-水通量计算方法[21]

式中:FS为泥水通量,µmol/(m2·h);Ø为沉积物孔隙度;DS为沉积物总扩散系数,cm2/s;dc/ds浓度梯度,μmol/m4;DW为N2O水体扩散系数,cm2/s;θ为弯曲度.
1.4.4 微环境实验中沉积物生成N2O速率计算 由2.4中计算水体溶存浓度过程中计算出培养体系内顶空气体浓度CH和剩余水体浓度和CW以及两相体积即可求得体系内N2O浓度,再根据培养瓶体积、培养时间以及所用沉积物质量换算出3个湖区沉积物N2O释放潜力.

式中:Ps为沉积物释放潜力,ng/(g⋅h);CT为水体累计生成N2O浓度,µmol/L;C0为水体初始N2O浓度,µmol/L;V为培养水体积,L;m为沉积物干重,g;t为培养时间,h;M为N2O的分子量,g/mol.
1.5 数据处理与分析
采用Excel2010和SPSS20.0进行数据分析,并用Origin8.0软件作图.单因素方差分析用以分析不同湖区N2O溶存、迁移及释放差异;Bonferroni多重比较分析用以分析不同浓度处理组间沉积物N2O生成潜力的差异.
2 结果与讨论
2.1 水柱及沉积物性质
如表2所示,藻型湖区,挺水植物及沉水植物湖区水温在采样期间无明显波动,水柱DO含量存在明显差异,藻型湖区水柱DO含量高于挺水植物湖区和沉水植物湖区.水柱TN及TP浓度自底部至表层逐渐降低,浓度呈增加趋势,水柱中表层及底层TN及均表现出藻型湖区>沉水植物湖区>挺水植物湖区,浓度表底层出现相反的趋势,即表层为挺水植物湖区相对较高,底层藻型湖区较高,均与呈相反的现象.沉积物,及含量与表层水体浓度呈现相同状况,均与泥-水界面浓度分布存在差异.底层与表层水体中的浓度变化可知挺水植物湖区表层浓度比底层高出133.2%,藻型湖区表层比底层下降10.7%,沉水植物湖区升高39.1%变化表现为藻型湖区表层高于底层,挺水植物湖区底层高于表层,沉水植物湖区基本稳定.的浓度总体表现为底层高于表层.
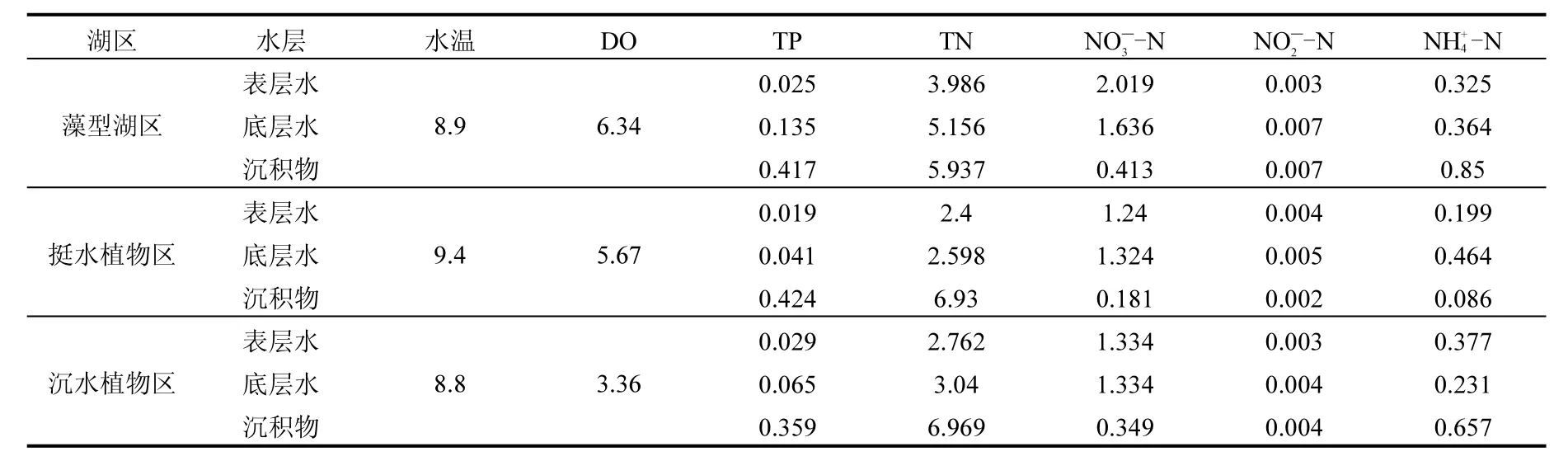
表2 2月份水柱及沉积物基本理化性质Fig.2 Basic physical and chemical properties of water and sediments in February
藻型湖区富营养化较为严重,水中氮营养盐含量均高于污染相对较轻的沉水植物湖区和挺水植物湖区,如表2所示.梅梁湾藻型湖区受到农业、工业污染及城市生活污染由来已久,采样点距离梁溪河口比较近,以前该区域受到梁溪河污水排放的影响比较大,沉积物中蓄积的营养盐含量较高,另外该研究区域靠近太湖鼋头渚风景区,该处水域受人为影响也比较大.所以梅梁湾藻型研究区水质及底泥富营养化程度较重.温度升高时,该湖区营养盐为蓝藻的爆发提供充足的供给物质,泥-水界面处3种形态N盐含量均较高,该区域沉积物内源负荷较为严重并对水柱的营养水平及环境产生影响[19].沉水植物及挺水植物湖区由于大量水生植物的存在,水生植物凋亡后会沉入底泥,导致草型湖区存在较高的有机质及总氮含量.另一方面,该区域水生植物生成发育良好,可以大量吸收湖水中的营养盐,起到净化水质的作用.
2.2 N2O泥-水通量、水体溶存浓度及水-气界面通量
3个湖区在泥-水界面N2O排放通量(图2C)存在显著差异(P<0.001),主要表现为藻型湖区>沉水植物湖区>挺水植物湖区((29.598 ±0.196)µmol/(m2·h),(10.89±1.6621)µmoL/(m2·h),(3.828±0.294)µmol/(m2·h)).水体溶存N2O浓度(图2B)存在空间上的显著性差异(P=0.001),主要表现为藻型湖区>挺水植物湖区>沉水植物湖区((0.0247±0.0003)µmol/L, (0.0236±0.0003)µmol/L,(0.0219±0.0001)µmol/L). 水-气界面N2O排放通量(图2A)与泥-水界面通量一致,存在显著性差异(P=0.002),主要表现为藻型湖区>沉水植物湖区>挺水植物湖区((123.1039±11.4334) µg/(m2·h),(79.1902±4.8957)µg/(m2·h),(53.4452±4.2251) µg/(m2·h)).

图2 N2O在水-气、泥-水界面通量及水柱中溶存浓度Fig.2 The flux of N2O in water-gas interface and sediment-water interface and dissolved N2O concentration in water column
梅梁湾水-气界面N2O释放通量最大值明显高于吴平等[20]对梅梁湾及东太湖水-气界面通量值范围,且空间分布也与其存在差异(图2).本次观测中,梅梁湾水气界面通量明显高于沉水植物及挺水植物,说明水体富营养化加剧了N2O释放.泥-水界面释放N2O通量与水-气界面存在一致性,均表现出藻型湖区>沉水植物湖区>挺水植物湖区,Pearson相关性分析显示水-气界面与泥-水界面N2O通量存在极显著相关关系(p=0.905).藻型湖区处于非蓝藻暴发期,沉积物中无机氮负荷(、、)要远远高于挺水植物及沉水植物区.其次不同研究点位其他环境因子的影响,冬季藻型湖区非藻蓝藻爆发期,水柱中无机氮含量较高,为N2O产生提供基质.
熊正琴等[21]研究得出水-气界面N2O释放通量与水柱溶存N2O浓度存在正相关性,而本文观测到挺水植物湖区泥-水界面及水-气界面通量均小于沉水植物湖区,但水体溶存浓度却高于后者,这与挺水植物湖区生长的植物特征有密切关系,芦苇根系创造了好氧与厌氧界面,为硝化反硝化提供了好氧与厌氧环境,古小治等[22]实验得出有芦苇存在是水体N2O浓度比无芦苇生长对照组高出14倍,王洪军[23]在梅梁湾监测植被型(芦苇)湖滨带水-气界面N2O释放通量达到190.7µg/(m2·h),明显高于裸露型湖滨带81.6µg/(m2·h).芦苇等挺水植物对氨氧化细菌(AOB)活性影响大于对氨氧化古菌(AOA),在芦苇根系氨氧化细菌将氧化为,为反硝化提供底物,从而增加水体N2O的浓度[24].另外,N2O的释放可通过植物通气组织而非气体扩散的途径释放到大气中,而在使用漂浮通量箱收集水-气界面N2O气体时并未将芦苇收割并罩在通量箱内,导致挺水植物区N2O水-气界面通量偏低.另外与沉水植物区相比,挺水植物区有着较高的水柱N2O溶存浓度也与挺水植物区所处的位置有关,挺水植物区位于岸边带,风浪扰动相对较小,更有利于N2O的溶存.另外推测可能与挺水植物区微生物区系也有关系,值得后续研究中对多生态类型湖区微生物区系开展研究.
2.3 环境因子对沉积物N2O生成速率的影响
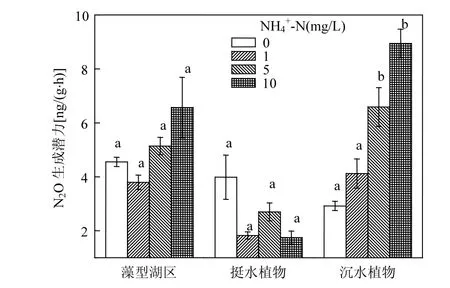
图3 添加对3个湖区沉积物生成N2O的影响Fig.3 Effect of concentration on the formation of N2O in 3 zones in Lake Taihu

图4 添加对3个湖区沉积物生成N2O的影响Fig.4 Effect of concentration on the formation of N2O in 3 zones in Lake Taihu

图5 有机碳添加对3个湖区沉积物生成N2O的影响Fig.5 Effect of organic carbon concentration on the formation of N2O in 3 zones in Lake Taihu
2.3.3 碳源添加对N2O释放的影响 不同浓度乙酸盐添加下(图5),藻型湖区及挺水植物湖区沉积物N2O释放潜力呈现显著差异(P=0.02,P=0.005),沉水植物湖区差异不显著(P=0.111).3个湖区N2O生成速率随添加乙酸盐浓度增加总体上呈下降趋势,多重比较分析显示藻型湖区添加乙酸盐浓度50mg/L时,N2O产生速率是增加的,乙酸浓度为100mg/L时,沉积物N2O释放潜力显著低于其他组,挺水植物湖区添加乙酸浓度20mg/L时,沉积物N2O释放显著低于其他组,沉水植物湖区沉积物N2O释放潜力随添加乙酸浓度增加不存在明显差异.因此乙酸盐对沉积物N2O产生的影响并非简单的随碳源添加而增加的关系,更多地表现为抑制沉积物N2O产生和释放.
在水体中,微生物主要利用可溶性有机碳(DOC).研究发现,碳氮比会影响反硝化过程,反硝化作用最适的碳氮比为1.25(摩尔数比)[34],碳氮比低于20:1,即乙酸浓度低于20mg/L时,水体发生不完全的反硝化作用,N2O还原受阻,会引起水体积累的N2O增多[35].当碳氮比过高时,乙酸会抑制N2O的产生[36-37],底层水柱中TN浓度分布为:藻型湖区(5.156mg/L)、挺水植物(3.598mg/L)、沉水植物(3.04mg/L),因此藻型湖区在添加乙酸浓度为50mg/L,及沉水植物超出20mg/L时抑制N2O生长及释放.研究发现相比较葡萄糖和蔗糖等碳营养源,乙酸钠作为反硝化过程的碳源更能提高反硝化速率,水体硝态氮的去除率更高且N2O生成量较少.一方面,从生物化学角度分析,糖酵解途径和三羧酸循环(TCA)是微生物利用有机碳作为碳源和能源的两条主要途径[38].乙酸作为碳源很容易形成乙酰基辅酶A(Acetyl-CoA),是以上两条途径的关键组分,所以乙酸钠是更加直接的碳源,当施加乙酸钠作为碳源时,反硝化系统中酶的活性(如硝酸还原酶、亚硝酸还原酶、一氧化氮还原酶以及氧化亚氮还原酶)也得到激发,由于乙酸盐对于N2OR活性的激发效果更加明显,所以作为反硝化中间产物的N2O并不会集聚[39-40].另一可能的原因反硝化微生物种类与基因间存在差别,所以当施加不同种类碳源时,会促进一部分微生物过度繁殖,从而会抑制其他微生物的生长与繁殖,由于参与的反硝化微生物不同,而产生的N2O速率也有所不同.所以从总体上说,冬季太湖沉积物-水界面N2O生成速率不受碳源的限制,这与太湖沉积物及上覆水中含有相对较多的碳源有关.
2.3.4 盐度(Cl-)对N2O生成的影响 藻型湖区N2O随添加不同盐度处理组间(图6)存在极显著性差异(P=0.009),而挺水植物和沉水植物湖区无显著性差异(P=0.629,P=0.158).藻型湖区及挺水植物湖区沉积物N2O释放潜力随添加Cl—浓度先增加然后逐渐降低,但添加Cl—组沉积物释放N2O潜力始终高于控制组;沉水植物湖区沉积物N2O释放潜力随添加Cl—浓度增高降低明显,在添加Cl—浓度为100mg/L时高于50mg/L,Cl—浓度为150mg/L时沉积物N2O释放潜力最低.

图6 盐度对3个湖区沉积物生成N2O的影响Fig.6 Effect of salinity on the formation of N2O in 3 zones in Lake Taihu
Bernhard等[41]发现氨氧化古菌(AOA)受水体中盐度影响且Magalhaes等[42]也发现河口沉积物中盐度升高使硝化细菌活性增加50%,因为在淡水湖泊中微生物种群或N2O还原酶对盐度升高更为敏感[43],可通过抑制N2O还原为氮气而直接或间接影响N2O的生成与排放[44],于是有更多的在反硝化过程中被氨氧化细菌还原为当培养水中Cl—浓度超过50mg/L时,出现相反的情况在水体沉积物中未见报道,但是在土壤 (包括农田和森林土壤)出现过相似情况[46].一方面盐分会加快有机质的分解,使土壤有机质含量随添加盐度增加而降低,为土壤呼吸提供基质而消耗的氧气越来越少,不利于反硝化过程产生N2O;另一方面可能是作为专性酶参与土壤硝态氮的进一步还原过程的硝酸还原酶和亚硝酸还原酶活性受盐度抑制,从而导致土壤N2O排放减少.太湖河网密布,且近几年多数河流受到城镇废污水及农村生活污水的的直接污染[47],严重富营养化河网释放的N2O等温室气体占整个太湖流域释放N2O的10%~50%[37],因此盐度对于N2O释放过程中硝化细菌和反硝化细菌的干扰机制有待进一步研究.
2.3.5 温度对N2O生成的影响 藻型湖区、挺水植物湖区及沉水植物湖区N2O生成潜力在不同培养温度下(图7)存在显著性差异(P=0.001,P=0.005,P<0.001),3个湖区中N2O生成都随着温度的升高而增大,多重比较分析显示温度升高至20℃时对沉积物N2O释放潜力的影响明显增加.即当温度从5℃升高至20℃时沉积物N2O释放潜力分别增加2.61,2.16和2.57倍.
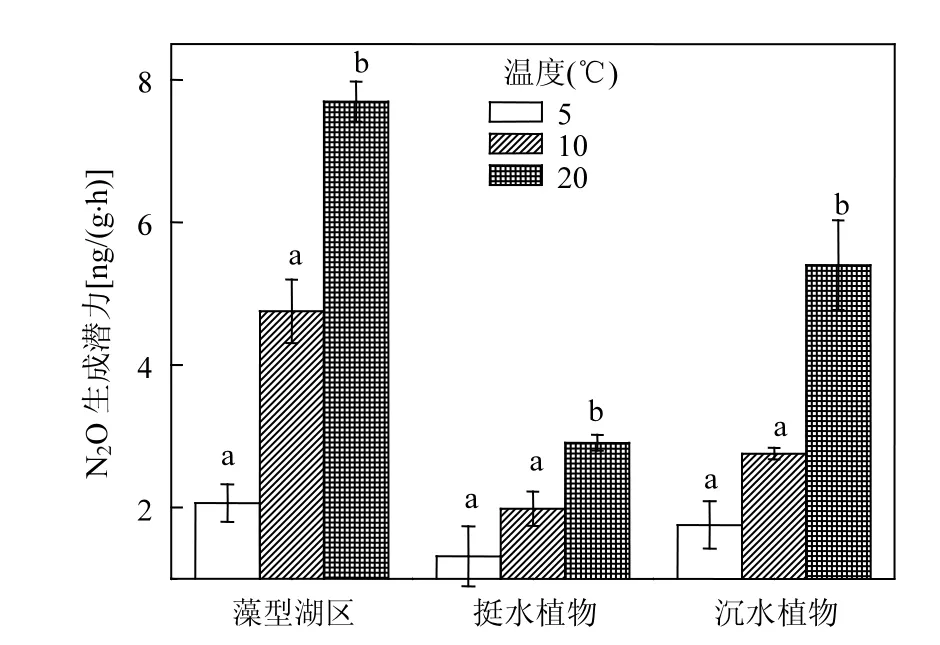
图7 温度对3个湖区沉积物生成N2O的影响Fig.7 Effect of temperature on the formation of N2O in 3 zones in Lake Taihu
温度通过影响沉积物微生物活性、硝化与反硝化速率及N2O传输速率而影响N2O的生成、迁移与转化.通常大于5℃的温度条件适宜微生物发生反硝化作用.有研究发现,温度与反硝化呈正比,温度会影响反硝化微生物的活性[48].Ryden等[49]的研究表明,在相同的土壤含水量和硝酸根含量条件下,土壤温度从5℃增加到10℃,土壤反硝化速率从0.02kg/(hm2·d)增加到0.11kg/(hm2·d).此外水温变化也会通过影响微生物活性和N2O气体在水体的溶解度,间接影响到N2O的迁移.水温升高能够激发微生物活性,降低N2O气体在水体中的溶解度,从而促进N2O的排放[50],这也就表明在夏季水温较高时,并且水体营养盐含量较高时是N2O释放的高峰期.
3 结论
3.1 太湖典型草、藻湖区N2O排放存在空间差异显著.首先水-气界面及泥-水界面N2O释放存在一致性:藻型湖区>挺水植物湖区>沉水植物湖区,其中水-气通量分别为(123.10±11.43)µg/(m2·h), (79.19±4.90)µg/(m2·h), 和(53.45±4.22)µg/(m2·h),泥-水通量分别为(29.60±0.20)µmol/(m2·h),(10.89±1.66)µmol/(m2·h),和(3.83±0.30)µmol/(m2·h));水体溶存N2O浓度为藻型湖区>沉水植物湖区>挺水植物湖区,为(0.0247±0.0003)µmol/L,(0.0236±0.0003)µmol/L,(0.0219 ±0.0001)µmol/L
3.2 藻型湖区及沉水植物湖区N2O产生与迁移特征与其水体营养盐含量相关;挺水植物湖区N2O的产生与迁移特征不仅与其水体营养盐相关,且与所处的地理位置及与其生长的芦苇等挺水植物的特征密不可分,
3.3 冬季太湖沉积物-水界面N2O的生成受无机氮浓度的影响,但对不同湖区的影响不尽相同;冬季N2O的生成不受碳源及盐度的影响,但受冬季低温的限制.
[1] Garnier J, Cébron A, Tallec G, et al. Nitrogen Behaviour and Nitrous Oxide Emission in the Tidal Seine River Estuary (France)as Influenced by Human Activities in the Upstream Watershed [J].Biogeochemistry, 2006,77(3):305-326.
[2] Liu F, Liu C Q, Wang S L, et al. Temporal and spatial variations of greenhouse gases concentrations in soils in Karst Stone Desertification Areas in central part of Guizhou Province. [J].2009,30(11):3136-3141.
[3] Wang H, Yang L, Wang W, et al. Nitrous oxide (N2O) fluxes and their relationships with water-sediment characteristics in a hypereutrophic shallow lake, China [J]. Journal of geophysical research-biogeoscience, 2007,112(G1):129-137.
[4] Harter T, Bossier P, Verreth J, et al. Carbon and nitrogen mass balance during flue gas treatment with Dunaliellasalina cultures[J]. Journal of applied phycology, 2013,25(2):359-368.
[5] Morell J M, Capella J, Mercado A, et al. Nitrous oxide fluxes in Caribbean and tropical Atlantic waters: evidence for near surface production [J]. Marine Chemistry, 2001,74(2):131-143.
[6] Weathers P J. N2O evolution by green algae [J]. Applied and environmental microbiology, 1984,48(6):1251-1253.
[7] Florez-Leiva L, Tarifeño E, Cornejo M, et al. High production of nitrous oxide (N2O), methane (CH4) and dimethylsulphoniopropionate(DMSP) in a massive marine phytoplankton culture [J].Biogeosciences Discussions, 2010,7(5):6705-6723.
[8] 张 路,范成新,王建军,等.太湖草、藻型湖区间隙水理化特性比较 [J]. 中国环境科学, 2004,24(5):556-560.
[9] 秦伯强,吴庆农,高俊峰,等.太湖地区的水资源与水环境——问题、原因与管理 [J]. 自然资源学报, 2002,17(2):221-228.
[10] 秦伯强,罗潋葱.太湖生态环境演化及其原因分析 [J]. 第四纪研究, 2004,24(5):561-568.
[11] 王永平,朱广伟,洪大林,等.太湖草、藻型湖区沉积物-水界面厚度及环境效应研究 [J]. 中国环境科学, 2013,33(1):132-137.
[12] Zhang L H, Song L P, Zhang L W, et al. Diurnal dynamics of CH4,CO2and N2O fluxes in the saline-alkaline soils of the Yellow River Delta, China [J]. Plant Biosystems, 2015,149(4):797-805.
[13] Zhong J C, You B S, Fan C X, et al. Influence of Sediment Dredging on Chemical Forms and Release of Phosphorus [J].Pedosphere (土壤圈(英文版)), 2008,18(1):34-44.
[14] 鲍士旦.土壤农化分析.3版 [M]. 北京:中国农业出版社, 2000:103-109.
[15] Zhao Y, Xia Y, Li B, et al. Influence of environmental factors on net N2, and N2O production in sediment of freshwater rivers [J].Environmental Science and Pollution Research, 2014,21(16):9973-9982.
[16] Christensen J P, Smethie Jr W M, Devol A H. Benthic nutrient regeneration and denitrification on the Washington continental shelf [J]. Deep Sea Research Part A. Oceanographic Research Papers, 1987,34(5/6):1027-1047.
[17] 钟继承,刘国锋,范成新,等.湖泊底泥疏浚环境效应:Ⅲ.对沉积物反硝化作用的影响 [J]. 湖泊科学, 2009,21(4):465-473.
[18] Weiss R F, Price B A. Nitrous oxide solubility in water and seawater [J]. Marine chemistry, 1980,8(4):347-359.
[19] 杨元龙,蔡启明,秦伯强.太湖梅梁湾沉积物-水界面氮迁移特征初步研究 [J]. 湖泊科学, 1998,10(4):141-47.
[20] 吴 平,李香华,逄 勇.太湖水-气界面温室气体N2O日通量变化特征 [J]. 工业安全与环保, 2007,33(8):49-51.
[21] 熊正琴,邢光熹,沈光裕,等.太湖地区湖水与河水中溶解N2O及其排放 [J]. 环境科学, 2002,23(6):26-30.
[22] Gu X, Chen K, Fan C. Preliminary evidence of effects of Phragmites australis, growth on N2O emissions by laboratory microcosms [J]. Ecological Engineering, 2015,83(5):33-38.
[23] 王洪君,王为东,卢金伟,等.湖滨带温室气体氧化亚氮(N2O)排放研究 [J]. 生态环境, 2006,15(2):270-275.
[24] Groffman P M, Gold A J, Jacinthe P A. Nitrous oxide production in riparian zones and groundwater [J]. Nutrient Cycling in Agro-ecosystems, 1998,52(2):179-186.
[25] Hwang S, Jang K, Jang H, et al. Factors Affecting Nitrous Oxide Production: A Comparison of Biological Nitrogen Removal Processes with Partial and Complete Nitrification [J].Biodegradation, 2006,17(1):19-29.
[26] Li X, Xia Y, Li Y, et al. Sediment denitrification in waterways in a rice-paddy-dominated watershed in eastern China [J]. Journal of Soils and Sediments, 2013,13(4):783-792.
[27] Wunderlin P, Mohn J, Joss A, et al. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions. [J]. Water Research, 2012,46(4):1027.
[28] Silvennoinen H, Liikanen A, Torssonen J, et al. Denitrification and Nitrous Oxide Effluxes in Boreal, Eutrophic River Sediments under Increasing Nitrate Load: A Laboratory Microcosm Study [J].Biogeochemistry, 2008,91(2):105-116.
[29] Mulder A, Graaf A A V D, Robertson L A, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor [J]. Fems Microbiology Ecology, 1995,16(3):177–184.
[30] Wang S, Liu C, Yeager K M, et al. The spatial distribution and emission of nitrous oxide (N2O) in a large eutrophic lake in eastern China: anthropogenic effects [J]. Science of the Total Environment, 2009,407(10):3330.
[31] Xia Y, Li Y, Li X, et al. Diurnal pattern in nitrous oxide emissions from a sewage-enriched river [J]. Chemosphere, 2013,92(4):421-428.
[32] Beaulieu J J, Schlesinger W H. Nitrous oxide emission from denitrification in stream and river networks [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011,108(1):214.
[33] Herrman K S, Bouchard V, Moore R H. Factors affecting denitrification in agricultural headwater streams in Northeast Ohio, USA [J]. Hydrobiologia, 2008,598(1):305-314.
[34] 吴耀国.地下水环境中反硝化作用 [J]. 环境工程学报, 2002,3(3):27-31.
[35] Li Q, Li P, Zhu P, et al. Effects of Exogenous Organic Carbon Substrates on Nitrous Oxide Emissions during the Denitrification Process of Sequence Batch Reactors [J]. Environmental Engineering Science, 2008,25(8):1221-1228.
[36] Mueller D T, Herman G, Eikelboom R. Kinetics of N2O production and reduction in a nitrate-contaminated aquifer inferred from laboratory incubation experiments [J].Biogeosciences Discussions, 2010,7(1):503-543.
[37] 王智平,曾江海.农田土壤N2O排放的影响因素 [J]. 农业环境保护, 1994,13(1):40-42.
[38] Tam N F Y, Wong Y S, Leung G. Effect of exogenous carbon sources on removal of inorganic nutrient by the nitrificationdenitrificationprocess [J]. Water Research, 1992,26(9):1229-1236.
[39] Murray P J, Hatch D J, Dixon E R, et al. Denitrification potential in a grassland subsoil: effect of carbon substrates [J]. Soil Biology& Biochemistry, 2004,36(3):545-547.
[40] Jian F L, Zhao G D, Long S C, et al. Effect of carbon source and C/N ratio on heterotrophic denitrification of pure culture [J].Rural Eco-environment, 2005,21(2):42-45.
[41] Bernhard A E, Landry Z C, Blevins A, et al. Abundance of ammonia-oxidizing archaea and bacteria along an estuarine salinity gradient in relation to potential nitrification rates [J].Applied and Environmental Microbiology, 2010,76(4):1285-1289.
[42] Magalhães C M, Joye S B, Moreira R M, et al. Effect of salinity and inorganic nitrogen concentrations on nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River estuary, Portugal [J]. Water Research, 2005,39(9):1783-1794.
[43] Teixeira C, Magalhães C, Joye S B, et al. The role of salinity in shaping dissolved inorganic nitrogen and N2O dynamics in estuarine sediment-water interface [J]. Marine Pollution Bulletin,2013,66(1/2):225-229.
[44] Hu Z, Lee J W, Chandran K, et al. Nitrous Oxide (N2O) Emission from Aquaculture: A Review [J]. Environmental Science &Technology, 2012,46(12):6470-6480.
[45] Yu R, Kampschreur M J, van Loosdrecht M C, et al. Mechanisms and specific directionality of autotrophic nitrous oxide and nitric oxide generation during transient anoxia. [J]. Environmental Science & Technology, 2010,44(4):1313-9.
[46] Wong V N L, Greene R S B, Dalal R C, et al. Soil carbon dynamics in saline and sodic soils: a review. [J]. Soil Use &Management, 2010,26(1):2-11.
[47] Qin B, Xu P, Wu Q, et al. Environmental issues of Lake Taihu,China [J]. Hydrobiologia, 2007,581(1):3-14.
[48] Schulthess R V, Kühni M, Gujer W. Release of nitric and nitrous oxides from denitrifying activated sludge [J]. Water Research,1995,29(1):215-226.
[49] Ryden J C. Denitrification loss from a grassland soil in the field receiving different rates of nitrogen as ammonium nitrate [J].European Journal of Soil Science, 1983,34(2):355-365.
[50] Schrieruijl A P, Veraart A J, Leffelaar P A, et al. Release of CO2and CH4from lakes and drainage ditches in temperate wetlands [J]. Biogeochemistry, 2011,102(1):265-279.
——以武汉紫阳湖为例

