地塞米松体外短期处理抑制CD8 T细胞的活化与功能
谢 婷,欧志兵,黄丽艳,张 健,金 坤,瞿小旺,刘文培,罗迪贤
(1南华大学附属郴州医院转化医学研究所,2南华大学附属郴州医院肝胆外科,湖南郴州423000)
0 引言
糖皮质激素具有强大的抗炎和免疫抑制作用,通过抑制促炎细胞因子、激活抗炎细胞因子以及趋化因子来影响免疫应答,因而广泛用于自身免疫性和炎症性疾病治疗。研究表明,糖皮质激素可以调节影响先天免疫和适应性免疫的各种免疫细胞的功能,但其介导的调节作用机制仍未完全阐明。CD8T细胞即细胞毒性T细胞可通过诱导靶细胞凋亡、分泌细胞因子抑制靶细胞或分泌穿孔素(perforin)和颗粒酶直接杀死靶细胞。细胞毒性T淋巴细胞抗原4(cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)、程序性死亡受体-1(programmed cell death 1,PD-1)、淋巴细胞活化基因3(lymphocyte activation gene 3,LAG-3)和T细胞免疫球蛋白粘蛋白分子-3(T-cell immunoglobulin-and mucin-domain-containing molecule,Tim-3)是表达于T细胞表面的抑制性受体。在稳态条件下,通过抑制性受体的信号传导来平衡共刺激受体的活性,确保免疫应答正常启动并发挥作用,当信号传导失控时将导致恶性激活和自身免疫。T盒转录因子(T-box expression in T cells,T-bet)和脱中胚蛋白(eomesodermin,Eomes)协同调节CD8效应性T细胞分化,调节功能性细胞因子γ干扰素(interferon-γ,IFN-γ)、颗粒酶 B(granzyme B,GzmB)、穿孔素(Perforin)的表达,与记忆CD8 T细胞转换与维持有关。 Eomes在大多数脊椎动物胚胎发育过程起重要调节作用,慢性病毒感染期间,T-bet和Eomes的差异表达促进了抗病毒CD8T细胞库的协同维持。
本研究通过糖皮质激素体外短期处理健康人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),探讨其对CD8T细胞表型、功能的影响及可能作用机制,为糖皮质激素在临床应用提供参考。
1 材料和方法
1.1 材料
1.1.1 研究对象 收集2017年11月至2018年8月无糖皮质激素使用史的健康志愿者外周血,剔除感染如乙型肝炎、丙型肝炎、丁型肝炎、人类免疫缺陷病、梅毒等感染性疾病样本。该研究在南华大学附属郴州市第一人民医院伦理委员会和志愿者知情同意下进行。本次研究对象共32例,男28例,女4例,年龄为(32.09±5.306)岁。
1.1.2 主要试剂 以下试剂购自eBioscience公司:兔抗人CCR7 PE 610(3D12);鼠抗人CD3 APC-eFluor780(SK7)、CD8 PerCP-Cy5.5(RPA-T8)、CD38 APC(HIT2)、Perforin FITC(dG9)、LAG3 FITC(3DS223H)、PD-1 PE-eFluor 610(eBioJ105)、 T-bet PE-Cyanine7(eBio4B10)、 Eomes APC(WD1928);Brefeldin A、Human TruStain FcX(Fc Receptor Blocking Solution)、Foxp3/Transcription Factor Staining Buffer Set。鼠抗人CD8 BUV737(SK1)、CD45RA FITC(HI100)、HLA-DR PE(G46-6)、TNF-α PE-Cy7(MAb11)、IFN-γ PE-CF594(B27)、Granzyme B PE(GB11)、Annexin V PE、 7-AAD PE-Cyanine5、Fixation/Permeabilization Solution Kit等试剂购自BD Biosciences公司。鼠抗人 Tim-3 PE(344823)购自 R&D。Dexamethasone、PMA、Ionomycin购自 Sigam-Aldricha公司。1.1.3 仪器与软件 MoFlo XDP流式细胞分选仪(Beckman公司)获取并分析细胞、软件FlowJo V10.0分析流式数据、软件GraphPad Prism 7作图。
1.2 方法
1.2.1 样本处理与地塞米松刺激 收集健康自愿者外周血6~10 mL,将外周血(血 ∶淋巴细胞分离液=2:1)沿管壁缓慢加入至含分离液的离心管中,2200 rpm离心22 min。离心后吸取中间单个核细胞层,加至含10 mL RPMI 1640洗液的15 mL离心管中,混匀后1800 rpm离心10 min,弃上清,加细胞冻存液冻存于液氮罐中备用。复苏细胞过夜后,加1 mL含10%FBS的RPMI 1640完全培养基重悬细胞后计数。调整细胞浓度至1×10/mL,同一样本分两孔,每孔100 μL接种于96孔平底板中。并用地塞米松(终浓度为10~10mol/L)或完全培养基按总体积 200 μL/孔处理,37℃、5%CO培养箱中培养3 d。
1.2.2 细胞表面染色 将刺激后的细胞转移至96孔V底板中,Live/Dead 1∶1000稀释至工作浓度后,100 μL/孔4℃ 避光染色30 min,以分析时排除死细胞。细胞表面染色前,25 μL/孔染含5%Human TruStain FcX抗体悬液,4℃ 避光染色5 min,按抗体最适浓度、根据不同panel配制总体积50 μL/孔抗体悬液染色 CD3、CD8、CD45RA、CCR7、CD38 、HLADR、LAG-3、CTLA-4等抗体,4℃ 避光染色30 min,含1%FBS的staining buffer洗涤三次后流式上机检测。
1.2.3 胞内细胞因子分泌检测 地塞米松处理PBMCs三天后,需检测胞内细胞因子则将细胞转移至96孔U底板中,PMA(50 ng/mL)+Ionomycin(1 μg/mL)再刺激6 h,开始刺激1 h后每孔加Golgistop(工作浓度1∶1500)以阻断细胞内细胞因子释放至胞外。细胞表面染色后,staining buffer洗涤细胞3次,Fixation/Permeabilization solution 100 μL/孔混匀后 4℃ 避光孵育20 min,BD Biosciences洗液洗涤细胞2次。按50 μL/孔体系加 GzmB、Perforin、TNF-α、IFN-γ 抗体,4℃ 避光染色30min,staining buffer洗涤三次后流式上机检测。
1.2.4 转录因子染色 表面染色后,Foxp3/Tran-scription Factor Staining Buffer按说明书配至工作浓度,100 μL/孔室温避光孵育40 min后,eBioscience洗液洗涤细胞2次,按50 μL/孔体系染色 Eomes、T-bet抗体,4℃ 避光染色30 min,staining buffer洗涤细胞3次后流式上机检测。
1.2.5 细胞凋亡检测 细胞经表面染色后,用预冷的PBS洗涤细胞两次后用1X binding buffer调整细胞浓度至2×10/mL,转移50 μL/孔至96孔V底板中。每孔加入7-AAD、Annexin v抗体室温避光孵育15 min。 加 200 μL/孔 1X binding buffer后 1 h 内流式上机检测细胞凋亡情况。
1.3 统计学处理 实验数据采用SPSS24.0统计分析,计量资料用x ±s表示,两组间比较采用配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 地塞米松体外短期处理显著降低效应性CD8T细胞比例,改变细胞亚群分布 为明确地塞米松对CD8T细胞的影响,本研究采用地塞米松(10~10mol/L)处理健康人PBMCs 3天,发现地塞米松(10~ 10mol/L)均减少 CD8T 细胞比例(图1B),且呈剂量依赖。根据该结果,本实验后期均选择10mol/L地塞米松作为处理浓度。我们进一步检测据CD45RA、CCR7的表达定义的CD8T细胞四个亚群(图1A),发现与对照组相比,初始 T细胞比例显著增加(<0.001),而效应T细胞比例显著减少(<0.001)(图1C)。这些结果表明,地塞米松体外短期处理主要降低效应性CD8T细胞比例。

图1 地塞米松短期处理改变CD8+T细胞及其亚群分布
2.2 地塞米松体外抑制CD8T细胞活化,促进效应性T细胞晚期凋亡 为进一步探讨地塞米松体外短期处理对CD8T细胞的影响,我们检测了CD8T细胞及其亚群在地塞米松短期处理后其活化与凋亡情况。研究发现:与对照组相比,地塞米松抑制CD8T细胞的活化(=0.044)(图2A),各个亚群的活化也相应受到抑制(=0.043、=0.04、=0.042、=0.045)(图2B)。地塞米松短期处理未见影响总的CD8T细胞凋亡(图2C、D)。分析其亚群细胞凋亡情况,发现地塞米松处理主要促进CD8效应性T细胞、抑制初始T细胞亚群的晚期凋亡(=0.032、=0.033)(图2E、F)。结合结果1,我们推测:地塞米松短期处理可能通过抑制效应性T细胞活化、促进其凋亡从而显著下调效应性T细胞比例。
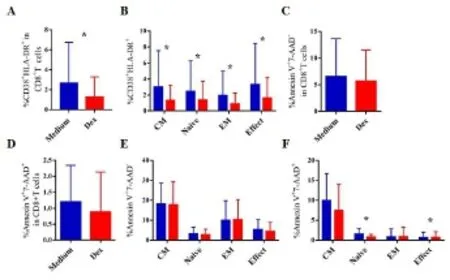
A和B:地塞米松抑制CD8+T细胞及其亚群的活化(活化标志:CD38+HLA-DR+)。C和E:早期凋亡情况。D和F:晚期凋亡情况(早期凋亡:Annexin V+7-AAD-;晚期凋亡:Annexin V+7-AAD+)。 蓝色柱:Medium红色柱:Dex。注*与Medium比较,P<0.05
2.3 地塞米松体外短期处理促进CD8T细胞耗竭
免疫抑制性受体如 PD-1、Tim-3、CTLA-4、LAG-3 等通常在T细胞活化后高表达,负向调节T细胞过度活化,慢性感染或炎症同样上调免疫抑制性受体表达,引起T细胞功能耗竭。本研究发现:地塞米松体外短期处理显著上调CD8T细胞表面抑制性受PD-1和 Tim-3的表达(=0.009、=0.023)(图 3A、B);而LAG-3、CTLA-4比例有上升趋势,但无统计学差异(图3C、D)。这些结果提示,地塞米松体外短期处理可能会进一步导致T细胞功能受损。

A:LAG-3表达;B:PD-1表达情况;C:Tim-3表达情况;D:CTLA-4表达情况。蓝色柱:Medium,红色柱:Dex。注*与Medium比较,P<0.05;**与Medium比较,P<0.01
2.4 地塞米松体外短期处理显著抑制CD8T细胞的功能 为进一步确认地塞米松处理对CD8T细胞功能的影响。将地塞米松短期处理过后的PBMCs,经PMA加Ionomycin刺激6 h后流式抗体胞内染色(图4A、B),研究发现地塞米松处理组CD8T细胞功能性因子 Perforin、GzmB 表达及 IFN-γ、TNF-α 分泌显著降低(=0.08、=0.001、=0.05、=0.022)(图4C、D),这些结果显示地塞米松体外短期处理抑制CD8T细胞功能。
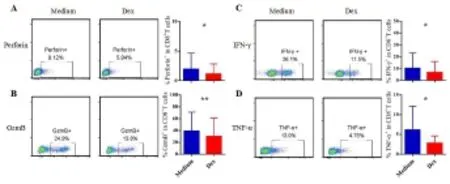
A:典型流式图(左图),CD8+T细胞Perforin表达情况;B:GzmB表达情况;C:IFN-γ 表达情况;D:TNF-α 表达情况。 蓝色柱:Medium,红色柱:Dex。注*与Medium比较,P<0.05;**与Medium比较,P<0.01
2.5 地塞米松体外短期处理影响CD8T细胞的转录因子表达 如图3、4所示,地塞米松短期处理抑制CD8T细胞功能,加速其耗竭。CD8T细胞的功能及免疫抑制性受体的表达主要受核内转录因子T-bet及Eomes表达的调控。与图3和图4所示结果一致,本研究将地塞米松短期处理过的PBMCs经破核膜后流式抗体核内染色(图5A),发现与对照组相比,地塞米松处理显著下调CD8T细胞核内转录因子Eomes表达(<0.001),T-bet的表达无统计学差异(图 5B),而 Eomes/T-bet的比值也呈显著降低(=0.005)(图5C)。

A:典型流式图;B:CD8+T细胞核内 T-bet及 Eomes频数;C:Eomes/T-bet的比值。蓝色柱:Medium,红色柱:Dex。注**与Medium比较,P<0.01,***与Medium比较,P<0.001
3 讨论
糖皮质激素具有免疫抑制和抗炎作用,也有研究表明皮质类激素可以增加免疫及炎症反应甚至增加适应性免疫应答。CD8T细胞是适应性免疫应答的重要参与者,通过细胞毒性如GzmB和Perforin介导非细胞毒性功能来影响靶细胞;也可以通过表达CD95L(Fas)以Fas-Fas L依赖性方式诱导细胞凋亡;或者直接分泌促炎细胞因子 IFN-γ、TNF-α 维持局部炎症。活化的T细胞上通常上调表达免疫抑制性受体:如CTLA-4上调,在维持细胞内免疫控制和外周耐受中发挥重要作用;LAG-3负调节T细胞活化和增殖;Tim在过敏和自身免疫性疾病中发挥着新的作用;PD-1作为效应T细胞应答的负调节剂,防止过度活化效应T细胞的免疫病理损伤。
本研究发现地塞米松体外短期处理PBMCs减少CD8T细胞比例,且呈剂量依赖。与体外激素处理初始 CD8T 细胞结果一致,Chen 等在小鼠模型上也有报道。进一步检测亚群发现,效应T细胞比例减少,而初始T细胞比例显著增加。Giles等也报道地塞米松增加初始 T细胞,减少效应记忆细胞的频率。T细胞凋亡及活化在维持免疫稳态中起重要作用,检测地塞米松对CD8T细胞活化及凋亡的影响,发现CD8T细胞及其四个亚群上CD38HLADR细胞频数均减少,初始T细胞晚期凋亡比例减少,而效应T细胞晚期凋亡比例增加。提示地塞米松可抑制CD8T细胞及其亚群的活化,影响亚群间的凋亡比例从而改变CD8T细胞亚群间的分布。Carol等报道多发性硬化症患者静脉注射甲泼尼龙后激活的CD8T细胞比例减少。Yi等在小鼠模型上证实地塞米松处理可使胸腺细胞凋亡百分比增加。这些结果表明,地塞米松体外短期处理,主要通过抑制效应性CD8T细胞的增殖和促进其凋亡从而降低效应性T细胞频率,从而达到免疫抑制作用。
一方面,地塞米松体外短期处理通过减少效应性T细胞数量;另一方面本研究发现地塞米松体外短期处理同时抑制T细胞功能。地塞米松处理后CD8T细胞上 PD-1和Tim-3表达显著上调,其与 Kailin Xing等报道,地塞米松以剂量依赖的方式增强激活T细胞上PD-1的表达研究一致。Fourcade等研究报道PD-1和 Tim-3上调将导致肿瘤特异性CD8T细胞功能失调,抑制其活化,当协同使用受体拮抗剂后,部分CD8T细胞数量及功能得以恢复。糖皮质激素的免疫抑制作用在于调节基因的转录,并抑制细胞因子如IFN-γ、TNF-α、白介素2等分泌。本研究发现地塞米松处理后CD8T细胞功能性细胞因子 GzmB、Perforin、IFN-γ、TNF-α 比例均显著减少,提示CD8T细胞功能受损。有研究表明:糖皮质激素几乎可完全阻断GzmB的产生,体外显著减少T细胞上 IFN-γ、自然杀伤细胞上 perforin的表达。进一步检测转录因子发现:地塞米松处理组CD8T细胞上T-bet无明显变化,但Eomes频率、Eomes/T-bet的比值显著降低。提示地塞米松破坏Eomes与T-bet之间的转录平衡,许多研究报道炎性细胞因子可反向调节记忆CD8T细胞中T-bet和Eomes的表达水平。CD8细胞耗竭的几种关键指标为:抑制性受体 PD-1、LAG-3、Tim-3、CTLA-4 等高表达;共刺激受体CD278和OX40的表达降低;转录因子T-bet、Eomes等的差异表达。 由于激素受体在免疫细胞上普遍高表达,本研究不能排除地塞米松处理增加其他免疫抑制性细胞如Treg,Tr1(本实验室前期已发表数据),从而间接抑制CD8 T细胞活化及功能的可能性。
综上,地塞米松体外短期处理一方面可抑制效应性CD8T细胞的分化,促进凋亡,降低效应性T细胞比率;另一方面抑制CD8T细胞功能促进T细胞耗竭,从而发挥其免疫抑制作用。本研究初步揭示了地塞米松对外周血CD8T细胞的影响及可能的机制,这些研究结果将为糖皮质激素在临床应用中,对免疫细胞调节提供一定的理论参考。由于本研究为体外实验,具有一定的研究局限性,下一步将有必要深入探讨糖皮质激素受体及其相关调节机制的研究,并在不同的免疫性疾病条件下,探讨激素对CD8T细胞免疫抑制的可能机制。

