饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能、血清生化指标和肠组织形态的影响
朱荣生 王怀中* 齐 波 黄保华 孙守礼 王建才 位 宾 呼红梅**
(1.山东省农业科学院畜牧兽医研究所,济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,济南 250100;3.青岛农业大学动物科学技术学院,青岛 266109;4.济南海华生物科技有限公司,济南 250108)
仔猪断奶应是一个平缓的、循序渐进的过程,一般应超过17周[1]。随着生猪养殖集约化、规模化的实施,大多数猪场为了提高母猪繁殖效率,将仔猪断奶时间提至7~28日龄。断奶使仔猪的生活环境、摄入饲粮等瞬间发生变化,由此引起的应激使仔猪肠屏障功能受损,采食量降低[2],肠绒毛萎缩[3-5],对传染性疾病的易感率增加[3]。
三丁酸甘油酯作为一种良好的丁酸来源,能够直达肠道,为肠道发育提供能量和养分,促进肠上皮细胞增殖,促进养分吸收利用[6-8]。研究表明,饲粮添加0.08%~0.30%三丁酸甘油酯可使断奶仔猪平均日增重增加5.79%~11.75%,料重比降低11.75%,空肠绒毛高度显著增加15.9%,隐窝深度显著降低8.9%,肠道中尸胺、腐胺、精胺、组胺含量增加1.5~10.0倍,而且三丁酸甘油酯的添加可显著缓解由乙酸刺激直肠引起的肌酸酐、前列腺素E2含量的升高[8-12]。饲粮添加0.1%~0.3%三丁酸甘油酯效果最优[8,10,12-13]。核苷酸是一种具有生物活性的物质,一般情况下机体内的核苷酸通过从头合成途径进行合成,但在快速生长和应激期间由饲粮中补充核苷酸对仔猪生长性能和健康有益[14]。仔猪断奶前采食富含核苷酸的母猪乳汁,但是断奶后饲粮中的核苷酸含量极少,因此断奶猪饲粮添加核苷酸可缓解断奶应激,增加采食量[15-16]。断奶仔猪饲粮添加0.5~2.0 g/kg核苷酸可使仔猪平均日增重、平均日采食量分别显著增加3.14%~11.07%和5.58%~15.50%,料重比显著降低3.16%~4.24%[17],腹泻率由15.63%降至1.53%,死亡率由4.69%降至1.56%[16],而且在免疫系统功能维持和降低氧化应激方面也发挥着重要作用[18-19]。基于三丁酸甘油酯对仔猪肠道发育和养分吸收的促进作用[8,10],以及核苷酸对仔猪采食量和生长性能的改善作用[14-17],但是目前二者同时在断奶仔猪上的应用研究未见报道,多数研究集中在单一物质的应用效果研究,因此,本试验旨在研究饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能、血清生化指标和肠组织形态的影响,为二者在断奶仔猪上的应用提供支撑。
1 材料与方法
1.1 试验设计
试验在菏泽宏兴原种猪繁育有限公司进行。选择21日龄、体重为8.4 kg左右的健康杜洛克×长白×大约克(DLY)三元断奶仔猪160头,随机分为2组,每组10个重复,每个重复8头。对照组饲喂基础饲粮,试验组在基础饲粮中添加0.20%三丁酸甘油酯和0.15%核苷酸。试验期38 d,期间猪只自由采食、饮水,按照猪场常规管理规程和正常免疫程序进行。基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 8 200 IU,VD32 100 IU,VE 30.5 mg,VK32.8 mg,VB25.2 mg,VB62.1 mg,VB120.11 mg,生物素 biotin 0.10 mg,叶酸 folic acid 0.96 mg,D-泛酸D-pantothenic acid 17.2 mg,烟酸 nicotinic acid 20.1 mg,氯化胆碱 choline chloride 702 mg,抗氧化剂 antioxidant 100 mg,Fe (as ferrous sulfate) 820 mg,I (as potassium iodide) 0.85 mg,Ca 8.6 g,P 3.5 g,赖氨酸 Lys 0.7 g。
2)代谢能为计算值,其余为实测值。ME was a calculated value, while the others were measured values.
1.2 试验材料
三丁酸甘油酯和核苷酸均由济南海华生物科技有限公司提供。三丁酸甘油酯纯度在45%以上,核苷酸纯度为50%,其余部分均为载体。
1.3 指标检测
1.3.1 生长性能指标
试验第1天和第38天晨饲前对仔猪逐头称重。在试验期间,每天09:00—10:00、17:00—18:00观察仔猪排粪情况,记录腹泻个体。以个体为单位记录猪只死亡和淘汰情况,发现死淘猪及时结料并称重。根据每日记录的给料量、剩余料量和损耗料量,以重复为单位计算平均日采食量、料重比,同时计算个体平均日增重和腹泻率。
1.3.2 血清生化指标
于试验第38天晨饲前试验猪空腹称重后,逐头前腔静脉采血10 mL,放入非抗凝离心管中静置15 min,3 000 r/min离心10 min分离血清,至于-80 ℃冰箱保存备用。
使用日立7180生化分析仪测定血清中尿素氮、尿酸、葡萄糖、总胆固醇、总蛋白、球蛋白、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)含量及二胺氧化酶活性。试剂盒购自四川迈克生物科技股份有限公司,操作步骤按照试剂盒说明书进行。
1.3.3 肠组织形态学检测及黏膜相关免疫细胞统计
试验第38天晨饲前试验猪空腹称重后,每组随机选择3头进行屠宰,取十二指肠、空肠、回肠制作石蜡切片,经苏木精-伊红(HE)染色、阿利新蓝-高碘酸雪夫氏(AB-PAS)染色、甲苯胺蓝染色后,于10×20倍显微镜下拍照,应用Image-Pro Plus 6.0软件测量肠绒毛高度、隐窝深度、黏膜厚度和肠壁厚度,统计杯状细胞、柱状细胞、淋巴细胞和肥大细胞数量。具体检测方法是:1)取每根肠管横断面,统计观察5根最长且排列整齐的绒毛,统计单位面积柱状细胞数量和分布;2)取每根肠管横断面,统计观察5根最长且排列整齐的绒毛,计数每100个肠黏膜上皮柱状细胞间淋巴细胞、杯状细胞数量和分布;3)统计观察每根肠管横断面的肠壁全层,包括黏膜及黏膜下层、肌层及浆膜层中每100个柱状细胞间的肥大细胞、淋巴细胞数量和分布。
1.3.4 空肠内容物消化酶活性检测
试验第38天晨饲前试验猪空腹称重后,每组随机选择3头进行屠宰,取空肠内容物,采用比色法测定脂肪酶、胰蛋白酶、淀粉酶、麦芽糖酶、乳糖酶和蔗糖酶活性。试剂盒购自南京建成生物工程研究所,操作步骤按照说明书进行。
1.4 数据统计分析
数据应用SPSS 19.0软件的单因素方差(one-way ANOVA)程序进行分析,差异显著时采用LSD法进行多重比较。P<0.05为差异显著,P<0.01为差异极显著,结果均以“平均值±标准误”表示。
2 结果与分析
2.1 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能的影响
由表2可见,组间试验猪初始体重相近,无显著差异(P>0.05);饲养38 d后试验组仔猪平均体重在数值上略高于对照组,提高了4.86%,但差异不显著(P>0.05)。与对照组相比,试验组平均日采食量和平均日增重分别提高了5.83%(P>0.05)和7.76%(P<0.05),腹泻率极显著降低了61.90%(P<0.01),料重比差异不显著(P>0.05)。由此可见,饲粮添加三丁酸甘油酯和核苷酸可增加断奶仔猪平均日采食量,显著提高断奶仔猪的平均日增重,极显著降低腹泻率。

表2 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01). The same as below.
2.2 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪血清生化指标的影响
由表3可见,与对照组相比,试验组血清葡萄糖含量显著降低了10.34%(P<0.05),血清IgA、IgG、IgM含量分别显著或极显著增加了82.03%(P<0.01)、15.65%(P<0.05)和15.69%(P<0.05),血清球蛋白含量显著增加了15.82%(P<0.05),血清二胺氧化酶活性极显著降低了34.04%(P<0.01)。试验组与对照组间血清尿素氮、尿酸、总胆固醇和总蛋白含量差异不显著(P>0.05)。由此可见,饲粮添加甘油三酯和核苷酸可显著增加仔猪血清球蛋白及IgA、IgG、IgM含量,显著降低血清葡萄糖含量和二胺氧化酶活性。
2.3 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪肠组织形态的影响
由表4可见,十二指肠、空肠、回肠绒毛高度依次降低,空肠和回肠的隐窝深度大于十二指肠,绒毛高度/隐窝深度(V/C)值的变化趋势与绒毛高度一致。与对照组相比,试验组仔猪十二指肠、空肠、回肠绒毛高度不同程度增加,隐窝深度不同程度减小,V/C值不同程度增加。其中,十二指肠和空肠绒毛高度分别显著增加了25.58%和26.98%(P<0.05);十二指肠和空肠V/C值分别显著或极显著增加了45.55%(P<0.01)和32.51%(P<0.05);十二指肠、空肠和回肠隐窝深度均减小,但差异不显著(P>0.05);回肠绒毛高度、V/C值虽然分别增加了10.39%和8.44%,但差异不显著(P>0.05)。
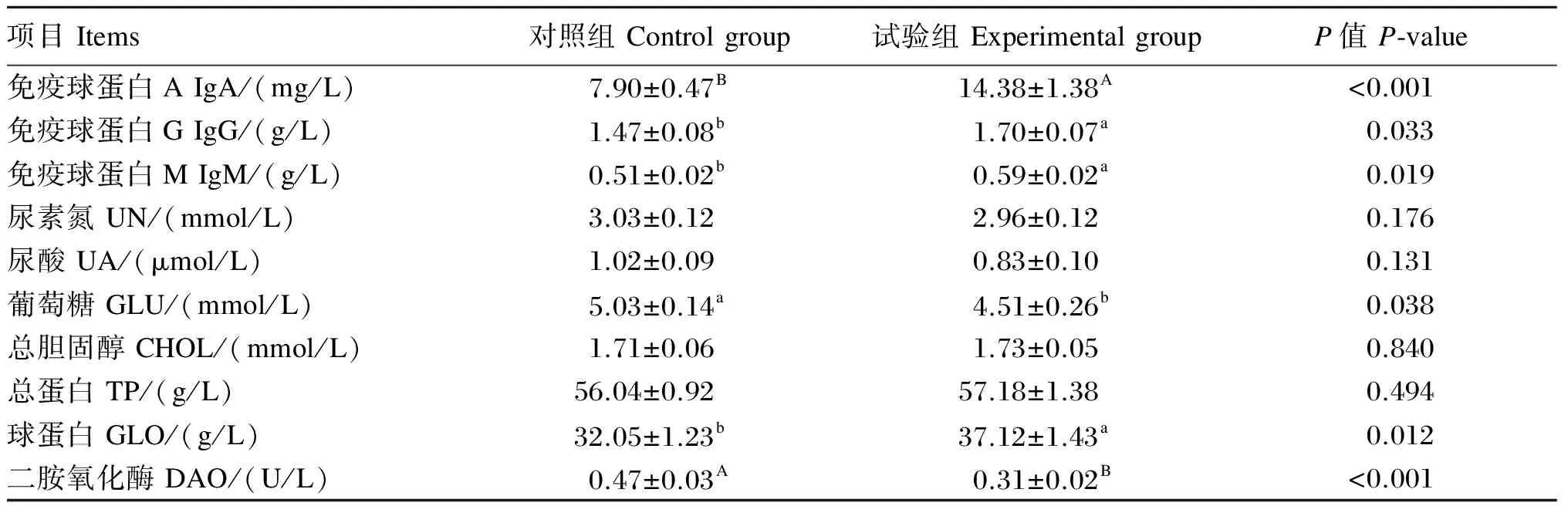
表3 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪血清生化指标的影响
十二指肠、空肠、回肠肠壁厚度、黏膜厚度呈递减趋势。与对照组相比,试验组仔猪十二指肠、空肠、回肠肠壁厚度分别增加了5.16%、4.88%、9.02%(P>0.05),黏膜厚度分别增加了3.30%(P>0.05)、10.91%(P>0.05)和35.89%(P<0.01)。
试验组仔猪十二指肠、空肠、回肠杯状细胞、柱状细胞、淋巴细胞、肥大细胞数量均与对照组间差异不显著(P>0.05)。与对照组相比,试验组仔猪十二指肠杯状细胞、淋巴细胞数量在数值上分别增加了32.82%、22.69%,空肠杯状细胞、柱状细胞、肥大细胞数量在数值上分别增加了25.37%、10.10%、22.66%,回肠杯状细胞、柱状细胞、淋巴细胞和肥大细胞数量在数值上分别增加了28.09%、19.21%、11.28%和25.35%。
由此可见,饲粮添加三丁酸甘油酯和核苷酸可增加断奶仔猪十二指肠、空肠、回肠绒毛高度、V/C值、肠壁厚度和黏膜厚度,降低隐窝深度。
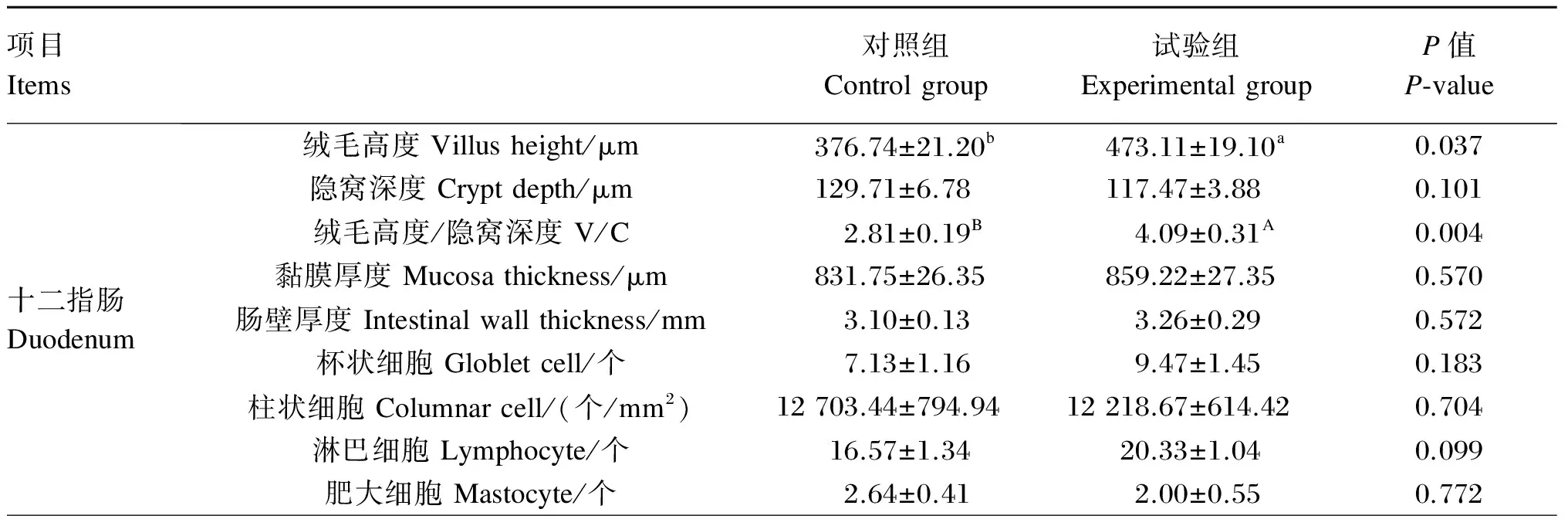
表4 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪肠组织形态的影响

续表4项目Items对照组Controlgroup试验组ExperimentalgroupP值P⁃value空肠Jejunum绒毛高度Villusheight/μm352.42±12.84b447.49±17.41a0.048隐窝深度Cryptdepth/μm144.95±4.35140.41±8.260.685绒毛高度/隐窝深度V/C2.43±0.17b3.22±0.37a0.047黏膜厚度Mucosathickness/μm744.70±34.19825.96±15.370.059肠壁厚度Intestinalwallthickness/mm2.87±0.083.01±0.140.493杯状细胞Globletcell/个6.15±1.287.71±0.930.302柱状细胞Columnarcell/(个/mm2)18854.82±1534.5420759.13±733.420.322淋巴细胞Lymphocyte/个7.21±0.757.00±0.410.858肥大细胞Mastocyte/个3.53±0.414.33±0.400.381回肠Ileum绒毛高度Villusheight/μm310.74±29.68343.03±20.140.363隐窝深度Cryptdepth/μm144.15±7.27137.10±4.370.585绒毛高度/隐窝深度V/C2.25±0.232.44±0.190.598黏膜厚度Mucosathickness/μm491.03±57.96B667.24±20.66A0.005肠壁厚度Intestinalwallthickness/mm2.55±0.322.78±0.410.625杯状细胞Globletcell/个8.33±1.1610.67±1.090.289柱状细胞Columnarcell/(个/mm2)18185.99±1102.0821679.54±1133.930.213淋巴细胞Lymphocyte/个8.33±0.989.27±1.370.557肥大细胞Mastocyte/个4.93±0.076.18±0.090.227
杯状细胞、淋巴细胞和肥大细胞数量为每100个柱状细胞间的数量。
The number of globlet cell, lymphocyte and mastocyte was the number of cells in every 100 epithelial cells.
2.4 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪肠内容物酶活性的影响
由表5可见,试验猪仔猪肠内容物脂肪酶、胰蛋白酶、淀粉酶、麦芽糖酶、乳糖酶和蔗糖酶活性均高于对照组,分别提高了18.08%、75.00%、9.69%、78.21%、8.66%和17.16%,其中胰蛋白酶和麦芽糖酶活性提高显著(P<0.05),其他酶活性提高均不显著(P>0.05)。

表5 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪肠内容物酶活性的影响
3 讨 论
3.1 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪生长性能的影响
研究表明,饲粮添加0.1%三丁酸甘油酯对仔猪平均日增重、平均日采食量、料重比的影响不显著,但腹泻率显著降低了6.83%,死亡率由18.75%降至6.25%[10,12]。饲粮添加0.15%~0.20%三丁酸甘油酯可使仔猪平均日增重显著增加10.24%~11.79%,料重比显著降低4.14%~6.62%,腹泻率显著降低49.35%~66.67%,平均日采食量增加3.10%~7.02%,而且饲粮中粗脂肪、粗蛋白质和能量的表观消化率显著提高4.09%~12.38%[11,13]。但是饲粮同时添加三丁酸甘油酯和乳糖醇、三丁酸甘油酯和牛至油对仔猪生长性能的影响显著高于单独添加三丁酸甘油酯或牛至油、乳糖醇[5,10,12]。饲粮添加0.5%~2.0%核苷酸可使仔猪平均日增重、平均日采食量分别显著增加3.14%~11.07%和5.58%~15.50%,料重比显著降低3.16%~4.24%[17],腹泻率由15.63%降低至1.53%,死亡率由4.69%降至1.56%[16]。三丁酸甘油酯能够通过胃到达肠道后段,被脂肪酶迅速降解为甘油和丁酸,吸收后进入肠上皮细胞,为肠细胞发育提供能量[20]。丁酸不仅能够为肠细胞提供所需的碳水化合物和能量,还能预防渗透性腹泻的发生[21]。丁酸在肠道中吸收的同时还可促进肠道中钠离子、钾离子和水的吸收,从而起到止泻的作用[20]。饲粮添加丁酸盐可使仔猪血浆中缩胆囊素增加4倍,缩胆囊素具有促生长作用[22]。而具有生物活性的核苷酸在代谢、结构、监测、免疫系统功能维持和降低氧化应激方面发挥重要作用[18-19],在快速生长和应激期间可增加仔猪采食量[14]。三丁酸甘油酯与乳糖醇同时添加时,三丁酸甘油酯的添加量为3 000 mg/kg[8,10],三丁酸甘油酯与牛至油同时添加时,三丁酸甘油酯的添加量为1 000 mg/kg[12],而且三丁酸甘油酯单独添加的效果显著低于分别与乳糖醇、牛至油同时添加[8,10,12]。Piva等[10]研究发现,饲粮中同时添加三丁酸甘油酯和乳糖醇比单独添加三丁酸甘油酯或乳糖醇可使仔猪平均日增重增加78.99%或5.97%,同时添加三丁酸甘油酯和乳糖醇仔猪死亡率为0,单独添加三丁酸甘油酯或乳糖醇仔猪死亡率均为6.25%,而对照组死亡率达18.75%。张勇等[12]发现,饲粮同时添加三丁酸甘油酯和牛至油比单独添加三丁酸甘油酯或牛至油可使仔猪腹泻率分别减少0.54、0.12百分点,腹泻发生率降至3.96%,仔猪平均日增重分别增加8.86%、6.65%。与对照组相比,饲粮中同时添加三丁酸甘油酯和乳糖醇或三丁酸甘油酯和牛至油可使仔猪平均日增重分别增加18.33%和13.11%,死亡率减少18.75百分点,腹泻率降低0.87百分点,降至3.96%[10,12]。本试验结果表明,饲粮添加0.20%三丁酸甘油酯和0.15%核苷酸可增加仔猪平均日采食量,显著增加平均日增重,极显著降低腹泻率,其中平均日增重提高了7.76%,腹泻率由4.96%降至1.89%,降低61.90%。与Piva等[10]和张勇等[12]的研究结果相比,本试验添加三丁酸甘油酯和核苷酸对仔猪平均日增重的改善效果较小,但是对腹泻率的改善效果较好。这有可能是因为本试验中三丁酸甘油酯和核苷酸的添加量或添加比例不适宜。
3.2 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪血清生化指标的影响
仔猪断奶后采食量降低会使小肠绒毛萎缩[3-5],小肠屏障功能紊乱,机体易感传染性疾病,这严重影响仔猪生长性能和健康水平[3],从而使组织器官的细胞膜受损,相应酶活性改变。血清总蛋白是动物体内蛋白质的一种重要来源,可用来修补组织、提供能量。血清总蛋白含量反映了饲粮中的粗蛋白质水平及动物对蛋白质的吸收代谢程度,总蛋白含量高说明蛋白质合成代谢速度快。球蛋白是由浆细胞分泌的,其在血清中的含量可反映出机体的抗应激能力。IgA、IgG、IgM是3种免疫球蛋白,由骨髓来源的淋巴细胞分泌,可参与体液免疫,它们在血清中含量可反映机体免疫力的强弱[23]。三丁酸甘油酯主要是通过控制炎症反应和调节抗炎因子表达来改善机体的免疫功能[24],而核苷酸可促进T淋巴细胞依赖性抗原的体液免疫应答,从而增加IgG、IgM的产生[17,25]。二胺氧化酶是哺乳动物小肠黏膜上层绒毛中具有高度活性的细胞内酶,在组胺和多胺代谢中起作用,肠黏膜受损时二胺氧化酶进入血液。血液中二胺氧化酶活性可反映肠道机械屏障的完整性和损伤程度[26]。研究表明,饲粮添加0.1%三丁酸甘油酯可使血清中IgA、IgG、IgM含量分别增加24.42%、13.68%、15.00%,同时添加三丁酸甘油酯和牛至油时血清中IgA、IgG、IgM含量分别增加24.42%、17.31%、8.75%,饲粮添加三丁酸甘油酯或牛至油或同时添加均不影响血清中总蛋白和球蛋白含量[12]。饲粮添加0.10%~0.15%三丁酸甘油酯可使仔猪血清中总蛋白和球蛋白含量均有不同程度提高,而且与三丁酸甘油酯添加量正相关[11]。本试验结果表明,仔猪饲粮添加三丁酸甘油酯和核苷酸显著提高血清球蛋白和IgA、IgG、IgM含量,血清二胺氧化酶含量极显著降低34.04%,但对血清总蛋白含量影响不显著。这与杨玲[11]和张勇等[12]的研究结果一致,说明饲粮添加三丁酸甘油酯和核苷酸具有提高仔猪免疫功能的作用,而且对肠道发育具有显著改善作用,能够减缓仔猪断奶应激。
杨玲[11]研究表明,饲粮添加三丁酸甘油酯使得仔猪血清尿素氮和总蛋白提高,而张勇等[12]发现添加三丁酸甘油酯后仔猪血清尿素氮含量增加,血清总蛋白含量降低,但均差异不显著。本试验研究结果表明,添加三丁酸甘油酯和核苷酸可使仔猪血清中尿素氮含量降低2.31%,葡萄糖含量显著降低10.34%。血清尿素氮是蛋白质代谢的主要终末产物,能够准确反映动物机体蛋白质代谢或者氨基酸间的平衡状况[27],血清尿素氮含量降低则说明动物机体蛋白质的利用率提高。这可能是因为饲粮添加三丁酸甘油酯为肠组织发育提供能量,而核苷酸的添加为肠组织细胞增殖、分化提供充足的必须核苷,为此促进了肠组织发育,提高了肠组织消化吸收能力,促进了蛋白质代谢,提高了养分吸收率;血清葡萄糖含量显著降低在一定程度上说明三丁酸甘油酯和核苷酸促进了糖的合成代谢,提高了饲粮中碳水化合物的利用率。
3.3 饲粮添加三丁酸甘油酯和核苷酸对仔猪肠组织形态的影响
本试验研究结果表明,断奶仔猪饲粮添加0.20%三丁酸甘油酯和0.15%核苷酸使得十二指肠、空肠、回肠绒毛高度增加了10.39%~26.98%,隐窝深度减少了3.13%~9.44%。这与Piva等[8]的研究结果一致,他们发现饲粮添加0.3%三丁酸甘油酯和乳糖醇使得黏膜厚度和空肠绒毛高度增加,空肠隐窝深度减小。这表明饲粮添加三丁酸甘油酯和核苷酸可增加肠组织吸收面积,这可能是由于肠上皮细胞有丝分裂增加,或细胞凋亡降低,抑或是二者共同作用造成的[22,28-29]。本试验研究发现,仔猪十二指肠、空肠、回肠肠壁厚度、黏膜厚度呈递减趋势,试验组分别比对照组增加4.88%~9.02%和3.30%~35.89%,这与Piva等[8]的研究结果一致。这主要是由于肠上皮细胞、黏膜细胞和免疫细胞的快速增生,使得肠壁和黏膜厚度增加,同时还可增强肠绒毛的活力,促进营养成分消化吸收[30]。
肠上皮细胞是仔猪抵抗饲料毒素和外来致病菌的第一道防线,其表面含有毒素和细菌的受体,并且包含具有免疫功能的淋巴细胞和杯状细胞[31-34]。杯状细胞通过特异性和非特异性免疫机制参与调节肠道免疫功能,通过分泌的酸性物质到达黏膜表面,从而形成屏障保护层[35]。肥大细胞具有抗感染免疫功能,通过自身分泌的细胞因子参与获得性免疫[30,36-37],因此淋巴细胞、杯状细胞、肥大细胞在仔猪肠道免疫的调节中起重要作用。本试验研究结果表明,饲粮添加三丁酸甘油酯和核苷酸增加了仔猪十二指肠、空肠和回肠杯状细胞、柱状细胞、淋巴细胞、肥大细胞数量,这说明饲粮添加三丁酸甘油酯和核苷酸可增强仔猪肠道免疫功能。这有可能是因为三丁酸甘油酯和核苷酸的添加抑制了淋巴细胞、杯状细胞和肥大细胞的凋亡,促进其增殖,从而提升免疫性能。
3.4 饲粮添加三丁酸甘油酯和核苷酸对断奶仔猪肠内容物酶活性的影响
Dong等[38]发现,三丁酸甘油酯可使宫内发育迟缓仔猪肠道消化酶活性显著增加,十二指肠、空肠、回肠内容物乳糖酶活性分别显著提高了3.66倍、1.35倍和2.63倍,回肠内容物蔗糖酶、麦芽糖酶、脂肪酶活性分别显著提高了2.30倍、2.43倍和4.15倍,空肠和回肠内容物胰蛋白酶活性分别显著提高了2.82倍和10.52倍。这与本试验的研究结果一致,饲粮添加三丁酸甘油酯可增加空肠内容物脂肪酶、胰蛋白酶、淀粉酶、麦芽糖酶、乳糖酶、蔗糖酶活性,其中胰蛋白酶和麦芽糖酶活性显著增加75.00%和78.21%。这可能是由于三丁酸甘油酯和核苷酸的添加为肠组织发育提供了能量和核苷,促进了肠组织发育,提高了肠绒毛高度,增加了养分吸收面积,促进了消化酶分泌。由此可见,饲粮添加三丁酸甘油酯可提高仔猪肠道的消化吸收能力[39],而且肠道酶活性增加可增强肠道的防御功能,防止细菌入侵[38]。
4 结 论
饲粮添加0.20%三丁酸甘油酯和0.15%核苷酸可使断奶仔猪平均日增重显著提高7.76%,腹泻率极显著降低61.90%,肠绒毛高度、V/C值、肠壁厚度和黏膜厚度在数值上增加,回肠内容物中胰蛋白酶和麦芽糖酶活性显著增加,同时可使血清中免疫球蛋白含量显著增加15.65%~82.03%,血清二胺氧化酶活性极显著降低34.04%。
[1] VAN DER MEULEN J,KOOPMANS S J,DEKKER R A,et al.Increasing weaning age of piglets from 4 to 7 weeks reduces stress,increases post-weaning feed intake but does not improve intestinal functionality[J].Animal,2010,4(10):1653-1661.
[2] WIJTTEN P J,VAN DER MEULEN J,VERSTEGEN M W.Intestinal barrier function and absorption in pigs after weaning:a review[J].British Journal of Nutrition,2011,105(7):967-981.
[4] MOESER A J,KLOK C V,RYAN K A,et al.Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,292(1):G173-G181.
[5] PLUSKE J R,WILLIAMS I H,AHERNE F X.Villous height and crypt depth in piglets in response to increases in the intake of cows milk after weaning[J].Animal Science Joural,1996,62(1):145-158.
[6] GASCHOTT T,STEINHILBER D,MILOVIC V,et al.Tributyrin,a stable and rapidly absorbed prodrug of butyric acid,enhances antiproliferative effects of dihydroxycholecalciferol in human colon cancer cells[J].The Journal of Nutrition,2001,131(6):1839-1843.
[7] KUEFER R,HOFER M D,ALTUG V,et al.Sodium butyrate and tributyrin induceinvivogrowth inhibition and apoptosis in human prostate cancer[J].British Journal of Cancer,2004,90(2):535-541.
[8] PIVA A,GRILLI E,FABBRI L,et al.Intestinal metabolism of weaned piglets fed a typical United States or European diet with or without supplementation of tributyrin and lactitol[J].Journal of Animal Science,2008,86(11):2952-2961.
[9] HOU Y Q,WANG L,YI D,et al.Dietary supplementation with tributyrin alleviates intestinal injury in piglets challenged with intrarectal administration of acetic acid[J].British Journal of Nutrition,2014,111(10):1748-1758.
[10] PIVA A,PRANDINI A,FIORENTINI L,et al.Tributyrin and lactitol synergistically enhanced the trophic status of the intestinal mucosa and reduced histamine levels in the gut of nursery pigs[J].Journal of Animal Science,2002,80(3):670-680.
[11] 杨玲.三丁酸甘油酯对断奶仔猪生长性能、肠道结构和血液生化指标的影响[J].饲料工业,2012(增刊1):46-49.
[12] 张勇,王萌,李方方,等.三丁酸甘油酯和牛至油对断奶仔猪生长性能、血清生化指标和营养物质表观消化率的影响[J].动物营养学报,2016,28(9):2786-2794.
[13] 侯改凤,李瑞,枉侯军,等.三丁酸甘油酯对断奶仔猪生长性能及养分消化率的影响[J].养猪,2014(5):4-6.
[15] MATEO C D,PETERS D N,STEIN H H.Nucleotides in sow colostrum and milk at different stages of lactation[J].Journal of Animal Science,2004,82(5):1339-1342.
[16] MARTINEZ-PUIG D,MANZANILLA E G,MORALES J,et al.Dietary nucleotide supplementation reduces occurrence of diarrhoea in early weaned pigs[J].Livestock Science,2007,108(1/2/3):276-279.
[17] WEAVER A C,KIM S W.Supplemental nucleotides high in inosine 5′-monophosphate to improve the growth and health of nursery pigs[J].Journal of Animal Science,2014,92(2):645-651.
[18] SAUER N,EKLUND M,BAUER E,et al.The effects of pure nucleotides on performance,humoral immunity,gut structure and numbers of intestinal bacteria of newly weaned pigs[J].Journal of Animal Science,2012,90(9):3126-3134.
[19] SALOBIR J,REZAR V,PAJK T,et al.Effect of nucleotide supplementation on lymphocyte DNA damage induced by dietary oxidative stress in pigs[J].Animal Science,2005,81(1):135-140.
[20] LEONEL A J,ALVAREZ-LEITE JI.Butyrate:implications for intestinal function[J].Current Opinion in Clinical Nutrition and Metabolic Care,2012,15(5):474-479.
[21] CRESCI G,NAGY L E,GANAPATHY V.LactobacillusGG and tributyrin supplementation reduce antibiotic-induced intestinal injury[J].Journal of Parenteral and Enteral Nutrition,2013,37(6):763-774.

[23] 何颖,赵武,秦毅武,等.NS复合乳酸菌制剂对断奶仔猪免疫水平的影响[J].动物医学进展,2011,32(12):51-56.
[24] LEONEL A J,TEIXEIRA L G,OLIVEIRA R P,et al.Antioxidative and immunomodulatory effects of tributyrin supplementation on experimental colitis[J].British Journal of Nutrition,2013,109(8):1396-1407.
[25] SAUER N,MOSENTHIN R,BAUER E.The role of dietary nucleotides in single-stomached animals[J].Nutrition Research Reviews,2011,24(1):46-59.
[26] 赵军魁,张小平.肠道屏障功能评估方法的现状及研究进展[J].河北医药,2009,31(22):3134-3136.
[27] MALMLOF K.Amino acid in farm animal nutrition metabolism,partition and consequences of imbalance[J].Journal of Agricultural Research,1988,18(4):191-193.

[29] GODLEWSKI M M,HALLAY N,BIERLA J B,et al.Molecular mechanism of programmed cell death in the gut epithelium of neonatal piglets[J].Journal of Physiology and Pharmacology,2007,58(Suppl 3):97-113.
[30] ZIEGLER T R, EVANS M E,FERNNDEZ-ESTVARIZ C,et al.Trophic and cytoprotective nutrition for intestinal adaptation,mucosal repair,and barrier function[J].Annual Review of Nutrition,2003,23(1):229-261.
[31] 顾宪红,张宏福,佘锐萍,等.断奶日龄对仔猪肠道黏膜水解酶及其上皮间淋巴细胞和杯状细胞数的影响[J].动物营养学报,2005,17(1):35-39.
[32] 寇涛,吕佳琪,李伟,等.母猪饲粮添加精氨酸对仔猪肠道免疫细胞数量的影响[J].动物营养学报,2014,26(8):2077-2084.
[33] 谯仕彦,侯成立,曾祥芳.乳酸菌对猪肠道屏障功能的调节作用及其机制[J].动物营养学报,2014,26(10):3052-3063.
[34] 徐子伟.仔猪肠道损伤修复营养调控及其机制和应用[J].动物营养学报,2014,26(10):3033-3045.
[35] 唐秀莹,陈正礼,罗启慧,等.大豆异黄酮对大鼠肠道上皮内淋巴细胞、杯状细胞及瘦素长型受体的影响[J].浙江大学学报(农业与生命科学版),2013,39(3):343-350.
[36] 郝振荣,朱志宁,王明,等.大豆异黄酮对奶牛泌乳后期泌乳性能、免疫功能和乳腺肥大细胞白介素-4水平的影响[J].动物营养学报,2010,22(6):1679-1686.
[37] 朱志宁,郝振荣,王明,等.大豆异黄酮对高产奶牛泌乳后期乳腺肥大细胞分泌肿瘤坏死因子-α和表面型免疫球蛋白A水平的影响[J].动物营养学报,2011,23(1):112-121.
[38] DONG L,ZHONG X,HE J T,et al.Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J].Clinical Nutrition,2016,35(2):399-407.
[39] CLAUS R,GÜNTHNER D,LETZGUB H.Effects of feeding fat-coated butyrate on mucosal morphology and function in the small intestine of the pig[J].Journal of Animal Physiology and Animal Nutrition,2007,91(7/8):312-318.

