PES多孔细管对INS-1细胞和胰岛在高糖环境下响应能力影响的研究
傅韵洁,黄高平
(1 北京市第四中学,北京 100088;2北京市卫生计划生育委员会政策法规处,北京 100053)
0 引言
糖是一种重要的营养物质,在体内主要以葡萄糖和糖原的形式存在,主要由葡萄糖参与糖代谢。人体有其自发的糖代谢调控机制,当血糖浓度降低时,人体中糖原降解以补充血糖;而当血糖升高时,胰岛素则被分泌并开始产生作用。当人体中的糖代谢出现问题时,体主便会罹患糖尿病。
糖尿病通常被分为I型糖尿病与II型糖尿病。I型糖尿病是由于胰岛无法正常产生胰岛素而导致,约占总数的10%左右。而II型糖尿病是由于胰岛素无法参与糖代谢调节导致。
由于胰腺无法正常对血糖状况进行反馈并供给胰岛素,I型糖尿病的治疗相比II型糖尿病来说更加困难。
糖尿病的治疗方法主要有胰岛素疗法、激素替代法、胰腺移植以及胰岛移植。胰岛素的发现将原本迅速致命的疾病转变为慢性疾病,对糖尿病的治疗带来了极大的突破。随后胰岛素疗法变为I型糖尿病最普遍的疗法。继短效胰岛素后,长效胰岛素的面世改善了许多病人的葡萄糖调控。但胰岛素疗法对于患者带来终生的负担和随后长期血糖控制能力的缺陷,以及糖尿病并发症,仍然对患者的生活质量造成重大影响。
在此之后的胰腺移植虽比不上长效胰岛素立竿见影,但是其生理反应是持续性的。不过普遍认为,胰腺移植面临的最大问题是宿主的免疫排斥。除非接受同卵双胞胎活体胰腺供给的I型糖尿病患者不需要免疫抑制阻止排斥反应外[1],大多数胰腺移植要进行免疫抑制诱导治疗以及使用抑制剂来维护免疫抑制[2]。由于可用的人类胰腺限制和免疫抑制的必要性,相对整个糖尿病人口来说只有极少数的人可以进行胰腺移植。
胰岛移植主要针对胰腺功能被部分削弱的患者,相较于整个胰腺的移植,胰岛移植在技术方面更为容易且恢复更快,但患者仍然面临着免疫抑制的风险。由于胰岛体积较小,胰岛移植作为细胞疗法,在再生操做以及免疫隔离上有着更大的灵活性[3]。见图1。
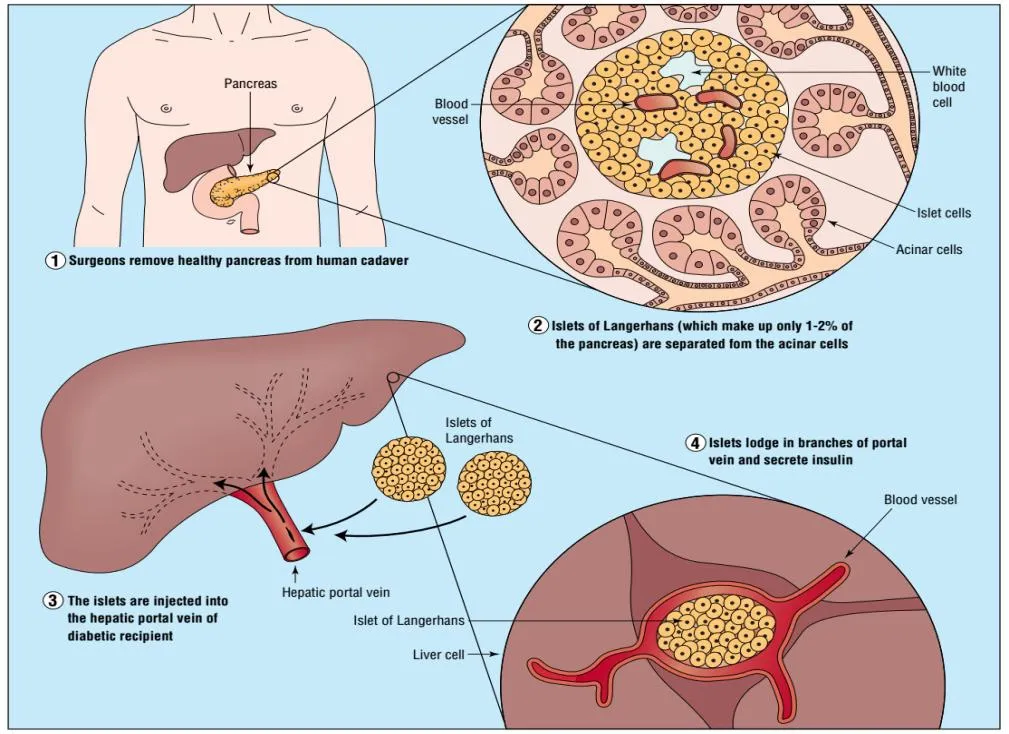
图1 胰岛移植图解[4]
在细胞移植中,如果移植的细胞材料缺少必要的保护,便会被宿主体内的免疫系统攻击,导致移植的细胞材料死亡,进而导致移植失败,甚至会使宿主产生较大的排斥反应,造成宿主的痛苦。这种必要的保护即免疫隔离。
对于移植的细胞材料,为了避免免疫排斥,需要将其包裹起来,使其与免疫系统隔离。这种用于包裹细胞使其保持活性的装置称之为免疫隔离装置。
常见的用于免疫隔离装置的材料如表1:
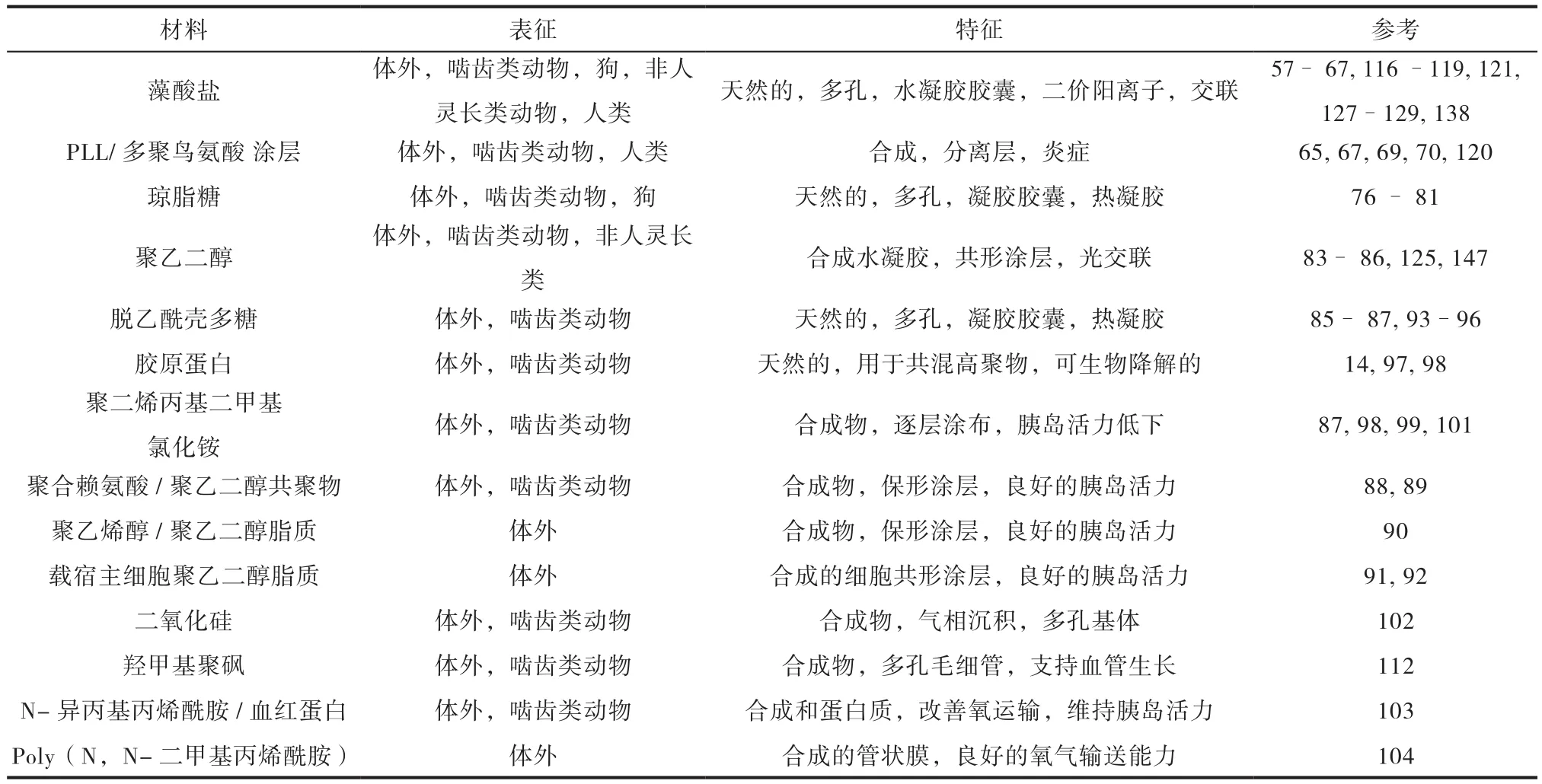
表1 常见的用于免疫隔离的材料[5]
空心纤维是具有直径范围从50到3000微米[6]的管状过滤膜。其几何形状赋予了它一系列的优点,如紧凑性、优良的传质性能和高耐外部静流体压力等[7]。在组织工程方面,空心纤维聚合物在细胞增殖和分化中充当支架或支持以允许营养物质和清除的废物高效通过[8]。聚醚砜(PES)是一种不可降解聚合物,作为生物相容性良好的生物材料,在组织工程中经常被使用。目前在血管再生、神经再生、生物反应器、生物人工肝(BAL)、生物人工肾(BAK)方面均有应用。
1 课题的提出
在引言中已经提到,胰岛移植作为I型糖尿病的一种较为有优势的治疗方法,也有一定的造成免疫排斥的风险,所以在移植时免疫隔离装置必不可少。
除了一些必要因素外,细胞能否在装置内正常工作也是一个重要的考虑因素。希望选择的免疫隔离装置不会对细胞的正常工作带来太大的影响。针对这个问题,提出了本课题的主要思路。
为了证明装置适宜细胞在其内工作,利用由四川大学膜科学实验室赠予的聚醚砜多孔细管设计微包囊结构,以大鼠胰腺癌细胞和小鼠胰岛作为研究对象,分别在普通培养皿和PES多孔管中进行培养,并通过测试其在正常以及高糖环境下释放胰岛素的量来评估细胞在PES的多孔管免疫隔离装置中的工作状态。
此课题的研究结果将对以PES多孔管作为免疫隔离装置进行胰岛的研究与应用提供改进经验,在一定程度上提高细胞移植的可行性和安全性。
2 材料及方法
2.1 材料
2.1.1 试剂
实验所用主要试剂与品牌如下表所示。
试剂名称 厂家杜氏磷酸缓冲液(DPBS)RPMI-1640培养基TrypLETMExpress胰酶胎牛血清(FBS)青霉素-链霉素丙酮酸钠MEM alpha培养基DMEM培养基Gibco(美国)牛血清白蛋白-V 北京欣经科二甲基甲酰胺(DMF)乙醇巯基乙醇北京化工厂硅胶 道康宁Histopaque 1077人淋巴细胞分离液 西格玛胶原蛋白酶P 罗氏
2.1.2 仪器
生物安全柜(Thermo),恒温培养箱(Thermo),数显恒温水浴器(国华电器),低速离心机(白洋),低温冰箱(Thermo),液氮及容器(乐山东亚),细胞冻存盒(NalGene),细胞计数板(上海求精),移液枪 (Eppendorf),移液器(accu-jet Pro)。解剖用具(上海金环)(眼科剪,眼科镊,动脉止血夹(3cm),显微止血夹(窄1.2mm),弯折的10mL注射器针头)一次性静脉输液针(0.45x0.15),蜡盘,体视镜。
2.1.3 耗材
10cm 培养皿(Corning),2mL 细胞冻存管(Corning),1.5mL离心管(Axygen),5mL离心管(Axygen),15mL离心管(Corning),50mL 离心管(Corning),10 mL 移液管(Costar),移液枪头(Axygen),微量注射器,1mL胰岛素用注射器(BectonDickinson)。
2.1.4 胰岛和细胞系
胰岛取自C57BL/6雄性小鼠,细胞系为INS-1胰腺肿瘤细胞系。
2.1.5 PES多孔细管由四川大学膜科学实验室使用微流控技术加工而成,内径为498μm,外径为696μm,平均孔径约为100nm。
2.2 方法
2.2.1 小鼠胰岛的提取与纯化
a)配消化液和终止液:
消化液0.5mg/mL(P型酶/HBSS缓冲液)现用现配。
终止液:15% FBS/HBSS缓冲液。
b)处死小鼠:断颈法,并用弯折的10mL注射器针头将其固定在蜡盘中。剪开腹腔,从小鼠体位的偏右侧翻开肠子,找到胆总管。
c)灌注胰腺:用显微止血夹将胆总管近肝端夹住,从近肠端的膨大处,利用静脉输液针向胰腺中灌注消化液(约2mL/只),至胰头胰尾头充盈即可。
d)分离胰腺:用两把眼科镊小心、快速的分离胰腺,并将分离的胰腺至于15mL离心管中。
e)静置消化:37℃水浴锅静止消化17-18min左右。
f)终止消化:先向消化好的胰腺中加入2-3mL终止液,稍稍用力晃散胰腺,没有大块的组织即可;然后将终止液加到10mL以上混匀。
g)通过100目筛网,滤液收集到50mL离心管,再用5mL终止液润洗15mL离心管,冲洗筛网,减少胰岛的丢失。
h)离心800RPM,2min,去上清,倒置离心管,置于吸水纸上,吸干剩余液体,将沉淀与5mL Histopaque 1077充分混匀,沿着内壁均匀加入5mL Hanks液,分层明显。
i)离心900g 20min,吸取中间胰岛层,经过倒置的100um滤网,使用5mL终止液将胰岛从滤网上冲洗下来,分装到两个6cm的培养皿中。
j)在体视镜下,手动挑取胰岛至含1-2mL HBSS液的3.5cm培养皿中,暂时不挑取的胰岛置于冰上。
k)胰岛培养:将纯化好的胰岛培养在3.5cm的培养皿中。
2.2.2 细胞培养
INS-1完全培养基分为88%的RPMI Medium 1640培养基、10%的胎牛血清(FBS)、1%的Sodium、1%的青霉素-链霉素(P-S)和0.005%的巯基乙醇。胰岛的培养基分为89%RPMI Medium 1640培养基、10%的胎牛血清FBS、1%青霉素-链霉素(P-S),加葡萄糖调到浓度为7mmol。
细胞的复苏过程中所用到的培养基需在水浴锅中预热准备。
a)将处于-80℃液氮罐中冻存的细胞取出,在37℃水浴锅中迅速振荡解冻,以减少在解冻过程中对细胞的损害。
b)将细胞(3mL)转移至15mL 离心管。
c)将离心管置入离心机,配平后设置100rpm,5min离心。
d)取出离心管,弃上清,向离心管中加入2mL培养基,吹打,转移至10cm培养皿。
e)用等量INS-1完全培养基稀释,以减少冻存液对细胞的持续损害。
f)加入5mL INS-1培养基于培养皿中,摇匀。
g)在培养皿边缘记录种类、代数、接种人、接种时间等信息。
h)将培养皿置于37℃恒温箱中培养。
在细胞培养过程中视其生长情况更换培养基,更换培养基时先弃旧培养基,用2mL DPBS缓冲液轻轻冲洗培养皿底部,然后弃DPBS缓冲液,加入7mLINS-1完全培养基。
当细胞占据培养皿底80%以上时,可以进行传代(传代所需TrypLETMExpress、DPBS缓冲液、INS-1完全培养基均需提前预热至37℃)。
传代步骤如下:
a)弃培养基,加入2DPBS缓冲液清洗培养皿底部,清除死亡细胞。
b)加入2mL胰酶,摇动培养皿使其铺满皿底,置于37℃恒温箱中3min。
c)取出培养皿,加入2mLINS-1完全培养基中和,吹打使细胞完全悬浮,收集液体于15mL离心管中。
d)将离心管置于离心机中,设置100rpm,5min离心。
e)弃上清,加入2mL INS-1完全培养基,吹打均匀。
f)将液体均分至两个皿中,每个皿添加INS-1完全培养基直至7mL。
g)在培养皿边缘记录种类、代数、接种人、接种时间等信息。
h)将培养皿置于37℃恒温箱中培养。
当无需继续使用该种细胞时,可将细胞冻存,冻存液的配方为15%的DMSO与85%的胎牛血清混合,在使用时每1mL冻存液与0.5mL细胞悬液混合,混合后装入细胞冻存管中,再封存至提前预热至室温的冻存盒中,放入-80℃冰箱中冻存,待冻结后转入液氮罐中进行冻存。
2.2.3 INS-1细胞和胰岛的二维和三维培养
将INS-1细胞悬液吹打混匀,向每个6cm培养皿中加入4.5μL(相当于每个多孔管细胞量的三倍)细胞悬液,加入3mL INS-1完全培养基,将培养皿置入37℃恒温箱培育。对于胰岛:向每个6cm培养皿中加入150个胰岛,加入3mL胰岛培养基,将培养皿置入37℃恒温箱培育。
将INS-1细胞置于75%乙醇中灭菌的PES多孔管取出,于DPBS缓冲液中反复漂洗。将细胞悬液吹打均匀,用微量注射器将1.5μL细胞悬液灌入多孔管,并用SILASTIC硅胶封闭两端开口。将每3个装置放入一个6cm培养皿中,加入3mL的INS-1完全培养基并置于37℃恒温箱培育。
对于胰岛:将置于75%乙醇中灭菌的PES多孔管取出,于DPBS缓冲液中反复漂洗。将细胞悬液吹打均匀,用微量注射器将150个胰岛与培养基一起灌入多孔管,并用SILASTIC硅胶封闭两端开口。将每3个装置放入一个6cm培养皿中,加入3mL的胰岛培养基并置于37℃恒温箱培育。
2.2.4 胰岛素体外分泌(GSIS)实验
a)取出培养INS-1细胞的培养皿,弃培养基,加入2 DPBS缓冲液清洗培养皿底部,清除死亡细胞。
b)加入2mL胰酶,摇动培养皿使其铺满皿底,置于37℃恒温箱中3min。
c)取出培养皿,加入2mL INS-1完全培养基中和,吹打使细胞完全悬浮,收集液体于15mL离心管中。
d)将离心管置于离心机中,设置100 rpm,5min离心。
e)弃上清,每管分别加入1mL 含2.8mM葡萄糖的INS-1完全培养基,37℃孵育一小时,各自收集上清后将上清-20℃保存待测。
f)每管分别加入1mL 含16.7mM葡萄糖的INS-1完全培养基,37℃孵育一小时,各自收集上清后将上清-20℃保存待测。
g)每组管中各加入1mL的Hanks缓冲液漂洗细胞,待重新沉淀后小心吸尽缓冲液。
h)加入酸乙醇(乙醇、水、浓盐酸以体积比为3:1:0.06 配比混合)1mL 裂解,-20℃保存待测。
对于胰岛,除收集时不用胰酶消化+离心收集而使用手动吸取外,同以上操作。
2.2.5 INS-1分泌胰岛素情况检测
该部分由北京北方生物技术研究所完成。
3 实验结果
3.1 INS-1肿瘤细胞对高糖环境响应情况
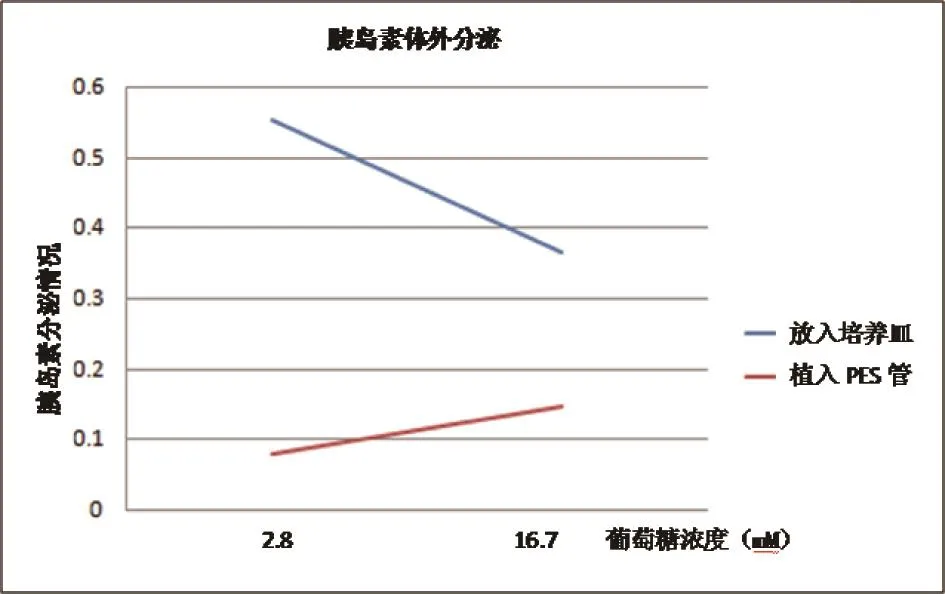
图2 胰岛素分泌曲线
由图2可以看出,随着葡萄糖浓度的提升,培养皿中的胰岛素分泌下降,而PES多孔管中胰岛素的分泌显著上升。由此可以说明,在PES管中胰腺癌细胞对于高糖的响应是比较理想的;而对于在培养皿中培养的胰腺癌细胞所出现的分泌下降的情况,可能是由于胰腺癌细胞分泌胰岛素能力的低下、培养皿中细胞团整体密度较大等原因造成。
3.2 胰岛体外培养对葡萄糖的响应性
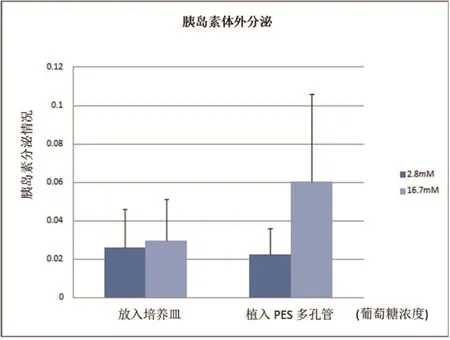
图3 放入培养皿和植入PES管的胰岛对高糖的反应性比对
由图3可以看出,随着葡萄糖浓度的提升,培养皿和PES多孔管中胰岛素的分泌都呈上升趋势,但在PES管中上升比在培养皿中的上升显著得多。由此可以说明,在PES管中胰岛对于高糖的响应是比较理想的。
4 讨论
胰岛腺移植作为Ⅰ型糖尿病根治手段之一,近年来也取得了许多进展。绝大多数Ⅰ型糖尿病、无胰岛素抗体和低水平C肽Ⅱ型糖尿病、糖尿病肾病、器官移植后糖尿病、胰腺疾病或胰腺切除导致的糖尿病等患者,适合进行成人胰岛细胞移植。
目前,胰岛移植领域主要存在的问题和困惑除了供体短缺外,移植物在宿主体内难以长期存活,患者不易获得胰岛素非依赖状态;还包括免疫抑制现存的若干问题:在无免疫抑制剂保护状态下,移植胰岛在宿主体内可出现快速排异反应,遭受免疫攻击而失活。而长期免疫抑制剂的应用又是引起供体胰岛进行性功能衰竭、导致继发失效的重要原因之一。
纳米多孔复合膜能有效地阻隔免疫球蛋白及免疫细胞,但小分子物质(如葡萄糖)能自由通过该膜,故该复合膜可以作为免疫隔离膜使用,并且具有良好的免疫隔离效果。
本文针对PES多孔管,对在装置中的胰腺癌细胞血糖响应进行定性以及定量的分析。由图2和图3数据可知胰腺癌细胞和胰岛细胞在PES多孔管中分泌胰岛素的量随着葡萄糖浓度升高而升高,展现出比较理想的情况,证实了胰岛在PES多孔管中能较为正常地工作,腺癌细胞能像胰岛细胞一样在PES多孔管中仍然能较为正常地工作。
综上,可以看出PES多孔管对胰岛性质细胞在高糖环境下的响应没有较大负面影响,能够作为潜在的免疫隔离装置,对于细胞移植有一定的价值,但其在胰岛移植方面的改良和应用仍有待进一步研究。
5 结论
INS细胞系和胰岛细胞一样具有很好的葡萄糖响应性;植入PES的胰岛对葡萄糖有很好的响应性;PES管可以作为免疫隔离装置应用于胰岛移植。
[1] Sutherland DE,Goetz FC,Sibley RK.Recurrence of disease in pancreas transplants[J].Diabetes,1989,38(suppl 1):85-87.
[2] Stratta R J,Farney A C,Rogers J,et al. Immunosuppression for pancreas transplantation with an emphasis on antibody induction strategies: review and perspective[J]. Expert Review of Clinical Immunology,2014, 10(1):117.
[3] Farney A C, Sutherland D E, Opara E C.Evolution of Islet Transplantation for the Last 30 Years[J].Pancreas,2016,45(1):8.
[4] Serup P,Madsen O D,Mandrup-Poulsen T. Science,medicine, and the future: Islet and stem cell transplantation for treating diabetes[J].Bmj,2001, 322(7277):29-32.
[5] O’Sullivan E S,Vegas A,Anderson D G,et al.Islets transplanted in immunoisolation devices:a review of the progress and the challenges that remain[J].Endocrine reviews,2011,32(6):827.
[6] Baker R W.Membrane Technology and Applications[J].Metallurgical Transactions A,2004,6.
[7] Klein E.Hollow fiber membrane developments[J].Appl Polym Symp,1997,31:361-381.
[8] Diban N,Stamatialis D.Polymeric hollow fiber membranes for bioartificial organs and tissue engineering applications[J].Journal of Chemical Technology & Biotechnology,2014,89(5):633-643.

