胰腺偶发囊肿的管理
——美国放射学院(ACR)偶发病变委员会白皮书
Alec J. Megibow, Mark E. Baker, Desiree E. Morgan, Ihab R. Kamel, Dushyant V. Sahani, Elliot Newman, William R. Brugge, Lincoln L. Berland, Pari V. Pandharipande
赵心明 译 曾蒙苏, 薛华丹, 刘再毅, 石喻 审校
ACR偶发病变项目概述
偶发病变项目的核心目标包括:①就描述偶发病变所需的患者特征和影像学特征形成共识;②为这些偶发病变的管理提供能平衡患者风险和收益的指导建议;③提出能反映影像诊断可信度的报告术语;④通过提出一个概括性的临床实践管理框架,来集中未来的研究焦点。2010年,IFC发布第一版白皮书,提出了针对胰腺、肾上腺、肾脏及肝脏四种脏器偶发病变的管理流程[1]。
共识过程:胰腺囊肿的管理方案
本文是关于IFC2010年胰腺偶发囊肿管理建议的第一次修订版。方案的制定过程包括任命1位亚组委员会主席,再由主席指定4位腹部影像学专家、1位胃肠道学专家和1位胰腺外科专家为亚组成员。亚组委员会根据已发表的文献证据提出该管理方案初稿并达成共识。如缺乏参考证据,则采用亚组的专家意见。管理方案的初稿由IFC的其他成员进行审核,包括体部委员会主席、IFC主席以及其他IFC亚组委员会主席。修订后的管理方案及相应的白皮书草稿再提交ACR的其他权益人以获得补充和反馈意见。通过反复的审核及修订达成共识,并最终形成管理方案和白皮书。IFC的共识达成过程符合ACR的标准,但并不符合其他明确的、官方的国家标准。该管理方案和建议并不代表ACR实践指南或ACR适宜性标准。该共识更适合被看做“指导”和“建议”,而不是具有正式定义的“指南”。
流程图要素:彩色编码
该方案由多个流程图组成(图1~4)。在每个流程图中,黄色方框代表需参考或获取临床数据(如病变的大小、稳定性),绿色方框代表推荐的操作(如影像随诊或活检),红色方框代表流程或随访可终止(如病变为良性或进展缓慢)。为尽量简化流程,该方案反映大多数的但非全部的影像表现和临床情况。当遇到方案中未提及的情况时,放射医师可根据病变的特定影像表现和患者特点做出判断。该方案应该被视为“建议”,而不是“管理准则”。
拟解决问题的性质和范围
1.胰腺囊肿的患病率
(美国)国家癌症研究所(National Cancer Institute,NCI)监督、流行病学和最终结局(Surveillance,Epidemiology,and End Results, SEER)登记处在2013年的一项研究显示,据统计,在40~84岁的美国人中,胰腺囊肿的患病数为3,428,874例,其总患病率为2.5%[2]。近年来,随着断层影像使用率的增加,胰腺囊肿的检出率不断提高;约2.2%的上腹部CT检查和19.6%的MRI检查检出胰腺囊肿[3-5]。尽管常用的处理指南假设了特定的胰腺囊肿类型[6-8],但许多影像检查发现的囊肿尚未定性,所以当放射医师发现这些病变时,无法据此预测其进展情况。
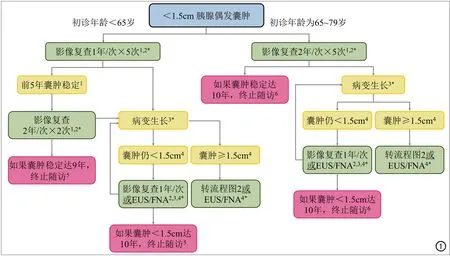
图1 <1.5cm胰腺偶发囊肿的处理策略流程图。1 对于微小“白点”病变,2年后单次随访是合适的,但如果囊肿稳定,后续是否继续随访以及随访的时间尚不明确;一些放射医师对于老年人(>75~80岁)中微小病变不予报告。2 影像随访采用增强MRI或胰腺CT扫描。3 生长(相邻两次检查比较)定义为:<5mm的囊肿最大径(在轴位或冠状位图像上)增加100%,≥5mm且<15mm的病灶最大径增加50%,无生长代表稳定。4 病变如果出现生长,可行影像随访或EUS/FNA;一般而言,EUS/FNA适合于相对更大或生长更快的囊肿;EUS/FNA的结果决定了后续步骤(图2b)。5 对<65岁的胰腺囊肿患者,部分医师选择随访至80岁。6 如果患者在随访结束前达到80岁,一般终止随访;如果囊肿初诊时患者接近但不到80岁,当患者达到80岁时,转图4以指导进一步的处理。* 无论囊肿的大小或生长速率,一旦出现壁结节、囊壁增厚、MPD扩张≥7mm或肝外胆管梗阻/黄疸应立即行EUS/FNA及外科评估。
在具有胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)家族史或遗传易感性的患者中,胰腺囊性肿瘤的患病率会增高[9]。然而,该人群现有囊肿恶变的风险增高与否,尚未明确。一项300例患导管内黏液性乳头状瘤(intraductal papillary mucinous neoplasm,IPMN)且一级亲属患PDAC的研究显示,病例组进展为胰腺癌的比率和对照组相仿,提示对于<3cm的囊肿,其随访策略不需更改[10]。患特殊遗传综合征的患者(如Peutz-Jehgers综合征和家族性非典型多痣及黑色素瘤综合征),其PDAC的患病风险增高,但尚不确定是否与胰腺囊肿的存在有关。
2.临床重要性
最常见的胰腺囊肿包括IPMN、浆液性囊腺瘤(serous cystadenoma,SCA)、含卵巢基质的黏液性囊性肿瘤(mucinous cystic neoplasm with ovarian neoplasm,MCN)、实性假乳头状瘤、胰腺囊性神经内分泌肿瘤(cystic pancreatic neuroendocrine tumor,cPNET)和假性囊肿[3]。罕见的胰腺囊肿包括真性上皮囊肿、淋巴上皮囊肿和非肿瘤性黏液囊肿。IPMN被进一步细分为分支胰管型(branch duct,BD)、主胰管型和混合型。
上述病变中,有4种无恶变潜能:假性囊肿、真性上皮囊肿、淋巴上皮囊肿及非肿瘤性黏液囊肿。实际上,恶性仅出现于黏液性囊性肿瘤。尽管有极少数恶性浆液性肿瘤的报道,SCA仍被认为是一种非恶性的病变。IPMN可从低级别进展为高级别不典型增生,最终进展为PDAC[11]。据报道,BD-IPMN的恶变率为12%~47%,混合型和主胰管型的恶变率相似,分别为38%~65%和38%~68%[3]。MCN的恶变率为10%~17%[12,13]。其他的胰腺囊性病变如实性假乳头状瘤和cPNET,一般具有特定的诊断特征,通常需手术切除。
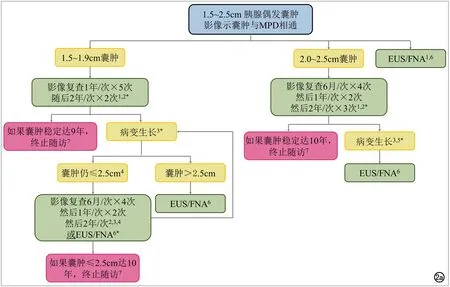
图2a 囊肿与MPD相通,大小为1.5~2.5cm的胰腺偶发囊肿的处理策略流程图。1 EUS/FNA可替代影像随访:1)初诊时;2)进入流程后(从图1)。一般而言,EUS/FNA更适合更大或生长更快的囊肿。2 影像随访采用增强MRI或胰腺CT扫描。3 生长(相邻两次检查比较)定义为囊肿最大径(在轴位或冠状位图像上)增长20%;无生长代表稳定。4 病变如果出现生长,可行影像随访或EUS/FNA。一般而言,EUS/FNA适合于更大或生长更快的囊肿。5 初诊(或从图1进入)≥2cm的囊肿的生长,按照定义囊肿至少增大到2.4cm,对于这些囊肿,建议EUS/FNA。6 EUS/FNA的结果决定了后续步骤(图2b)。7 如果患者在随访结束前达到80岁,一般终止随访。如果囊肿初诊时患者接近但不到80岁,当患者达80岁时,转图4以指导进一步的处理。* 无论囊肿的大小或生长速率,一旦出现壁结节、囊壁增厚、MPD扩张≥7mm或肝外胆管梗阻/黄疸应立即行EUS/FNA及外科评估。
在一个包含连续300例全因尸检的经典研究中,胰腺小囊肿(<4mm)的检出率为24.3%[14]。与目前所接受的腺瘤-癌演变顺序的概念[15]相对应,一个偶然发现的胰腺囊肿可能是PDAC的前身。然而,有关BD-IPMN的观察结果提示,≤2cm的病灶进展缓慢,仅小部分进展为恶性[16-20],即使存在壁结节结果同样如此[21]。偶然发现的胰腺小囊肿进展为恶性的确切概率尚不得知。
胰腺囊肿可能提示囊肿以外部位发生PDAC的概率增高;多位研究者均观察到囊肿以外的PDAC[22-25]。在一项大型的、以退伍军人为受试对象的研究中,患胰腺囊肿者的胰腺癌患病率为5.08/1,000(人·年),而无胰腺囊肿者的患病率仅为0.32/1,000(人·年);遗憾的是,该研究未报道胰腺癌与相关囊肿的位置关系[26]。在<65岁的试验组中,患有胰腺囊肿的受试者的全因死亡率高于无胰腺囊肿的受试者;但在≥65岁的试验组中,该结论不成立[24]。
3.胰腺小囊肿的意义
诊断的不确定性多集中于<2.5cm的胰腺囊肿。主要存在以下几个重要的问题:①囊肿是黏液性的吗?②如果是黏液性的,它与主胰管(main pancreatic duct,MPD)的关系如何?③如果是黏液性的,是否存在壁结节?一些研究结果显示,对<2.5cm、无壁结节的BD-IPMN予以影像随诊是适宜的[16,17,21,27],其依据是病理研究显示该病变的恶变率低[28]。然而,即使是“Sendai标准阴性”的小囊肿,也可能存在邻近MPD的微浸润,提示了影像鉴别侵袭性病变的局限性[29,30]。需注意壁结节的存在或进展,即使是在大小不变的囊肿中[31]。
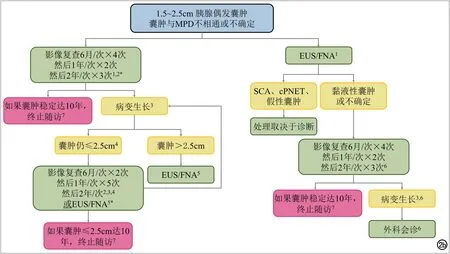
图2b 囊肿与MPD不相通或难以确定,大小为1.5~2.5cm的胰腺偶发囊肿的处理策略流程图。1 EUS/FNA可替代影像随访:1)初诊时;2)进入流程后(从图1)。一般而言,EUS/FNA更适合更大或生长更快的囊肿。2 影像随访采用增强MRI或胰腺CT扫描。3 生长(相邻两次检查比较)定义为囊肿最大径(在轴位或冠状位图像上)增长20%;无生长代表稳定。4 病变如果出现生长,可行影像随访或EUS/FNA。一般而言,EUS/FNA适合于更大或生长更快的囊肿。初诊(或从图1进入)≥2cm的囊肿的生长,按照定义囊肿至少增大到2.4cm,对于这些囊肿,建议EUS/FNA。5 EUS/FNA的结果决定了后续步骤(流程图右支)。6 在随访期间,如果出现生长或出现令人担忧的特点或高危特征,建议行手术评估。7 如果患者在随访结束前达到80岁,一般终止随访。如果囊肿初诊时患者接近但不到80岁,当患者达80岁时,转图4以指导进一步的处理。* 无论囊肿的大小或生长速率,一旦出现壁结节、囊壁增厚、MPD扩张≥7mm或肝外胆管梗阻/黄疸应立即行EUS/FNA及外科评估。
4.超声内镜引导下的细针抽吸的价值
近5年来,超声内镜(endoscopic ultrasound,EUS)引导下的细针抽吸(fine needle aspiration,FNA)的应用率逐渐增高,其作用如下:①判断囊肿是否为黏液性或黏液性可能;②明确囊肿是否与MPD相通;③检测囊液突变以预测病变行为。可根据存在非肠源性黏蛋白(艾尔逊蓝染色阳性)及癌胚抗原(CEA)浓度≥192ng/mL,诊断为黏液性囊肿[32];CEA<5ng/mL提示假性囊肿或SCA。淀粉酶>250IU/L提示假性囊肿[33];淀粉酶>18,000IU/L可明确诊断假性囊肿。2mL的液体相当于直径为1.7cm的囊肿,经验丰富的检测医师足以据此完成细胞学和CEA、淀粉酶水平检查[34]。推荐行突变相关的分子标记物检测(如K-ras,GNASmRNA 21),以及鉴别黏液性和非黏液性囊肿的葡萄糖检测[35]。囊肿的细胞学检测可能发现不典型增生的细胞。
抽吸可能有助于良恶性囊肿的鉴别[36,37],尤其是联合影像、细胞学和分子标记物信息时[38]。近期的一项多中心回顾性研究显示,一大系列的分子标记物在联合影像和临床数据时,鉴别囊肿类别的敏感度达90%~100%,特异度达92%~98%,从而可避免91%的不必要手术[39]。尽管商业的实验室可行囊液分析并获得一个针对个体囊肿的相对风险报告[40],但其与影像和细胞学相比的获益增加受到一些同行评阅出版物的质疑[41,42]。
5.随访时间
既往方案推荐2年的随访时间以确定囊肿的稳定性,及明确稳定囊肿的良性或惰性[1]。尽管该方法对大多数囊肿仍有效[43],但已有一些囊肿出现延迟生长的文献报道[44,45]。在更新方案时,我们将其纳入参考,同时参考预后与年龄相关的新观点[24]和胰腺囊肿可作为提示全胰腺PDAC患病风险增高的标志。

图3 >2.5cm的胰腺偶发囊肿的处理策略流程图。1 对于该大小的囊肿,许多中心即刻行EUS/FNA。2 对于>4cm的SCA,建议外科会诊或考虑手术切除。3 低危特点:无壁结节,无囊壁增厚,MPD管径正常,无边缘钙化。如果低危囊肿计划手术,强烈推荐术前行EUS/FNA。4 高危特点:壁结节,囊壁增厚,MPD最大管径≥7mm,边缘钙化。所有初诊有"高危特征"(肝外胆管梗阻/黄疸,强化的壁结节,MPD≥10mm)的囊肿,均需立即行手术评估。5 影像随访采用增强MRI或胰腺CT扫描。6 生长(相邻两次检查比较)定义为囊肿最大径(在轴位或冠状位图像上)增长20%;无生长代表稳定。7 如果患者在随访结束前达到80岁,一般终止随访。如果囊肿初诊时患者接近但不到80岁,当患者达80岁时,转图4以指导进一步的处理。* 无论囊肿的大小或生长速率,如果出现壁结节、囊壁增厚、MPD扩张≥7mm或肝外胆管梗阻/黄疸应立即行EUS/FNA及外科评估。
对于大多数患者,我们主张9~10年的随访,随访终点为80岁(图1~3)。对于初诊年龄<65岁的胰腺囊肿患者,以80岁为随访终点时,随访时间会超过9~10年,但这是谨慎的[24];增加随访年限与否取决于患者的个体情况。对于初诊年龄≥80岁的胰腺囊肿患者,则适用于另一套方案(图4)。根据我们的方案,年长者可不必完成全程的随访,而相对年轻的患者则可能需要更长的随访时间。所建议的随访间隔时长是依据经验性的观察制定的,而不是以随机对照试验为依据。
如上所述,对于初诊<80岁的患者,一般不建议80岁后继续随访。但发现囊肿时,年龄接近但尚未达到80岁的例外。在这种情况下,随访策略的制定需根据患者的个体情况(如患者的一般健康情况、患者的手术意愿)及囊肿的综合情况,管理策略可转至初诊年龄≥80岁的流程图(图4)。
6.完美的管理方案所面临的挑战
胰腺偶发囊肿的自然病史尚不得知,我们的方案也不能过于简单或完全确定。自2010年以来,一些相关的多研究机构及专业团体的共识文章、Meta分析以及大规模观察研究报告相继出现[1,21,34,46-50],然而这些证据的质量较差或者不够全面,其结论仍存在争议[34]。医师必须与患者讨论这些不确定性,并综合患者的风险容忍度、医师的临床判断、以及当地的专业技术做出决策。当地专业技术有限时,强烈鼓励将患者转诊至临床诊疗出色的相关机构。
报告要点
当CT或MRI检查偶然发现胰腺囊肿时,以下6点在报告中必须予以描述:囊肿的形态、部位;囊肿的大小;是否与MPD相通;是否存在“令人担忧的特点”和/或“高危特征”;在随访过程中的生长情况;是否为多发。

图4 初诊年龄≥80岁的胰腺偶发囊肿的处理策略流程图。EUS=超声内镜;FNA=细针抽吸;SCA=浆液性囊腺瘤。1 影像随访或EUS/FNA的决策需考虑患者整体健康情况以及患者的意愿;该处理流程仅适用于可行外科手术的患者。2 生长(相邻两次检查比较)定义为:<5mm的囊肿最大径(在轴位或冠状位图像上)增加100%,≥5mm且<15mm的病灶最大径增加50%,≥15mm的病灶最大径增加20%;无生长代表稳定。3 终止影像随访的决定取决于患者能否接受手术治疗、患者意愿以及囊肿的稳定性。4 对于>4cm的SCA,建议外科会诊考虑手术切除。5 低危特点:无壁结节,无囊壁增厚,主胰管管径正常,无边缘钙化。如果低危囊肿计划手术,强烈推荐术前行EUS/FNA。6 高危特点:壁结节,囊壁增厚,MPD最大管径≥7mm,边缘钙化。所有初诊有"高危特征"(肝外胆管梗阻/黄疸,强化的壁结节,MPD≥10mm)的囊肿,如患者能接受手术治疗,均需立即行手术评估。* 无论囊肿的大小或生长速率,一旦出现壁结节、囊壁增厚、MPD扩张≥7mm或肝外胆管梗阻/黄疸应立即行EUS/FNA及外科评估。
1.囊肿的形态、部位
如上所述,最常见的胰腺囊肿包括IPMN、SCA、MCN、实性假乳头状瘤、cPNET和假性囊肿。罕见的囊肿包括单纯上皮囊肿、淋巴上皮囊肿和黏液性非肿瘤性囊肿。IPMN进一步分为BD型、主胰管型和混合型。直径<10mm的囊肿是难以或几乎不可能定性的。1~3cm的囊肿通常为"不确定的",除非能明确是否与主胰管相通。如果囊肿与胰管相通,则病变为BD型或混合型IPMN。直径≥3cm的囊肿可分为寡囊、微囊、大囊、单房、或多房[51]。如果囊肿中有钙化,需报告钙化的位置。伴中心钙化的囊肿极可能为SCA,而伴边缘钙化的囊肿则可能为MCN。伴边缘钙化的MCN的恶性可能性更大[52]。
需尽可能明确SCA或假性囊肿的诊断。超过60%的SCA具有典型的特征[53],虽然一大部分的病例会出现“不典型”的形态[6,54]。临床病史和约18,000IU/L的囊液淀粉酶水平有助于假性囊肿的诊断;然而,黏液性囊肿也常见淀粉酶升高[55]。我们假定难以定性的偶发囊肿很可能是黏液性的(如IPMN),并通常需要影像随访和/或EUS引导下的FNA。
胰腺囊肿的部位(钩突、头、颈、体和尾)在评估对照研究中非常重要,且有助于鉴别诊断。例如,MCN常见于胰腺尾部,而BD-IPMN则多见于胰腺头部/钩突。
2.囊肿大小
尽管囊肿的大小对管理决策的制定非常重要,但目前尚无统一的测量方法,即使在广泛使用的共识指南中也是如此[7,48]。我们推荐在轴位或冠状位图像上测量囊肿的最长径,并报告相应的图像和序列数。含测量光标的图像需存档于临床数据库中。尽管在三维(3D)图像上可获得更精确的测量数据,但上述更简单的测量方法的可重复性更好。
3.与MPD的关系
放射医师需要报告囊肿是否与MPD相通,因为这是诊断囊肿为BD-IPMN所必要的。CT三维重建和磁共振胰胆管成像(MRCP)均能很好地观察病变与胰管是否相通,其诊断价值与EUS相仿[56,57],然而,两者并非总能明确病变与胰管相通与否。我们的方案考虑到了这种情况(图2b)。报告囊肿与MPD相通的重要性在于,与诊断不明确的结果相比,一些小的BD-IPMN(图2a),可采取稍缓和一些的管理策略。
BD-IPMN需要进一步分为单纯型或者混合型。单纯型病变与MPD以细颈相连。混合型病变同时累及MPD,且MPD直径多变。各类型的BD-IPMN均需记录MPD的最宽径,即使最宽径远离囊肿也应如此。扩张的MPD是诊断BD-IPMN的可疑征象,需立即行EUS和FNA检查以决定进一步的管理方案[58,59]。MPD扩张的标准将在下文中陈述。需要注意的是,在单纯型BD-IPMN中,MPD与囊肿颈部相连接的部位可能表现为局限性的梭形扩张。
4、“令人担忧的特点”和/或“高危特征”的存在
我们鼓励放射科医生报告中使用特定的术语——“令人担忧的特点”或“高危特征”(表1)。这些术语起源于仙台的多专家共识书[7],后于日本福冈进行修订[48],被治疗胰腺疾病的医师和其他相关临床医师广泛接受。“令人担忧的特点”包括囊肿≥3cm、增厚强化的囊壁、以及不强化的壁结节。Fukuoka标准将MPD扩张5~9mm(无其他梗阻原因)也列入其中,而我们建议将7mm定为阈值[59]。影像学检出的高危特征包括胰头囊肿继发的肝外胆道梗阻、强化的实性成分、及无其他原因所致的MPD扩张≥10mm。

表1 令人担忧的特点和高危特征*
注:*来源于Tanka等[48]。★基于Kang等[59]。
5.随访检查中的病变生长
尽管目前文献中尚无公认的关于显著“生长”的定义,我们推荐放射科医师根据以下标准报告随访中病变生长:<0.5cm的囊肿,长径增大100%; ≥0.5cm且<1.5cm的囊肿,长径增大50%;>1.5cm的囊肿,长径增大20%。
尽管大多数临床医师、外科医师和放射科医师认为病变生长可能提示病变进展为高级别不典型增生或恶性,但该假设亦受到质疑[34]。尽管如此,病变生长仍是长期随访中被广泛应用的指标。
放射科医师应尽可能的报告囊肿的生长率。部分学者认为更快的生长率(>2mm/年)有助于区分进展快和进展缓慢的囊肿[60,61]。
6.多发
放射科医师应报告多发囊肿的存在。具有最大直径的囊肿应该被作为标准病变。然而,在初诊和随访过程中,每个囊肿均需被评估生长情况和是否存在令人担忧的特点及高危特征,因为任何一个囊肿都可能出现上述特点。我们的方案适用于单个或多个胰腺偶发囊肿,因为文献对于多发囊肿的不同结局的阐述尚不明确[62,63]。目前已有一些科研团队通过2个及2个以上囊肿的患者来探讨多灶性IPMN的重要性[8,62-64],其中两个研究团队的结果显示多灶IPMN组的高级别不典型增生或恶性风险高于单发IPMN组[62,64],而另外两个研究团队未得到相同的结论[8,63]。
应用管理方案的纳入标准和排除标准
我们的方案包括5个独立的流程图(图1、2a、2b、3、4)。只有在患者为成年人(≥18岁)且无症状的情况下,该方案才可被应用于偶然检出的胰腺囊肿。当患者存在可能的相关症状(如黄疸、厌食、体重下降、可触及的肿块或脂肪泻)或相关的实验室指标异常(如淀粉酶升高)时,该方案不适用。对于腹痛患者,判断该方案是否适用在于,放射科医师需要评估疼痛是否与囊肿相关,同时考虑直接与患者沟通和/或与临床医师商议。如果患者在随访过程中出现症状,需终止应用该方案,并依据其他临床情况将患者转诊至外科会诊。
影像及临床特征的意义
流程图的5个共同原则
①所有的偶发囊肿均被假定为黏液性的,除非该囊肿有明确的其他病理特征(如SCA)或囊液抽吸证实非黏液性。这些假定的黏液性囊肿需予以随访观察或考虑手术[16,19,46]。根据初诊的囊肿大小,我们一般推荐不同策略的9~10年随访。如果囊肿生长,需增加随访频率和/或考虑EUS引导下的FNA。
②囊肿大小引导随访或干预。尽管我们推荐的囊肿大小的阈值(如<1.5cm、1.5~2.5cm、>2.5cm)不同于通常使用的3cm[48],但我们的建议紧跟具有手术证实的、“Sendai标准阴性”、<3cm的囊肿的相关研究,这些研究显示该大小的囊肿也可能存在高级别不典型增生或恶性[30,65-67]。
③因为这些流程图适用于大小在一定范围内的囊肿,囊肿生长后需更换新的流程图,最常见的是囊肿大小由<1.5cm增大为≥1.5cm。这样的更换也适用于初诊年龄接近80岁的情况,如上文(“拟解决问题的性质和范围”部分)。一般情况下,更换新的流程图后不推荐新的9~10年的随访时限,总随访时限的决策需根据患者的情况而定。或者,对生长的囊肿直接取样(如EUS引导的FNA)也是合适的。
④“令人担忧的特点”或“高危特征”的出现,如上文所述(“报告要点”部分),应该考虑EUS/FNA及外科会诊。≥3cm的囊肿如无其他“令人担忧的特点”或“高危特征”,可仅随访。
⑤与既往影像进行对照至关重要,因为既往检查可评估囊肿的稳定性和特点,包括那些经常可观察到胰腺的检查,如胸部CT、脊椎CT/MR、PET/CT以及腹部超声。同时,可将之前检查的日期作为基线以制定随访时间表。
管理方案总结
流程图1阐述的是<1.5cm的囊肿患者。患者被分为两组(<65岁和65~79岁)。年龄越小,胰腺囊肿越罕见[2],但对应的全因死亡率更高[24],故≥65岁组的随访频率低于<65岁组(初始随访时间分别为2年及每年)[43]。我们并不推荐对每个初次发现的囊肿进行明确定性。我们建议假设所有的囊肿均为黏液性(如小IPMN),需要随访观察[68],因为其绝大部分为惰性[16,27,69]。
T2WI上见到的“白点”(<5mm)病变是一个特殊情况。根据有限的临床及已发表文献的经验,我们认为2年后行1次CT/MRI随访,如果病变稳定,则终止随访[43,69]。某些放射科医师对75~80岁患者中的“白点”病变不予报告。
流程图2a、2b根据囊肿是否与MPD相通,是否可被明确诊断为BD-IPMN,将1.5~2.5cm的囊肿分为两组。如果与MPD相通(图2a),随访策略取决于初诊的囊肿大小。1.5~1.9cm的囊肿的随访策略为先每年随访,随访5年,然后每2年随访,随访4年。2.0~2.5cm的囊肿先每6个月随访,随访2年;接着每年随访,随访2年;然后每2年随访,随访6年。发现病变时直接予以EUS引导下的FNA是代替随访的一个选择。该方法是基于囊液抽吸和血清学检查所获得的数据可进一步将囊肿进行危险分层;然而,囊液抽吸很少获得超过影像学的获益[39,70],除非进行最先进的生物标记物及基因分析。
流程图2b提供了不确定为黏液性的、1.5~2.5cm的囊肿的处理指导(图2b)。该流程图描述了两条途径:密切的影像随访和EUS引导的FNA。后者可确定囊肿是否为黏液性,并指导相关的决策制定[71]。
流程图3阐述的是初诊>2.5cm的囊肿。如果影像或囊液抽吸可诊断囊肿为“良性”,如SCA,则随访取决于患者的症状,尽管有症状或>4cm的SCA因为大小和/或预期增长需要进行手术切除[72]。这不包括假性囊肿,因为大多数患者会有或近期曾有相关症状。而对于其他的>2.5cm的囊肿,需要评估是否存在上述的令人担忧的特点和/或高危特征。低危囊肿可仔细随访(即使≥3cm),而高危囊肿需立即予EUS/FNA,以及手术评估。许多中心对>3cm的囊肿一律行囊液抽吸检查,如果为黏液性则推荐手术切除[73]。我们推荐在手术切除前行EUS和FNA,以将不必要的手术最少化。
流程图4阐述的是初诊年龄≥80岁的胰腺偶发囊肿患者。该推荐是基于囊肿大小阈值为2.5cm、整体的健康情况、以及患者的意愿。我们不推荐对不适合手术的囊肿患者进行随访观察。如上文所述(“拟解决问题的性质和范围”部分),如果发现囊肿时,患者的年龄接近但不到80岁,当患者到80岁时,可用图4指导进一步的管理策略。
成像方案优化
影像随访可采用含对比剂增强的MRI检查或有“胰腺扫描方案”的多排CT。MRI能避免多次CT随访所产生的累积辐射暴露,但其对“令人担忧的特点”或“高危特征”的检出并不优于胰腺CT扫描[20,74-76]。
不论何种检查方式,一般均需静脉注射对比剂、多期采集、以及薄层三维观察。16排或更高排数的CT机可获得体素各向同性的亚毫米层厚图像,且可重建成更厚的层厚(3~5mm)。胰腺期扫描在注射对比剂后50s左右进行。采用4~5mL/s的对比剂注射流率可最佳显示胰腺周围血管结构且使胰腺最大强化。第二期扫描推荐时间在80s左右,用以评估肝脏情况[77,78]。
MRI检查可使用1.5T或3T机器。推荐序列有脂肪抑制的T2加权序列(单次激发或屏气)以及包括动脉期、门脉早期、门脉晚期的钆剂增强的T1加权梯度回波序列[79]。在原始数据(薄层)三维分析的辅助下,MRCP有助于诊断囊肿与MPD相通与否。MRI随访是否常规使用增强扫描尚存在争议。MRI平扫扫描时间更短,花费更低,同时在不典型增生进展方面的检出与增强扫描无明显差异[80,81]。但是,MRI增强扫描有助于壁结节强化(高危征象)的检出,且胰腺期可提高其他部位的异时性PDAC的检出能力。包含T2加权和增强扫描的简化MR扫描程序,与标准的MR检查在随访中的作用相当[81]。
CT及MRI胰腺扫描方案的具体情况详见美国胰腺协会及腹部放射学会的联合声明[82]。这些扫描方案已被纳入美国国立综合癌症网络(NCCN)的胰腺扫描指南(版本1.2016)。
结论
更新后的管理方案纳入了关于胰腺囊肿生长时间框延长的最新信息,并指出了对特定囊肿的恶性风险的评估能力是有限的。本白皮书提出了测量囊肿的特定标准和病变生长的定义,推荐了根据患者特点和囊肿初诊大小所采用的不同随访策略。
致谢:ACR感谢腹部放射学会、CT及磁共振学会为本白皮书做出的贡献及支持。此外,我们感谢ACR IFC执行委员会成员William Mayo-Smith博士(IFC肾上腺委员亚组主席)、Brain Herts博士(IFC肾脏委员亚组主席)和Richard Gore博士(IFC肝脏委员亚组主席)对本白皮书内容的投入和反馈。
[1] Berland LL,Silverman SG,Gore RM,et al.Managing incidental findings on abdominal CT:white paper of the ACR incidental findings committee[J].J Am Coll Radiol,2010,7(10):754-773.
[2] Gardner TB,Glass LM,Smith KD,et al.Pancreatic cyst prevalence and the risk of mucin-producing adenocarcinoma in US adults[J].Am J Gastroenterol,2013,108(10):1546-1550.
[3] Stark A,Donahue TR,Reber HA,et al.Pancreatic cyst disease:a review[J].JAMA,2016,315(17):1882-1893.
[4] Zanini N,Giordano M,Smerieri E,et al.Estimation of the prevalence of asymptomatic pancreatic cysts in the population of san marino[J].Pancreatology,2015,15(4):417-422.
[5] Moris M,Bridges MD,Pooley RA,et al.Association between advances in high-resolution cross-section imaging technologies and increase in prevalence of pancreatic cysts from 2005 to 2014[J].Clin Gastroenterol Hepatol,2016,14(4):585-593.
[6] Sun HY,Kim SH,Kim MA,et al.CT imaging spectrum of pancreatic serous tumors:based on new pathologic classification[J].Eur J Radiol,2010,75(2):e45-e55.
[7] Tanaka M,Chari S,Adsay V,et al.International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas[J].Pancreatology,2006,6(1-2):17-32.
[8] Mori Y,Ohtsuka T,Kono H,et al.Management strategy for multifocal branch duct intraductal papillary mucinous neoplasms of the pancreas[J].Pancreas,2012,41(7):1008-1012.
[9] Canto MI,Hruban RH,Fishman EK,et al.Frequent detection of pancreatic lesions in asymptomatic high-risk individuals[J].Gastroenterology,2012,142(4):796-804.quiz e14-e15.
[10] Mandai K,Uno K,Yasuda K.Does a family history of pancreatic ductal adenocarcinoma and cyst size influence the follow-up strategy for intraductal papillary mucinous neoplasms of the pancreas?[J].Pancreas,2014,43(6):917-921.
[11] Adsay NV.Cystic neoplasia of the pancreas:pathology and biology[J].J Gastrointest Surg,2008,12(3):401-404.
[12] Park JW,Jang JY,Kang MJ,et al.Mucinous cystic neoplasm of the pancreas:is surgical resection recommended for all surgically fit patients?[J].Pancreatology,2014,14(2):131-136.
[13] Yamao K,Yanagisawa A,Takahashi K,et al.Clinicopathological features and prognosis of mucinous cystic neoplasm with ovarian-type stroma:a multi-institutional study of the Japan pancreas society[J].Pancreas,2011,40(1):67-71.
[14] Kimura W,Nagai H,Kuroda A,et al.Analysis of small cystic lesions of the pancreas[J].Int J Pancreatol,1995,18(3):197-206.
[15] Brat DJ,Lillemoe KD,Yeo CJ,et al.Progression of pancreatic intraductal neoplasias to infiltrating adenocarcinoma of the pancreas[J].Am J Surg Pathol,1998,22(2):163-169.
[16] Tanno S,Nakano Y,Nishikawa T,et al.Natural history of branch duct intraductal papillary-mucinous neoplasms of the pancreas without mural nodules:long-term follow-up results[J].Gut,2008,57(3):339-343.
[17] Maguchi H,Tanno S,Mizuno N,et al.Natural history of branch duct intraductal papillary mucinous neoplasms of the pancreas:a multicenter study in Japan[J].Pancreas,2011,40(3):364-370.
[18] Handrich SJ,Hough DM,Fletcher JG,et al.The natural history of the incidentally discovered small simple pancreatic cyst: long-term follow-up and clinical implications[J].Am J Roentgenol,2005,184(1):20-23.
[19] Arlix A,Bournet B,Otal P,et al.Long-term clinical and imaging follow-up of nonoperated branch duct form of intraductal papillary mucinous neoplasms of the pancreas[J].Pancreas,2012,41(2):295-301.
[20] Nougaret S,Reinhold C,Chong J,et al.Incidental pancreatic cysts:natural history and diagnostic accuracy of a limited serial pancreatic cyst MRI protocol[J].Eur Radiol,2014,24(5):1020-1029.
[21] Kobayashi G,Fujita N,Maguchi H,et al.Natural history of branch duct intraductal papillary mucinous neoplasm with mural nodules:a Japan pancreas society multicenter study[J].Pancreas,2014,43(4):532-538.
[22] Tanno S,Nakano Y,Koizumi K,et al.Pancreatic ductal adenocarcinomas in long-term follow-up patients with branch duct intraductal papillary mucinous neoplasms[J].Pancreas,2010,39(1):36-40.
[23] Law JK,Wolfgang CL,Weiss MJ,et al.Concomitant pancreatic adenocarcinoma in a patient with branch-duct intraductal papillary mucinous neoplasm[J].World J Gastroenterol,2014,20(27):9200-9204.
[24] Chernyak V,Flusberg M,Haramati LB,et al.Incidental pancreatic cystic lesions:is there a relationship with the development of pancreatic adenocarcinoma and all-cause mortality?[J].Radiology,2015,274(1):161-169.
[25] Lafemina J,Katabi N,Klimstra D,et al.Malignant progression in IPMN:a cohort analysis of patients initially selected for resection or observation[J].Ann Surg Oncol,2013,20(2):440-447.
[26] Munigala S,Gelrud A,Agarwal B.Risk of pancreatic cancer in patients with pancreatic cyst[J].Gastrointest Endosc,2016,84(1):81-86.
[27] Morris-Stiff G,Falk GA,Chalikonda S,et al.Natural history of asymptomatic pancreatic cystic neoplasms[J].HPB(Oxford),2013,15(3):175-181.
[28] Terris B,Ponsot P,Paye F,et al.Intraductal papillary mucinous tumors of the pancreas confined to secondary ducts show less aggressive pathologic features as compared with those involving the main pancreatic duct[J].Am J Surg Pathol,2000,24(10):1372-1377.
[29] Fritz S,Klauss M,Bergmann F,et al.Pancreatic main-duct involvement in branch-duct IPMNs:an underestimated risk[J].Ann Surg,2014,260(5):848-55;discussion 855-856.
[30] Fritz S,Klauss M,Bergmann F,et al.Small (Sendai negative) branchduct IPMNs:not harmless[J].Ann Surg,2012,256(2):313-320.
[31] Uehara H,Ishikawa O,Katayama K,et al.Size of mural nodule as an indicator of surgery for branch duct intraductal papillary mucinous neoplasm of the pancreas during follow-up[J].J Gastroenterol,2011,46(5):657-663.
[32] Rockacy M,Khalid A.Update on pancreatic cyst fluid analysis[J].Ann Gastroenterol,2013,26(2):122-127.
[33] van der Waaij LA,van Dullemen HM,Porte RJ.Cyst fluid analysis in the differential diagnosis of pancreatic cystic lesions:a pooled analysis[J].Gastrointest Endosc,2005,62(3):383-389.
[34] Scheiman JM,Hwang JH,Moayyedi P.American gastroenterological association technical review on the diagnosis and management of asymptomatic neoplastic pancreatic cysts[J].Gastroenterology,2015,148(4):824-848,e22.
[35] Thiruvengadam N,Park WG.Systematic review of pancreatic cyst fluid biomarkers:the path forward[J].Clin Transl Gastroenterol,2015,6(6):e88.
[36] Freeny PC,Saunders MD.Moving beyond morphology:new insights into the characterization and management of cystic pancreatic lesions[J].Radiology,2014,272(2):345-363.
[37] Khashab MA,Kim K,Lennon AM,et al.Should we do EUS/FNA on patients with pancreatic cysts? The incremental diagnostic yield of EUS over CT/MRI for prediction of cystic neoplasms[J].Pancreas,2013,42(4):717-721.
[38] Gillis A,Cipollone I,Cousins G,et al.Does EUS-FNA molecular analysis carry additional value when compared to cytology in the diagnosis of pancreatic cystic neoplasm?A systematic review[J].HPB (Oxford),2015,17(5):377-386.
[39] Springer S,Wang Y,Dal Molin M,et al.A combination of molecular markers and clinical features improve the classification of pancreatic cysts[J].Gastroenterology,2015,149(6):1501-1510.
[40] Das A,Brugge W,Mishra G,et al.Managing incidental pancreatic cystic neoplasms with integrated molecular pathology is a cost-effective strategy[J].Endosc Int Open,2015,3(05):E479-E486.
[41] Lee LS,Wu BU,Banks PA,et al.Utility of commercial DNA analysis in detecting malignancy within pancreatic cysts[J].JOP,2014,15(2):182-188.
[42] Panarelli NC,Sela R,Schreiner AM,et al.Commercial molecular panels are of limited utility in the classification of pancreatic cystic lesions[J].Am J Surg Pathol,2012,36(10):1434-1443.
[43] Das A,Wells CD,Nguyen CC.Incidental cystic neoplasms of pancreas:what is the optimal interval of imaging surveillance?[J].Am J Gastroenterol,2008,103(7):1657-1662.
[44] Brook OR,Beddy P,Pahade J,et al.Delayed growth in incidental pancreatic cysts:are the current American college of radiology recommendations for follow-up appropriate?[J].Radiology,2016,278(3):752-761.
[45] Khannoussi W,Vullierme MP,Rebours V,et al.The long term risk of malignancy in patients with branch duct intraductal papillary mucinous neoplasms of the pancreas[J].Pancreatology,2012,12(3):198-202.
[46] Buscarini E,Pezzilli R,Cannizzaro R,et al.Italian consensus guidelines for the diagnostic work-up and follow-up of cystic pancreatic neoplasms[J].Dig Liver Dis,2014,46(6):479-493.
[47] Del Chiaro M,Verbeke C,Salvia R,et al.European experts consensus statement on cystic tumours of the pancreas[J].Dig Liver Dis,2013,45(9):703-711.
[48] Tanaka M,Fernandez-del Castillo C,Adsay V,et al.International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J].Pancreatology,2012,12(3):183-197.
[49] Tanaka S,Nakao M,Ioka T,et al.Slight dilatation of the main pancreatic duct and presence of pancreatic cysts as predictive signs of pancreatic cancer:a prospective study[J].Radiology,2010,254(3):965-972.
[50] Moris M,Raimondo M,Woodward TA,et al.International intraductal papillary mucinous neoplasms registry:long-term results based on the new guidelines[J].Pancreas,2017,46(3):306-310.
[51] Sahani DV,Kadavigere R,Saokar A,et al.Cystic pancreatic lesions:a simple imaging-based classification system for guiding management[J].Radiographics,2005,25(6):1471-1484.
[52] Procacci C,Carbognin G,Accordini S,et al.CT features of malignant mucinous cystic tumors of the pancreas[J].Eur Radiol,2001,11(9):1626-1630.
[53] Procacci C,Graziani R,Bicego E,et al.Serous cystadenoma of the pancreas:report of 30 cases with emphasis on the imaging findings[J].J Comput Assist Tomogr,1997,21(3):373-382.
[54] Choi JY,Kim MJ,Lee JY,et al.Typical and atypical manifestations of serous cystadenoma of the pancreas:imaging findings with pathologic correlation[J].Am J Roentgenol,2009,193(1):136-142.
[55] Park WG,Mascarenhas R,Palaez-Luna M,et al.Diagnostic performance of cyst fluid carcinoembryonic antigen and amylase in histologically confirmed pancreatic cysts[J].Pancreas,2011,40(1):42-45.
[56] Kim JH,Eun HW,Park HJ,et al.Diagnostic performance of MRI and EUS in the differentiation of benign from malignant pancreatic cyst and cyst communication with the main duct[J].Eur J Radiol,2012,81(11):2927-2935.
[57] Jones MJ,Buchanan AS,Neal CP,et al.Imaging of indeterminate pancreatic cystic lesions:a systematic review[J].Pancreatology,2013,13(4):436-442.
[58] Fritz S,Hackert T,Buchler MW.Pancreatic intraductal papillary mucinous neoplasm-where is the challenge?[J].Dig Dis,2015,33(1):99-105.
[59] Kang MJ,Jang JY,Lee S,et al.Clinicopathological meaning of size of main-duct dilatation in intraductal papillary mucinous neoplasm of pancreas:proposal of a simplified morphological classification based on the investigation on the size of main pancreatic duct[J].World J Surg,2015,39(8):2006-2013.
[60] Kang MJ,Jang JY,Kim SJ,et al.Cyst growth rate predicts malignancy in patients with branch duct intraductal papillary mucinous neoplasms[J].Clin Gastroenterol Hepatol,2011,9(1):87-93.
[61] Kwong WT,Lawson RD,Hunt G,et al.Rapid growth rates of suspected pancreatic cyst branch duct intraductal papillary mucinous neoplasms predict malignancy[J].Dig Dis Sci,2015,60(9):2800-2806.
[62] Raman SP,Kawamoto S,Blackford A,et al.Histopathologic findings of multifocal pancreatic intraductal papillary mucinous neoplasms on CT[J].Am J Roentgenol,2013,200(3):563-569.
[63] Castelli F,Bosetti D,Negrelli R,et al.Multifocal branch-duct intraductal papillary mucinous neoplasms (IPMNs) of the pancreas:magnetic resonance (MR) imaging pattern and evolution over time[J].Radiol Med,2013,118(6):917-929.
[64] Fritz S,Schirren M,Klauss M,et al.Clinicopathologic characteristics of patients with resected multifocal intraductal papillary mucinous neoplasm of the pancreas[J].Surgery,2012,152(3):S74-S80.
[65] Woo SM,Ryu JK,Lee SH,et al.Branch duct intraductal papillary mucinous neoplasms in a retrospective series of 190 patients[J].Br J Surg,2009,96(4):405-411.
[66] Pelaez-Luna M,Chari ST,Smyrk TC,et al.Do consensus indications for resection in branch duct intraductal papillary mucinous neoplasm predict malignancy? A study of 147 patients[J].Am J Gastroenterol,2007,102(8):1759-1764.
[67] Jang JY,Kim SW,Lee SE,et al.Treatment guidelines for branch duct type intraductal papillary mucinous neoplasms of the pancreas:when can we operate or observe?[J].Ann Surg Oncol,2008,15(1):199-205.
[68] Farrell JJ.Prevalence,diagnosis and management of pancreatic cystic neoplasms:current status and future directions[J].Gut Liver,2015,9(5):571-589.
[69] Allen PJ,D'Angelica M,Gonen M,et al.A selective approach to the resection of cystic lesions of the pancreas:results from 539 consecutive patients[J].Ann Surg,2006,244(4):572-582.
[70] Hoffman RL,Gates JL,Kochman ML,et al.Analysis of cyst size and tumor markers in the management of pancreatic cysts:support for the original Sendai criteria[J].J Am Coll Surg,2015,220(6):1087-1095.
[71] Walsh RM,Henderson JM,Vogt DP,et al.Prospective preoperative determination of mucinous pancreatic cystic neoplasms[J].Surgery,2002,132(4):628-33;discussion 633-634.
[72] Jais B,ReboursV,Malleo G,et al.Serous cystic neoplasmof the pancreas:a multinational study of 2622 patientsunder the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas)[J].Gut,2016,65(2):305-312.
[73] Walsh RM,Vogt DP,Henderson JM,et al.Management of suspected pancreatic cystic neoplasms based on cyst size[J].Surgery,2008,144(4):677-684;discussion 684-685.
[74] Chen FM,Ni JM,Zhang ZY,et al.Presurgical evaluation of pancreatic cancer:a comprehensive imaging comparison of CT versus MRI[J].Am J Roentgenol,2016,206(3):526-535.
[75] Lee HJ,Kim MJ,Choi JY,et al.Relative accuracy of CT and MRI in the differentiation of benign from malignant pancreatic cystic lesions[J].Clin Radiol,2011,66(4):315-321.
[76] Sainani NI,Saokar A,Deshpande V,et al.Comparative performance of MDCT and MRI with MR cholangiopancreatography in characterizing small pancreatic cysts[J].Am J Roentgenol,2009,193(3):722-731.
[77] Fletcher JG,Wiersema MJ,Farrell MA,et al.Pancreatic malignancy:value of arterial,pancreatic,and hepatic phase imaging with multidetector row CT[J].Radiology,2003,229(1):81-90.
[78] McNulty NJ,Francis IR,Platt JF,et al.Multi-detector row helical CT of the pancreas:effect of contrast-enhanced multiphasic imaging on enhancement of the pancreas,peripancreatic vasculature,and pancreatic adenocarcinoma[J].Radiology,2001,220(1):97-102.
[79] Matos C,Bali MA,Delhaye M,et al.Magnetic resonance imaging in the detection of pancreatitis and pancreatic neoplasms[J].Best Pract Res Clin Gastroenterol,2006,20(1):157-178.
[80] Macari M,Lee T,Kim S,et al.Is gadolinium necessary for MRI follow-up evaluation of cystic lesions in the pancreas? Preliminary results[J].Am J Roentgenol,2009,192(1):159-164.
[81] Pozzi-Mucelli RM,Rinta-Kiikka I,Wunsche K,et al.Pancreatic MRI for the surveillance of cystic neoplasms:comparison of a short with a comprehensive imaging protocol[J].Eur Radiol,2017,27(1):41-50.
[82] Al-Hawary MM,Francis IR,Chari ST,et al.Pancreatic ductal adenocarcinoma radiology reporting template:consensus statement of the Society of Abdominal Radiology and the American Pancreatic Association[J].Gastroenterology,2014,146(1):291-304,e1.

