人参3-O-UGT1基因RNAi表达载体工程菌的构建
卢 超,赵寿经,,张晓佳,杜芃川,王雪松,
(1.吉林大学 生物与农业工程学院,长春 130022;2.吉林大学 生命科学学院,长春 130012)
0 引 言
人参和西洋参是重要的传统中药材,人参皂苷是人参属植物主要的药理活性成分[1,2]。与西洋参相比,人参根部的Rg1/Rd比值较高,这是传统中医理论人参“性温”而西洋参“性凉”的现代分子基础[3,4]。原人参二醇型皂苷以人参皂苷Rd为代表,主要通过催化原人参二醇的C3和C20号位羟基的糖基化形成;原人参三醇型皂苷以人参皂苷Rg1为代表,主要通过催化原人参三醇的C6和C20号位羟基的糖基化形成[5,6]。
原人参二醇3号位葡糖糖基转移酶1基因(Pg3-O-UGT1)可催化原人参二醇形成人参皂苷Rh2,是二醇型皂苷合成过程的关键酶基因。通过RNA干扰(RNA interference, RNAi)技术抑制人参中Pg3-O-UGT1基因的表达,可使代谢能量主要流向三醇型皂苷合成支路;在改善人参药理活性的同时为人参皂苷合成途径的分子机理研究奠定基础[7,8]。
本文利用酶切连接技术,通过克隆载体构建了人参3-O-UGT1基因的植物表达载体工程菌(A4-pBI121-3UGT1-RNAi),为研究人参皂苷体内合成机制和种质创新奠定了基础,也为传统名贵中药材的研究提供了素材。
1 实验材料
人参发根材料和发根农杆菌(Agrobacterium rhizogenes)A4为本实验室保存;感受态大肠杆菌JM109、pMD20-T载体、pBI121植物双元表达载体、总RNA提取试剂盒、反转录试剂盒、DNA凝胶回收试剂盒、T4 DNA连接酶、DNA聚合酶以及各种限制性内切酶等,均购于宝生物工程(大连)有限公司;卡那霉素购自于北京鼎国生物制品有限公司。
2 试验方法
2.1 RNA干扰元件核心片段的获得
由GenBank得到原人参二醇3号位葡糖糖基转移酶1基因(Pg3-O-UGT1;JX898529)序列,通过Clustal X软件将其核酸序列与其他物种糖基转移酶基因(西洋参GT, KR028477; 黄瓜GT, XM004136988; 甜瓜GT, XM008457048)对比确定其保守区域。再与人参中原人参二醇合成酶基因(人参D12H, JN604536)、原人参三醇合成酶基因(人参P6H, JX036031)、人参皂苷3号位葡糖糖基转移酶2基因(人参GT2, JX898530)对比确定干扰区域不会影响其他相关基因的正常表达。用软件 Primer Premier 5.0设计核心片段的特异性引物:P1, 5′- AGA GGA AAA AGG CCT AAT AGT GAG T-3′;P2, 5′-ACT CAT CAA TAT TCT TAT CAG AGC T-3′。
以MS液体培养基中培养4周的人参发根为实验材料,用植物总RNA提取试剂盒提取人参总RNA。以总RNA为模板,用反转录试剂盒进行RT-PCR,获得人参cDNA。以人参cDNA为模板进行核心片段的PCR扩增,将纯化后的PCR产物按比例与pMD20-T载体进行TA克隆连接,采用热转化法将连接产物转化至E.coliJM109感受态细胞中,提取质粒测序验证。将验证正确的重组质粒命名为pMD-GT。
2.2 RNA干扰元件的构建
以重组质粒pMD-GT为模板,以P3(在P1的5′端添加XbaⅠ酶切位点和保护碱基)和P4(在P2的5′端添加BamH Ⅰ酶切位点和保护碱基)为引物扩增正义片段,PCR程序与扩增核心片段相同;以重组质粒pMD-GT为模板,以P5(在P2的5′端添加SmaⅠ酶切位点和保护碱基)和P6(在P1的5’端添加SacⅠ酶切位点和保护碱基)为模板扩增反义片段,PCR程序与上相同。使用XbaⅠ/BamH Ⅰ限制酶对重组质粒pMD-GT和正义片段同时双酶切,纯化酶切产物,使用T4 DNA连接酶进行连接,将测序验证后的重组载体命名为pMD-S;使用SmaⅠ/SacⅠ限制酶对重组质粒pMD-S和反义片段同时双酶切,纯化酶切产物,使用T4 DNA连接酶进行连接,采用热转化法将连接产物转化至E.coliJM109感受态细胞中,提取质粒进行双酶切和测序验证。将验证后的重组载体命名为pMD-3UGT1-RNAi(3种重组质粒结构如图1所示)。
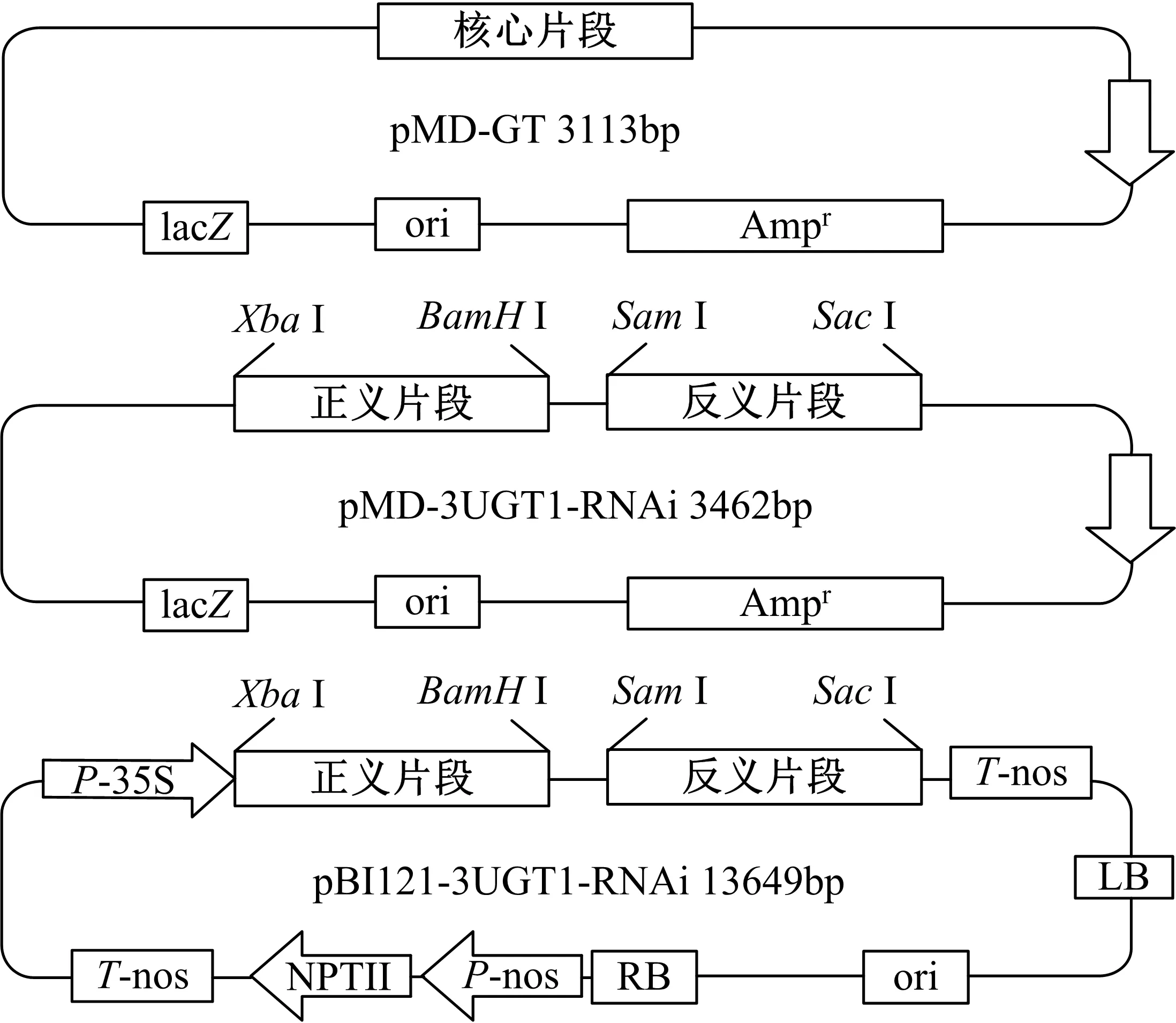
图1 三种重组载体结构示意图Fig. 1 Schematic diagram of three recombinant vectors
2.3 RNA干扰表达载体的构建和转化
使用XbaⅠ/SacⅠ限制酶对重组质粒pMD-3UGT1-RNAi和表达载体pBI121同时双酶切,纯化酶切产物,使用T4 DNA连接酶进行连接,采用热转化法将连接产物转化至E.coliJM109感受态细胞中,涂布于含有50 mg/L卡那霉素的LB固体培养基上,过夜培养挑取单菌落扩大培养后提取质粒进行双酶切验证。将验证后的重组载体命名为pBI121-3UGT1-RNAi。采用热转化法将重组载体pBI121-3UGT1-RNAi转化至发根农杆菌A4感受态细胞中,涂布于含有50 mg/L卡那霉素的YEB固体培养基上培养36 h,挑取单菌落扩大培养后提取Ri质粒进行质粒PCR验证。
3 结果与分析
3.1 RNA干扰元件核心片段的扩增
相关基因的核酸序列对比结果如图2和3所示。在所示图中,序列上方的黑点越密集就表示该区域保守性越高,反之亦然。

图2 不同植物GT基因序列对比图Fig. 2 Comparison of GT sequences in different plants

图3 人参中相关基因序列对比图Fig. 3 Comparison of relative gene sequences inPanax ginseng
在图2中,所选取的Pg3-O-UGT1基因片段与西洋参、甜瓜、黄瓜的糖基转移酶(GT)基因相比较具有较高的保守性,可以确定该核酸片段为Pg3-O-UGT1基因核心片段。在图3中,拟干扰的核心片段与人参中其他影响皂苷合成的基因相似性很低。因此,干扰所选取的目的基因不会影响其他与皂苷合成的相关基因的正常表达。
人参发根总RNA的电泳结果如图4所示。在图4的 1~3泳道中28S rRNA和18S rRNA的特征条带清晰,且28S rRNA和18S rRNA条带的亮度和宽度比例大约为2∶1。电泳结果证明所提总RNA比较完整,满足后续实验需要。

图4 人参总RNA电泳图Fig.4 Electrophoresis of total RNA from Panax ginseng
以人参发根总RNA发转录获得的cDNA为模板,以P1/P2为引物扩增核心片段。核心片段的电泳结果如图5所示。
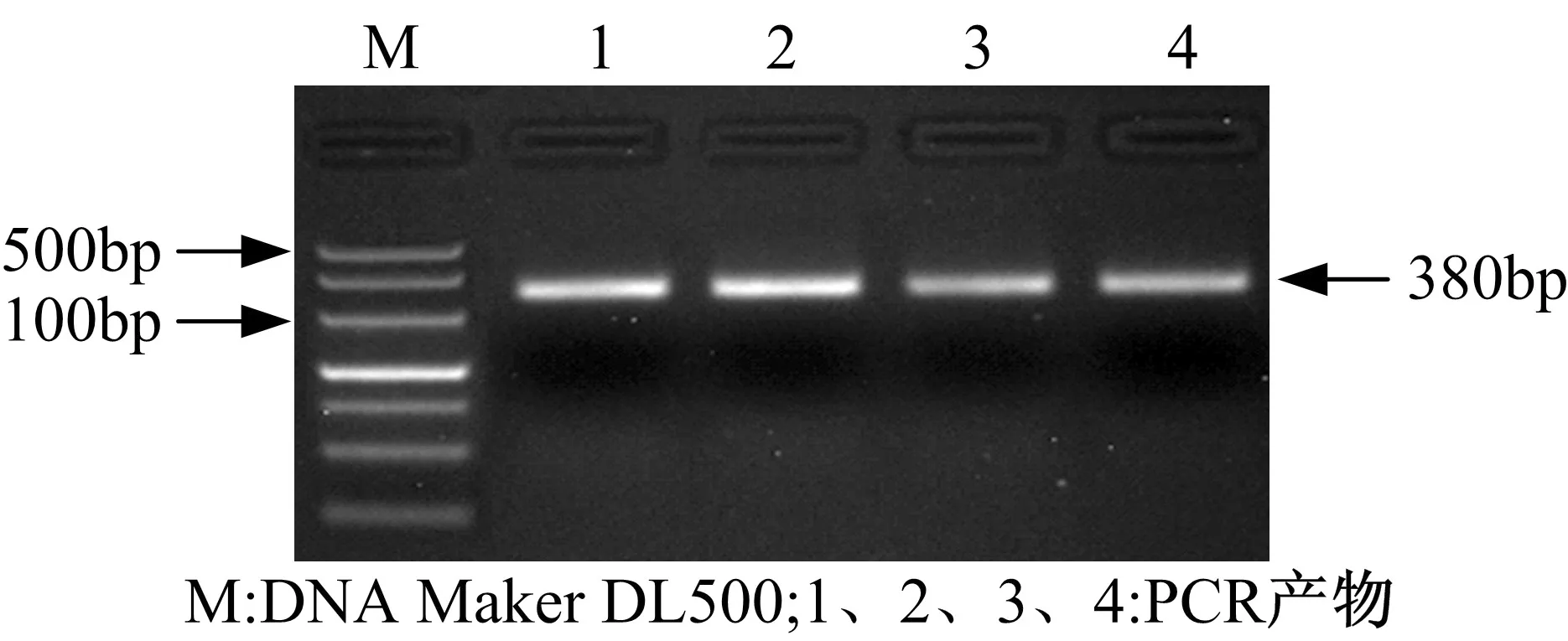
图5 RT-PCR产物电泳图Fig. 5 Electrophoresis of the RT-PCR products
在图5中,1-4泳道在380bp左右处有清晰条带,将该条带纯化回收后与pMD20-T载体连接,并转化E.coliJM109感受态细胞。将阳性克隆菌送至北京金维智公司进行测序验证,测序结果与GenBank已发表的糖基转移酶序列一致。将经验证的该重组质粒命名为pMD-GT。
3.2 RNA干扰元件的构建
以重组质粒pMD-GT为模板,以P3/P4为引物扩增正义片段。用XbaⅠ/BamHⅠ限制酶对纯化后的正义片段与重组质粒pMD-GT同时双酶切,用T4 DNA连接酶进行连接并转化E.coliJM109感受态细胞。提取阳性克隆菌质粒进行双酶切和测序验证,双酶切结果如图6所示。
在图6中,1泳道2730bp和380bp大小条带分别是经酶切后的pMD20-T载体片段和正义片段。将验证后的重组载体命名为pMD-S。
以重组质粒pMD-GT为模板,以P5/P6为引物扩增反义片段。用SmaⅠ/SacⅠ限制酶对纯化后的反义片段与重组质粒pMD-S同时双酶切,用T4 DNA连接酶进行连接并转化E.coliJM109感受态细胞。提取阳性克隆菌质粒用XbaⅠ/SacⅠ限制酶进行双酶切和测序验证,双酶切结果如图7所示。

图6 pMD-S克隆载体的双酶切鉴定Fig.6 Double enzyme digestion of pMD-S vector

图7 pMD-3UGT1-RNAi克隆载体的双酶切鉴定Fig. 7 Double enzyme digestion ofpMD-3UGT1-RNAi vector
在图7中,1泳道2730bp和780bp大小条带分别是经酶切后的pMD20-T载体片段和构建好的RNAi干扰元件。将验证后的重组载体命名为pMD-3UGT1-RNAi。
3.3 RNA表达载体的构建和转化
使用XbaⅠ/SacⅠ限制酶对重组质粒pMD-3UGT1-RNAi和表达载体pBI121同时双酶切,用T4 DNA连接酶进行连接并转化E.coliJM109感受态细胞。提取阳性克隆菌质粒进行双酶切验证,双酶切结果如图8所示。
在图8中,1泳道13600bp和780bp大小条带分别是经酶切后的pBI121载体片段和构建好的RNAi干扰元件。电泳结果与预期一致,说明表达载体pBI121-3UGT1-RNAi构建成功。

图8 pBI121-3UGT-RNAi表达载体的双酶切鉴定Fig.8 Double enzyme digestion of expressionvector pBI121-3UGT1-RNAi
用热转化法[9]将重组载体pBI121-3UGT1-RNAi转化至发根农杆菌A4感受态细胞中,涂布于含有50 mg/L卡那霉素的YEB固体培养基上培养36 h后,挑取阳性克隆菌扩大培养。提取阳性克隆菌的Ri质粒进行质粒PCR鉴定,以Ri质粒为模板,P1/P2为引物。电泳结果如图9所示。
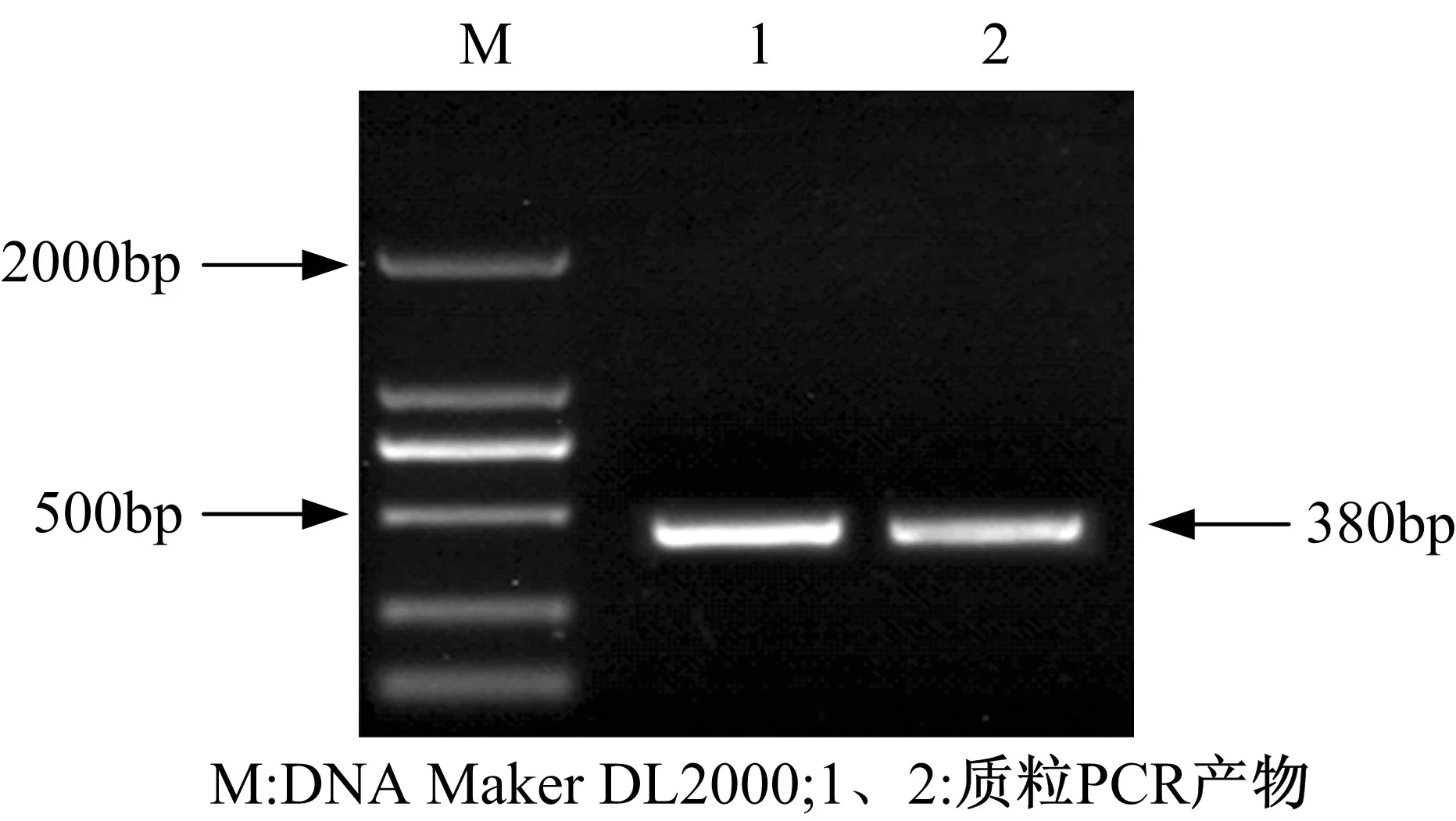
图9 质粒PCR电泳图Fig.9 Electrophoresis of the plasmid PCR products
在图9中,两泳道在380bp左右处有清晰条带,表明RNAi植物表达载体成功转入发根农杆菌A4中。将该工程菌命名为A4-pBI121-3UGT1-RNAi,甘油冷冻保存。
4 结束语
RNAi技术在鉴定功能基因和次级代谢产物合成的研究方面一直有着广泛的应用。本文利用酶切连接技术,通过pMD20-T载体的高效利用,成功构建原人参二醇3号位葡糖糖基转移酶1基因(Pg3-O-UGT1)RNAi植物表达载体,并构建了相应的植物表达载体工程菌A4-pBI121-3UGT1-RNAi。与一般构建方法相比,既避免了PCR条件的反复摸索,又能够保证验证的准确性,材料廉价易得,适应性广。
[1] Liang Y L, Zhao S J. Progress in understanding of ginsenoside biosynthesis[J]. Plant Biology, 2008, 10 (4): 415-421.
[2] Chen C F, Chiou W F, Zhang J T. Comparison of the pharmacological effects of Panax ginseng and Panax quinquefolium[J]. Acta Pharmacologica Sinica, 2008, 29(9): 1103-1108.
[3] Zhao C, Xu T H, Liang Y L, et al. Functional analysis of beta-amyrin synthase gene in ginsenoside biosynthesis by RNA interference[J]. Plant Cell Reports , 2015,34(8):1307-1315.
[4] Wang L, Zhao S J, Liang Y L, et al. Identification of the protopanaxatriol synthase gene CYP6H for ginsenoside biosynthesis in Panax quinquefolius[J]. Functional & Integrative Genomics, 2014, 14(3): 559-570.
[5] Pace R, Martinelli E M, Sardone N, et al. Metabolomic evaluation of ginsenosides distribution in Panax genus (Panax ginseng and Panax quinquefolius) using multivariate statistical analysis[J]. Fitoterapia, 2006,101(9):80-91.
[6] Han J Y, Kwon Y S, Yang D C et al. Expression and RNA interference-induced silencing of the dammarenediol synthase gene in Panax ginseng[J]. Plant and Cell Physiology, 2006,47(12):1653-1662.
[7] Han J Y, In J G, Kwon Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng[J]. Phytochemistry, 2010, 71(3):36-46.
[8] Kim Y J, Zhang D B,Yang D C. Biosynthesis and biotechnological production of ginsenosides[J]. Biotechnology Advances, 2015, 33(6): 717-735.
[9] Sun Y, Zhao S J, Liang Y L, et al. Regulation and differential expression of protopanaxadiol synthase in Asian and American ginseng ginsenoside biosynthesis by RNA interferences[J]. Plant Growth Regulation, 2013, 71(3): 207-217.

