肝移植术后吻合血管并发症的危险因素分析
林婷 张春 崔瑞霞 张靖垚 董顺斌 王瑞涛 张晓刚 刘学民 王博 刘昌
肝移植为治疗终末期肝病的最终手段[1]。术后吻合血管并发症是导致病人死亡、移植物丢失、再次移植、住院时间延长及花费增加的主要原因之一。本文拟通过回顾性分析,了解本中心肝移植术后吻合血管并发症的危险因素及治疗对策,以做好预防、提高手术成功率。
资料与方法
一、一般资料
收集2011年2月至2017年10月于西安交通大学第一附属医院肝胆外科施行的381例肝移植病人的临床资料,其中男性316例,女性65例;年龄(46.0±9.9)岁;原发病分别为乙型肝炎后肝硬化失代偿180例,乙型肝炎合并原发性肝细胞癌62例,自身免疫性肝炎合并肝癌1例,丙型肝炎后肝硬化失代偿17例,丙型肝炎合并肝癌8例,酒精性肝硬化失代偿10例,自身免疫性肝硬化失代偿15例,药物性肝损伤7例,其余类型肝病81例(隐源性肝硬化、肝包虫、肝囊肿等)。术式包括:经典原位肝移植372例,离体右半肝+自体肝移植1例,肝肾联合移植1例,二次肝移植7例。
二、术后吻合血管病变诊断
所有病人术后均于外科ICU行术后早期恢复,术后24 h内开始至术后第1周每天行移植肝彩色多普勒超声(color Doppler flow imaging,CDFI)检查,判断肝脏及其血管(门静脉、肝动脉、肝静脉、下腔静脉)情况,之后每周1~2次,遇异常情况适当增减检查频率。
血管造影包括超声造影(contrast-enhanced ultrasound,CEUS),选择性肝动脉造影,间接门静脉造影,经皮股静脉穿刺下腔静脉造影检查作为确诊的依据,对临床表现或CDFI检查提示可能存在血管并发症的病例均行血管造影检查以明确有无血管病变。
三、病例分组
1.病例组 经血管造影证实吻合血管并发症病人15例作为病例组,其中男性14例,女性1例;年龄(44.1±2.0)岁;乙型肝炎肝硬化失代偿9例,原发性肝癌合并乙型肝炎肝硬化3例,胆汁淤积型肝硬化失代偿1例,自身免疫性肝硬化失代偿1例,肝包虫1例;术前存在血管病变及相关手术者11例,包括门静脉血栓形成6例,门静脉海绵样变性1例,肝总动脉病变1例,术前行肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)1例,术前行脾切除术1例,二次肝移植1例。
2.对照组 选择同期无术后并发症病人252例作为对照组(余114例病人存在其他并发症,包括4例早期CDFI检查提示可疑血管并发症及110例其他并发症如肺部感染、腹腔感染、高胆红素血症、急性肾损伤、急性排斥反应、弥散性血管内凝血、术中室颤等)。252例中男性205例,女性47例;年龄(45.5±0.6)岁;二次肝移植3例,余病人均行经典原位肝移植术,临床诊断为肝炎后肝硬化(包括乙型肝炎和丙型肝炎后肝硬化)185例,药物性肝损伤2例,自身免疫性肝硬化失代偿7例,原发性肝癌22例,其他原因(胆汁性、酒精性、隐源性等)所致肝硬化32例,肝包虫1例,多囊肝1例,肝移植术后急性排斥反应1例,肝豆状核变性1例;术前存在血管病变37例,术前曾接受脾切除+门奇静脉断流术1例,术前接受单纯脾切除术9例,术前行门体分流1例,术前TACE23例,术前行经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)14例,术前接受硬化剂治疗13例,术前行TACE+脾切除术1例,术前行TIPS+脾切除术1例,术前行TACE+食管胃底静脉黏堵术2例,术前行TIPS+脾切除+食管胃底曲张静脉黏堵术1例,术前行TIPS+食管胃底曲张静脉黏堵术1例,术前行脾切除+食管胃底曲张静脉黏堵术1例,术前行脾部分切除1例。
四、观察指标
①术前统计指标:受者年龄、性别、原发病(肝炎后肝硬化、自身免疫性肝硬化、酒精性肝硬化等)、术前血管病变情况、术前是否行脾切断流术、术前是否行TIPS或TACE、术前是否行硬化剂治疗;②术中记录指标:无肝期时间、热缺血时间、冷保存时间、总手术时间、术中失血量、术中液入量、术中尿量;③术后分析指标:住院时间。
五、统计学方法

结 果
一、肝移植术后吻合血管并发症病人的一般资料
术后CDFI诊断血管并发症为19例,4例病人经超声造影后排除血管并发症,血管造影证实15例,血管并发症发生率为3.9%(15/381),CDFI对血管并发症的诊断的敏感度及特异度分别为78.9%和21.1%。其中,动脉并发症11例,发生率为2.9%,包括:肝动脉血栓形成7例(1.8%),肝动脉狭窄4例(1.0%);下腔静脉并发症2例(0.5%),均为下腔静脉血栓形成;门静脉并发症2例,均为门静脉血栓形成(0.5%)。
二、有血管并发症与无并发症病人的术前一般情况及手术相关因素、住院时间比较
两组病人在年龄、性别、原发病、术中出血量、术中尿量、手术时间、热缺血时间、冷保存时间上的比较差异均无统计学意义(P>0.05)。病例组术前血管病变及相关手术史11例,占73.3%,对照组106例,占42.1%,两组间差异有统计学意义(P<0.05)。病例组无肝期时间较对照组延长,差异有统计学意义(P<0.05)。病例组术中液入量较对照组明显增加,差异有统计学意义(P<0.05)。与对照组相比,病例组病人在住院时间上显著延长,差异具有统计学意义(P<0.001)。具体情况见表1。
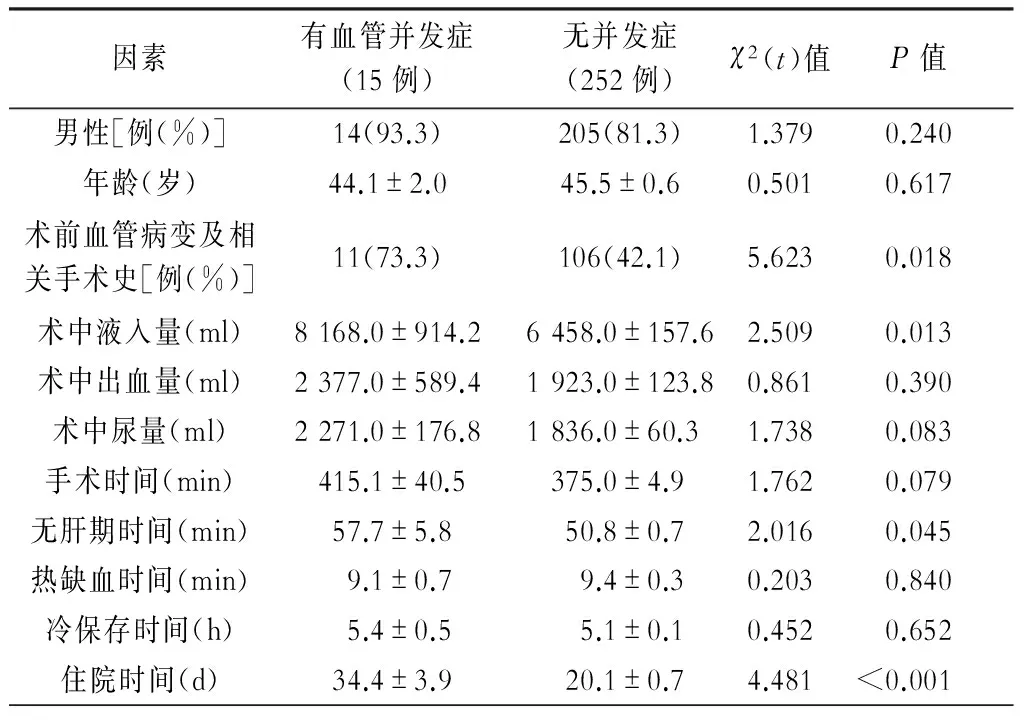
表1 有血管并发症与无并发症病人的相关因素比较
三、肝移植术后血管并发症的治疗
有9例病人(肝动脉血栓形成5例、门静脉血栓形成2例、下腔静脉血栓形成2例)进行了介入下局部置管溶栓+全身抗凝治疗,其中5例病人出现了出血相关并发症:头皮血肿1例,胸壁血肿1例,腹腔出血3例。1例病人(肝动脉血栓形成)因导丝无法通过血栓部位给予了全身抗凝,后因肝衰竭死亡。4例病人(肝动脉狭窄)给予了局部抗凝或全身抗凝,未出现出血相关并发症。1例病人(肝动脉血栓形成)在抗凝后效果不佳于术后半年接受了再次肝移植治疗,术后早期出现高胆红素血症,给予激素冲击等治疗后好转,但后来死于腹腔感染、腹腔出血。
讨 论
肝移植术后吻合血管并发症是引起移植物丢失和受者死亡的重要原因之一。任何形式、任何部位的血管吻合都可能导致出血、狭窄、血栓、血管瘤等并发症,总体发生率为8%~15%[2-4]。出现血管并发症的受者生存率会显著下降,本组血管并发症发生率为3.9%。
一、血管并发症危险因素
动脉并发症是肝移植术后最常见的血管并发症(>50%)[5-6],其中,肝动脉血栓形成是最严重的并发症,其发病率为3%~5%,病死率高(20%~60%)[7-8]。肝移植术后肝动脉狭窄和肝动脉血栓形成多与肝动脉本身的病变以及吻合技术有关,包括动脉内径细小(<3 mm)、血管内膜损伤、动脉粥样硬化、畸形、吻合口狭窄、多次吻合、过长扭曲成角、介入治疗史、手术时间长、术中输血量大(全血>6 U或新鲜冰冻血浆≥15 U)、术后动脉血流缓慢等[9]。其他与移植手术或操作无关的因素对肝动脉血栓形成的发生同样扮演着重要角色。例如,TACE作为肝细胞肝癌肝移植术前的“过渡”或“降期”治疗手段,能够导致动脉周围炎,进而诱发肝动脉血栓形成[10]。门静脉吻合口狭窄和门静脉血栓形成是原位肝移植术后最常见的门静脉并发症。门静脉狭窄发生率约为0.6%~3%,而门静脉血栓形成发生率则为1%~2%[11],门静脉血栓形成和一些潜在的危险因素高度相关,文献报道包括高龄、男性、Child-Pugh C级、高凝状态、术前即已存在门静脉病变、脾切除术和分流、血管吻合技术或供受者门静脉管径不匹配以及门静脉重建时使用移植血管等等[12-13]。下腔静脉狭窄和(或)血栓形成发生率较低,发病率为0.5%~3.7%[14-15],此类并发症好发于吻合口部位,主要归因于吻合技术缺陷、移植肝过度肿胀、肝段下腔静脉旁血肿压迫等,与巴德-吉亚利综合征或下腔静脉闭塞综合征有相似的临床表现[16]。本研究病例组较对照组无肝期时间及术中液入量差异均有统计学意义,与既往研究一致。
二、血管并发症诊断
CDFI具有无创、灵敏、便于动态观察的特点,用来监测肝移植术后血管并发症尤为适合。血管并发症多发生于肝移植术后的早期,因而术后1周内每天1次的CDFI检查非常必要。CDFI检查也有其局限性,如不易显示肝动脉狭窄及肝动脉血栓形成的部位和程度,源于膈下动脉或肠系膜上动脉的侧支循环可造成假阴性,术后早期低血流灌注状态、吻合口水肿、移植肝肿胀等可导致CDFI出现假阳性等。本组中CDFI对血管并发症诊断的敏感度和特异度分别为78.9%和21.1%,因而肝移植术后应将CDFI检查作为血管并发症常规的监测手段。
CEUS可以实时观察移植肝血流灌注,显著提高血管成像清晰度,得到类似于数字减影血管造影(DSA)效果的血管图,近年来,国内外有研究报道其在肝移植术后肝动脉并发症的诊断敏感性和特异性可高达100%[17]。本研究中有2例CDFI肝动脉显示不清病人行CEUS后显影良好,避免了进一步的有创血管造影检查。对肝移植术后某些重症病人特别是重症监护病人,不方便行有创血管造影检查,在这种情况下,具有便捷、相对准确、可行床边检查的CEUS检查就具有十分重要的临床意义,不仅可以缩短诊断时间,还可以减少放射污染,降低医疗成本[18]。
及时准确的选择性血管造影是早期诊断血管并发症不可缺少的手段。它可以清晰地显示血管狭窄和血栓形成的部位及程度,另外还可以进行球囊扩张狭窄血管+放置血管内支架等治疗,虽不能作为常规的监测手段,但当非侵入性检查怀疑而不能确诊时应及时行选择性血管造影术[19]。
三、血管并发症治疗
血管并发症的治疗主要有血管内介入治疗和外科手术两种方法,前者包括经皮腔内血管成形术(percutaneous transluminal angiography,PTA)、动脉内溶栓治疗(intra-arterial thrombolysis,IAT)、支架置入术等,后者包括血栓切除术、再吻合术以及再次移植[10]。Singhal等[20]报道溶栓治疗的成功率为68%(47/69),IAT最常见的并发症是出血,必须在监测纤维蛋白原水平、凝血酶原时间及活化部分凝血活酶时间情况下指导溶栓药物的使用。在血管内介入无效或禁忌的情况下,应考虑血管重建及再次移植等外科手术治疗[21]。门静脉并发症的标准治疗方案是经皮肝穿刺,结合受者及并发症特点,辅以球囊扩张术、支架植入术和药物溶栓等。PTA和支架植入是治疗下腔静脉狭窄的首选方法。
四、结语
对临床征象及CDFI提示可能存在血管并发症的受者,一旦出现可疑征象,除继续CDFI动态监测外,可行CEUS检查,如仍不能排除血管并发症,即应当及时造影检查。血管并发症一经发现,必须及时处理,只有这样才能够有效减少受者病死率及再移植的可能。血管内介入治疗正在发挥越来越重要的作用,而外科治疗作为传统有效的治疗手段依然占据重要地位。
1 Liou IW.Management of end-stage liver disease.Med Clin North Am,2014,98:119-152.DOI:10.1016/j.mcna.2013.09.006.
2 Pérez-Saborido B,Pacheco-S nchez D,Barrera-Rebollo A,et al.Incidence,management, and results of vascular complications after liver transplantation. Transplant Proc,2011,43:749-750.DOI:10.1016/j.transproceed.2011.01.104.
3 Sieders E,Peeters PM,Ten Vergert EM,et al.Early vascular complications after pediatric liver transplantation.Liver Transpl,2000,6:326-332.DOI:10.1053/lv.2000.6146.
4 Duffy JP,Hong JC,Farmer DG,et al.Vascular complications of orthotopic liver transplantation: experience in more than 4200 patients.J Am Coll Surg,2009,208:896-905. DOI:10.1016/j.jamcollsurg.2008.12.032.
5 Saad WE,Davies MG,Saad NE,et al.Catheter thrombolysis of thrombosed hepatic arteries in liver transplant recipients:predictors of success and role of thrombolysis.Vasc Endovascular Surg,2007,41:19-26.DOI:10.1177/1538574406296210.
6 Bekker J,Ploem S,de Jong KP.Early hepatic artery thrombosis after liver transplantation:a systematic review of the incidence,outcome and risk factors.Am J Transplant,2009,9:746-757.DOI:10.1111/j.1600-6143.2008.02541.x.
7 Jiang XZ,Yan LN,Li B,et al.Arterial complications after living-related liver transplantation: single-center experience from West China.Transplant Proc,2008,40:1525-1528.DOI:10.1016/j.transproceed.2007.11.078.
8 Nolten A,Sproat IA.Hepatic artery thrombosis after liver transplantation:temporal accuracy of diagnosis with duplex US and the syndrome of impending thrombosis.Radiology,1996,198:553-559.DOI:10.1148/radiology.198.2.8596865.
9 Rinaldi P, Inchingolo R, Giuliani M, et al. Hepatic artery stenosis in liver transplantation: imaging and interventional treatment. Eur J Radiol,2012,81:1110-1115. DOI: 10.1016/j.ejrad.2011.02.055.
10杨翰, 张水军.肝移植术后血管并发症及其治疗进展.实用器官移植电子杂志,2014,2:317-320.DOI:10.3969/j.issn.2095-5332.2014.05.012.
11Settmacher U,Nussler NC,Glanemann M,et al.Venous complications after orthotopic liver transplantation.Clin Transplant.2000,14:235-241.DOI:10.1034/j.1399-0012.2000.140309.x.
12Adani GL, Baccarani U, Risaliti A, et al. Percutaneous transhepatic portography for the treatment of early portal vein thrombosis after surgery. Cardiovasc Intervent Radio,2007,30:1222-1226.DOI:10.1007/s00270-007-9056-z.
13Ghabril M,Agarwal S,Lacerda M,et al.Portal vein thrombosis is a risk factor for poor early outcomes after liver transplantation:analysis of risk factors and outcomes for portal vein thrombosis in waitlisted patients.Transplantation,2016,100:126-133.DOI:10.1097/TP.0000000000000785.
14Darcy MD.Management of venous outflow complications after liver transplantation.Tech Vasc Interventional Rad,2007,10:240-245.DOI:10.1053/j.tvir.2007.09.018.
15Akun E,Yaprak O,Killi R,et al.Vascular complications in hepatic transplantation: single-center experience in 14 years.Transplant Proc,2012,4:1368-1372.DOI: 10.1016/j.transproceed.2012.02.027.
16陈规划,王国栋,何晓顺,等.原位肝移植术后下腔静脉狭窄的诊断和治疗.中华肝胆外科杂志,2000, 6:464.DOI:10.3760/cma.j.issn.1007-8118.2000.06.023.
17韩红,王文平,黄备建,等.超声造影在肝移植术后动脉并发症诊断中的应用价值.中华超声影像学杂志,2009,18:46-48.DOI:10.3760/cma.j.issn.1004-4477.2009.01.015.
18毛仁,任杰,郑荣琴,等.超声造影诊断肝移植术后肝动脉狭窄.中华超声影像学杂志,2010,19:684-687. DOI:10.3760/cma.j.issn. 1004-4477.2010.08.016.
19Saad WE,Davies MG,Rubens DJ,et al.Endoluminal management of anerioponal fistulae in liver transplant recipients:a single-center experience.Vasc Endovascular Surg,2006,40:451-459.DOI:10.1177/1538574406294072.
20Singhal A,Stokes K,Sebastian A,et al.Endovascular treatment of hepatic artery thrombosis following liver transplantation.Transpl Int,2010,23:245-256.DOI:10.1111/j.1432-2277.2009.01037.x.
21Saad WE,Davies MG,Sahler L,et al.Hepatic artery stenosis in liver transplant recipients:primary treatment with percutaneous transluminal angioplasty.J Vasc Interv Radiol,2005,16:795-780.DOI:10.1097/01.RVI.0000156441.12230.13.

