用浓盐酸制取的二氧化碳能否使澄清石灰水变浑浊的实验研究
陆茜

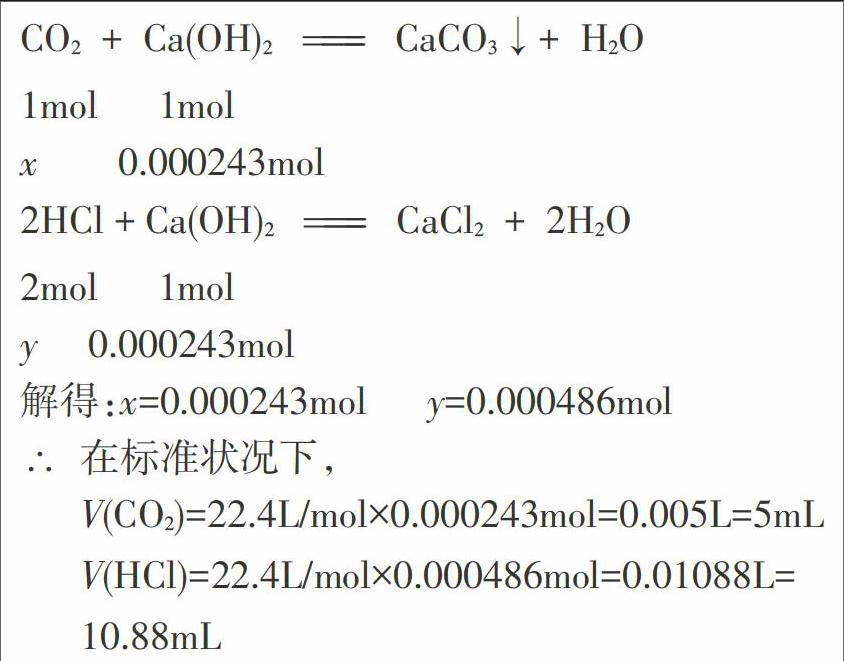
摘要:通过实验探讨“将浓盐酸与大理石反应产生的气体通入澄清石灰水,石灰水仍然变浑浊”的原因。
关键词:浓盐酸;二氧化碳;浑浊;实验研究
文章编号:1008-0546(2017)12-0081-02 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2017.12.027
一、问题的提出
笔者在实际教学过程中关注到2008年某市的一道中考题,并对其选项B产生了一丝疑惑,具体题目如下。原题对选项B的解析是“浓盐酸易挥发,它与大理石反应放出的二氧化碳气体中会混有氯化氢气体,将该气体通入澄清石灰水时,氯化氢溶于水得到盐酸,先与石灰水反应,干扰了二氧化碳与石灰水的反应,所以始终不浑浊,故不能证明石灰水一定变质。”下列实验设计及操作,其现象足以说明结论的是?
笔者又在百度搜索引擎上输入“用浓盐酸制取的二氧化碳能使澄清石灰水变浑浊吗”,搜索出的结果约有115000条,第一页上就有9条信息都认同“浓盐酸会挥发出氯化氢气体,所以用浓盐酸制取的二氧化碳不能使澄清石灰水变浑浊”。
二、实验及分析
到底事实的真相是什么呢?笔者饶有兴趣地做了这个实验:取一支试管加入少量石灰石,再注入适量37%的浓盐酸,把生成的气体通入10mL饱和澄清石灰水。意外的现象发生了,澄清石灰水立即出现了浑浊。为了排除偶然因素,笔者又重做了一次,结果石灰水还是立即出现浑浊。
笔者又把饱和石灰水稀释2倍、3倍、4倍、5倍、6倍,制得不同浓度的Ca(OH)2溶液。用试管分别取10mL上述5种溶液,每种溶液准备两份,再把用1:4的稀盐酸与用37%的浓盐酸制取的二氧化碳分别通入这五种Ca(OH)2溶液中,得出的实验结果如表1。
由实验可知,当饱和石灰水与水的体积比大于1:3时,无论用37%的浓盐酸还是1:4的稀盐酸制取的二氧化碳均能使其变浑浊。而当饱和石灰水与水的体积比为1:4或1:5时,无论用37%的浓盐酸还是1:4的稀盐酸制取的二氧化碳均不能使其变浑浊。
而当饱和石灰水与水的体积比大于1:3時,无论用37%的浓盐酸还是1:4的稀盐酸制取的二氧化碳均能使其变浑浊。会不会是因为浓盐酸挥发出的氯化氢气体不够多,不足以把饱和石灰水中的氢氧化钙完全反应完,以致于仍有氢氧化钙与二氧化碳反应,从而生成沉淀呢?为了弄清楚原因,笔者以饱和石灰水为例,进行了如下分析:
1.相关计算分析
已知0℃时Ca(OH)2的溶解度是0.18g,在此温度下,C a(OH)2饱和溶液的溶质质量分数约为0.18%。因此取10mL 0℃时的饱和石灰水,其中溶质Ca(OH)2的量约有0.000243mol。
由理论计算可知,在标准状况下,如果把混合气体通人饱和石灰水,则氯化氢和二氧化碳至少要以2:1的体积比混合,石灰水才有可能不变浑浊。
2.实验验证
(1)实验准备
①用大理石与稀盐酸反应制取二氧化碳气体,用排水法收集5瓶气体,贴好标签(依次标记为“CO2①”至“CO2⑤”),备用。
②用氯化钠粉末与浓硫酸反应制取氯化氢气体,用向上排空气法收集5瓶气体,也贴好标签(依次标记为“HCl①”至“HCl⑤”),备用。
③配制饱和石灰水,静置后备用。
(2)实验过程
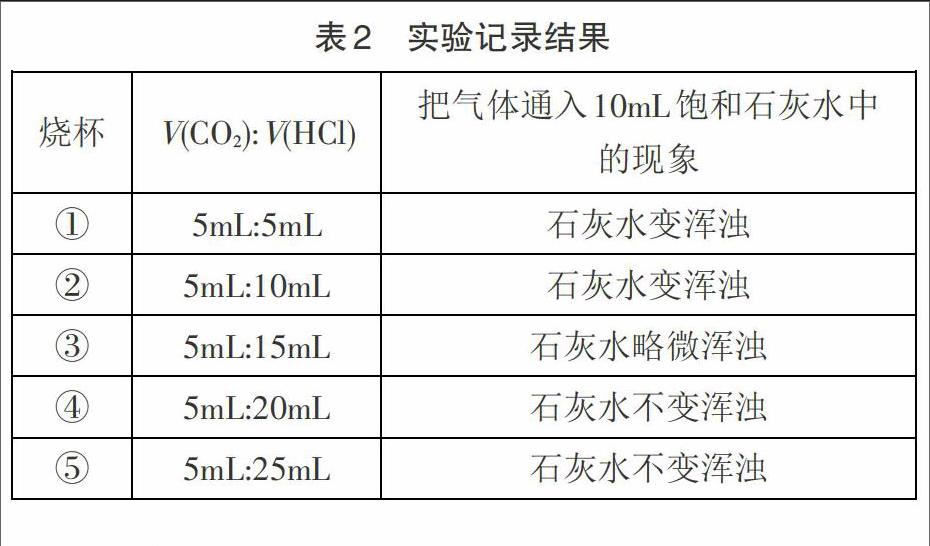
实验一:取5只小烧杯,以烧杯①至烧杯⑤标记,分别注入10mL新制的饱和石灰水,按序排好。用一支50mL的注射器分别抽取5mLCO2气体和5mLHCl气体,再把抽取的气体通入饱和石灰水①中,振荡,观察现象。
实验二:在第二瓶CO2气体和第二瓶HCl气体中分别以5mL和10mL的量抽取气体,再把气体通入饱和石灰水②中,振荡,观察现象。
实验三:在第三瓶气体中分别抽取5mLCO2气体和15mLHCl气体,再把气体通入饱和石灰水③中,振荡,观察现象。
实验四:在第四瓶气体中分别抽取5mLCO2气体和20mLHCl气体进行上述实验。
实验五:在第五瓶气体中分别抽取5mLCO2气体和25mLHC|气体进行上述实验。
(3)实验现象记录如表2。
3.实验结论及反思
由上述实验分析可知,氯化氢气体和二氧化碳气体至少要以3:1的体积比混合时,一起通入饱和石灰水,石灰水才有可能不变浑浊,这个结果虽然与理论计算略有出入,但考虑到在实际操作中氯化氢气体是用向上排空气法收集的,气体纯度不够高,而且把气体通入石灰水时,气体会有部分逸出,所以实验结果还是合理的。
在实验室制取二氧化碳时,如果用浓盐酸反应,那因挥发而逸出的氯化氢气体的量能有多少呢?会不会是二氧化碳的量的几倍呢?笔者利用美国威尼尔软件与技术公司的pH传感器再次实验,试图找到证据。具体实验操作如下:用适量37%的浓盐酸和大理石反应,把生成的气体通入饱和的澄清石灰水,同时用威尼尔pH传感器监测石灰水的pH变化情况。获得的实验数据见图1。
数据表明澄清石灰水由澄清到浑浊,溶液的pH基本都在12.5左右,表明上述过程中溶液的酸碱性变化不大。可能是浓盐酸挥发出的氯化氢气体不多,也可能是石灰水吸收了氯化氢。说明浓盐酸挥发出的氯化氢气体肯定不如反应生成的二氧化碳的量多,更不可能为二氧化碳的量的几倍。同理,如果用1:1、1:2、1:3的石灰水进行上述分析,也能得出相似的结论。而1:4、1:5的石灰水可能因为溶液太稀,溶质质量分数太小,导致实验均无明显现象。
所以本文开头描述的那道题目中“将浓盐酸和大理石反应产生的气体通入澄清石灰水,石灰水始终未浑浊”这种现象是可能存在的,但主要原因不是因为浓盐酸的挥发,而是因为澄清石灰水的浓度太稀。也就是说,上述中考题题目本身并没有问题,但解释似乎并不正确。endprint

