基于双回路技术的二维色谱在线/离线接口设计与评价
唐 涛 张维冰 张 政 夏明珠 贡雪东 王风云 李 彤
1(南京理工大学工业化学研究所,南京 210094) 2(齐齐哈尔大学化学与化学工程学院,齐齐哈尔 161006) 3(大连依利特分析仪器有限公司,大连 116023)
1 引 言
二维液相色谱技术以其高峰容量、高分辨力的特点,成为近年来蛋白质分析[1,2]、中药成分分析[3,4]、代谢组学研究[5]的重要方法之一。二维接口是二维液相色谱系统的核心,常见的接口形式可分为离线接口和在线接口两大类。离线接口[6,7]依次收集第一维的馏分,随后通过转移进行第二维分析。在线接口的形式多种多样,是二维接口发展的主要趋势。定量环接口[8,9]利用定量环存储第一维的样品,通过阀切换将样品切入第二维分析。对于停流接口[10],第一维洗脱产物直接转移到第二维色谱柱柱头,转动切换阀,第二维开始分析,此时第一维停流。对于平行柱接口[11],利用两支同样的色谱柱交替富集第一维的样品,并作为第二维的分析柱使用; 对于捕集柱接口[12],第一维的洗脱产物富集到捕集柱柱头,切换阀后,第二维流动相将捕集柱上的样品反冲到第二维色谱柱上进行分析。此外,还有一些特殊的接口形式,如真空辅助溶剂蒸发接口[13]、液滴微流控接口[14]等。已报道的这些接口中,离线接口结构简单,对设备要求不高,并可以对第一维馏分进行相应的浓缩、合并、脱盐等操作,但转移过程中易造成样品损失、污染; 定量环接口结构简单,但第二维样品有效样品量偏低,影响检测灵敏度; 停流接口,第二维不受分析时间限制,可以充分发挥系统分辨率,但第一维停流往往容易使样品扩散; 平行柱接口避免了停流接口的扩散问题,但第二维分析时间受到第一维分离时间的限制; 捕集柱接口有在线富集的功能,可很好的保证第二维样品浓度,但捕集效率不稳定是不可忽略的问题,且第二维分析时间同样受到第一维限制。总体上,这些接口有各自的优点,但也都受到一定的限制,应用范围有限,不能满足多种分离目的灵活切换的需求; 且自动化、集成化程度不高,不适合分析时间长、数量大的样品。
在本研究组前期工作的基础上[15,16], 本研究设计了一种兼有样品收集、进样功能的新型在线/离线接口,可完成样品微量制备、难分离组分的精细拆分和复杂样品的二维分离。分别以芳香族化合物、蛋白质样品、蛋白质酶解产物为分析对象,对接口进行系统的评价,获得了良好的结果。
2 实验部分
2.1 仪器与试剂
iChrom 5100高效液相色谱仪,包括P5102高压恒流泵、D5101紫外-可见检测器、M5102系统组织器、W5100色谱数据工作站等(大连依利特分析仪器有限公司); FE20 pH计(瑞士Mettler Toledo公司); C52-1346I两位六通切换阀(瑞士Valco公司); Biobasic SCX色谱柱(250 mm ×4.6 mm i.d., 5 μm, 300 Å, 美国Thermofisher 公司); Supersil ODS2色谱柱(250 mm ×4.6 mm i.d., 5 μm, 120 Å, 大连依利特分析仪器有限公司),SinoChrom C8色谱柱(150 mm×4.6 mm i.d., 5 μm, 300 Å, 大连依利特分析仪器有限公司)。
苯乙酮、甲苯、乙苯、芴、尿素、碳酸氢铵(分析纯,天津科密欧化学试剂有限公司); 甲醇、乙腈(色谱纯,美国Tedia试剂公司); 细胞色素C(Cytochrome C, Cyt C)、核糖核酸酶A(RNase A)、核糖核酸酶B(RNase B)、鸡卵清白蛋白(Chicken egg white albumin, CEA)、牛血清白蛋白(Bovine serum albumin, BSA)均购自Sigma-Aldrich公司; 三氟乙酸(Trifluoroacetic acid, TFA)、二硫苏糖醇(98%, Dithiothreitol, DTT)购自北京百灵威科技有限公司; 碘乙酰胺(99%, Iodoracetamide, IAA, Amresco公司); 实验用水为超纯水(Milli-Q,美国Millipore公司)。
2.2 实验方法
2.2.14种芳香族化合物的微量制备样品:苯乙酮、甲苯、乙苯、芴(2×10-7g/mL)。进样量为20 μL。收集条件: 1#馏分2.5~3.5 min,2#馏分5.0~6.0 min,3#馏分7.0~8.0 min,4#馏分13.0~14.0 min。再进样条件:收集到4组馏分各1 mL,浓缩至约0.3 mL,再依次进样,进样量为100 μL。色谱条件: Supersil ODS2色谱柱(250 mm×4.6 mm i.d., 5 μm); 流动相为甲醇-水(85∶15,V/V); 流速1.0 mL/min; 检测波长254 nm。
2.2.25种蛋白质的精细拆分(1)样品制备 分别称取BSA 2.3 mg、Cyt C 2.0 mg、RNase A 2.0 mg、RNase B 4.1 mg和CEA 2.3 mg,用1 mL乙腈-水(2∶98,V/V, 含0.1% TFA)溶解, 0.22 μm滤膜过滤,备用。(2)第一维强阳离子交换色谱(Strong cation exchange chromatography, SCX) Biobasic SCX色谱柱(250 mm ×4.6 mm i.d., 5 μm, 300 Å); 流动相A为10 mmol/L磷酸盐缓冲液(pH 5.37); 流动相B为流动相A+1.0 mol/L NaCl(pH 5.37); 梯度洗脱条件: 0~30 min,10%~30% B; 30~40 min, 50% B, 流速1.0 mL/min; 进样量20 μL; 检测波长214 nm。(3)第二维反相色谱(Reversed-phase chromatography, RP) SinoChrom C8色谱柱(150 mm×4.6 mm i.d., 5 μm, 300 Å); 流动相A为乙腈-水(2∶98,V/V)+0.1% TFA; 流动相B为乙腈-水(98∶2,V/V)+0.1% TFA; 梯度洗脱条件: 0~3 min, 5% B; 3~5 min, 5%~25% B; 5~17 min, 25%~75% B; 17~20 min, 75%~5% B。 流量1.0 mL/min; 进样量20 μL; 检测波长214 nm。
2.2.3BSA酶解产物的二维分离(1)样品制备 称取1.0 mg BSA溶于8 mol/L 尿素和100 mmol/L NH4HCO3缓冲液(pH 8.0)中; 加入8 μL 1 mol/L DTT,60 ℃水浴反应2 h; 加入20 μL 1 mol/L IAA,常温下避光反应0.5 h; 随后使用100 mmol/L NH4HCO3将样品中尿素浓度稀释至1 mol/L,并按质量比1∶25加入胰蛋白酶,37 ℃下反应过夜; 最后,将得到的蛋白质酶解液调至酸性,除盐后冻干,待用。(2)第一维强阳离子交换色谱 Biobasic SCX色谱柱(250 mm×4.6 mm i.d., 5 μm, 300 Å); 流动相A为10 mmol/L磷酸盐缓冲液(pH 2.2); 流动相B为流动相A+0.5 mol/L NaCl(pH 2.2); 梯度洗脱程序: 0~10 min, 0% B; 10~30 min,0~100% B; 30~60 min,100% B; 60~70 min,0% B。流速0.5 mL/min; 进样量100 μL; 检测波长214 nm。(3)第二维反相色谱 XBP C18色谱柱(150 mm × 0.3 mm i.d., 5 μm, 实验室自制); 流动相A为乙腈-水(2∶98,V/V)+0.1% TFA; 流动相B为乙腈-水(98∶2,V/V)+0.1% TFA; 梯度洗脱条件: 0~10 min, 0% B; 10~70 min, 5%~35% B; 70~80 min, 100% B; 80~95 min, 0% B。流速8.0 μL/min; 进样量5 μL; 检测波长214 nm。
3 结果与讨论
3.1 在线/离线接口的设计
双回路技术采用一套机械传动组件和流路系统,实现双重功能。本研究基于一套三维机械传动装置控制样品针以及一套样品托盘、活塞、两位三通阀和同一套流路系统,利用2个两位六通切换阀,设计了一种全新的接口,如图1所示。通过活塞、样品针吸入样品至阀A的定量环,控制阀A的位置状态,实现LC-A系统的自动进样; 也可通过阀B和阀A的连接和控制,经过样品针,实现对LC-B系统分离馏分的收集,形成两个可控、互不干扰的回路。同时,设计了配套的色谱数据工作站,可集成化控制接口中各个阀的状态和多套液相色谱仪,结合序列分析和外部触发两种方式,可灵活实现在线/离线功能。

图1 在线/离线接口流程示意图Fig.1 Schematic diagram of online/offline interface
3.2 接口的功能实现
进样和馏分收集功能:通过电路和软件程序控制,控制阀A在实线状态,阀B在实线状态,移动样品针到指定的样品瓶,通过活塞将样品吸入阀A的定量环中,完成上样; 切换阀A到虚线状态,可将样品推入LC-A系统中进行色谱分析,实现进样。此时,通过切换三通阀C,利用活塞吸入清洗溶剂,再切换阀C,推动活塞,可实现清洗样品针; 同时也可以通过阀B连接的泵,推入溶剂,清洗样品针外侧,避免交叉污染。切换阀B到虚线状态,LC-B系统分析的样品,通过阀B,连接阀A,通过样品针可以收集到指定的样品瓶中,实现馏分收集功能。再次控制阀A到实线状态、阀B到实线状态,可重复上述功能。
3.2.1样品的微量制备功能当LC-A和LC-B是同一系统,利用接口完成进样后,继续通过接口按时间直接收集全部馏分或者按出峰信号收集感兴趣的馏分; 然后对所收集馏分在线进行二次分析,或离线浓缩处理后再分析,获得馏分的纯度信息,进一步完成后处理,实现样品的微量制备。
3.2.2难分离组分的精细拆分功能通过接口连接两套不同的色谱系统,通过LC-B系统对样品进行第一级分离; 根据分离的结果,选择性地将难分离组分收集; 进一步采用LC-A系统进行第二级分离,根据样品浓度选择直接在线进样或者离线处理后再进样。通过两级分离,可以完成对样品的精细拆分。
3.2.3复杂样品的二维分离功能对于复杂样品,通过接口构建二维色谱系统进行高效分离。离线模式,通过LC-B系统进行第一维分离,将样品全部收集,并通过离线方式对馏分进行合并、浓缩、除盐等处理后,通过接口依次进入到LC-A系统中进行第二维分析。在线模式,通过接口同时连接一套常规分析系统(LC-B)和一套微量色谱系统(LC-A),以图1为例,当阀A和阀B均处于虚线位置,利用LC-B完成第一维分析,馏分收集至托盘的样品瓶中; 切换阀B到实线位置,利用三通阀C和活塞清洗管路和样品针,避免交叉污染; 由于第二维是微量系统,样品无需进一步浓缩,切换阀A到实线位置,选择需要的馏分,直接上样到定量环中; 再次切换阀A到虚线位置,馏分进入LC-A系统完成第二维分析; 此过程全程通过软件实现自动化控制,无人为干扰。
3.3 接口的评价
3.3.1样品的微量制备近年来,越来越多的稀有样品通过分析型液相色谱完成微量制备,如生物样品活性组分的提取[17]、中药组分对照品的制备[18]。本研究中,利用一套液相色谱系统,连接新设计的接口,按照2.2.1节所述实验条件,对4种芳香族化合物进行了分离。图2A是4种化合物的分离谱图,各组分得到了基线分离。按照图上标注虚线位置为起始点收集4组馏分,并离线进行浓缩后,再依次进样到同一套色谱系统分析,叠加谱图如图2B所示,各馏分纯度高且保留时间与目标物一致。此实验说明,利用接口的进样-收集-再进样,按照预设域值在线收集对应馏分,通过再次进样分析可以获得馏分的纯度信息,完成样品的微量制备。
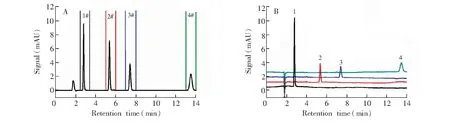
图2 (A)分离4种芳香族化合物色谱图; (B)4组馏分再进样叠加谱图。 1. 苯乙酮; 2. 甲苯; 3. 乙苯; 4. 芴Fig.2 (A) Chromatogram of 4 kinds of aromatic compounds; (B) Stacked chromatogram of 4 fractions. 1. Acetophenone; 2. Toluene; 3. Ethylbenzene; 4. Fluorene
3.3.2难分离组分的精细拆分利用新构建的接口连接两套液相色谱系统,按照2.2.2节所述步骤分离5种蛋白质样品,结果如图3所示。BSA和CEA属于酸性蛋白质,由于采用了pH 5.37的流动相进行洗脱,所以在SCX模式下,BSA和CEA几乎没有保留,在系统死时间出峰,其余3种蛋白质样品分离效果良好。直接按照保留时间,在控制软件设定收集的时间窗口,将图中峰“1+2”的馏分收集,切入第二维RP模式,BSA和CEA得到了基线分离。通过设计的接口,可以连接二维系统,并根据一维分离情况,选择性的将部分馏分切入第二维,实现难分离组分的精细拆分。
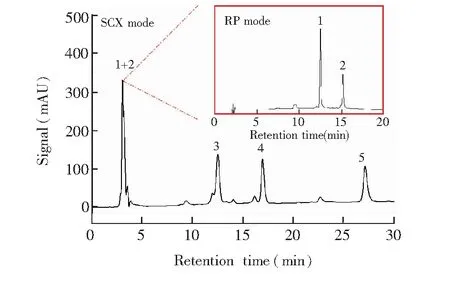
图3 5种蛋白质样品的分离谱图1.牛血清白蛋白; 2. 鸡卵清白蛋白; 3. 核糖核酸酶B; 4. 核糖核酸酶A; 5. 细胞色素CFig.3 Chromatogram of 5 kinds of proteins1. Bovine serum albumin (BSA); 2. Chicken egg white albumin (CEA); 3. RNase B; 4. RNase A; 5. Cytochrome C
3.3.3复杂样品的二维分离BSA酶解产同时具有疏水、亲水等成分。采用设计的接口连接两套液相色谱系统,第一维采用SCX模式,充分发挥上样量高的优势; 为了减少离线浓缩的二次处理步骤,第二维直接采用微柱RP模式,通过设定序列表全自动在线分离。如图4A所示,采用SCX模式,样品响应可分为两个区域,区域Ⅰ(5~20 min),组分响应少且不高,按照出峰分2个馏分进入第二维; 区域Ⅱ(24~36 min)有集中的、较强响应,后续按每0.5 min一个馏分连续收集并全部依次进入第二维分析。由于第一维SCX模式采用了高盐的流动相,第二维RP模式前10 min设置了较低比例有机相(2% 乙腈)的洗脱,一方面起到在线除盐的作用,另一方面可以更好兼容两维的流动相。二维分析结果如图4B所示,样品得到了较好的分离效果,以1 mAU为积分阈值,共识别色谱峰292个。此外,整个二维分析用时约45 h,基于设计的接口,配合色谱数据工作站,全过程实现了自动化分析,消除了人为操作带来的误差。

图4 (A)BSA酶解产物SCX分离谱图; (B)BSA酶解产物二维分离谱图Fig.4 (A) SCX chromatogram of a tryptic digest of BSA; (B) 2D-LC chromatogram of a tryptic digest of BSA
4 结 论
以双回路技术为基础,设计了一种二维色谱在线/离线接口。采用4种芳香族化合物、5种蛋白质样品和BSA酶解产物对设计的接口进行了系统地评价。结果表明,通过接口连接不同色谱系统,不仅可以实现基本的自动进样和馏分收集功能,还可利用色谱数据工作站设定程序实现样品的微量制备、难分离组分的精细拆分和复杂样品的二维分离。该接口功能强大、自动化程度高,为二维液相色谱的集成化控制及复杂样品的分析提供了有力工具。
1 Wang F, Min Y, Geng X D.J.Sep.Sci.,2012, 35: 3033-3045
2 ZHANG Xiang-Min.ChineseJournalofChromatography,2017, 35(1): 138-140
张祥民. 色谱,2017, 35(1): 138-140
3 XIE Xiu-Man, SUN Wan-Yang, HUANG Jing-Yi, Navaneethakrishnan P, ZHONG Ling, SUN Guo-Xiang.ChineseJ.Anal.Chem.,2016, 44(7): 1140-1147
谢秀满, 孙万阳, 黄竞怡, Navaneethakrishnan P, 仲 玲, 孙国祥. 分析化学,2016, 44(7): 1140-1147
4 SHEN Bao-Jia, QIN Kun-Ming, LIU Qi-Di, CAI Hao, LIU Xiao, CAI Bao-Chang.Sci.ChieseChem.,2013, 43(11): 1480-1489
沈保家, 秦昆明, 刘启迪, 蔡 皓, 刘 晓, 蔡宝昌. 中国科学: 化学,2013, 43(11): 1480-1489
5 Li Z, Chen K, Guo M Z, Tang D Q.J.Sep.Sci.,2016, 39: 21-37
6 Wei Z S, Fu Q, Cai J F, Huan L Y, Zhao J C, Shi H, Jin Y, Liang X M.J.Sep.Sci.,2016, 39: 2221-2228
7 Simone S, Michael L, Wolfgang L.J.Chromatogr.A,2012, 1259: 100-110
8 Pierre G, Didier T, Patrick S, Jérme V.J.Chromatogr.A,2012, 1255: 252-258
9 ZHANG Yan-Hai, ZHANG Da-Wei, CAO Ying, JIN Yan.JournalofInstrumentalAnalysis,2016, 35(1): 28-34
张艳海, 张大伟, 曹 莹, 金 燕. 分析测试学报,2016, 35(1): 28-34
10 Paola D, Nermeen F, Filomena C, Francesco C, Paola D, Luigi M.J.Chromatogr.A,2013, 1278: 46-53
11 Cacciola F, Jandera P, Mondello L.J.Sep.Sci.,2007, 30: 462-474
12 QIU Ya, QIN Feng, WEN Hong-Liang, ZHAO Jing-Dan, LIU Hao, YANG Mei-Cheng.ChineseJournalofChromatography,2015, 33(12): 1314-1319
裘 亚, 秦 峰, 闻宏亮, 赵敬丹, 刘 浩, 杨美成. 色谱,2015, 33 (12): 1314-1319
13 Ding K, Xu Y, Wang H, Duan C F, Guan Y F.J.Chromatogr.A,2010, 1217: 5477-5483
14 YE Lin-Quan, WU Qing-Shi, DAI Si-Min, XIAO Zhi-Liang, ZHANG Bo.ChineseJournalofChromatography,2011, 29(9): 857-861
叶淋泉, 吴清实, 戴思敏, 肖志良, 张 博. 色谱,2011, 29(9): 857-861
15 Wei Y L, Lan T, Tang T, Zhang L Y, Wang F Y, Li T, Du Y P, Zhang W B.J.Chromatogr.A,2009, 1216: 7466-7471
16 TANG Tao, ZHANG Wei-Bing, LI Tong, WANG Feng-Yun.ChineseJ.Anal.Chem.,2007, 35(12): 1767-1771
唐 涛, 张维冰, 李 彤, 王风云. 分析化学,2007, 35(12): 1767-1771
17 WANG Jian-Shan, XIA Hong-Jun, WAN Guang-Ping, LIU Jia-Wei, JIN Li-Hua, BAI Quan.ActaChim.Sinica,2016, 74(3): 265-270
王建山, 夏红军, 万广平, 刘家玮, 金丽花, 白 泉. 化学学报,2016, 74(3): 265-270
18 SONG Yu-Peng, DONG Jing, CHEN Hai-Fang, HU Yuan-Xiang, TAN Shu-Shu, YANG Wu-Liang.ChineseJournalofPharmaceuticalAnalysis,2017, 37(1): 137-141
宋玉鹏, 董 晶, 陈海芳, 胡源祥, 谭舒舒, 杨武亮. 药物分析杂志,2017, 37(1): 137-141

