小细胞肺癌中DBC1的表达及预后相关性研究
张苏宁,刘宗昂
(中国医科大学附属盛京医院胸外科,沈阳 110004)
肺癌的发病率和死亡率居恶性肿瘤之首,其中,小细胞肺癌 (small cell lung cancer,SCLC) 约占肺癌的20%~25%。约90%的SCLC患者在确诊时已有转移,因此,其早期诊断与治疗愈发重要,寻求特异性与敏感性高的肿瘤标志物是临床开展早期诊断项目最重要的一环。
乳腺癌缺失基因1 (deleted in breast cancer-1,DBC1) 最初由HAMAGUCHI等[1]应用代表性差异分析 (representational difference analysis,RDA) 筛选获得,因其在乳腺癌组织中杂合性缺失而得名乳腺癌缺失基因,定位于8p2l。研究[2-7]发现,在体外培养的肿瘤细胞系和实体肿瘤组织标本中,DBC1并未出现表达缺失,其表达水平在肿瘤组织中明显高于相应的正常组织,且与组织分化程度、TNM分期、淋巴结转移、总体生存时间、无病生存时间等临床指标密切相关。
本研究回顾性分析了中国医科大学附属盛京医院73例SCLC患者的临床资料,对上述患者肺癌组织标本中DBC1的表达水平进行了检测,并分析了DBC1表达与SCLC复发转移和生存期之间的关系,旨在探讨DBC1作为SCLC预后分子标志的可能性。
1 材料与方法
1.1 材料
1.1.1 标本来源:收集中国医科大学附属盛京医院医院2009年12月至2013年6月期间手术切除并经病理确诊为SCLC的石蜡标本73例。按照2007年第八版UICC-AJCC (Union for International Cancer Control-American Joint Committee on Cancer) 对SCLC的诊断标准进行肺癌病理分型及分期。本研究经中国医科大学附属盛京医院医学伦理委员会批准。
1.1.2 主要试剂及仪器:-80 ℃超低温冰箱 (中国Haier公司) ;高速冷冻离心机 (SorvallTMLegendTMMicro 21 Microcentrifuge,美国Thermo Fisher Scientific公司) ;mirVana PARIS Kit (美国Thermo Fisher Scientific公司) ;NanoDropND-1000紫外分光光度计(美国Thermo Fisher Scientific公司) ;Real-time 逆转录试剂盒 (日本TaKaRa公司) ;DBC1、内参RNU6B引物 (美国Applied Biosystems公司) ;Cobas z480实时荧光定量PCR仪 (瑞士Roche公司) ;miRNA qPCR Kit(美国GeneCopoeia公司) 。
1.2 方法
1.2.1 实时定量PCR:按照mirVana PARIS Kit试剂盒说明书操作,提取肺癌石蜡组织总RNA,50 μ L DEPC稀释后-80 ℃储存备用。按照Real-time 逆转录试剂盒操作程序进行逆转录反应,取RNA 500 ng,冰上加入5×PrimeScript Buffer 2 μ L,PrimeScript RT Enzyme MixⅠ 0.5 μ L,Oligo dT Primer 0.5 μ L,Random 6 mers 0.5 μ L,total RNA 500 ng,DECP水,总体积 10 μ L。反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 15 min,反应完毕后置于-80 ℃保存备用。按照miRNA qPCR Kit试剂盒说明书行实时定量PCR,加入qPCR Mix 10 μ L,上游引物 (2 μ mol/L) 2 μ L,下游引物 (2 μ mol/L)2 μ L,cDNA 2 μ L,加入DEPC水至20 μ L,置于Cobas z480实时荧光定量PCR仪,反应条件为95 ℃ 10 min预变性,后按95 ℃ 10 s变性、-2 ℃ 20 s 退火、72 ℃10 s,扩增40个循环。实验重复3次。
1.2.2 随访:电话随访全部73例患者,了解患者生存情况,随访截止时间为2017年5月,随访时间11~64个月。其中6例患者失访,3例患者随访截止时仍存活。
1.3 统计学分析
根据DBC1相对表达量进行实验分组,采用2-ΔΔCt方法,把2-ΔΔCt中位数作为分界值,将患者分为高表达和低表达组。DBC1表达与临床病理参数的相关性采用χ2检验分析,采用Kaplan-Meier方法计算SCLC生存指标,并采用log-rank检验比较生存率,采用COX风险比例模型分析预后的独立影响因素。采用SPSS 19.0统计软件进行统计学分析,P <0.05为差异有统计学意义。
2 结果
2.1 基本资料
共收集SCLC患者资料73例,其中男59例,女14例;年龄≥60岁36例,<60岁37例;吸烟56例,不吸烟17例;局限期33例,广泛期40例;有复发转移46例,无复发转移27例。
2.2 DBC1表达与SCLC患者预后参数的相关性
根据DBC1的表达量,将73例肺癌患者分为高表达组 (57例) 和低表达组 (16例) 。统计结果显示,DBC1的表达量在不同性别 (χ2=0.332,P = 0.123) 、年龄 (χ2=0.188,P = 0.394) 及吸烟史 (χ2=0.504,P = 0.106) 等方面差异均无统计学意义 (P > 0.05) 。DBC1表达量与复发转移情况及肿瘤分期相关,差异有统计学意义 (χ2=5.723,P = 0.017;χ2=10.748,P = 0.001),其中,有复发转移肺癌患者中,DBC1高表达40例,低表达6例;无复发转移肺癌患者中DBC1高表达17例,低表达10例。局限期患者中DBC1高表达20例,低表达13例;广泛期患者中DBC1高表达37例,低表达3例。
2.3 DBC1表达水平与SCLC患者生存及预后的关系
采用Kaplan-Meier方法计算不同DBC1表达水平组的SCLC生存率,并采用log-rank检验比较生存率。结果显示,DBC1高表达组患者的中位无病生存时间 (disease free survival,DFS) (17个月) 明显较低表达组 (21个月) 缩短,差异有统计学意义 (P =0.007) (图1) ,DBC1高表达组患者的中位总生存时间 (overall survival,OS) (27个月) 明显较低表达组患者 (30个月) 缩短,差异有统计学意义 (P = 0.043)(图2) 。同时,肿瘤分期 (P < 0.001) 及复发转移 (P <0.001) 也与SCLC患者预后相关,广泛期或有复发转移或DBC1表达水平高的SCLC患者预后较差。Cox回归模型多因素分析显示:分期 (P < 0.001) 、复发转移 (P < 0.001) 和DBC1高表达 (P < 0.001) 是SCLC患者预后的独立影响因素 (表1) 。
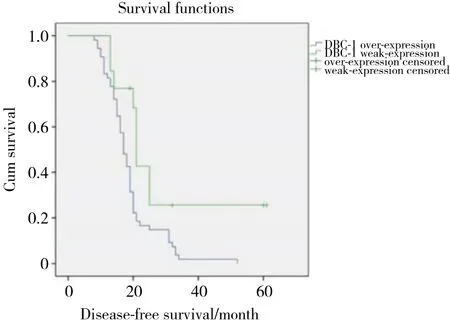
图1 无病生存时间Fig.1 Disease-free survival time.
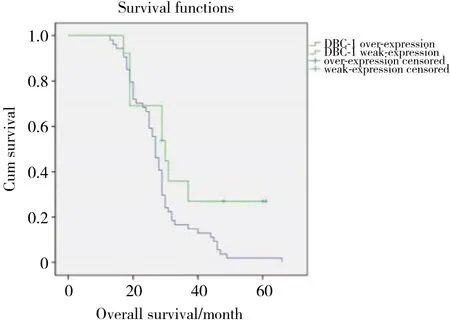
图2 总生存时间Fig.2 Overall survival time
3 讨论
肺癌主要包括包括非SCLC、SCLC及其他类型,近年来SCLC的发病率缓慢上升,尤其在女性中发病率逐年上升。尽管SCLC的早期诊断和临床综合治疗水平近几年提升迅速,但预后仍不佳[8]。随着分子生物学的快速发展,某些基因表达的变化不仅能够准确地反映肿瘤特性,而且能够更为准确地反映肿瘤细胞的基因组学及表观遗传学变化,从而成为肿瘤研究领域热点。
DBC1的生理和病理功能目前还知之甚少。虽然最初报道DBC1可以抑制p53的去乙酰化作用,被认为是肿瘤抑制基因,但随着研究的深入,发现DBC1并不是在所有的癌组织中都是表达缺失的,DNA微阵列数据显示,与正常乳腺组织相比较,乳腺癌组织中DBC1的表达是上调的[9]。DBC1相关机制研究[4,10-12]发现DBC1通过影响SIRT1、ER等分子的表达和甲基化,参与调控细胞侵袭、转移、增殖、凋亡及组蛋白修饰等生理病理过程。研究[12-14]提示,CK2a可在转录后水平调节DBC1甲基化,通过调节caspase通路促进TNF-α诱导细胞凋亡[12-13],DBC1还可直接结合SIRT1,抑制SIRT1的去乙酰化酶活性,影响SIRT1-p53通路,促进细胞凋亡[14];这些结果提示DBC1在肿瘤的发生发展中起重要作用。
本研究回顾分析了73例SCLC患者的临床资料,采用实时定量PCR技术检测了患者肺癌组织标本中DBC1的表达水平,并分析其与患者临床病理参数的相关性,研究DBC1与SCLC患者预后的关系。结果发现,DBC1的表达与患者肿瘤是否发生复发转移相关,与性别、年龄、分期及吸烟史均无明显相关;DBC1的表达水平与患者生存期呈负相关,即DBC1高表达的患者生存期较短;分期、复发转移和DBC1水平与SCLC患者预后相关,且均为独立危险因素。以上研究结果均提示DBC1高表达状态可能是SCLC患者预后的不良因素,并与SCLC一线治疗后早期复发转移相关。
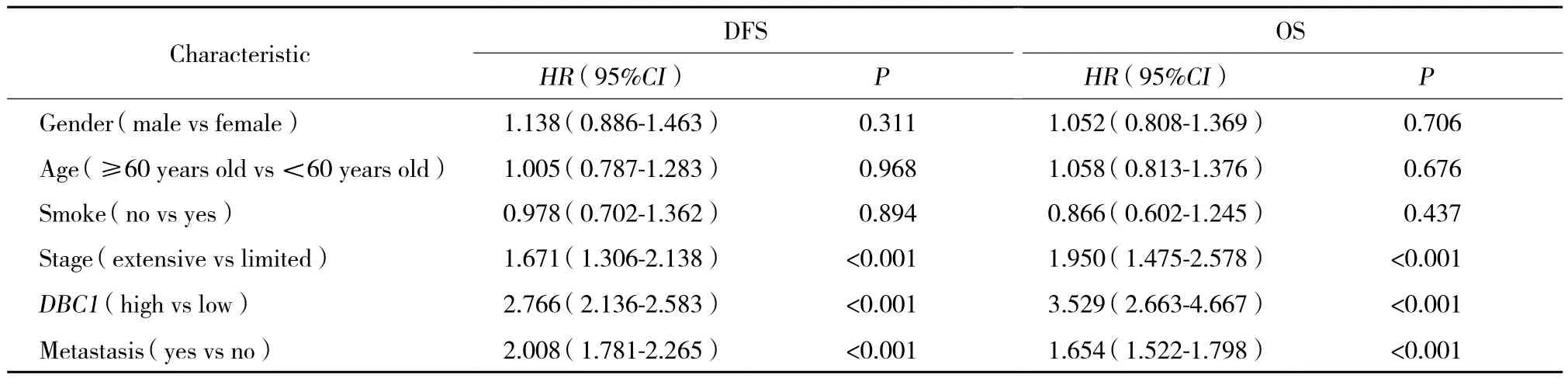
表1 SCLC患者预后COx多因素回归分析Tab.1 COx multivariate regression analysis of the prognostic factors of SCLC patients
本研究作为回顾性分析有诸多局限性,如临床资料不甚完整,无法根据肿瘤组织分化程度进行更为精确的分组,未能取得手术患者瘤旁正常组织以作为肿瘤组织对照组等。本研究组正在进行外周血DBC1表达水平指导SCLC患者治疗方案的前瞻性研究,期待进一步的数据证实本结果的可靠性。
总之,本研究结果表明DBC1高表达与SCLC复发转移密切相关,并提示SCLC患者预后不良,提示DBC1表达水平可以作为提示SCLC患者复发转移和预后的一个重要标志。
[1] HAMAGUCHI M,METH JL,VON KLITZING C,et al. DBC2,a candidate for a tumor suppressor gene involved in breast cancer [J]. Proc Natl Acad Sci USA,2002,99(21):13647-13652. DOI:10.1073/pnas.212516099.
[2] KIM W,CHEON MG,KIM JE. Mitochondrial CCAR2/DBC1 is required for cell survival against rotenone-induced mitochondrial stress[J]. Biochem Biophys Res Commun,2017,485(4):782-789. DOI:10.1016/j.bbrc.2017.02.131.
[3] YU EJ,KIM SH,KIM HJ,et al. Positive regulation of beta-catenin-PROX1 signaling axis by DBC1 in colon cancer progression [J].Oncogene,2016,35(26):3410-3418. DOI:10.1038/onc.2015.401.
[4] LIU X,EHMED E,LI B,et al. Breast cancer metastasis suppressor 1 modulates SIRT1-dependent p53 deacetylation through interacting with DBC1[ J]. Am J Cancer Res,2016,6(6):1441-1449.
[5] HA SY,KIM JH,YANG JW,et al. Expression of DBC1 is associated with poor prognosis in hepatitis virus-related hepatocellular carcinoma[ J]. Pathol Res Pract,2016,212(7):616-621. DOI:10.1016/j.prp.2016.04.001.
[6] WON KY,CHO H,KIM GY,et al. High DBC1( CCAR2) expression in gallbladder carcinoma is associated with favorable clinicopathological factors[ J]. Int J Clin Exp Pathol,2015,8(9):11440-11445.
[7] CHO D,PARK H,PARK SH,et al. The expression of DBC1/CCAR2 is associated with poor prognosis of ovarian carcinoma[ J]. J Ovarian Res,2015,8:2. DOI:10.1186/s13048-015-0129-3.
[8] JEMAL A,SIEGEL R,XU J,et al. Cancer statistics,2010[ J]. CA Cancer J Clin,2010,60(5):277-300. DOI:10.3322/caac.20073.
[9] RADVANYI L,SINGH-SANDHU D,GALLICHAN S,et al. The gene associated with trichorhinophalangeal syndrome in humans is overexpressed in breast cancer[ J]. Proc Natl Acad Sci USA,2005,102(31):11005-11010. DOI:10.1073/pnas.0500904102.
[10] SATHISHKUMAR C,PRABU P,BALAKUMAR M,et al. Augmentation of histone deacetylase 3( HDAC3) epigenetic signature at the interface of proinflammation and insulin resistance in patients with type 2 diabetes[ J]. Clin Epigenetics,2016,8:125. DOI:10.1186/s13148-016-0293-3.
[11] QIN B,MINTER-DYKHOUSE K,Yu J,et al. DBC1 functions as a tumor suppressor by regulating p53 stability[ J]. Cell Rep,2015,10(8):1324-1334. DOI:10.1016/j.celrep.2015.01.066.
[12] BAE JS,PARK SH,KIM KM,et al. CK2alpha phosphorylates DBC1 and is involved in the progression of gastric carcinoma and predicts poor survival of gastric carcinoma patients[ J]. Cancer,2015,136(4):797-809. DOI:10.1002/ijc.29043.
[13] KOYAMA S,WADA-HIRAIKE O,NAKAGWA S,et al. Repression of estrogen receptor beta function by putative tumor suppressor DBC1[ J]. Biochem Biophys Res Commun,2010,392(3):357-362.DOI:10.1016/j.bbrc.2010.01.025.
[14] ZHAO W,KRUSE JP,TANG Y,et al. Negative regulation of the deacetylase SIRT1 by DBC1[ J]. Nature,2008,451(7178):587-590. DOI:10.1038/nature06515.

