白三烯受体拮抗剂通过Wnt/β-catenin信号通路影响哮喘小鼠气道重塑机制的研究
蒋昱,黄传君,李泽,张才擎
(1. 山东大学医学院呼吸内科,济南 250012; 2. 山东省千佛山医院呼吸内科,济南 250013; 3. 临沂市高新技术产业开发区人民医院呼吸内科,山东 临沂 276017)
支气管哮喘是由多种细胞 (嗜酸粒细胞、中性粒细胞、肥大细胞、平滑肌细胞及上皮细胞) 和细胞组分介导的变态反应性疾病,主要发病机制是气道炎症-免疫和神经调节机制失衡[1]。气道炎症以及气道上皮损伤/修复的迁延极易引起重塑,表现为气道上皮细胞黏液化生、上皮下胶原沉积、平滑肌细胞增生/肥大等。气道重塑呈现进行性发展,是进一步导致不可逆性气流受限和持续性气道高反应(airway hyperresponsiveness,AHR) 的重要因素,并且是激素抵抗的关键原因,最终诱导难治性哮喘的慢性化[2]。Wnt7b/β-catenin信号通路存在于多种组织细胞的增殖、分化中,呈高度保守,最新研究[3]发现它对哮喘气道炎症和重塑具有非常重要的作用。本研究主要针对白三烯受体拮抗剂多靶点的药理作用特点,以BALB/C小鼠模型为研究对象,探究Wnt/β-catenin信号通路在哮喘小鼠气道重塑方面的作用机制。
1 材料与方法
1.1 材料
40只SPF级BALB/C雌性小鼠( 7~8周龄,体质量15~20 g,购自山东大学医学院动物实验中心) ;孟鲁司特钠咀嚼片( 4 mg/ 片,杭州默沙东制药有限公司) 。鸡清卵蛋白( ovalbumin,OVA) ( 美国Sigma公司) ;Wnt7b、β-catenin及c-Myc抗体( 英国Abcam公司) ;SDS-PAGE 凝胶配制试剂盒( 中国碧云天生物技术研究所) ;TRIzol试剂液及引物( 美国Invitrogen 公司) ;SYBR Premix Ex Taq 及 PrimeScript RT 试剂盒( 日本TaKaRa 公司) ;980超声雾化仪( 上海新天缘医疗设备有限公司) 。
1.2 方法
1.2.1 动物模型建立:将30只小鼠按照随机数字表分为对照组、哮喘组和孟鲁司特钠组,每组10只。哮喘组在实验1、8、15 d腹腔注射0.5 mL含0.1 mg OVA及1 mg氢氧化铝凝胶佐剂的生理盐水致敏,15~28 d在自制箱中 (30 cm×25 cm×30 cm) 每天给予5%OVA雾化30 min,激发建立哮喘小鼠模型,孟鲁司特钠组在雾化OVA 溶液2 h前,按照1 mg/kg的剂量灌胃给药,孟鲁司特钠药物剂量根据药物剂量计算公式估算推出,1次/d[4]。对照组小鼠采用生理盐水替代进行灌胃及雾化处理,其余处理相同,28 d后用于实验。
1.2.2 标本的采集:第28天最后1次雾化后,在24 h内用10%水合氯醛注射麻醉处死小鼠,摘取眼球取血,低温离心后取上清备用,将小鼠置于解剖台固定,剪开胸颈部暴露气管,取支气管和肺,部分在液氮中冻存用于Western blotting和实时PCR,部分肺组织浸泡于4%多聚甲醛固定,经脱水、石蜡包埋、切片,用于HE染色和图像采集。
1.2.3 HE染色及图像采集:将部分支气管和肺组织用4%多聚甲醛固定,常规脱水、包埋以及石蜡以4~6 μ m切片后,甲苯脱蜡及乙醇复水,然后苏木素染色、冲洗、伊红染色,乙醇脱水中性树胶封片。
1.2.4 ELISA 法检测血清 OVA-sIgE 的表达:按照ELISA 试剂盒说明书操作步骤,设标准孔、待测样品孔、空白孔,分别加样、显色液,最后加入终止液终止,利用酶标仪按照 450 nm波长测量各孔的OD值,按照标准曲线计算样品OVA-sIgE 的浓度。
1.2.5 Western blotting检测肺组织提取蛋白中Wnt7b、β-catenin和c-Myc含量:取100 mg小鼠肺组织标本加入0.5 mL的裂解液( RIPA∶PMSF=100∶1) ,冰上剪碎并匀浆,4 ℃下12 000 r/min离心 15 min,取上清液加入上样缓冲液,金属浴95 ℃,5 min分装后置于-80 ℃冰箱中保存,配制10%分离胶和5%浓缩胶进行蛋白凝胶电泳,接着将蛋白转膜到 0.22 μ m的 PVDF 膜上,并用5% 脱脂牛奶封闭,Wnt7b单克隆抗体、β-catenin单克隆抗体及c-Myc单克隆抗体按照1∶100稀释,内参( 山羊抗兔GAPDH抗体1∶3 000) 4 ℃ 孵育过夜,TBST清洗3次,每次10 min,辣根过氧化物酶标记山羊抗兔二抗( 1∶5 000) 37 ℃孵育2 h后,ECL发光试剂盒显影。结果用 ImageJ2×软件分析测定条带的积分光密度值的峰面积。
1.2.6 实时 PCR 法检测Wnt7b、β-catenin及c-Myc mRNA表达:分别取每只小鼠肺组织称重剪碎,加入适量TRIzol提取总RNA,按照试剂盒说明,取2 μ g总RNA 反转录为 cDNA。取cDNA产物2 μ L,SYBR 预混液 16 μ L、上下游引物 2 μ L 共计 20 μ L总 反 应 体系 行 实 时 定 量 PCR。每个样本设3个复孔。反应程序为:95 ℃预变性90 s,95 ℃退火5 s,55 ℃延伸30 s,共40个循环,用荧光定量 PCR 仪( ABI7500) 自动分析并计算出每个样本的CT值,实验组Wnt7b、β-catenin及c-Myc mRNA相对于对照组基因表达倍数采用 2-ΔΔCT进行数据处理。
1.2.7 图像采集分析:将肺组织切片在显微镜下放大200倍,观察各组小鼠肺泡及支气管周围炎症程度,每只小鼠选取3个具有完整的小支气管且直径100~200 μ m的横截图像,运用图像采集系统、医学图像分析软件测定支气管管腔周长 (basement membrane perimeter,PBM) 、支气管管壁面积 (wall area of bronchial tube,WAt) 、支气管管壁平滑肌面积 (wall area of bronchial smooth muscle,WAm) 和平滑肌细胞计数 (the number of bronchial smooth muscle cells,N) ,上述指标用PBM标准化,分别以 WAt / PBM、WAm /PBM、N / PBM表示。
1.3 统计学分析
所有数据采用 SPSS 17.0 统计软件分析,计量数据以±s表示,采用单因素方差分析 (one-way ANOVA ) ,多组间两两比较采用 LSD-t检验,P < 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理切片HE染色比较
结果显示,对照组小鼠支气管黏膜完整,光滑,无充血水肿,支气管上皮细胞排列有序,上皮基底膜无增厚、无炎症细胞浸润现象。哮喘组小鼠支气管壁增厚狭窄,黏膜充血水肿,基底膜增厚断裂,支气管壁和血管周围有大量炎症细胞浸润;孟鲁司特钠组小鼠支气管黏膜充血水肿,基底膜增厚及炎症细胞浸润程度均较哮喘组轻。见图1。
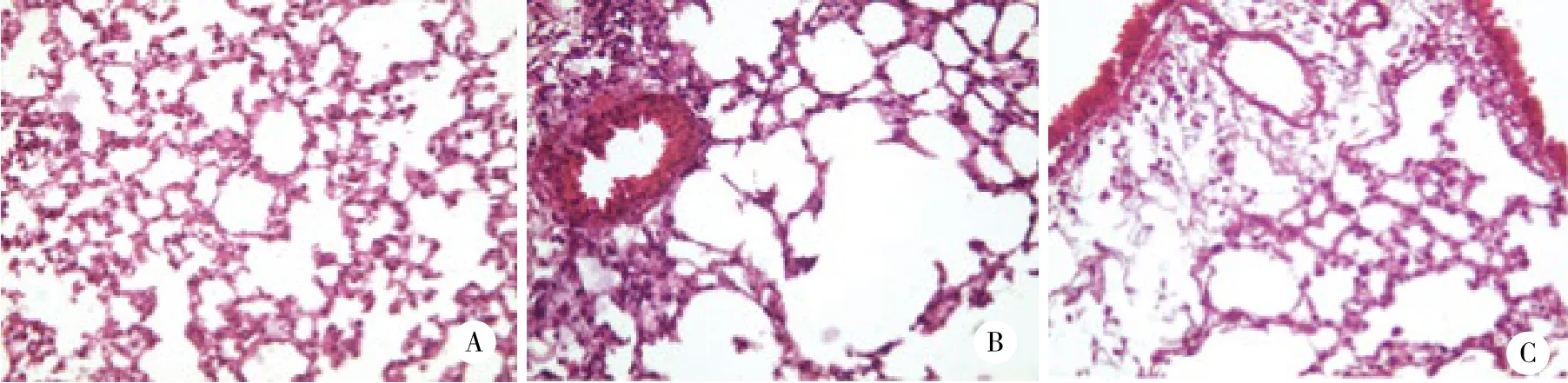
图1 各组小鼠肺组织HE 染色 ×200Fig.1 H&E staining of the lung tissue from each group ×200
2.2 各组小鼠ELISA 检测结果比较
结果显示,哮喘组小鼠血清 OVA-sIgE 明显高于对照组 (P < 0.05) ,孟鲁司特钠组血清 OVA-sIgE水平低于哮喘组但仍高于对照组 (P < 0.05) ,造模成功。见图 2。
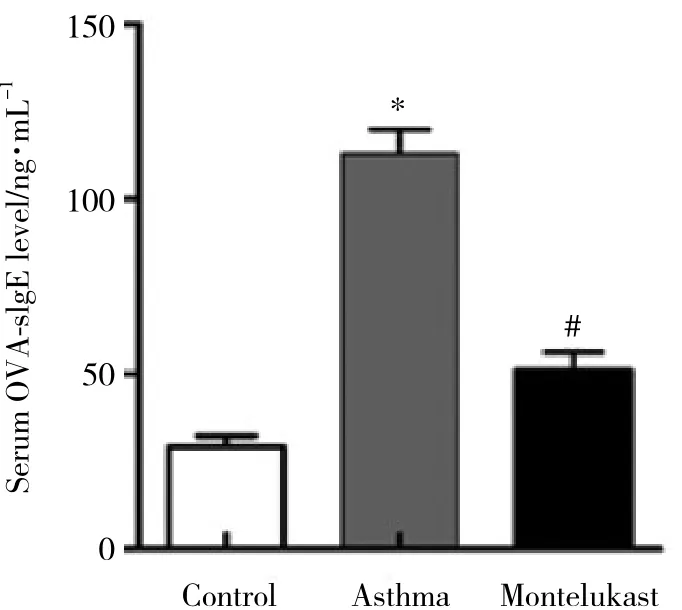
图2 各组小鼠血清 OVA-sIgE 表达水平Fig.2 Serum OVA-slgE expression levels in each group
2.3 Western blotting 检测各组小鼠肺组织提取蛋白中Wnt7b、β-catenin及c-Myc水平
结果显示,哮喘组小鼠肺组织中Wnt7b的表达明显高于孟鲁司特钠组 (P < 0.05) ;β-catenin及c-Myc在哮喘组表达明显较对照组升高,在孟鲁司特钠组较低,但仍高于对照组。见表1。
2.4 实时 PCR 检测各组肺组织Wnt7b、β-catenin及c-Myc mRNA的表达结果
实时 PCR 结果显示,哮喘组小鼠肺组织Wnt7b、β-catenin及c-Myc mRNA相对表达量均明显高于对照组 (P < 0.05) ,孟鲁司特钠组 Wnt7b、β-catenin及c-Myc mRNA 水平低于哮喘组,但均高于对照组(P < 0.05) ,见表2。
2.5 各组小鼠WAt /PBM、WAm /PBM、N /PBM比较
结果显示,孟鲁司特钠组小鼠WAt/PBM、WAm /PBM低于哮喘组小鼠,差异有统计学意义 (均P <0.05) ,见表3。
表1 各组小鼠肺组织中Wnt7b、β-catenin和c-Myc的蛋白表达 (±s)Tab.1 The expression of Wnt7b,β-catenin,and c-Myc in the lung tissue of mice (±s)

表1 各组小鼠肺组织中Wnt7b、β-catenin和c-Myc的蛋白表达 (±s)Tab.1 The expression of Wnt7b,β-catenin,and c-Myc in the lung tissue of mice (±s)
1) P < 0.05 vs control group;2) P < 0.05 vs asthma group.
Group Wnt7b protein β-catenin protein c-Myc protein Control 0.10±0.05 0.24±0.04 0.29±0.03 Asthma 0.20±0.08 1) 0.42±0.09 1) 0.47±0.11 1)Montelukast 0.13±0.07 2) 0.33±0.05 2) 0.37±0.07 2)
表2 各组小鼠肺组织中Wnt7b、β-catenin和c-Myc mRNA表达 (±s)Tab.2 The mRNA expression of Wnt7b,β-catenin,and c-Myc in the lung tissue of mice (±s)

表2 各组小鼠肺组织中Wnt7b、β-catenin和c-Myc mRNA表达 (±s)Tab.2 The mRNA expression of Wnt7b,β-catenin,and c-Myc in the lung tissue of mice (±s)
1) P < 0.05 vs control group;2) P < 0.05 vs asthma group.
Group Wnt7b mRNA β-catenin mRNA c-Myc mRNA Control 1.52±0.25 1.15±0.31 1.12±0.27 Asthma 8.21±1.311) 2.03±0.721) 3.71±0.931)Montelukast 3.78±0.672) 1.55±0.392) 1.84±0.692)
表3 各组小鼠WA t /PBM、WAm /PBM、N /PBM的比较 (±s)Tab.3 The comparison of WAt/PBM,WAm/PBM,and N/PBM ratios in mice (±s)

表3 各组小鼠WA t /PBM、WAm /PBM、N /PBM的比较 (±s)Tab.3 The comparison of WAt/PBM,WAm/PBM,and N/PBM ratios in mice (±s)
1) P < 0.05 vs control group;2) P < 0.05 vs asthma group.
GroupWAt/PBM (μ m2 /μ m)WAm/PBM (μ m2 /μ m)N/PBM (N/μ m)Control 5.6±2.1 3.3±1.8 0.03±0.02 Asthma 18.2±4.71) 8.8±3.51) 0.08±0.031)Montelukast 10.2±3.92) 6.1±3.72) 0.05±0.022)
3 讨论
气道重塑是引起支气管哮喘不可逆性气流受限的重要因素,也是激素抵抗的病理生理学基础,积极预防改善气道重塑在支气管哮喘的治疗中尤为重要。Wnt通路是人体内重要的信号转导系统,它广泛存在于各组织细胞中,参与细胞增殖、分化、凋亡及胚胎发育等多种生理过程,Wnt基因位于12q13上[5],Wnt信号通路主要有家族分泌蛋白、散乱蛋白、β-catenin、卷曲蛋白 (frizzled,Frz) 及糖原合成酶激酶 3β组成。在正常的成熟细胞中Wnt基因并不表达,处于沉默状态,当细胞受到慢性炎症,理化因子长期刺激以及细胞癌变的过程时Wnt基因本身或是下游信号成分改变而被激发。Wnt信号通路主要通过Wnt蛋白受体、胞内蛋白、核内转录等途径激活下游基因的表达,参与信号转导。Wnt7b是Wnt信号蛋白家族成员之一,并参与经典Wnt/β-catenin信号通路,与Frz 跨膜受体结合后进行信号传递[6]。Wnt7b主要在肺组织上皮表达,在胚胎时期便参与肺的发育和维持血管平滑肌的完整[7]。β-catenin位于经典Wnt信号通路的中心环节,它在细胞质/核内异常累积转录激活Wnt反应基因。以往的研究[8]发现,β-catenin与多种恶性肿瘤(直肠腺癌、卵巢癌及乳癌)的发生相关,它是一种多功能细胞质可溶性蛋白,其在胞质内过量表达时,可以向细胞核转移并在c-myc、Cyclin D1的催化下与LEF转录子结合,引起细胞增殖异常,最终导致癌症的发生。而近年研究[9-10]发现,不仅仅是在恶性肿瘤,支气管过度收缩或是拉伸可以激活β-catenin,并使其在气道上皮以细胞增殖、分化、组织修复和细胞外基质生产等方式参与组织修复、促纤维化以及哮喘气道重塑。c-Myc是β-catenin下游最为重要的靶基因之一,其本质是一种原癌基因,可与染色体 DNA 结合,介导细胞的增殖、分化和凋亡,朱等[11]研究表明,在哮喘疾病中β-catenin和c-Myc的含量与气道重塑的程度成正相关,促进细胞因子及炎症介质的表达和释放,与气道炎症和气道重塑密切相关。
近几年白三烯受体拮抗剂作为非类固醇类平喘抗炎药疗效确切,它能抑制炎症细胞黏附、聚集和增殖,阻止气道平滑肌细胞增生,上皮下胶原的沉积以及上皮下纤维化,具有抑制气道重塑和抗纤维化的作用[12-13]。白三烯受体拮抗剂具有多种药理作用,在哮喘疾病的治疗中,能在不同的信号通路中发挥抗炎抗气道重塑的作用,如减少Th2型白介素 (IL-4、IL-5及IL-13) 、 TGF-β及MMP-9等[14-15]。本研究结果显示,孟鲁司特钠组小鼠支气管无明显增厚,管腔无过多分泌物,亦未见周围炎症细胞浸润,且Wnt7b、β-catenin、c-Myc及气道重塑指标WAt /PBM、WAm /PBM的表达明显低于哮喘组小鼠,这说明白三烯受体拮抗剂可以通过Wnt/β-catenin信号通路抑制哮喘的炎症反应和气道重塑。在BELLER等[16]研究中发现白三烯受体拮抗剂具有强大抗炎和抗纤维化作用,对气道形态具有逆转作用。因此推测哮喘是体内外因素影响作用下体内Wnt/β-catenin信号通路被激活,并且相互作用共同促进气道平滑肌细胞分裂增殖,加剧气道炎症和气道重塑,白三烯受体拮抗剂可能通过抑制Wnt/β-catenin的异常累积,减少下游炎性细胞因子表达,在信号通路的上游水平进行控制,减轻炎症和气道高反应。白三烯受体拮抗剂抑制气道重塑与通路中各分子之间具体关系还有待进一步研究。
[1] HOSHINO M,OHTAWA J,AKITSU K. Association of airway wall thickness with serum periostin in steroid-naive asthma [J].Allergy Asthma Proc,2016,37 (3) :225-230. DOI:10.2500/aap.2016.37.3945.
[2] YANG ZC,YI MJ,SHAN YC,et al. Targeted inhibition of Six1 attenuates allergic airway inflammation and remodeling in asthmatic mice[J]. Biomed Pharmacother,2016,12 (84) :1820-1825. DOI:10.1016/j.biopha.2016.10.090.
[3] BARRETO-LUIS A,CORRALES A,ACOSTA-HERRERA M,et al.A pathway-based association study reveals variants from Wnt signalinggenes contributing to asthma susceptibility [J]. Clin Exp Allergy,2017,47( 5) :618-626. DOI:10.1111/cea.12883.
[4] 陈奇,孙瑞元,邓文龙,等. 中药药理研究方法学[ M]. 北京:人民卫生出版社,1993:33-34.
[5] SHARMA S,TANTISIRA K,CAREY V,et al. A role for Wnt signaling genes in the pathogenesis of impaired lung function in asthma[ J].Am J Respir Crit Care Med,2010,181( 4) :328-336. DOI:10.1164/rccm.200907-1009OC.
[6] YAN Z,KUI Z,PING Z. Reviews and prospectives of signaling pathway analysis in idiopathic pulmonary fibrosis[ J]. Autoimmun Rev,2014,13( 10) :1020-1025. DOI:10.1016/j.autrev.2014.08.028.
[7] COHEN ED,IHIDA-STANSBURY SK,LU MM,et al. Wnt signaling regulates smooth muscle precursor development in the mouse lung via a tenascin C/PDGFR pathway[ J]. J Clin Invest,2009,119( 9) :2538-2549. DOI:10.1172/JCI38079.
[8] BILIC J,HUANG YL,DAVIDSON G,et al. Wnt induces LRP6 signalosomes and promotes dishevelled-dependent LRP6 phosphorylation[ J]. Science,2007,316( 5831) :1619-1622. DOI: 10.1126/science.1137065.
[9] YAO L,ZHAO H,TANG H,et al. Blockade of β-catenin signaling attenuates toluene diisocyanate-induced experimentalasthma[ J]. Allergy,2017,72( 4) :579-589. DOI:10.1111/all.13045.
[10] FANG C,LU W,LI C,et al. MiR-3162-3p is a novel microRNA that exacerbates asthma by regulating β-catenin[ J]. PLoS One,2016,11( 3) :1-16. DOI:10.1371/journal.pone.0149257.
[11]朱婷婷,翁翠叶,贾宵宵,等. Wnt7b/β-catenin信号通路在大鼠哮喘气道重塑中的作用[J]. 温州医科大学学报,2017,47( 1) :14-18. DOI:10.3969/j.issn.2095-9400.2017.01.003.
[12] TENERO L,PIAZZA M,SANDRI M,et al. Effect of montelukast on markers of airway remodeling in children with asthma[ J]. Allergy Asthma Proc,2016,37( 5) :77-83. DOI:10.2500/aap.2016.37.3978.
[13] CI KOWSKI J,MAZUREK H,HYDZIK P,et al. Inflammatory markers as exacerbation risk factors after asthma therapy switch from inhaled steroids to montelukast[ J]. Pulm Pharmacol Ther,2016,39(8) :7-13. DOI:10.1016/j.pupt.2016.05.002.
[14] PENG J,ZHOU H,KUANG G,et al. The selective cysteinyl leukotriene receptor 1 ( CysLT1R) antagonistmontelukast regulates extracellular matrix remodeling[ J]. Biochem Biophys Res Commun,2017,484( 3) :474-479. DOI:10.1016/j.bbrc.2017.01.052.
[15] CHAN PH,TO CY,CHAN EY,et al. A randomized placebo-controlled trial of traditional Chinese medicine as an add-on therapy to oral montelukast in the treatment of mild persistent asthma in children[ J]. Complement Ther Med,2016,29( 12) :219-228. DOI:10.1016/j.ctim.2016.10.010.
[16] BELLER TC,FRIEND DS,MAEKAWA A,et al. Cysteinyl leukotriene 1 receptor controls the severity of chronic pulmonary inflammation and fibrosis[ J]. Proc Natl Acad Sci USA,2004,101( 9) :3047-3052. DOI:10.1073/pnas.0400235101.

