1H-MRS检测帕金森病伴轻度认知障碍患者后扣带回代谢物
黄明明,蒲 伟,2,李旭红,焦 玲,余 晖*
(1.贵州医科大学附属医院影像科,3.神经内科,贵州 贵阳 550004;2.贵州省人民医院影像科,贵州 贵阳 550002)
帕金森病(Parkinson disease, PD)是一种常见的神经系统变性疾病,主要表现为运动功能障碍;随病程进展,多数患者可出现认知功能障碍,进而发展成为痴呆[1-2]。1H-MRS波谱技术可无创检测生化代谢物;联合线性拟合模型(linear combination model, LCmodel)软件,更可精确测算N-乙酰天门冬氨酸(N-acetyl aspartate, NAA)、胆碱复合物(glycerophosphocholine+phosphocholine, tCho)、肌酸(creatine, Cr)、肌醇(myo-inositol, mI)、谷氨酸(glutamate, Glu)、谷氨酸和谷氨酰胺(glutamate+glutamine, Glx)及谷胱甘肽(glutathione, GSH)等大脑代谢物的含量。既往关于PD及PD伴认知障碍脑代谢物的研究多以相对定量的方法(即代谢物/Cr的比率)来表征大脑代谢物的改变,但在某些病理情况下,脑内Cr含量可相应升高或降低。O'Neill等[3]发现PD患者黑质中Cr可下降24%,以Cr为波谱研究内标的可靠性由此受到质疑。此外,有学者[4-5]发现后扣带回(posterior cingulate gyrus, PCG)区域可在静息状态时依然维持较高的代谢状态,是默认网络中的重要中枢节点,主要参与复杂的认知进程。影像学研究[6]表明PD患者通常表现出PCG损伤,如低灌注、皮层变薄及代谢异常等。Kizu等[7]提出PCG代谢物比率的异常(NAA/Cr、Cho/Cr 和mI/Cr)是导致老年痴呆以及额颞叶型痴呆的重要因素。本研究探讨1H-MRS波谱技术联合LCmodel软件在PD伴认知障碍中的诊断价值。
1 资料与方法
1.1 一般资料 收集2015年9月—2016年4月于我院神经内科就诊的35例PD患者(PD组),男19例,女16例,年龄41~83岁,平均(62.8±11.1)岁,均符合1997年英国PD协会脑库诊断标准[8],排除帕金森综合征、帕金森叠加综合征及外科治疗后患者。根据是否伴有认知功能障碍将其分为2个亚组:PD无认知功能障碍亚组(PDN亚组)22例,男13例,女9例,年龄41~83岁,平均(61.8±10.3)岁,简易精神状态检查量表(mini mental status examination, MMSE)评分≥26分,蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)≥26分;PD伴认知障碍亚组(PDMCI亚组)13例,男6例,女7例,年龄43~80岁,平均(63.3±13.3)岁,MMSE评分<26分,MoCA评分<26分。入选标准:①有独立行为能力且神经检查正常;②无任何精神或神经病史;③MRI仅可见脑萎缩和深部白质少量T2WI高信号(最大径<1 cm),无其他异常改变。选择年龄、性别相匹配的健康体检者22名作为对照组,男8名,女14名,年龄40~71岁,平均(57.3±7.5)岁。2组年龄、性别差异无统计学意义(P均>0.05)。本研究经贵州医科大学附属医院伦理委员会批准,所有受检者均签署知情同意书。
1.2 仪器与方法 采用Philips Achieva 3.0 T超导型MR扫描仪,8通道标准头线圈。采用3DT1序列,矢状位扫描,参数TE 5.9 ms,TR 12.0 ms,TI 400 ms,FA 15°,扫描矩阵 384×384×257,视野250 mm,层厚0.6 mm,分辨率0.57 mm×0.57 mm×0.60 mm;获取可定位PCG的结构像(图1)。
1H-MRS检查选择单体素点解析波谱序列(point resolved spectroscopy, PRESS),于3DT1矢状位上找到后扣带回(图1),扫描参数为TR 2 000 ms,TE 40 ms,视野 15 mm×15 mm×15 mm,扫描次数128次,扫描时间4 min。
1.3 MRS数据处理 波谱数据采集完毕后,将扫描仪器上生成的波谱原始数据导入电脑工作站。以LCmodel软件对波谱原始数据自动进行基线校正和平滑处理,对物质浓度标准差的下限低于20%、半高宽的最大值<0.1 ppm的数据进行分析。剔除PDN亚组、PDMCI亚组各1例及对照组中1名信噪比较差的波谱。计算主要代谢物的绝对浓度(某个解剖区域所含代谢物的含量,单位mM/L):总N-乙酰天门冬氨酸(total N-acetylaspartate, tNAA; NAA及少许NAAG)、tCho、总肌酸(total creatine, tCr)、Glu和Glx、mI及GSH(图2、3)。
1.4 统计学分析 采用SPSS 13.0统计分析软件,计量资料以±s表示。采用单因方差分析比较组间代谢物的绝对浓度(mM/L)的差异,方差齐则采用LSD检验,方差不齐则采用Dunnett检验。采用Pearson相关分析观察各代谢物浓度与认知功能评分的相关性,r≥0.8为高度相关,0.5≤r<0.8为中度相关,0.3≤r<0.5为存在相关性,r<0.3为关系极弱(不相关)。以P<0.05为差异有统计学意义。
2 结果
2.1 各代谢物绝对浓度比较 各组各代谢物绝对浓度比较见表1,PDN亚组各代谢物绝对浓度与对照组差异均无统计学意义(P均>0.05);PDMCI亚组tCr、NAA、mI和tCho的绝对浓度均较对照组显著下降(P均<0.05);PDMCI亚组tCr的绝对浓度较PDN亚组显著下降(P<0.05)。
2.2 相关性分析Pearson相关分析显示,tCr(r=0.444,P=0.01)、GSH(r=0.393,P=0.024)的绝对浓度与MMSE评分存在相关性;tCr(r=0.367,P=0.035)、GSH(r=0.376,P=0.031)及tCho(r=0.375,P=0.031)的绝对浓度与MoCA评分存在相关性(图3);其他代谢物的绝对浓度与MMSE、MoCA评分均无相关性。

图1 大脑矢状位T1WI图,红色方框位置为波谱所选取的FOV位置 图2 1H-MRS谱线图示未经拟合的波谱(黑线)及经LCmodel软件拟合后的波谱图(红线) A.健康体检者; B.PD患者

图3PCG区域各代谢物绝对浓度与认知功能评分的相关分析图 A、B.PCG区域tCr(A)、GSH(B)绝对浓度与MMSE评分相关分析图; C~E.PCG区域tCr(C)、GSH(D)、tCho(E)绝对浓度与MoCA评分相关分析图
表1 各组代谢物绝对浓度比较(mM/L,±s)
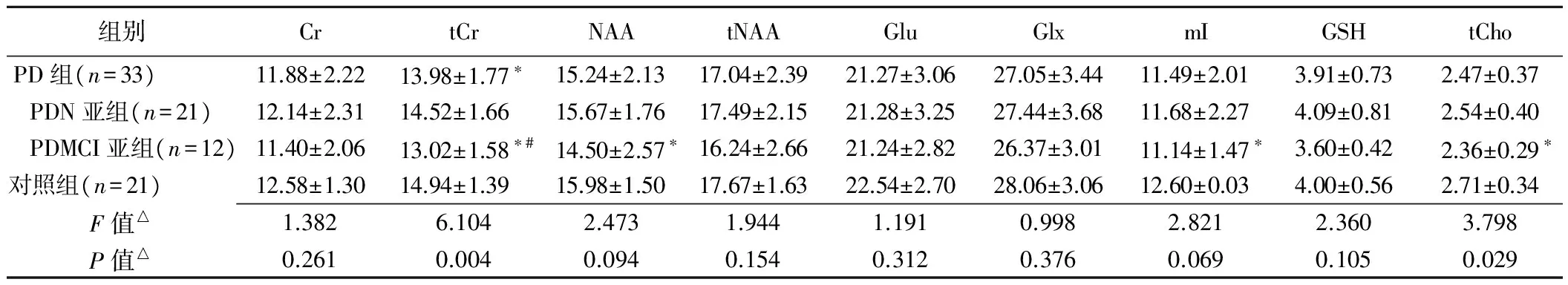
表1 各组代谢物绝对浓度比较(mM/L,±s)
组别CrtCrNAAtNAAGluGlxmIGSHtChoPD组(n=33) 11.88±2.2213.98±1.77∗15.24±2.1317.04±2.3921.27±3.0627.05±3.4411.49±2.013.91±0.732.47±0.37PDN亚组(n=21)12.14±2.3114.52±1.6615.67±1.7617.49±2.1521.28±3.2527.44±3.6811.68±2.274.09±0.812.54±0.40 PDMCI亚组(n=12)11.40±2.0613.02±1.58∗#14.50±2.57∗16.24±2.6621.24±2.8226.37±3.0111.14±1.47∗3.60±0.422.36±0.29∗对照组(n=21) 12.58±1.3014.94±1.3915.98±1.5017.67±1.6322.54±2.7028.06±3.0612.60±0.034.00±0.562.71±0.34F值△1.3826.1042.4731.9441.1910.9982.8212.3603.798P值△0.2610.0040.0940.1540.3120.3760.0690.1050.029
注:*:与对照组比较,P<0.05;#:与PDN亚组比较,P<0.05;△:PDN亚组、PDMCI亚组、对照组间方差分析结果
3 讨论
本研究结果显示,PCG区域tCr绝对浓度在PD伴认知障碍的进程中表现出下降趋势,且tCr的绝对浓度与MMSE评分和MoCA评分存在一定相关性。本研究中PD组tCr绝对浓度较对照组明显下降,提示脑内tCr的绝对浓度可随病理状态而改变,PDMCI亚组tCr浓度的降低可能与能量代谢水平有关。Kamagata等[9]发现PD和PD伴痴呆(Parkinson disease dementia, PDD)患者后皮层区域均表现出脑血流(cerebral blood flow, CBF)显著下降,且PDD区域CBF下降程度更大。Hosokai等[10]的研究也显示PDMCI患者后皮质区葡萄糖代谢(cerebral metabolic rate for glucose, CMRglc)低于PDN患者,提示PCG区域tCr的绝对浓度显著下降可能是上述CBF及CMRglc降低的直接表现,而tCr下降的程度可能是引起认知功能障碍的重要因素。此外,PD患者其他脑区tCr的绝对浓度也可下降,O'Neill等[3,11]发现PD患者黑质中的Cr有显著下降趋势。浓度是反映脑代谢物变化的敏感指标,观察PD及其他神经退行性病变时,定量分析脑代谢物绝对浓度可更准确、可靠地反映其病理进程。
本研究中,PDMCI亚组NAA、mI、tCho均较对照组显著下降。NAA为神经元的标志,其绝对浓度下降提示大脑神经元结构(形态、密度)和功能(活性)发生改变[12]。Griffith等[13-14]发现PDD及阿尔茨海默病(Alzheimer's disease, AD)患者PCG区域的NAA/Cr均显著下降,且NAA/Cr与记忆能力呈正相关;刘艳艳等[15]也发现遗忘型轻度认知功能障碍患者(amnestic mild cognitive impairment, aMCI)左侧PCG区域NAA/Cr显著下降;Sharma等[16]认为NAA浓度下降是PD引起大脑神经元凋亡的生物标识物。此外,研究[7]表明AD及额颞叶痴呆患者PCG区域的NAA/Cr也显著下降。上述研究提示PCG区域NAA浓度的变化可能是影响认知功能障碍的危险因素。
mI可反映胶质细胞增生或活性增强。本研究PDMCI亚组mI绝对浓度下降,可能与该区域中CMRglc降低有关[10]。有学者[17]认为mI的含量与脑内葡萄糖含量有关,CMRglc降低可引起肌醇合成的底物减少,导致mI含量降低。关于PD引起大脑内代谢物mI含量变化的研究较少见,可能因低场下mI(3.56 ppm)的信噪比较低而未被纳入分析。Cho可提供髓鞘和细胞膜磷脂代谢的相关信息。既往研究[18]认为PD患者豆状核及黑质有神经胶质细胞增生,Cho浓度升高。Griffith等[13]发现AD患者PCG区域Cho/Cr显著上升,而PDD患者PCG区域Cho/Cr含量无明显变化。本研究结果显示PCG区域Cho绝对浓度显著下降,且Cho的绝对浓度与MoCA评分存在相关性,与既往研究结果不同,可能因本研究采用绝对定量方法,与传统相对定量法存在差别。
GSH缺乏是导致PD的重要因素,尤其是PD患者黑质中GSH含量显著降低[19-20]。研究[21-22]表明早期PD患者大脑内GSH浓度或GSH氧化还原剂已发生改变。周红等[23]发现血浆T-GSH水平下降与PDMCI患者的MoCA评分具有相关性,提示血浆T-GSH可能为早期PDMCI患者认知功能障碍的潜在预测指标。本研究所获结果与上述观点有所不同,PDMCI亚组PCG区域GSH绝对浓度与PDN亚组和对照组相比差异均无统计学意义,但GSH绝对浓度与MMSE和MoCA评分均存在相关性,其原因可能与本组PDMCI样本数较少、从而致其GSH浓度及信噪比较低有关。
本研究的局限性:样本量较少,未能根据PD患者的年龄、病情轻重及病程长短等进行比较研究;未进行纵向研究,未来需进一步扩大样本量进行研究。
综上所述,1H-MRS技术联合LCmodel软件可定量分析PCG区域代谢物的变化,有助于评估PD伴认知障碍。
[1] Litvan I, Goldman JG, Tröster AI, et al. Diagnostic criteria for mild cognitive impairment in Parkinson's disease: Movement Disorder Society Task Force guidelines. Mov Disord, 2012,27(3):349-356.
[2] Emre M, Aarsland D, Brown R, et al. Clinical diagnostic criteria for dementia associated with Parkinson's disease. Mov Disord, 2007,22(12):1689-1707.
[3] O'Neill J, Schuff N, Marks WJ Jr, et al.Quantitative1H magnetic resonance spectroscopy and MRI of Parkinson's disease. Mov Disord, 2002,17(5):917-927.
[4] Leech R, Sharp DJ. The role of the posterior cingulate cortex in cognition and disease. Brain, 2014,137(Pt 1):12-32.
[5] Andrews-Hanna JR, Reidler JS, Sepulcre J, et al. Functional-anatomic fractionation of the brain's default network. Neuron, 2010,65(4):550-562.
[6] Almuqbel M, Melzer TR, Myall DJ, et al. Metabolite ratios in the posterior cingulate cortex do not track cognitive decline in Parkinson's disease in a clinical setting. Parkinsonism Relat Disord, 2016,22:54-61.
[7] Kizu O, Yamada K, Ito H, et al. Posterior cingulate metabolic changes in frontotemporal lobar degeneration detected by magnetic resonance spectroscopy. Neuroradiology, 2004,46(4):277-281.
[8] Hughes AJ, Daniel SE, Lees AJ. Improved accuracy of clinical diagnosis of Lewy body parkinsons disease. Neurology, 2001,57(8):1497-1499.
[9] Kamagata K, Motoi Y, Hori M, et al. Posterior hypoperfusion in Parkinson's disease with and without dementia measured with arterial spin labeling MRI. J Magn Reson Imaging, 2011,33(4):803-807.
[10] Hosokai Y, Nishio Y, Hirayama K, et al. Distinct patterns of regional cerebral glucose metabolism in Parkinson's disease with and without mild cognitive impairment. Mov Disord, 2009,24(6):854-862.
[11] Kickler N, Krack P, Fraix V, et al. Glutamate measurement in Parkinson's disease using MRS at 3 T field strength. NMR Biomed, 2007,20(8):757-762.
[12] Block W, Träber F, Flacke S, et al. In-vivo proton MR-spectroscopy of the human brain: Assessment of N-acetylaspartate (NAA) reduction as a marker for neurodegeneration. Amino Acids, 2002,23(1/3):317-323.
[13] Griffith HR, den Hollander JA, Okonkwo OC, et al. Brain metabolism differs in Alzheimer's disease and Parkinson's disease dementia. Alzheimers Dement, 2008,4(6):421-427.
[14] Camicioli RM, Korzan JR, Foster SL, et al. Posterior cingulate metabolic changes occur in Parkinson's disease patients without dementia. Neurosci Lett, 2004,354(3):177-180.
[15] 刘艳艳, 杨忠现,陈薇,等.二维多体素波谱定量分析遗忘型轻度认知功能障碍患者颅内代谢物.中国医学影像技术,2012,28(3):426-430.
[16] Sharma S, Moon CS, Khogali A, et al. Biomarkers in Parkinson's disease (recent update). Neurochemistry Int, 2013,63(3):201-229.
[17] Tomlinson DR, Gardiner NJ. Glucose neurotoxicity. Nat Rev Neurosci, 2008,9(1):36-45.
[18] 钟小梅,黄飚,梁长虹,等.1H-MRS技术结合LCmodel软件对原发性帕金森病的诊断价值.中国医学影像技术,2012,28(3):421-425.
[19] Jenner P. Oxidative stress in Parkinson's disease. Ann Neurol, 2003,53(Suppl 3):S26-S36.
[20] Holmay MJ, Terpstra M, Coles LD, et al. N-Acetylcysteine boosts brain and blood glutathione in gaucher and parkinson diseases. Clin Neuropharmacol, 2013,36(4):103-106.
[21] Vila M, Ramonet D, Perier C. Mitochondrial alterations in Parkinson's disease: New clues. J Neurochem, 2008,107(2):317-328.
[22] Mcnaught KS, Jackson T, Jnobaptiste R, et al. Proteasomal dysfunction in sporadic Parkinson's disease. Neurology, 2006,66(10 Suppl 4):S37-S49.
[23] 周红,袁永胜,戚志强,等.帕金森病患者血浆氧化应激指标变化与认知功能的关系.中华医学杂志,2015,95(41):3357-3360.
消息
《中国医学影像技术》作者投稿请登录本刊网站(www.cjmit.com)主页,点击左上角“作者登录”进入,第一次投稿需完成作者注册;专家审稿请点击“审稿登录”进入。
为了便于广大作者、读者查阅本刊文献,本站提供从1985年起的过刊和现刊的全文检索。

