基于高光谱的温室网纹甜瓜不同叶位叶片含水率监测
向佳琳, 姚鑫锋, 刘 倩, 黄丹枫,2, 常丽英
[1.上海交通大学农业与生物学院,上海 200240; 2.农业部都市农业重点实验室(南方中心),上海 200240; 3.上海市农业科学院农业科技信息研究所,上海 201403]
甜瓜(CucumismeloL.)是葫芦科(Cucurbitaceae)甜瓜属(CucumisL.)一年生蔓生植物。网纹甜瓜(Cucumismelovar.reticulatusNaud.)属于厚皮甜瓜的一个变种。对于网纹甜瓜来说,植株水分状况不仅影响植株长势,还影响其外观品质,如网纹发生速度、质量和美观程度[1],此外还影响甜瓜内部品质,如可溶性固形物含量、糖类含量等[2]。伸蔓期是甜瓜营养生长旺盛时期,水分需求最大且转运频繁,直接影响甜瓜向上生长及侧枝发生,是甜瓜水分监测的重要时期。
多年以来,温室植物管理多采用基于监控作物周围的环境信息,例如温湿度、光照、基质含水量作为依据的管理策略[3-4]。通过传感器监测,存在无法大面积实时监控、破坏性取样、手持式传感器不能连续监测植株生理状态等问题。随着植物生理生态传感技术的发展,已经有多种对植物本身的生理生态信息进行监测的方法[5-7]。
Kriedemann等认为,植物的水分状况可以通过叶片含水量体现,因此前人利用光谱技术手段对植物叶片水分状况进行研究,为实时获取植物水分状况提供了新的途径[8]。Fernandez等研究发现,在970、1 450、1 940 nm波段附近,小麦的光谱反射率高峰能较好地反映叶片的水分状况[9]。田永超等发现,基于作物冠层在610、540 nm波段组合的光谱比值植被指数与在810、610 nm波段组合的光谱归一化植被指数的比值能预测小麦植株水分状况,说明由可见光和近红外区域波段构成的植被指数可用于植物叶片水分状况的监测[10]。田庆久等研究发现,小麦叶片水分含量与特定光谱吸收特征峰存在较好的回归关系[11]。田永超等的研究结果证实了利用光谱反射率准确预测植物叶片含水量的可行性[12]。以上研究虽然针对植物叶片含水量和叶片反射光谱进行,但是多数以分析作物冠层叶片为主,没有具体分析不同层次叶片含水量及其反射光谱。不同层次叶片因蒸腾作用及水分转移,受水分胁迫存在非同步性,不同叶片与植株生理状况的关系随叶位而有所差异。为了实现精准监控,确认监测叶位,进行针对性水分监测,对于指导甜瓜栽培过程中的精准灌溉具有实际指导意义。
1 材料与方法
1.1 试验设计
试验1于2015年8—9月在上海交通大学农业与生物学院现代农业工程训练中心Venlo型自控玻璃温室进行。供试品种为厚皮网纹甜瓜“网路”,试验采用基质盆栽,每盆种植2株,种植密度为6.5株/m2,盆口直径0.3 m,底直径0.26 m,盆钵高0.3 m。基质由上海孙桥溢佳有限公司提供,有机基质容重为0.283 g/cm3,总孔隙度为77.8%,pH值为6.57,有机质含量为66.48%,全氮含量为1.34%,全磷含量为0.32%,全钾含量为0.98%,速效氮含量为834.8 mg/kg,速效磷含量为 45.5 mg/kg,速效钾含量为290 mg/kg,基质田间最大持水量为140%(质量分数)。以王静静等开展的水分对厚皮甜瓜生长发育影响的研究为基础[13-14],为甜瓜伸蔓期设置了4个不同灌溉量处理,分别为处理1(T1),田间持水量35%~50%;处理2(T2),田间持水量51%~65%;处理3(T3),田间持水量66%~80%;处理4(T4),田间持水量 81%~100%。每个处理16盆,分别设置4个重复。
试验2于2016年8—9月在上海交通大学农业与生物学院现代农业工程训练中心Venlo型自控玻璃温室进行。供试品种为厚皮网纹甜瓜“网路”。试验设计同试验1。
水分处理使用国产便携式土壤水分测速仪实时测定,通过人工补水将各处理基质含水量补充至设定值。
1.2 项目测定
1.2.1 光谱反射率测试 测量仪器为美国Analytical Spectral Device(简称ASD)公司的FieldSpec,光谱仪的波段范围为325~1 075 nm,测量前仪器预热30 min,并用BaSO4标准白板校正。光谱采样间隔为1.41 nm。每组数据采集前均进行白板校正。于甜瓜定植25 d后,从各处理内随机选取甜瓜植株12株,分别测定植株3个层次完全展开叶的上、中、下部共6个点的反射光谱,取平均值作为被测叶位叶片的光谱反射率。
1.2.2 叶片水分含量测定 将进行光谱测试的叶片迅速称鲜质量后装入自封袋,然后在108 ℃杀青后,于80 ℃烘至恒质量后称其干质量,计算叶片含水率,公式如下:
叶片含水率=(鲜质量-干质量)/鲜质量×100%。
1.2.3 植被指数构建 基于325~1 075 nm波段范围内的原始光谱反射率、一阶导数光谱反射率和倒数光谱反射率,构建由任意2个波段(R1、R2)组合而成的归一化植被指数(normalized differential vegetation index,简称NDVI)和比值植被指数(ratio vegetation index,简称RVI),选出表现最好的植被指数及敏感波段组合。
1.3 数据处理
数据分析过程均基于Excel 2007及Matlab 2014a的自编程序进行。
“凭栏”意象除了表现作者闺怨之情和爱国之情之外,离别和旅行中也有许多悲伤的表情,他们大多表达想念家乡亲人的感觉。
2 结果与分析
2.1 不同叶位叶片含水率随基质含水量的动态变化
甜瓜叶片含水率是判断甜瓜植株水分状况的重要指标之一,在不同水分处理下,不同叶位叶片含水量变化范围为上部82.95%~93.30%,中部84.80%~92.94%,下部82.76%~92.39%。总体而言,3个叶位叶片含水率呈现由下部向上部升高的趋势。
由图1可以看出,4个处理中,甜瓜中部及下部叶片含水率整体呈现逐渐上升的趋势,上部叶片含水率呈现先上升后下降的趋势。其中,处理3甜瓜叶片含水率与处理4没有明显差异。

2.2 甜瓜不同叶位叶片光谱反射率与叶片含水率的相关性
图2显示,同一基质含水量处理下不同叶位叶片的光谱反射率呈现梯度分布特征。在可见光波段(380~760 nm),T1、T2处理反射率均表现为下部>中部>上部,T3、T4处理反射率均表现为中部>下部>上部。在近红外短波区域(760~1 100 nm),4个处理反射率均呈现下部>中部>上部的趋势。甜瓜叶片光谱反射率在可见光及近红外短波区域所表现的这种空间变化规律,可能与叶片的水分含量密切相关。在基质含水量较少的处理下,水分的亏缺从下部叶片开始。
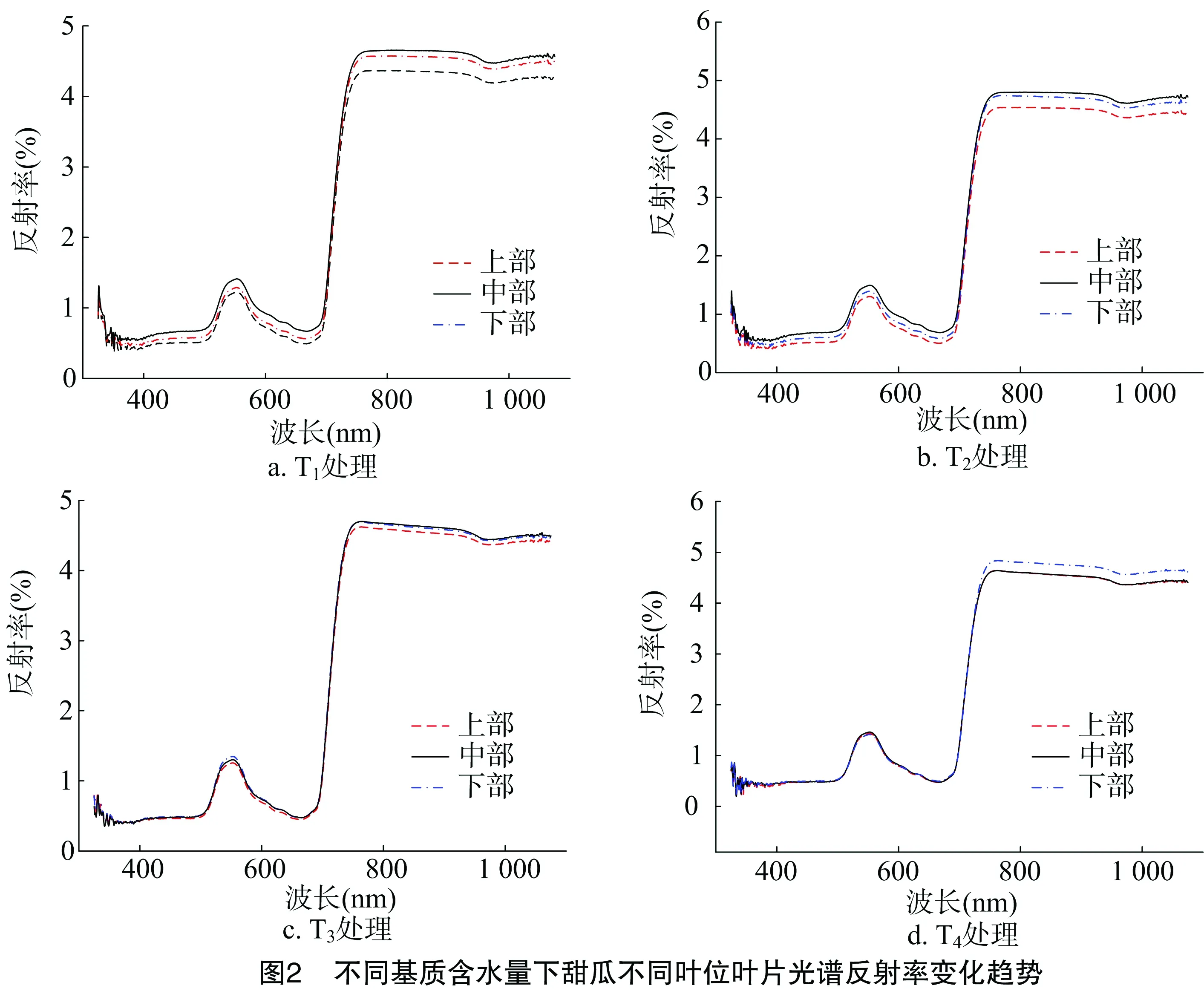
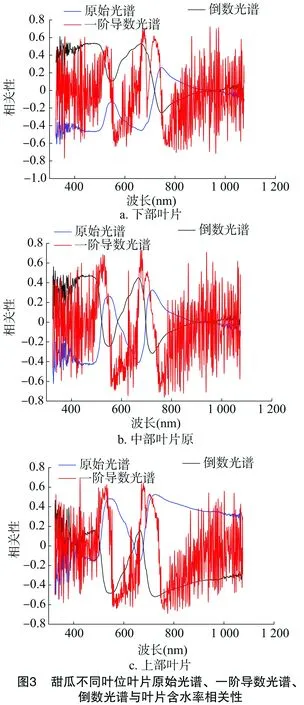
图3显示,甜瓜下、中、上部叶片水分含量的原始光谱和倒数光谱间的相关关系有类似的变化曲线,相关性基本呈相反的趋势。由表1可知,下、中、上部叶片的原始光谱与倒数光谱相关系数最大值分布在可见光区域的较多,最小值分布在近红外短波区域范围的较多,而一阶导数相关系数最大、最小值分布在近红外短波区域范围内的居多。其中,上部叶片原始光谱相关系数最大值为0.526 20,对应波段为724 nm;中部叶片原始光谱相关系数最小值为-0.622 1,对应波段为327 nm。中部叶片一阶导数相关系数的最大值为0.701 7,对应波段为680 nm;最小值为-0.720 5,对应波段为770 nm。中部、上部叶片一阶导数相关系数的最大、最小值对应波段大致在670~780 nm之间。一阶导数可增强光谱反射率与叶片含水率的相关性,这也说明近红外短波区域范围内存在较好的叶片水分状况监测敏感波段。
2.3 甜瓜不同叶位叶片、不同类型光谱指数与叶片含水率的关系
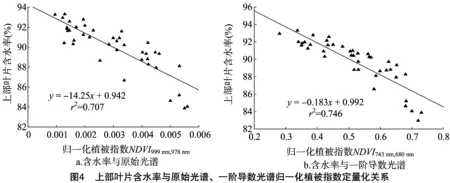
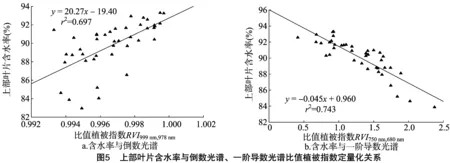
表2汇总了不同光谱类型的光谱指数中表现最好的敏感波段组合、回归方程及决定系数。可以看出,不同叶位叶片、不同类型光谱指数建模的决定系数表现为上部叶片较中部、下部叶片稳定。其中,上部叶片原始、一阶导数构建的归一化植被指数(图4)及倒数、一阶导数构建的比值植被指数(图5)决定系数分别为0.707、0.746、0.697、0.743。原始光谱及倒数光谱构建的归一化植被指数及比值决定系数排序为上部>下部>中部,一阶导数光谱构建的归一化植被指数及比值决定系数排序为上部>中部>下部。

表1 甜瓜不同叶位叶片水分含量与原始光谱、一阶导数光谱和倒数光谱间相关系数最小值、最大值及相应波段
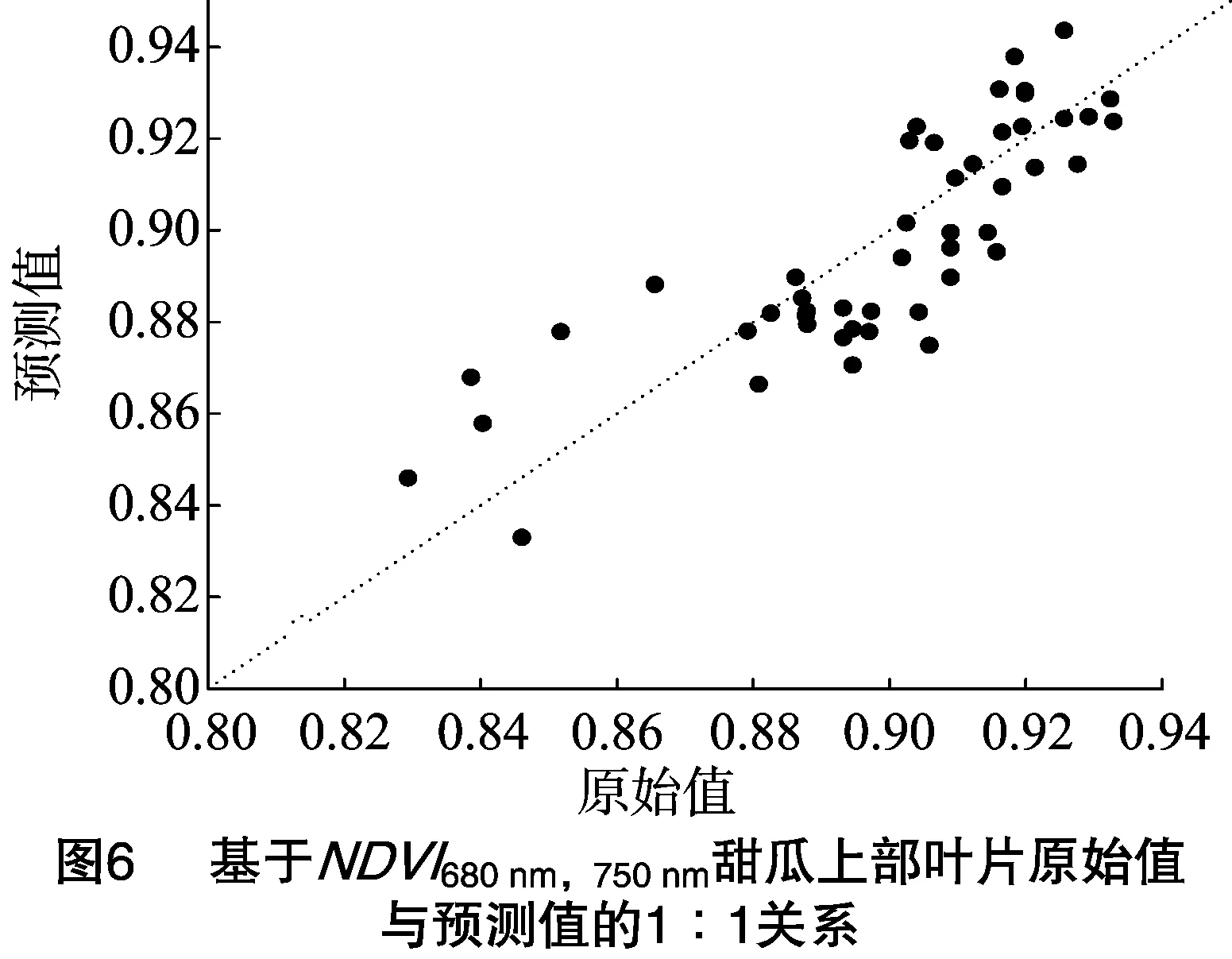
利用2016年独立的试验数据,对上述单叶水分模型和叶位间组合的水分模型进行测试和检验,同时利用预测值和观测值之间的决定系数(r2)、平均相对误差(MRE)和相对均方根差(RRMSE)3个指标来综合考察模型的表现(表3),作出预测值与观测值的1 ∶1关系图(图6)。
3 讨论与结论
单叶高光谱的测定方法简单、快速、非破坏性、不受外界环境因素的影响,且考虑水分在植株体内的分布梯度,特别适用于温室作物快速估测。本研究就甜瓜不同叶位叶片光谱反射率与叶片含水率定量关系进行深入研究。通过分析发现,在近红外短波区域(760~1 100 nm),4个处理光谱反射率均呈现下部>中部>上部的趋势,随着水分含量的提高,叶片在近红外波段的光谱反射率均降低,与Cibula等的研究结果[15-17]基本一致。
植物叶片表面存在较强反射,在叶片角质层、叶毛等表面结构与内部结构的影响下,用单一波段的光谱反射率难以全面、准确地估测作物水分状况。而通过构造光谱指数则可以使植被的有效光谱信息最大化,降低外部因素的影响,提高其预测精度[18]。但因甜瓜与其他作物在叶面表层及叶肉结构上差异较大,前人研究的特征波段及模型[19]在甜瓜叶片水分监测上的拟合度并不高,本研究基于Matlab 2014a软件,利用不同水分处理下的试验材料的原始光谱、光谱一阶导数及光谱倒数的任意2个波段组合下的2个植被指数,分析其与甜瓜叶片含水率的定量关系,筛选出适合网路甜瓜的敏感波段组合并构建监测模型。结果发现,上部叶片一阶导数NDVI680 nm,750 nm、RVI680 nm,734 nm、中部叶片一阶导数RVI603 nm,758 nm模型建立与检验r2分别为0.667、0.660和 0.600,均达到0.6以上,MRE与RRSME值分别为1.449%、1.500%、1.500%和1.409%、1.629%、1.923%,均在1%~2%之间。筛选的特征波段主要集中在600~680 nm及730~750 nm之间,与Dobrowski等发现的690、740 nm的光谱可以反映植物受水分胁迫的状态[20],以及Graeff等对不同水分处理下的小麦叶片光谱数据研究结论[21]相一致。
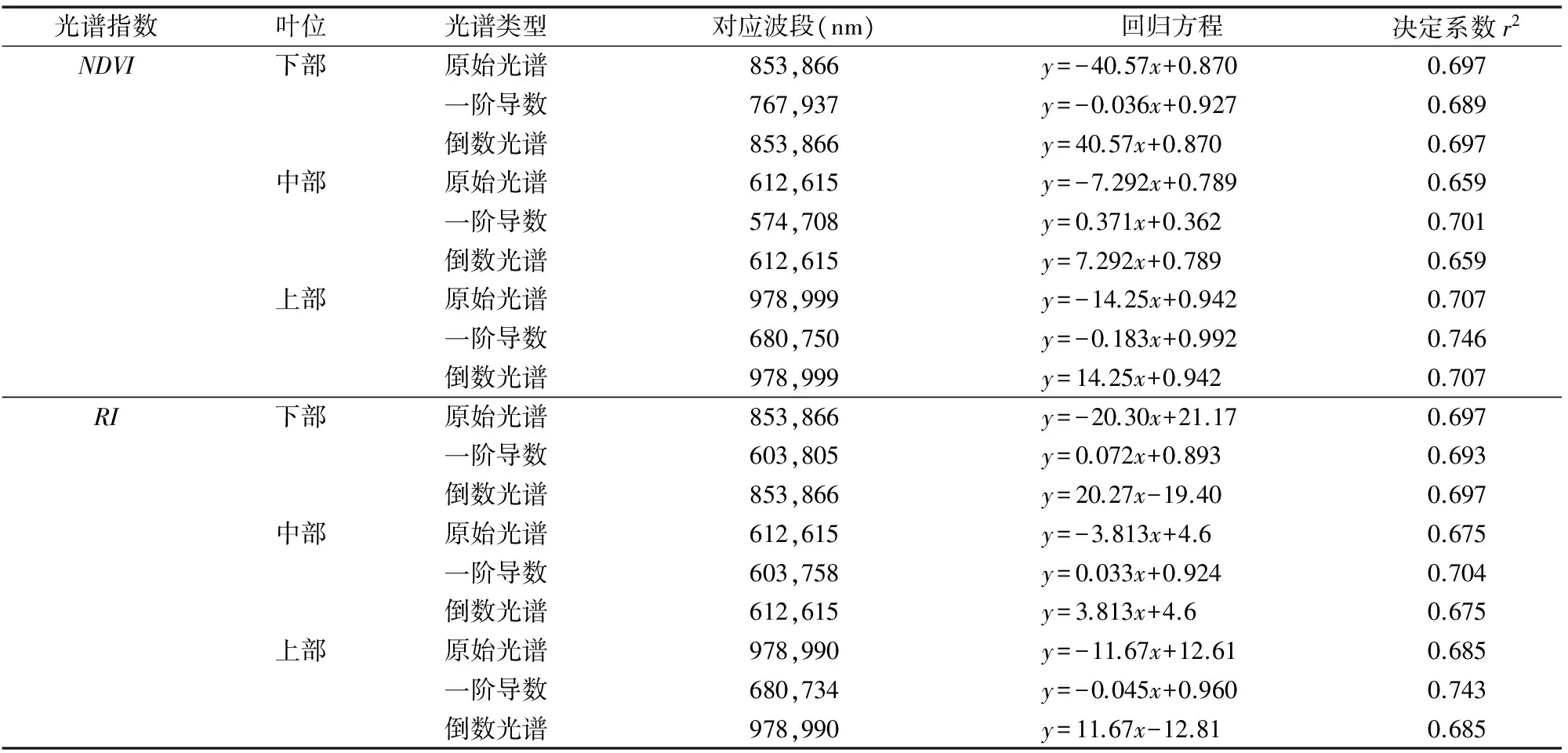
表2 甜瓜不同叶位叶片含水量与不同类型光谱指数的关系
本研究通过分析叶片反射光谱与叶片含水率的相关关系,提取了准确反演水分的特征波段,并采用多种方式预处理原始光谱,构建了简单适用的模型,在一定程度上提高了模型的准确性。虽然本试验资料基于2个年份,4个水分梯度,3种光谱数据类型,构建了2种植被指数模型,比较分析了不同类型的光谱数据对植株不同叶位叶片含水率的模拟效果及其模型预测能力,在一定程度上可适应不同栽培条件,网路甜瓜植株不同叶位叶片含水率监测具有重要的应用前景,但是模型在不同生长时期下、不同品种的普适性和可靠性表现还需要更多的检验。
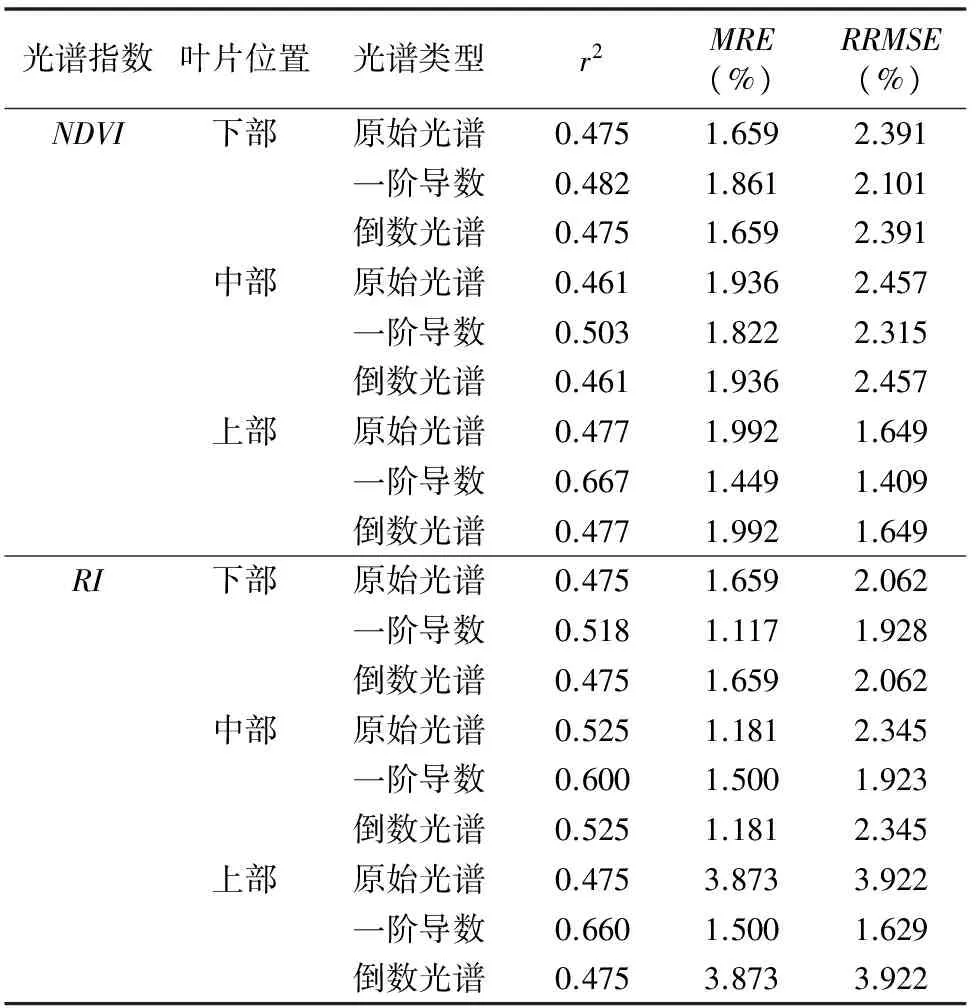
表3 甜瓜不同叶位叶片含水量与不同类型光谱指数构建模型检验效果
[1]管学玉. 网纹甜瓜品质形成特点的研究[D]. 杭州:浙江大学,2006:20-25.
[2]崔 冲. 基质含水量与温室网纹甜瓜果实品质形成的模拟[D]. 上海:上海交通大学,2012:39-47.
[3]Fares A,Polyakov V. Advances in crop water management using capacitive water sensors[J]. Advances in Agronomy,2006,90(6):43-77.
[4]张大龙,常毅博,李建明,等. 大棚甜瓜蒸腾规律及其影响因子[J]. 生态学报,2014,34(4):953-962.
[5]要世瑾,杜光源,牟红梅,等. 基于核磁共振技术检测小麦植株水分分布和变化规律[J]. 农业工程学报,2014,30(24):177-186.
[6]彭 文,李庆武,霍冠英,等. 基于计算机视觉的植物水分胁迫状况监测方法[J]. 科学技术与工程,2013,13(9):2313-2317,2330.
[7]朱晨亮. 作物冠层叶色变化远程自动监测技术[D]. 杭州:浙江理工大学,2016:22-43.
[8]Kriedemann P E,Barrs H D. Photosynthetic adaptation to water stress and implications for drought resistance[M]//Raper C D Jr,Kramer P J. Crop reactions to water and temperature stresses in humid,temperate climates. Boulder:Westview Press,1983:201-230.
[9]Fernandez S,Vidal D,Simon E,et al. Radiometric characteristics ofTriticumaestivumcv. Astral under water and nitrogen stress[J]. International Journal of Remote Sensing,1994,15(9):1867-1884.
[10]田永超,曹卫星,姜 东,等. 不同水氮条件下水稻冠层反射光谱与植株含水率的定量关系[J]. 植物生态学报,2005,29(2):318-323.
[11]田庆久,宫 鹏,赵春江,等. 用光谱反射率诊断小麦水分状况的可行性分析[J]. 科学通报,2000,45(24):2645-2650.
[12]田永超,朱 艳,曹卫星,等. 小麦冠层反射光谱与植株水分状况的关系[J]. 应用生态学报,2004,15(11):2072-2076.
[13]王静静,李建明,张艳丽,等. 温室温湿度及灌溉量对甜瓜生长发育的影响[J]. 北方园艺,2011(6):50-55.
[14]毛炜光,吴 震,黄 俊,等. 水分和光照对厚皮甜瓜苗期植株生理生态特性的影响[J]. 应用生态学报,2007,18(11):2475-2479.
[15]Cibula W G,Zetka E F,Rickman D L. Response of thematic mapper bands to plant water-stress[J]. International Journal of Remote Sensing,1992,13(10):1869-1880.
[16]苏 毅,王克如,李少昆,等. 棉花植株水分含量的高光谱监测模型研究[J]. 棉花学报,2010,22(6):554-560.
[17]Imanishi J,Sugimoto K,Morimoto Y. Detecting drought status and LAI of twoQuercusspecies canopies using derivative spectra[J]. Computers and Electronics in Agriculture,2004,43(2):109-129.
[18]Cheng T,Rivard B,Sanchez-Azofeifa A. Spectroscopic determination of leaf water content using continuous wavelet analysis[J]. Remote Sensing of Environment,2011,115(2):659-670.
[20]Dobrowski S Z,Pushnik J C,Zarco-Tejada P J,et al. Simple reflectance indices track heat and water stress-induced changes in steady-state chlorophyll fluorescence at the canopy scale[J]. Remote Sensing of Environment,2005,97(3):403-414.
[21]Graeff S,Claupein W. Identification of water stress in wheat leaves. (TriticumaestivumL.) by means of reflectance measurements[J]. Irrigation Science,2007,26(1):61-70.

