α-乳白蛋白酶解物体外抗氧化及活性氧清除作用
吴相佚,宋馨然,刘斯,李天歌,毛学英
(中国农业大学食品科学与营养工程学院,北京100083)
0 引言
氧化应激是指机体在有害刺激条件下产生活性氧自由基,使机体处于易损状态,从而引起一系列疾病,如肿瘤、老年性痴呆症、炎症、动脉粥样硬化、糖尿病等[1-2]。寻求天然、安全、高效的食源抗氧化功能因子,改善氧化应激和抗氧化防御之间的不平衡,营养干预氧化损伤具有重要意义。天然乳源抗氧化肽可通过清除自由基、螯合金属离子或直接消除活性氧等方式发挥其功能作用,从而提高机体的抗氧化能力,缓解氧化应激状态[3-4]。α-乳白蛋白作为乳清蛋白中的一种重要组分,不仅能为机体提供丰富的营养,而且富含多种生物活性序列。因此,本研究研究α-乳白蛋白酶解物的体外抗氧化作用以及对HepG2肝细胞内ROS的抑制作用,旨在为α-乳白蛋白酶解物作为功能性原料提供科学依据。
1 实验
普通化学试剂:氢氧化钠、质量分数为36.5%浓盐酸、冰醋酸、十二烷基硫酸钠(SDS)、二水合磷酸二氢钠(N aH2PO4·2H2O)、磷酸氢二钠(N a2HPO4)、无水乙醇、质量分数为5%的TNBS溶液、2,2-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、硫酸亚铁(FeSO4·7H2O)、菲啰嗪一钠盐、30%过氧化氢、邻二氮菲等。
1.1 材料与仪器
1.1.1材料
α-乳白蛋白(Alpha-Lactalbumin),MEM高糖培养基,胎牛血清,青链霉素双抗溶液(100×),非必需氨基酸(100×),0.25%胰蛋白酶(含 EDTA),DCFH-DA。
1.1.2仪器
TGL-20M型低温高速离心机,LGJ-12型真空冷冻干燥机,UF/UVPL5124型超纯水机,MCO-17AC型二氧化碳培养箱,iM arkTMMicroplateReader酶标仪,ZDX 35BI型高压灭菌锅,DK-98-Ⅱ2KW型超净工作台,QL-861型旋涡混合器,UV-2600型紫外可见分光光度计,DK-8B型电热恒温水浴锅,BS124s型分析天平,L2102型电子天平,FE20型pH计。
1.2 方法
1.2.1α-乳白蛋白碱性蛋白酶酶解产物的制备
称取10 gα-乳白蛋白,制成质量浓度为50 g/L的蛋白质溶液。按照质量分数为5%酶与底物比加入蛋白酶水解。水解结束时于85℃条件下加热20 min灭酶以终止反应,转速为4 000 r/min离心后弃沉淀,将上清液冷冻干燥后得到α-乳白蛋白酶解物。
1.2.2ABTS法测定抗氧化活性
将5 mL浓度为7 mmol/L的ABTS溶液和88μL浓度为140 mmol/L的过硫酸钾溶液混合,在室温、避光条件下静置过夜,形成ABTS储备液。使用前用pH值为7.4的PBS缓冲液稀释40~50倍,使其在734 nm波长下的吸光度为0.70±0.02,即得到ABTS工作液[5]。取2 mL的ABTS工作液,加入20μL酶解物样品的PBS溶液,震荡10 s以充分混合,静置5min,于734 nm处测定其吸光值Ar。抗氧化活性为
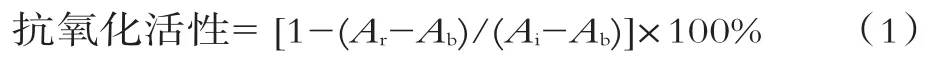
式中:Ai为ABTS工作液初始的吸光值;Ab为空白对照(PBS缓冲液)的吸光值。
1.2.3Fe2+合能力的测定
取2 mL酶解物样品溶液,加入浓度为2 mmol/L的FeSO4溶液50μL,浓度为0.5 mm o l/L菲啰嗪溶液1 mL,空白组用2 mL去离子水替代酶解物样品溶液,40℃水浴10min,于562 nm处测定吸光值。
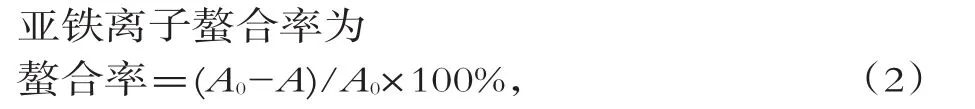
式中:A0为空白组的吸光度;A为样品组的吸光度。
1.2.4羟自由基清除能力的测定

表1 羟自由基清除能力的测定方法 mL
按照表1所列顺序依次向试管中加入试剂,38℃反应50 min,反应结束后于波长536 nm处分别测定吸光度。羟自由基清除率(D)为
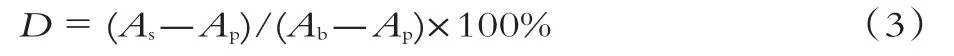
1.2.5HepG2细胞培养
细胞在培养瓶贴壁面积达到80%~90%时开始传代,弃去旧培养基,用PBS冲洗残留培养液,加入0.25%胰蛋白酶消化后将胰酶吸弃,加入新鲜培养基不断吹打平皿底壁,使细胞均匀分散重悬,然后接种到新的培养瓶中继续培养。
1.2.6DCFH-DA测定细胞内ROS水平[6]
细胞接种至96孔板,浓度为2×104/mL,每孔接种200μL。加入不同浓度的α-乳白蛋白酶解物,加入浓度为400μm o l/L的H2O2溶液处理细胞。处理结束后,吸出培养基,避光加入150μL荧光探针DCFH-DA溶液,37℃下避光孵育60min,孵育结束后,使用荧光酶标仪检测荧光强度,激发波长为488 nm,发射波长为530 nm。
1.2.7数据统计
结果表示为平均值±标准差。统计分析均采取版本为17.0的SPSS软件进行(SPSS Inc.,Chicago,1L)。当多组数据间进行显著性分析时,使用单因素方差分析(one way ANOVA)伴随Duncan多重比较,当P<0.05时认为差异显著。
2 结果与分析
2.1 α-乳白蛋白酶解物的Fe2+合能力
采用菲啰嗪法测定α-乳白蛋白酶解物的Fe2+螯合能力,根据体系颜色的变化即可测定样品的Fe2+螯合能力[7],结果如图1所示。由图1可以看出,在α-乳白蛋白酶解物质量浓度为0.25~2.0 g/L时,α-乳白蛋白酶解物显示出较强的Fe2+螯合能力,但弱于阳性对照EDTA(P<0.05)。随着α-乳白蛋白酶解物浓度的增加,其Fe2+螯合能力也逐渐增加,呈现浓度依赖效应。当α-乳白蛋白酶解物质量浓度为2.0 g/L时,其Fe2+螯合率达到65.73%±2.60%。
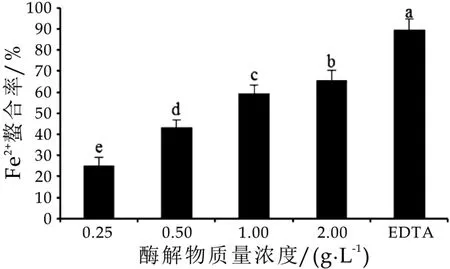
图1 α-乳白蛋白酶解物的Fe2+合能力
2.2 α-乳白蛋白酶解物的ABTS自由基清除能力
ABTS自由基清除能力被广泛作为测定生物样品的总抗氧化能力的指标之一。具有抗氧化的物质与ABTS自由基反应后使其溶液褪色,特征吸光度降低,吸光度越低,表明所检测物质的总抗氧化能力越强[8]。由图2可以看出,在ABTS测试体系中,α-乳白蛋白酶解物质量浓度在0.25~2.0 g/L的浓度范围内,随着浓度的增加,ABTS自由基清除率显著增加,呈现浓度依赖效应,但弱于阳性对照VC组(P<0.05)。当α-乳白蛋白酶解物质量浓度为2.0 g/L时,ABTS自由基清除率达到66.81%±6.23%。
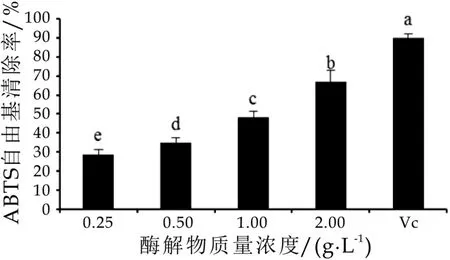
图2 α-乳白蛋白酶解物的ABTS自由基清除能力
2.3 α-乳白蛋白酶解物的羟自由基清除能力
羟自由基(·OH)属于体内最活泼的活性氧。利用Fenton反应来引发产生羟自由基,羟自由基氧化水杨酸得到2,3-二羟基苯甲酸,用其在510 nm处的吸光值表示·OH的多少[9]。由图3可以看出,在0.25~2.0 g/L的α-乳白蛋白酶解物质量浓度范围内,其羟自由基清除能力显著增加,呈质量浓度依赖效应,当α-乳白蛋白酶解物质量浓度为2.0 g/L时,其羟自由基清除率为52.51%±3.63%(P<0.05)。
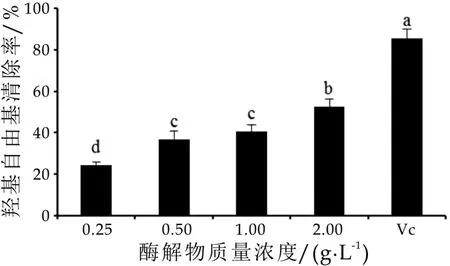
图3 α-乳白蛋白酶解物的羟自由基清除能力
2.4 α-乳白蛋白酶解物对细胞内的清除作用
测定α-乳白蛋白酶解物对H2O2损伤H epG 2细胞内ROS浓度的影响,结果如图4所示。与正常对照组相比,H2O2可诱导细胞内ROS水平显著上升(P<0.05)。与H2O2单独处理组相比,随着α-乳白蛋白酶解物干预浓度的升高,细胞内ROS水平显著降低(P<0.05),且呈现浓度依赖效应。当干预质量浓度达到2.0 g/L时,α-乳白蛋白酶解物对H2O2诱导HepG2细胞内ROS水平上升的抑制率高达78.61%。α-乳白蛋白酶解物本身对于细胞内的ROS生成量没有显著的影响作用。
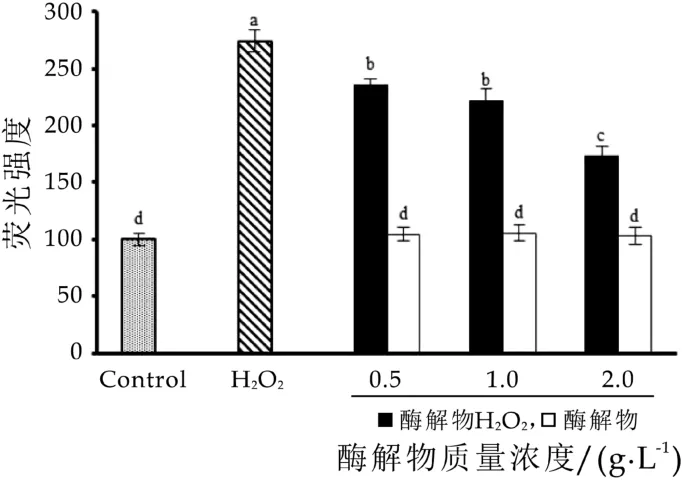
图4 α积-的乳影白响蛋白酶解物对H 2O 2诱导HepG2细胞内ROS蓄
3 讨论
自由基是需氧生物体内,通过正常的氧化代谢活动所产生的[10]。自由基在机体内的产生是不可避免的,但在机体抗氧化酶系统以及抗氧剂作用下能够被不断地清除,在生理情况下自由基可维持在有利无害的极低水平。但当机体处于氧化应激状态时,自由基就会攻击人体内的大分子物质如脂质、蛋白质和核酸,破坏其结构和功能,导致各种疾病的发生[11]。天然抗氧化肽具有天然、安全、易吸收、副作用小等特点,可通过清除自由基、螯合金属离子或直接消除活性氧等方式发挥其功能作用,此外,能够提高细胞中的抗氧化酶活力,清除过量ROS的生成,降低脂质过氧化损伤水平,从而提高机体的抗氧化能力,缓解氧化应激状态[12]。Li[13]等从山羊奶酪蛋白酶解物中分离鉴定出五种新型抗氧化肽,其肽段组成分别为Val-Tyr-Pro-Phe,Phe-Gly-Gly-Met-Ala-Hi,Phe-Pro-Tyr-Cys-Ala-Pro,Tyr-Val-Pro-Glu-Pro-Phe,Tyr-Pro-Pro-Tyr-Glu-Thr-Tyr,具有良好的自由基清除能力、Fe2+结合能力及降低脂质过氧化水平的能力。乳清蛋白酶解物对于对乙酰氨基酚造成的肝脏氧化应激损伤具有较好的保护与治疗作用,它可通过增加肝细胞总抗氧化能力及抗氧化酶的活性来发挥其活性功能[14]。此外,乳清蛋白酶解物可降低D-半乳糖对小鼠造成的急性氧化应激损伤,维持小鼠体内氧化和抗氧化系统的平衡[15]。
H2O2是一种重要的活性氧,其本身并不具有自由基的性质,但它极易透过细胞膜,引发脂质氧化、导致生物大分子损伤,是建立细胞氧化损伤的常用物质之一,广泛用于成骨细胞、神经细胞、血管内皮细胞、肝细胞等细胞模型中[16]。乳蛋白是一种常见的优质蛋白质,国内外研究者已利用酶解、发酵等方式从酪蛋白和乳清蛋白中提取到具有抗氧化活性的生物肽。牛乳酪蛋白酶解物经过滤分级后得到的低分子量组分能够通过增加肝细胞抗氧化酶活力及改善细胞凋亡来缓解H2O2诱导的H epG 2细胞氧化应激损伤[17]。乳清蛋白酶解物对H2O2诱导的PC 12细胞氧化应激损伤具有良好的抑制作用,通过抑制细胞内活性氧的聚集等来发挥抗氧化作用[18]。酪蛋白糖巨肽酶解物具有较好的羟自由基清除能力、过氧化氢清除能力、Fe2+螯合能力和铁还原能力,并可以通过降低巨噬细胞内ROS生成,提高细胞内抗氧化酶活力来缓解H2O2诱导的巨噬细胞细胞凋亡和脂质过氧化损伤[19]。
本研究表明α-乳白蛋白酶解物具有良好的体外抗氧化能力,能有效缓解H2O2诱导的H epG 2细胞内ROS的过量积累,推测其原因是α-乳白蛋白酶解后产生发挥抗氧化作用的肽段,这些肽段能淬灭部分H2O2在细胞内代谢产生的氧自由基,缓解了自由基对细胞膜脂质的过氧化损伤,进而保护了细胞内的抗氧化系统。
4 结论
α-乳白蛋白酶解产物具有良好的抗氧化活性,当其浓度为2.0 m g/mL时,其Fe2+螯合率、ABTS清除率、羟自由基清除率分别达到65.73%±2.60%,66.81%±6.23%和52.51%±3.63%。此外,α-乳白蛋白酶解物能够抑制H2O2诱导的HepG 2细胞内ROS的过量生成,从而缓解氧化损伤。研究结果为乳源生物活性肽研发提供了一定的科学依据。课题组将通过SephadexG-25凝胶过滤和RP-HPLC对α-乳白蛋白酶解物进一步分离,采用LC-MS/MS鉴定活性肽的氨基酸序列。
参考文献:
[1]ZHU R,WANG Y,ZHANG L,et al.Oxidative stress and liver disease[J].Hepatology Research,2012,42(8):741-749.
[2]SAVU O,SUNKARI V G,BOTUSAN IR,et al.Stability of mitochondrial DNA against reactive oxygen species(ROS)generated in diabetes[J].Diabetes/Metabolism Research and Reviews,2011,27(5):470-479.
[3]POWER O,JAKEMAN P,FITZGERALD R J.Antioxidative peptides:enzymatic production,in vitro and in vivo antioxidant activity and potential applications of milk-derived antioxidative peptides[J].Amino Acids,2013,44(3):797-820.
[4]PIHLANTO A.Antioxidative peptides derived from milk proteins[J].International Dairy Journal,2006,16(11):1306-1314.
[5]RE R,PELLEGRINI N,PROTEGGENTE A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology And Medicine,1999,26(9):1231-1237.
[6]WANG H,JOSEPH J.Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader[J].Free Radical Biology and Medicine,1999,27(5-6):612-616.
[7]GUO L,HARNEDY P A,O'KEEFFEM B,et al.Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J].Food Chemistry,2015,173:536-542.
[8]MIRZAEIA M,MIRDAMADIB S,EHSANIC M R,et al.Antioxidant,ACE-Inhibitory and antibacterial activities of Kluyveromyces marxianus protein hydrolysates and their peptide fractions[J].Functional Foods in Health and Disease,2016,6(7):425-439.
[9]ZHAO J,XIONG Y L,MCNEAR D H.Changes in Structural Characteristics of Antioxidative Soy Protein Hydrolysates Resulting from Scavenging of Hydroxyl Radicals[J].Journal of Food Science,2013,78(2):C152-C159.
[10]VALKO M,LEIBFR ITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry&Cell Biology,2007,39(1):44-84.
[11]ROCHETTE L,ZELLER M,COTTIN Y,et al.Diabetes,oxidative stress and therapeutic strategies[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2014,1840(9):2709-2729.
[12]AHN C,KIM J,JE J.Purification and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion[J].Food Chemistry,2014,147:78-83.
[13]LIZ,JIANG A,YUE T,et al.Purification and identification of five novel antioxidant peptides from goat m ilk casein hydrolysates[J].Journal of Dairy Science,2013,96(7):4242-4251.
[14]ATHIRA S,MANN B,SHARMA R,et al.Ameliorative potential of whey protein hydrolysate against paracetamol-induced oxidative stress[J].Journal of Dairy Science,2013,96(3):1431-1437.
[15]ZHANG Q,LING Y,SUN Z,et al.Protective effect of whey protein hydrolysates against hydrogen peroxide-induced oxidative stress on PC12 cells[J].Biotechnology Letters,2012,34(11):2001-2006.
[16]ZOROV D B,FILBURN C R,KLOTZ L,et al.Reactive oxygen species(ROS)-induced ROS release:a new phenomenon accompanying induction of the mitochondrial permeability transition in cardiac myocytes[J].The Journal of Experimental Medicine,2000,192(7):1001-1014.
[17]XIEN,WANG C,AO J,et al.Non-gastrointestinal-hydrolysis enhances bioavailability and antioxidant efficacy of casein as compared with its in vitro gastrointestinal digest[J].Food Research International,2013,51(1):114-122.
[18]JIN M,ZHANG L,YU H,et al.Protective effect of whey protein hydrolysates on H2O2-induced PC12 cells oxidative stress via a mitochondria-mediated pathway[J].Food Chem is try,2013,141(2):847-852.
[19]CHENG X,GAO D,SONG J,et al.Casein glycomacropeptide hydrolysate exerts cytoprotection against H2O2-induced oxidative stress in RAW 264.7 macrophages via ROS-dependent heme oxygenase-1 expression[J].The Royal Society of Chemistry,2015,5:4511-4523.

