胰腺神经内分泌肿瘤5例报告并文献复习
赵臣,贾国洪,贾志芳
(中国人民解放军第二五一医院 普通外科,河北 张家口 075000)
1907年Oberndorfer首次提出了“类癌”这一术语,它起源于神经内分泌细胞的肿瘤,能够合成、贮存和分泌生物活性胺、小分子多肽类或肽类激素。近100多年来,通过大量的观察和研究,人们现已逐步认识到,神经内分泌肿瘤是一类起源于胚胎的神经内分泌细胞、具有神经内分泌标记物和可以产生多肽激素的肿瘤。其中,胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,PNENs)是来源于胰腺内分泌部的一类罕见肿瘤,由于其种类繁多,缺乏典型临床表现以及病理特征、恶性程度和预后差异较大,确诊依赖病理检查。我科自2013年6月—2016年6月共收治胰腺神经内分泌肿瘤5例,均经病理证实,现结合文献复习报告如下。
1 临床资料
1.1 一般资料
本组5例PNENs患者中,男2例,女3例;年龄48~75岁;无症状2例,上腹部疼痛伴黄疸2例,背部憋胀1例。血清学检查CA19-9升高1例。
1.2 影像学检查
2例B超检查发现胆总管扩展,肿块位于胰头,进一步行增强CT考虑胰腺癌;1例因背部憋胀行腹部B超未见明显异常,增强CT示胰头颈部占位,肿瘤边界不清,肠系膜上动静脉包绕于其中,远端胰管扩张,肝转移,胆总管扩展;2例因其他疾病行腹部增强CT考虑胰尾部占位,其中1例行PET-CT考虑胰腺神经内分泌肿瘤(图1),1例行腹部增强CT考虑胰腺体尾部肿瘤。
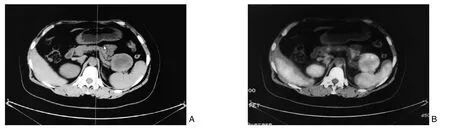
图1 胰体尾肿瘤伴肾上腺转移 A:CT;B:PET-CTFigure 1 Tumor of the body and tail of the pancreas with adrenal gland metastasis A: CT image; B: PET-CT image
1.3 结果
行手术治疗4例,胰头十二指肠切除1例,胰体尾+脾切除+肾上腺肿瘤切除1例,胆肠吻合术1例,肿瘤剜除术1例。行穿刺活检1例。术后发生胰瘘和胃瘫各1例。病理(根据2010年WHO分期)结果为G1期2例,G2期1例,G3期2例。5例均随访,每3个月复查腹部CT及神经元特异性烯醇化酶(neuronspecificenolase,NSE)、嗜铬蛋白A(chromogranin A,CgA),随访期间1例胆肠吻合患者术后12个月因肝转移死亡,4例存活至今,无肿瘤复发及转移。5例PNENs患者的基本资料及手术、术后随访资料见表1。

表1 5例PNENs患者的基本资料及手术、术后情况Table 1 The general data as well as surgical and postoperative conditions of the 5 PNENs patients
2 讨论与文献复习
2.1 PNENs的临床表现及分类
PNENs的发病率约为(4~5)/100万,约占胃肠胰神经内分泌肿瘤7%~9%和胰腺肿瘤的1%~2%[1-2]。PNENs一般无特异性的临床表现,根据肿瘤是否分泌多肽类激素可分为功能性和无功能性两大类。功能性PNENs中胰岛素瘤最常见(20%~30%),其次为胃泌素瘤(15%~20%)[3]。大约60%~90%的PNENs属于无功能性的,因其发病隐匿,病程较长,往往患者就诊时已经出现许多并发症,例如:上腹部胀痛、阻塞性黄疸、腹部不适、腹部肿块、不完全性肠梗阻等[4]。近十几年,随诊影像学技术的发展及医生们对PNENs的认识,该病的发病率及早期诊断率逐年增高。
PNENs和大多数恶性肿瘤一样,根据肿瘤的类型、部位、大小、浸润深度和范围、核分裂象计数和Ki-67阳性指数、神经内分泌标志物、淋巴结转移等情况进行分期分级,从而制定不同的治疗方案和随访计划。目前PNENs的3种不同分级系统是WHO(2010)分级、AJCC(2010)TNM分级、ENETS分级[5]。
2.2 PNENs的诊断
大多数患者都是在出现上述症状时前来就诊,然而常用的肿瘤指标CEA、CA19-9及CA125等大多处于正常值范围,我院5例患者仅1例患者CA19-9增高,所以对怀疑PNENs的患者因加测NSE、CgA和胰抑制素(pancreastatin)。当实验室检查考虑PNENs就要通过螺旋CT、正电子发射断层成像与计算机断层扫描、磁共振成像、内镜超声等来确定肿瘤的大小及是否有转移。在国外超声内镜已经广泛用于PNENs的诊断,因为其敏感度远远高于核磁及螺旋CT[6],同时可以行肿瘤的穿刺活检确定肿瘤的病理类型。大多数PNENs过表达生长抑素受体(SSTR),注射标记的奥曲肽对SSTR靶向结合,由此形成同位素显像协助诊断,同时可预测肿瘤对其治疗的敏感度[3,7-8]。因PNENs缺乏特异性临床表现及发病隐匿,所以联合多种检查可提高诊断的阳性率。本文中5例患者均行腹部增强CT,1例患者加做PET-CT,1例患者行B超引导下穿刺活检。
2.3 PNENs的手术治疗
PNENs确诊的患者首选手术,因为手术是该疾病唯一可治愈的方式。对于已有淋巴结或肝转移的患者手术同样可以延长患者的中位生存期[9]。随着腹腔镜技术的发展,腔镜下肿瘤切除或肿瘤剔除对PNENs的患者是安全的。对于肝转移的患者如果手术可以切除90%的转移灶,可考虑同期或者分期行手术治疗[10],在施育鹏等[11-12]研究中表明根治性切除组比姑息性切除组生存时间长。本组患者全部建议手术治疗,其中1例肿瘤<2 cm的患者因各种原因拒绝手术治疗,长期随访,病情无明显进展。
2.4 PNENs的全身治疗
晚期患者也可选择全身治疗包括以下方式:SSAS、化疗、靶向治疗、肽受体治疗及放射性核素治疗,其目的是延长患者生存,改善生活质量。生长抑素类似物(奥曲肽,兰瑞肽,奥曲肽微球)可控制功能性神经内分泌肿瘤的临床症状,缓解疾病的进展,同时可以抑制PNENs的增值[13-14]。在CLARINET和PROMID试验中表明,接受生长抑素类似物治疗的患者相对于安慰剂组总生存期延长了8.3个月,疾病稳定率明显提高(66.7% vs. 37.2%)[15]。有研究[16]表明生长抑素类似物兰瑞肽在长达40个月的治疗中安全性非常可靠,没有明显的副作用。但是长期使用生长抑素类似物可增加胆汁淤积及胆囊炎的风险,建议对于手术的患者行胆囊切除术[17]。细胞毒性药物(卡培他滨、链脲霉素、阿霉素、5-氟尿嘧啶和替莫唑胺)常被用来治疗生长抑素类似物治疗失败的患者或WHO分期为G3的患者,在最近的研究[18]中表明这些药物的联合使用可以延长患者的中位生存期,但整体有效率都低50%[19],所以本组患者中只有1例患者因无法切除肿瘤行卡培他滨治疗。常用的放射性元素有90Y及177Lu 2种,在欧洲的一些治疗中心研究表明放射性元素治疗PNENs取得了一定的成效,但是王国慧等[20]研究显示放射性元素的副作用很大,尤其表现在肾毒性方面,所以该治疗方式不被推广。对于笔者所在地区的患者,大多数患者因家庭经济条件有限,没有选择上述治疗方式。
2.5 PNENs的生物治疗
随着对PNENs分子机制的研究有了实质性进展,靶向治疗成为继手术后唯一可以治愈该疾病的方法。哺乳动物雷帕霉素靶蛋白(mTOR)是一种丝氨酸/苏氨酸蛋白激酶,在细胞生长、分化、增殖、迁移和存活上扮演重要角色。血管内皮生长因子(VEGF)是一种可以强烈诱导血管生长的因子,在血管生成过程中起重要作用。目前最常用的靶向药物主要涉及mTOR抑制剂及抗VEGF药物[21-22]。在一项III期临床研究(RADIANT-3)[23]中,410例晚期的PNENs患者分别接受依维莫司和安慰剂治疗,结果依维莫司组的无进展生存期明显高于安慰剂组(11月vs. 4.6月,P<0.001)。在随后的研究进程中RADIANT-3实验组报道患者的总生存期为44个月,远远高于以前文献[24]报道的27个月。在另一项前瞻性III期临床研究[25]中指出舒尼替尼组患者的无进展生存期为11.4个月,而安慰剂组患者仅为5.5个月(P<0.001)。Roviello等[26]研究中指出靶向治疗组无论在无进展生存期还是总生存期都明显高于安慰剂组。近期在Bajetta[27]研究中报道生长抑素类似物联合靶向药物治疗进展期的患者,可以提高患者对靶向药物的耐受性。
2.6 无症状且<2 cm的PNENs的治疗
在过去的几十年中,随着影像技术及内镜技术的发展,发现了一部分体积小且无症状的PNENs。对于<2 cm且无临床症状的患者是手术治疗还是临床随访目前还没有达成共识。在最近的一项研究资料中显示(肿瘤大小为1.4~2.3 cm)手术组与随访组在总生存期、转移及复发没有明显的差异[28]。在Falconi等[29]的研究研究中同样被证明,但是需要指出的是手术组术后的并发症高达37.2%。同样也有研究[30]指出对于偶然发现的<2 cm神经内分泌肿瘤同样需要手术,术后再随访,这样比带瘤观察的风险大大减小。来自美国癌症中心的一份数据表明,<2 cm的神经内分泌肿瘤的预后和手术无明显关系,而是和患者的年龄、肿瘤的并发症及分级成正相关[31]。所以笔者认为对<2 cm且无临床症状的患者,医生要结合患者的意愿、患者定期随访的依从性及当地人民的医疗水平来综合决定的,而不是仅仅告诉患者手术或观察。本文1例肿瘤<2 cm的患者长期随访,目前无特殊不适。
总之,由于PNENs的发病率低,且表现多样性,这就需要我们各个专业的医生共同合作,对每例患者制定不同的治疗方案,相信随着大家对该疾病的认识和研究,PNENs的治疗会取得很好的效果。
[1]Cloyd JM, Poultsides GA. Non-functional neuroendocrine tumors of the pancreas: Advances in diagnosis and management[J]. World J Gastroenterol, 2015, 21(32):9512–9525. doi: 10.3748/wjg.v21.i32.9512.
[2]蔺武军, 毕玉田, 陈东风. 胰腺神经内分泌肿瘤的诊治进展[J]. 胃肠病学和肝病学杂志, 2017, 26(2):234–238. doi:10.3969/j.issn.1006–5709.2017.02.032.Lin WJ, Bi YT, Chen DF. Advances in diagnosis and treatment of pancreatic neuroendocrine neoplasms[J]. Chinese Journal of Gastroenterology and Hepatology, 2017, 26(2):234–238.doi:10.3969/j.issn.1006–5709.2017.02.032.
[3]刘毫, 吴诚义, 吕忠柱. 胰腺神经内分泌肿瘤的综合治疗[J]. 中国普外基础与临床杂志, 2016, 23(3):369–373.Liu H, Wu CY, Lu ZZ. Comprehensive Treatment of Pancreatic Neuroendocrine Neoplasms[J]. Chinese Journal of Bases and Clinics in General Surgery, 2016, 23(3):369–373.
[4]黄湘辉, 张建伟, 陈应泰, 等. 71例胰腺神经内分泌肿瘤诊治分析[J]. 中国肿瘤临床与康复, 2016, 23(4):394–397.Huang XH, Zhang JW, Chen YT. Pancreatic neuroendocrine neoplasm: retrospective analysis of 71 cases[J]. Chinese Journal of Clinical Oncology and Rehabilitation, 2016, 23(4):394–397.
[5]柯牧京, 李宜雄. 胰腺神经内分泌肿瘤诊断和治疗进展[J]. 中国普通外科杂志, 2014, 23(9):1258–1263. doi:10.7659/j.issn.1005–6947.2014.09.019.Ke MJ, Li YX. Diagnosis and treatment of pancreatic neuroendocrine tumors:recent advances[J]. Chinese Journal of General Surgery, 2014, 23(9):1258–1263. doi:10.7659/j.issn.1005–6947.2014.09.019.
[6]Fujimori N, Osoegawa T, Lee L, et al. Efficacy of endoscopic ultrasonography and endoscopic ultrasonography-guided fineneedle aspiration for the diagnosis and grading of pancreatic neuroendocrine tumors[J]. Scand J Gastroenterol, 2016, 51(2):245–252. doi: 10.3109/00365521.2015.1083050.
[7]Berardi R, Torniai M, Savini A, et al. Gastro-entero-pancreatic neuroendocrine tumors: Is now time for a new approach?[J]. World J Clin Oncol, 2016, 7(2):131–134. doi: 10.5306/wjco.v7.i2.131.
[8]Sadowski SM, Neychev V, Millo C, et al. Prospective Study of 68Ga-DOTATATE Positron Emission Tomography/Computed Tomography for Detecting Gastro-Entero-Pancreatic Neuroendocrine Tumors and Unknown Primary Sites[J]. J Clin Oncol, 2016, 34(6):588–596. doi: 10.1200/JCO.2015.64.0987.
[9]Keutgen XM, Nilubol N, Glanville J, et al. Resection of primary tumor site is associated with prolonged survival in metastatic nonfunctioning pancreatic neuroendocrine tumors[J]. Surgery, 2016,159(1):311–318. doi: 10.1016/j.surg.2015.05.042.
[10]石毅, 孙跃明, 苗毅, 等. 无功能胰腺神经内分泌癌的诊断与外科治疗[J]. 中国普通外科杂志, 2007, 16(10):939–942.Shi Y, Sun YM, Miao Y, et al. Diagnosis and surgical treatment of nonfunctioning pancreatic neuroendocrine carcinoma[J]. Chinese Journal of General Surgery, 2007, 16(10):939–942.
[11]施育鹏, 沙素梅, 王新, 等. 胰腺神经内分泌肿瘤预后相关因素的临床研究[J]. 实用肿瘤杂志, 2016, 31(6):508–511.Shi YP, Sha SM, Wang X, et al. Clinical evaluation of prognostic factors in pancreatic neuroendocrine tumor[J]. Journal of Practical Oncology, 2016, 31(6):508–511.
[12]郑楷炼, 彭智勇, 胡先贵, 等. 胰腺神经内分泌癌60例临床病理特征及外科治疗策略[J]. 中华肝胆外科杂志, 2014, 20(1):32–34.doi:10.3760/cma.j.issn.1007–8118.2014.01.009.Zheng KL, Peng ZY, Hu XG, et al. Clinicopathological features and surgical treatment strategies of pancreatic neuroendocrine carcinoma[J]. Chinese Journal of Hepatobiliary Surgery, 2014,20(1):32–34. doi:10.3760/cma.j.issn.1007–8118.2014.01.009.
[13]Öberg K, Knigge U, Kwekkeboom D, et al. Neuroendocrine gastroentero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(Suppl 7):vii124–130.
[14]Anthony L,Freda PU. From somatostatin to octreotide LAR:evolution of a somatostatin analogue[J]. Curr Med Res Opin, 2009,25(12):2989–2999. doi: 10.1185/03007990903328959.
[15]Pavel ME, Wiedenman B. Novel therapeutic agents for the treatment of gastroenteropancreatic neuroendocrine tumors[J]. Horm Metab Res, 2011, 43(12):844–853. doi: 10.1055/s-0031–1291368.
[16]Caplin ME, Pavel M, Ćwikła JB, et al. Anti-tumour effects of lanreotide for pancreatic and intestinal neuroendocrine tumours: the CLARINET open-label extension study[J]. Endocr Relat Cancer,2016, 23(3):191–199. doi: 10.1530/ERC-15–0490.
[17]楼文晖. 《中国胃肠胰神经内分泌肿瘤专家共识》胰腺神经内分泌肿瘤外科治疗部分解读[J]. 中国实用外科杂, 2014,34(6):482–483.Lou WH. Part of the interpretation of the diagnosis and treatment of pancreatic neuroendocrine neoplasms CSCO expert consensus surgery[J]. Chinese Journal of Practical Surgery, 2014, 34(6):482–483.
[18]Burns WR, Edil BH. Neuroendocrine pancreatic tumors: guidelines for management and update[J]. Curr Treat Options Oncol, 2012,13(1):24–34. doi: 10.1007/s11864–011–0172–2.
[19]梁后杰, 杨晨. 胃肠胰腺神经内分泌肿瘤治疗共识( NCCN、ENETs、NANETs)解读[J]. 临床肿瘤学杂志, 2011, 16(11):1039–1043. doi:10.3969/j.issn.1009–0460.2011.11.019.Liang HJ, Yang C. Interpretation consensus on treatment of gastroenteropancreatic neuroendocrine neoplasm[J]. Chinese Clinical Oncology, 2011, 16(11):1039–1043. doi:10.3969/j.issn.1009–0460.2011.11.019.
[20]王国慧, Eddie WF, Shakher LR, 等. 177Lu-octreotate治疗神经内分泌胃肠胰腺肿瘤的SPECT显像研究[J]. 中华核医学杂志, 2007,27(5):313–314. doi:10.3760/cma.j.issn.2095–2848.2007.05.022.Wang GH, Eddie WF, Shakher LR, et al. SPECT imaging study of 177Lu-octreotate treatment for neuroendocrine gastrointestinal and pancreatic tumors[J]. Chinese Journal of Nuclear Medicine and Molecular Imaging, 2007, 27(5):313–314. doi:10.3760/cma.j.issn.2095–2848.2007.05.022.
[21]Fazio N, Buzzoni R, Baudin E, et al. A Phase II Study of BEZ235 in Patients with Everolimus-resistant, Advanced Pancreatic Neuroendocrine Tumours[J]. Anticancer Res, 2016, 36(2):713–719.
[22]Phan AT, Dave B. The pivotal role of mammalian target of rapamycin inhibition in the treatment of patients with neuroendocrine tumors[J]. Cancer Med, 2016, 5(10):2953–2964.doi: 10.1002/cam4.742.
[23]Yao JC, Shah MH, Ito T, et al. Everolimus for advanced pancreatic neuroendocrine tumors[J]. N Engl J Med, 2011, 364(6):514–523.doi: 10.1056/NEJMoa1009290.
[24]Raymond E, Dahan L, Raoul JL, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors[J]. N Engl J Med,2011, 364(6):501–513. doi: 10.1056/NEJMoa1003825.
[25]Yao JC, Pavel M, Lombard-Bohas C, et al. Everolimus for the Treatment of Advanced Pancreatic Neuroendocrine Tumors: Overall Survival and Circulating Biomarkers From the Randomized, Phase III RADIANT-3 Study[J]. J Clin Oncol, 2016, 34(32):3906–3913.
[26]Roviello G, Zanotti L, Venturini S, et al. Role of targeted agents in neuroendocrine tumors: Results from a metaanalysis[J]. Cancer Biol Ther, 2016, 17(9):883–888. doi:10.1080/15384047.2016.1210735.
[27]Bajetta E, Catena L, Fazio N, et al. Everolimus in combination with octreotide long-acting repeatable in a first-line setting for patients with neuroendocrine tumors: an ITMO group study[J]. Cancer,2014, 120(16):2457–2463. doi: 10.1002/cncr.28726.
[28]Rosenberg AM, Friedmann P, Del Rivero J, et al. Resection versus expectant management of small incidentally discovered nonfunctional pancreatic neuroendocrine tumors[J]. Surgery, 2016,159(1):302–309. doi: 10.1016/j.surg.2015.10.013.
[29]Falconi M, Eriksson B, Kaltsas G, et al. ENETS Consensus Guidelines Update for the Management of Patients with Functional Pancreatic Neuroendocrine Tumors and Non-Functional Pancreatic Neuroendocrine Tumors[J]. Neuroendocrinology, 2016,103(2):153–171. doi: 10.1159/000443171.
[30]Haynes AB, Deshpande V, Ingkakul T, et al. Implications of incidentally discovered, nonfunctioning pancreatic endocrine tumors: short-term and long-term patient outcomes[J]. Arch Surg,2011, 146(5):534–538. doi: 10.1001/archsurg.2011.102.
[31]Sharpe SM, In H, Winchester DJ, et al.Surgical resection provides an overall survival benefit for patients with small pancreatic neuroendocrine tumors[J]. J Gastrointest Surg, 2015, 19(1):117–123. doi: 10.1007/s11605–014–2615–0.

