皮肤切创愈合过程中FoxO1表达与损伤时间关系
陈 扬 ,季心怡 ,范琰琰 ,喻林升
(1.温州医科大学法医学系,浙江 温州 325035;2.温州医科大学司法鉴定中心,浙江 温州 325035;3.温州医科大学司法鉴定科学技术研究所,浙江 温州 325035)
损伤时间准确推断能为判断案情提供线索和依据,一直是法医学界研究的重要课题。传统的损伤时间推断方法主要是肉眼观察和组织学检查。近年来,为了更精确地推断损伤时间,寻找与损伤经历时间具有良好相关性的指标成为法医学研究的热点,方法主要有运用免疫组织化学或Western印迹法检测创口中蛋白质的表达水平、采用逆转录聚合酶链反应或原位杂交技术对创口中基因水平进行研究等。
皮肤创口愈合是一个多细胞、多分子参与的复杂过程,可分为炎症、增殖和再塑三个阶段。在炎症阶段,中性粒细胞和单核细胞浸润至创口,产生活性氧及氧化应激[1-2],并释放促炎细胞因子。此后,成纤维细胞开始大量增殖并分化为肌成纤维细胞,产生胶原纤维沉积于创口内,与新生的毛细血管构成肉芽组织,最终经过改建和再塑转变为瘢痕组织。同时,表皮细胞增生覆盖创口,使创口愈合。在皮肤创口愈合期间,大量细胞因子和转录因子参与其中。
叉头框(forkhead box,Fox)蛋白家族[3-4]是一类DNA结合区具有翼状螺旋结构的转录因子,来源于果蝇的“叉头”突变,于1990年首次发现,至今已发现了90多种Fox基因,2000年被统一命名为转录因子家族,广泛存在于从酵母到哺乳类的真核生物中。Fox含17个亚家族,其中FoxO家族研究最为深入,FoxO1是FoxO亚家族中的主要成员之一。研究[5-9]证实,FoxO1在炎症、氧化应激、血管发生及成纤维细胞分化等过程中发挥重要作用,可能与皮肤创口愈合的进程密切相关。本研究应用免疫组织化学染色技术和Western印迹法,检测皮肤切创后不同时间段FoxO1的表达及其时间规律性,旨在探讨FoxO1在皮肤损伤时间推断中的应用价值。
1 材料与方法
1.1 动物模型制作及分组
成年C57BL/KsJ雄性小鼠45只(温州医科大学实验动物中心提供),体质量25~30 g,随机分为对照组和创伤形成后 6 h、12 h、1 d、3 d、5 d、7 d、10 d、14 d组,每组5只。创伤组小鼠在腹腔注射戊巴比妥钠麻醉后,背部皮肤剪毛处理,于背部中央做一长1cm的皮肤全层纵向切口后进行分笼饲养。分别于创口形成后 6h、12 h、1 d、3 d、5 d、7d、10d、14 d,将创伤组小鼠吸入乙醚麻醉后,脱颈椎处死,并以创口为中心,取创口及周边处1.5cm×2.0cm大小的皮肤。对照组小鼠脱颈椎处死后,在与创伤组小鼠取材的相同部位取同等大小的皮肤样本。
1.2 HE染色
每组样本皮肤的1/2放入4%多聚甲醛溶液中固定12h,梯度乙醇脱水,透明,石蜡包埋,制成5μm厚的连续石蜡切片,将切片常规脱蜡及水化后采用苏木素伊红染液染色制成病理切片。光学显微镜下观察。
1.3 免疫组织化学染色
石蜡切片常规脱蜡及水化:(1)石蜡切片放置在60℃恒温箱中烘烤 120min。(2)依次按二甲苯(20min)、二甲苯(20min)、无水乙醇(10min)、95%乙醇(10min)、90%乙醇(10 min)、80%乙醇(10 min)脱蜡和水化,微波热修复法修复抗原。兔抗小鼠FoxO1单抗1∶100(2880,美国Cell Signaling Technology公司)作为一抗,按照ZLI-9018免疫组织化学染色试剂盒(北京中杉金桥生物技术有限)说明书进行操作。在正置显微镜(日本Nikon公司)下观察,每张切片在创口周边区随机选择10个视野,采用ImageJ2x软件(美国National Institute of Health)计数细胞总数及FoxO1阳性细胞数,并计算阳性细胞率。
1.4 Western印迹法检测
冰浴上将各时间段剩余的1/2皮肤样本剪碎,加蛋白裂解液(78833,美国Thermo Fisher Scientific公司)300 μL及苯甲基磺酰氟(上海碧云天生物技术有限公司)匀浆,超声破碎,4℃下,以离心半径10cm,12000r/min,离心 30min,吸取上清液,用 Lowry法测量蛋白浓度,将样品置于-80℃保存,备用。变性5 min,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后,将蛋白转印到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF;德国Merck公司)上,转膜条件为5V 40min。含有聚山梨酯的三羟甲基氨基甲烷缓冲盐-吐温20(tris buffered saline with tween-20,TBST)洗涤 3次,用 5%脱脂牛奶封闭 2 h,用兔抗小鼠 FoxO1单抗(1∶1 000)孵育,4℃过夜。TBST洗涤3次,羊抗兔IgG二抗(1∶2000)(中国北京中杉金桥生物技术有限公司)室温孵育2 h,TBST洗涤3次后,增强型化学发光(enhanced chemiluminescent,ECL)法显色。 用 ImageJ2x 软件分析各时间段条带的光密度值,以甘油醛-3-磷酸脱氢 酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,计算各组FoxO1蛋白表达的相对水平。
1.5 统计分析
2 结 果
2.1 HE染色
中性粒细胞于伤后6h出现在创口周围,伤后12h显著增多;伤后1 d,单核细胞聚集于创口的边缘,其数量于伤后3d增多,同时成纤维细胞也开始出现在创口底部,伤后5 d增多,伤后7 d其数量达到高峰;伤后5~10d,肉芽组织形成,其内可见大量的新生血管和成纤维细胞;伤后10d,表皮完全覆盖创口;伤后14 d,损伤区新生血管和成纤维细胞数量显著减少,间质增多,肉芽组织向瘢痕组织转变(图1)。

图1 切创后皮肤组织HE染色结果(×400)
2.2 免疫组织化学染色
对照组皮肤,FoxO1弱表达于表皮、毛囊、皮脂腺、血管内皮及真皮中少数的成纤维细胞。创伤组皮肤,伤后6 h可见浸润的中性粒细胞表达FoxO1,伤后12 h表达FoxO1的中性粒细胞显著增多,此后表达FoxO1的中性粒细胞显著减少。伤后6~12h亦可见少量浸润的单核细胞表达FoxO1,伤后1~3 d表达FoxO1的单核细胞显著增多,从伤后5d起表达FoxO1的单核细胞逐渐减少,伤后14 d的创口中仅可见少量FoxO1阳性的单核细胞。伤后3d可见创口边缘及底部有少量的成纤维细胞表达FoxO1,伤后5 d表达FoxO1的成纤维细胞显著增多,于伤后7d达到峰值,伤后10~14d表达FoxO1的成纤维细胞显著减少。伤后5~10d亦可见新生血管内皮表达FoxO1,于伤后7d达到峰值(图2)。
2.3 免疫组织化学染色阳性细胞率分析
FoxO1免疫组织化学染色在对照组和创伤组中的阳性细胞率见表1。FoxO1的阳性细胞率(包括中性粒细胞、单核细胞及成纤维细胞)于伤后7 d达到峰值。
2.4 Western印迹法检测分析
以GAPDH(相对分子质量约为34 000)为内参,对照组及各创伤组均有FoxO1阳性条带,位于80000处。创伤后各时间段FoxO1表达强度有一定规律,伤后6 h表达开始增强,伤后12 h出现第一个表达高峰,伤后1~5d稍有下降,伤后7d FoxO1表达再次达到峰值,随后表达逐渐降低,至伤后14d略高于对照组。各组FoxO1蛋白表达的相对水平见表2和图3。
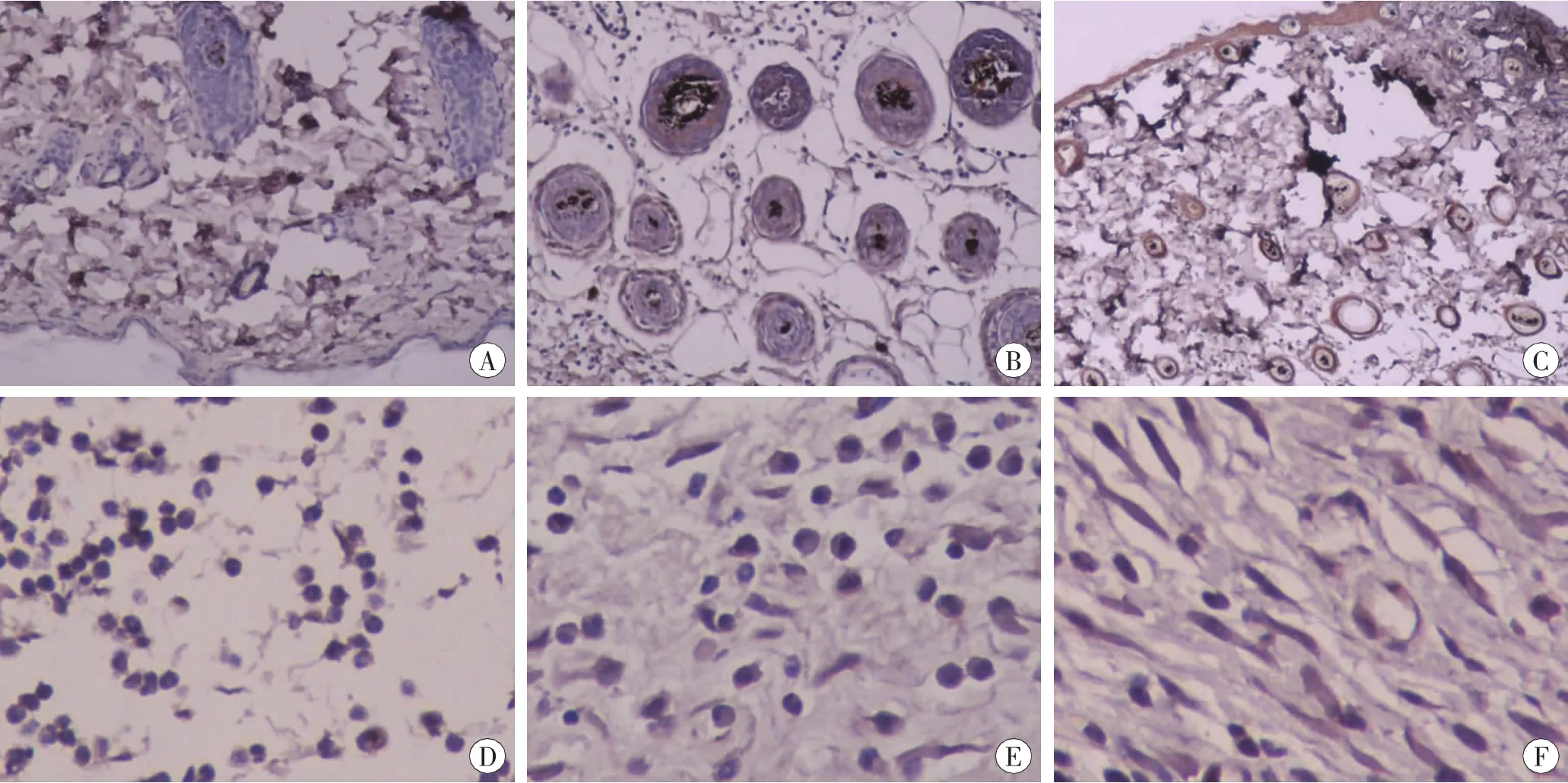
图2 切创后皮肤组织免疫组织化学染色结果
表1 小鼠皮肤切创后对照组和创伤组的细胞总数及FoxO1阳性细胞率 (n=5,±s)

表1 小鼠皮肤切创后对照组和创伤组的细胞总数及FoxO1阳性细胞率 (n=5,±s)
注:1)与相邻上组比较,P<0.05
组别 细胞总数 FoxO1阳性细胞率/% 出现的主要炎症细胞对照 39.20±3.50 6.14±1.50 中性粒细胞6h 120.40±4.501) 21.55±1.211) 中性粒细胞12h 172.00±9.601) 30.34±2.561) 单核细胞1d 141.00±7.301) 34.66±3.381) 单核细胞3d 115.40±2.101) 37.87±3.131) 单核细胞、成纤维细胞5d 123.60±4.301) 41.20±5.171) 单核细胞、成纤维细胞7d 189.60±3.901) 52.56±6.361) 成纤维细胞10d 211.00±4.601) 21.36±3.201) 成纤维细胞14d 182.80±6.701) 7.40±3.341) 成纤维细胞
表2 FoxO1蛋白在对照组和创伤组中的相对表达量(n=5,±s)

表2 FoxO1蛋白在对照组和创伤组中的相对表达量(n=5,±s)
注:1)与相邻上组比较,P<0.05
组别 相对表达量对照 0.44±0.03 6h 2.26±0.091)12h 2.46±0.101)1d 1.05±0.041)3d 1.28±0.101)5d 1.59±0.091)7d 5.27±0.121)10d 1.53±0.061)14d 0.53±0.041)

图3 对照组和创伤组皮肤组织FoxO1蛋白的表达
3 讨 论
皮肤创口形成时间推断在法医学研究中一直是重点与难点。皮肤损伤愈合是一个复杂的组织修复过程,包括氧化应激、炎症、血管发生、成纤维细胞增殖与分化、肉芽组织形成和纤维组织重建等,在该过程中有大量细胞因子和转录因子参与[10-11]。
FoxO蛋白家族是一类在动物的生长发育、细胞分化、代谢等方面起着重要作用的转录调节因子[4]。其中FoxO1是FoxO家族中最早发现的成员,FoxO1蛋白包含4个结构域,依次为N端的forkhead区域(此区域同时也是DNA结合域)、核定位信号肽、核输出序列和C端富含脯氨酸和丝(苏)氨酸的转录激活域[12]。研究[5-9]证实,FoxO1在氧化应激、炎症、血管发生及成纤维细胞分化等过程中发挥重要作用。
HE染色显示皮肤创口正常愈合。免疫组织化学染色结果显示,和对照组小鼠相比,伤后6~12h创口周边区表皮及皮肤附件FoxO1表达增强,此外可见浸润的中性粒细胞表达FoxO1,提示FoxO1可能参与皮肤损伤后氧化应激反应的调控。研究[13-14]表明,在创口愈合过程中,浸润的中性粒细胞可产生活性氧,与氧化应激反应密切相关。抗氧化酶类的表达也在创伤后有所增加,在创口的多个部位尤其是创缘表皮及毛囊周围,超氧化物歧化酶、谷胱甘肽过氧化物酶mRNA水平明显升高[15-16]。PONUGOTI等[7]研究发现,FoxO1可以调节谷胱甘肽过氧化物酶-2的表达,保护角质细胞免受氧化应激损伤,这说明FoxO1的表达增强可起到抗氧化应激的作用。因此,伤后6~12h创口周边区表皮及皮肤附件FoxO1表达增强可能与抗氧化应激反应密切相关。此外,在伤后1~3d的创口FoxO1以单核细胞阳性表达为主,提示FoxO1可能参与炎症反应的调控。研究[5]显示,FoxO1在巨噬细胞中的过表达可抑制其促炎介质的释放,表明FoxO1的表达可对炎症反应起到负向调节作用。本研究发现,伤后5~10d FoxO1在新生血管内皮及成纤维细胞呈现广泛的表达,提示FoxO1可能参与皮肤创口愈合中的血管发生及成纤维细胞分化事件。ROUDIER等[8]研究表明,FoxO1可以调节内皮细胞凝血酶敏感蛋白-1的表达抑制血管发生。VIVAR等[9]研究发现,转化生长因子-β1可以刺激成纤维细胞表达FoxO1,诱导成纤维细胞分化为肌成纤维细胞。最新研究[17]显示,FoxO1介导了角质细胞对皮肤创口愈合的调节作用,敲除FoxO1后创口愈合能力受损,抑制了创口愈合期间的成纤维细胞增殖、肌成纤维细胞形成及胶原产生,这表明FoxO1可以通过调节成纤维细胞的增殖与分化促进皮肤创口的愈合。
为了明确FoxO1蛋白表达的时序性变化,本实验通过Western印迹法检测了在皮肤切创后各时间段的FoxO1蛋白相对水平。结果显示,对照组及各创伤组均有FoxO1阳性条带,损伤后FoxO1表达有其时间规律性,伤后6h表达开始增强,伤后12 h出现第一个表达高峰,伤后1~5d稍有下降,伤后7d FoxO1表达再次达到峰值,随后表达逐渐降低,至伤后14d略高于对照组。免疫组织化学结果表明,在对照组皮肤,FoxO1弱表达于表皮、毛囊、皮脂腺、血管内皮及真皮中少数的成纤维细胞。伤后12h创口有较多中性粒细胞表达FoxO1,此外创口周边区表皮及皮肤附件FoxO1表达显著增强。因此,中性粒细胞、表皮及皮肤附件表达FoxO1形成了伤后12h的表达峰值。伤后1~5 d,虽然创口中有较多单核细胞表达FoxO1,但FoxO1在表皮及皮肤附件中的表达强度减弱,因此FoxO1表达的整体水平有所下降。伤后7d是成纤维细胞增殖、分化及血管发生的高峰阶段,创口中有大量的成纤维细胞及新生血管内皮表达FoxO1,此外亦可见较多单核细胞表达FoxO1,因此伤后7 d FoxO1表达再次达到峰值。伤后14d表达FoxO1的成纤维细胞和新生血管内皮细胞显著减少,故FoxO1表达回落到略高于正常对照组的水平。
在以往推断皮肤创口形成时间的研究[18]中,创口愈合相关性蛋白的表达峰值多在损伤1d后,且多呈单峰式变化趋势。本研究Western印迹法结果显示,FoxO1蛋白在创口愈合期间出现两个表达峰值,于伤后6h表达开始增强,伤后12h出现第一个表达高峰,伤后7d再次达到峰值,提示FoxO1表达可同时为早晚期损伤时间的推断提供参考。尤其在伤后6h,创口中浸润的炎症细胞较少,用传统的组织学检查难以准确地推断损伤时间,FoxO1的表达情况可用于参考。Western印迹法检测仅较精确地反映出表达的整体水平,但FoxO1在两个表达峰值前后的一些时间点的整体水平差异较小,故FoxO1用于创口形成时间推断时需同时结合Western印迹法、免疫组织化学检测及组织学特征进行综合评判,以缩小推断的误差。此外,对创口中FoxO1的表达是否受到死后变化的影响,将是我们进一步研究的目标。
本研究证实,FoxO1在皮肤创口中不同类型细胞呈现广泛的表达,提示其密切参与了皮肤损伤愈合的进程。皮肤损伤后FoxO1蛋白水平的时序性变化可望作为一种检测指标用于皮肤损伤时间的推断。
[1]杨国志,王润秀,林源.氧化应激与创面愈合[J].中国组织工程研究与临床康复,2007,11(2):355-358.
[2]SCHÄFER M,WERNER S.Oxidative stress in normal and impaired wound repair[J].Pharmacol Res,2008,58(2):165-171.
[3]曹冬梅,卢建.叉头框(Fox)转录因子家族的结构与功能[J].生命科学,2006,18(5):491-496.
[4]陈小玲,黄志清,毛湘冰,等.FoxO1的功能研究进展[J].中国畜牧兽医,2011,38(9):90-93.
[5]张娜,张紫燕,赵凌霞,等.FoxO1转录因子在巨噬细胞中的表达与炎症的关系[J].系统医学,2016,1(9):1-5,46.
[6]SUBAUSTE A R,BURANT C F.Role of FoxO1 in FFA-induced oxidative stress in adipocytes[J].Am J Physiol Endocrinol Metab,2007,293(1):E159-E164.
[7]PONUGOTI B, XU F, ZHANG C, et al.FOXO1 promotes wound healing through the up-regulation of TGF-β1 and prevention of oxidative stress[J].J Cell Biol,2013,203(2):327-343.
[8]ROUDIER E,MILKIEWICZ M,BIROT O,et al.Endothelial FoxO1 is an intrinsic regulator of thrombospondin 1 expression that restrains angiogenesis in ischemic muscle[J].Angiogenesis,2013,16(4):759-772.
[9]VIVAR R,HUMERES C,MUNOZ C, et al.FoxO1 mediates TGF-beta1-dependent cardiac myofibroblast differentiation[J].Biochim Biophys Acta,2016,1863(1):128-138.
[10]VELNAR T, BAILEY T, SMRKOLJ V.The wound healing process: an overview of the cellular and molecular mechanisms[J].J Int Med Res,2009,37(5):1528-1542.
[11]SEHER A,NICKEL J,MUELLER T D, et al.Gene expression profiling of connective tissue growth factor (CTGF) stimulated primary human tenon fibroblasts reveals an inflammatory and wound healing response in vitro[J].Mol Vis,2011,17:53-62.
[12]OBSIL T,OBSILOVA V.Structure/function relationshipsunderlying regulation ofFOXO transcription factors[J].Oncogene,2008,27(16):2263-2275.
[13]WLASCHEK M,SCHARFFETTER-KOCHANEK K.Oxidative stress in chronic venous leg ulcers[J].Wound Repair Regen,2005,13(5):452-461.
[14]JAMES T J,HUGHES M A,CHERRY G W,et al.Evidence of oxidative stress in chronic venous ulcers[J].Wound Repair Regen,2003,11(3):172-176.
[15]RAJASEKARAN N S, NITHYA M, ROSE C, et al.The effect of finger millet feeding on the early responses during the process of wound healing in diabetic rats[J].Biochim Biophys Acta,2004,1689(3):190-201.
[16]STEILING H, MUNZ B, WERNER S, et al.Different types of ROS-scavenging enzymes are expressed during cutaneous wound repair[J].Exp Cell Res,1999,247(2):484-494.
[17]ZHANG C, LIM J, LIU J, et al.FOXO1 expression in keratinocytes promotes connective tissue healing[J].Sci Rep,2017,7:42834.
[18]CECCHI R.Estimating wound age:looking into the future[J].Int J Legal Med,2010,124(6):523-536.

