Glu在适量饮用贵州某食用白酒1型糖尿病小鼠表达的变化
李容瑢,梁文妹,夏白娟,李一欣,王燕林,尹 丹
(贵州医科大学组织学与胚胎学教研室,贵州贵阳 550025)
1型糖尿病(type 1 diabetes mellitus,T1DM)发病率近年来呈升高趋势,主要患病群体为儿童及青少年。胰岛α及β细胞的稳态被打破是T1DM发病的直接因素。胰岛α细胞主要分泌胰高血糖素(Glucagon,Glu),Glu促进肝糖原分解及糖异生等作用而升高血糖[1],同时可调控β细胞分泌胰岛素(Insulin,Ins)的功能[2]。研究发现,敲除实验动物Glu受体基因后破坏其胰岛β细胞,并不会引发高血糖,且可以修复β细胞部分功能[3-4],故Glu在T1DM发病过程中也具有重要作用。
中国白酒成分除酒精与水外还含有丰富的生物活性物质,适量饮酒与健康的关系也受到越来越多的关注。有关饮酒对胰岛Glu的分泌影响的报道并不多见,有研究认为,适量饮酒能够降低正常人血浆Glu水平[5],Aagaard[6]则发现健康不定期饮酒者,饮酒后Glu分泌有所增加。本实验通过建立小鼠单纯饮酒、T1DM饮酒模型,观察小鼠胰岛Glu表达变化并检测胰腺Glu mRNA表达水平,探讨适量饮酒在T1DM小鼠发病过程中对α细胞可能的作用。
1 材料与方法
1.1 实验动物与试剂
6~8周正常雄性C57BL/6J小鼠210只,由贵州医科大学动物实验中心提供;链脲佐菌素(streptozotocin ,STZ),Sigma公司;54%vol董酒;小鼠抗Glu多克隆抗体,新西兰Watpa公司;免疫组织化学SABC试剂盒,武汉博士德公司;DAB显色剂,北京中杉金桥生物技术有限公司;GCG、β-actin引物由上海生工生物有限公司合成;RNA逆转录试剂盒,Thermo公司。
1.2 动物分组
C57BL/6J小鼠适应性喂养1周后,随机分为单纯饮酒低剂量组(liquor consumption-low dose group,L-LDG,2.5 mL/kg·d,n≥6)、单纯饮酒高剂量组(liquor consumption-high dose group,L-HDG,5.0 mL/kg·d,n≥6);糖尿病组(diabetes group,DG,n≥6);糖尿病-饮酒低剂量组(diabetes-low dose group,D-LDG,2.5 mL/kg·d,n≥6),糖尿病-饮酒高剂量组(diabetes-high dose group,D-HDG,5.0 mL/kg·d,n≥6)、空白对照组(blank control group,BCG,n=3)。
1.3 模型制作及标本处理
单纯饮酒组及糖尿病饮酒组均通过灌胃饮酒,每天1次,4:00 PM,连续灌胃至取材。灌胃第5周起糖尿病饮酒组及糖尿病组通过腹腔注射STZ 40 mg/kg,每天1次,连续5次,建立T1DM小鼠模型[7]。空白对照组不做特殊处理。
各组小鼠均分别于开始注射STZ后3 d、7 d、10 d、14 d、21 d、28 d取尾尖血测空腹血糖。每组分别取胰尾组织:(1)4%多聚甲醛固定,常规石蜡包埋,制成4 μm连续切片,每例3张切片,切片间隔56 μm;(2)液氮速冻,用于real-time PCR。
1.4 免疫组织化学SABC法
切片常规化蜡入水,10%甲醇-H2O2,羊血清(1:10),滴加一抗Glu(1∶2000),4 ℃孵育过夜,羊抗小鼠 IgG(1∶100),SABC 复合物(1∶100),DABH2O2显色,苏木精复染细胞核,中性树脂封片。0.01%PBS液代替一抗作阴性对照。
1.5 Real-time PCR检测胰组织Glu mRNA表达
引物序列:GCG上游引物5'TTTACTTTGTGGCTGGATTGC 3',下游引物 5'CCTGTGAGTGGCGTTTGTCT 3',扩增产物长度156 bp;β-actin 上游引物 5'TGCTATGTTGCTCTAGACTTCG3',下游引物5'ATGCCACAGGATTCCATACC 3',扩增产物长度174 bp。将各组胰组织匀浆按TRIzol法提取总RNA,琼脂糖凝胶电泳检测RNA完整性,并将RNA按逆转录试剂盒说明书逆转录合成cDNA。Real-time PCR反应体系20 μL:cDNA模板2 μL,上下游引物各 0.4 μL,SYBR 溶液10 μL,超纯水7.2 μL;反应条件:95 ℃ 3 min;95 ℃7 s,55 ℃ 10 s,72℃15 s重复45个循环。以上反应在LightCycler480 Software Setup中进行。以β-actin作为内参,每个标本3个复孔进行结果分析。结果采用相对定量法,目的基因相对表达差异倍数采用2-△△CT法计算。
1.6 图像分析及形态学计量
随机取各时间点各组小鼠免疫组织化学切片3张,40倍物镜下,每张切片用BioMias图像分析系统计数5个胰岛。用Image pro plus 6.0图像分析系统检测α细胞的Glu平均光密度;测胰岛面积、有核α细胞数,按下列公式计算得α细胞面数密度(个/4000 μm2):

其中:NA为面数密度,Nx为计数有核阳性细胞总数,Ar为计数胰岛总面积。
1.7 统计学处理
应用SPSS l6.0软件包对所得数据用单因素方差分析进行统计分析,结果用x±s表示。
2 结果与分析
2.1 空腹血糖值
各时间点小鼠空腹血糖值如图1所示,BCG、L-LDG及L-HDG无明显变化(P>0.05);DG及DHDG空腹血糖值14 d开始升高,D-LDG 21 d开始升高且至28 d升至最高(P<0.01),DG、D-LDG和D-HDG血糖均高于小鼠糖尿病成模标准11.1 mmol/L,与BCG、L-LDG、L-HDG相比差异具有统计学意义(P<0.05);在21 d及28 d,DG、D-LDG及D-HDG相比,差异无统计学意义(P>0.05)。
2.2 胰岛α细胞形态和数量
BCG、L-LDG、L-HDG小鼠胰岛呈圆形或卵圆形,散在分布于胰腺外分泌部之间。DG、DLDG、D-HDG小鼠在注射STZ 7 d,即开始出现胰岛数目逐渐减少,面积有所减小。
α细胞主要分布于胰岛周边,数量较多,其免疫反应产物Glu呈棕黄色细颗粒状,分布于胞质内。随注射STZ时间延长DG、D-LDG、D-HDG α细胞数量有所增多,大部分α细胞表达Glu免疫反应强度无明显变化。
免疫组织化学显示胰岛α细胞见图2。图2中,A为空白对照组;B为饮酒低剂量组;C为饮酒高剂量组;D、E、F分别为糖尿病组7 d、14 d及28 d;G、H、I分别为糖尿病-饮酒低剂量组7 d、14 d及28 d;J、K、L分别为糖尿病-饮酒高剂量组7 d、14 d及28 d。
2.3 胰岛α细胞图像分析及形态学计量
各时间点小鼠胰岛α细胞Glu平均光密度值测定结果如图3所示,单纯饮酒及糖尿病各组差异无统计学意义(P>0.05)。
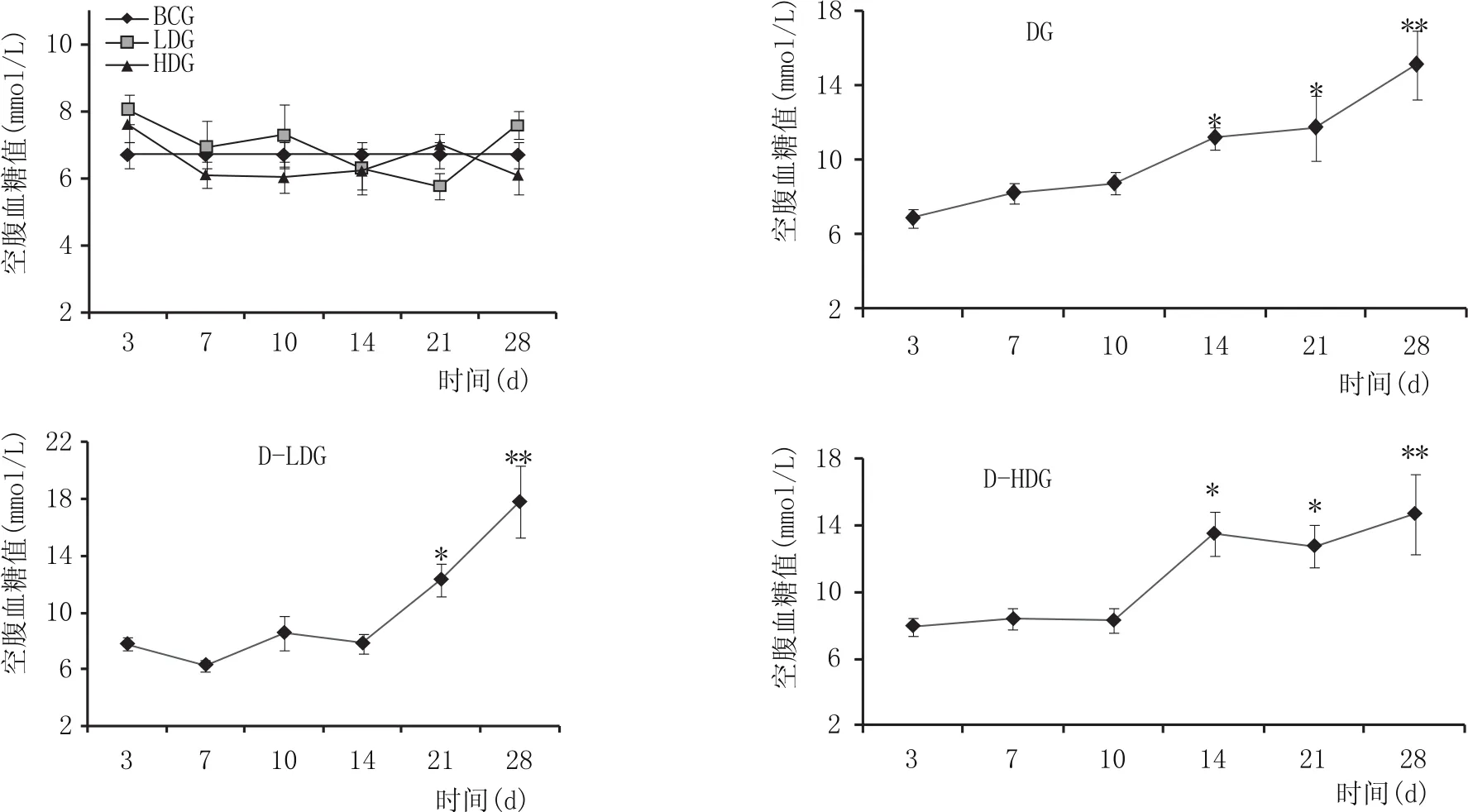
图1 空腹血糖值检测结果(mmol/L)(x±s)
胰岛α细胞的面数密度值如图4所示,单纯饮酒各组小鼠NA与BCG差异无统计学意义;DG NA于7 d开始增加,D-LDL及D-HDL NA于10 d开始增加(P<0.05)。

图2 免疫组织化学显示胰岛α细胞
2.4 Glu mRNA的表达
Real-time PCR结果检测Glu mRNA的表达在胰组织中的鉴定:Glu及β-actin mRNA的溶解曲线显示单一溶解峰,未检测到引物二聚体及其他非特异性荧光信号。
各组Glu mRNA相对表达量见图5:BCG、LLDG Ins mRNA表达在各个时间点无明显变化(P>0.05);L-HDG Ins mRNA在21 d及28 d有所升高(P<0.05);与BCG、L-LDG、L-HDG相比,DG、D-LDG、D-HDG Ins mRNA表达自10 d起逐渐升高(P<0.05)。

图3 胰岛α细胞的平均光密度值(x±s)

图4 胰岛α细胞的面数密度值(x±s)
3 讨论
Glu是由胰岛α细胞分泌的29个氨基酸组成的多肽,对血糖有重要的调控作用。小鼠Gcg基因编码产物为Glu、GLP-1及GLP-2。T1DM发病过程中胰岛β细胞分泌的Ins绝对缺乏,同时Glu相对增多[8],胰岛内稳态失衡,主要表现在空腹血糖及餐后血糖升高;但低血糖时Glu反而分泌相对不足[8-9],使用小剂量Glu则可减缓T1DM发病过程中的低血糖症状[10]。
本课题组已在前期实验中观察了单纯饮用某白酒及T1DM小鼠饮酒后胰岛Ins的表达无明显变化[11]。本实验中单纯饮酒组小鼠空腹血糖值、胰岛Glu平均光密度值及NA,与BCG相比差异基本无显著性,显示该饮酒剂量及时间对小鼠无明显影响。L-LDG及L-HDG Glu mRNA自21 d起表达有所增加,但相对应时间点空腹血糖及Glu平均光密度、NA未见明显差异,可能与转录与翻译的时差性有关,有待进一步研究证实。
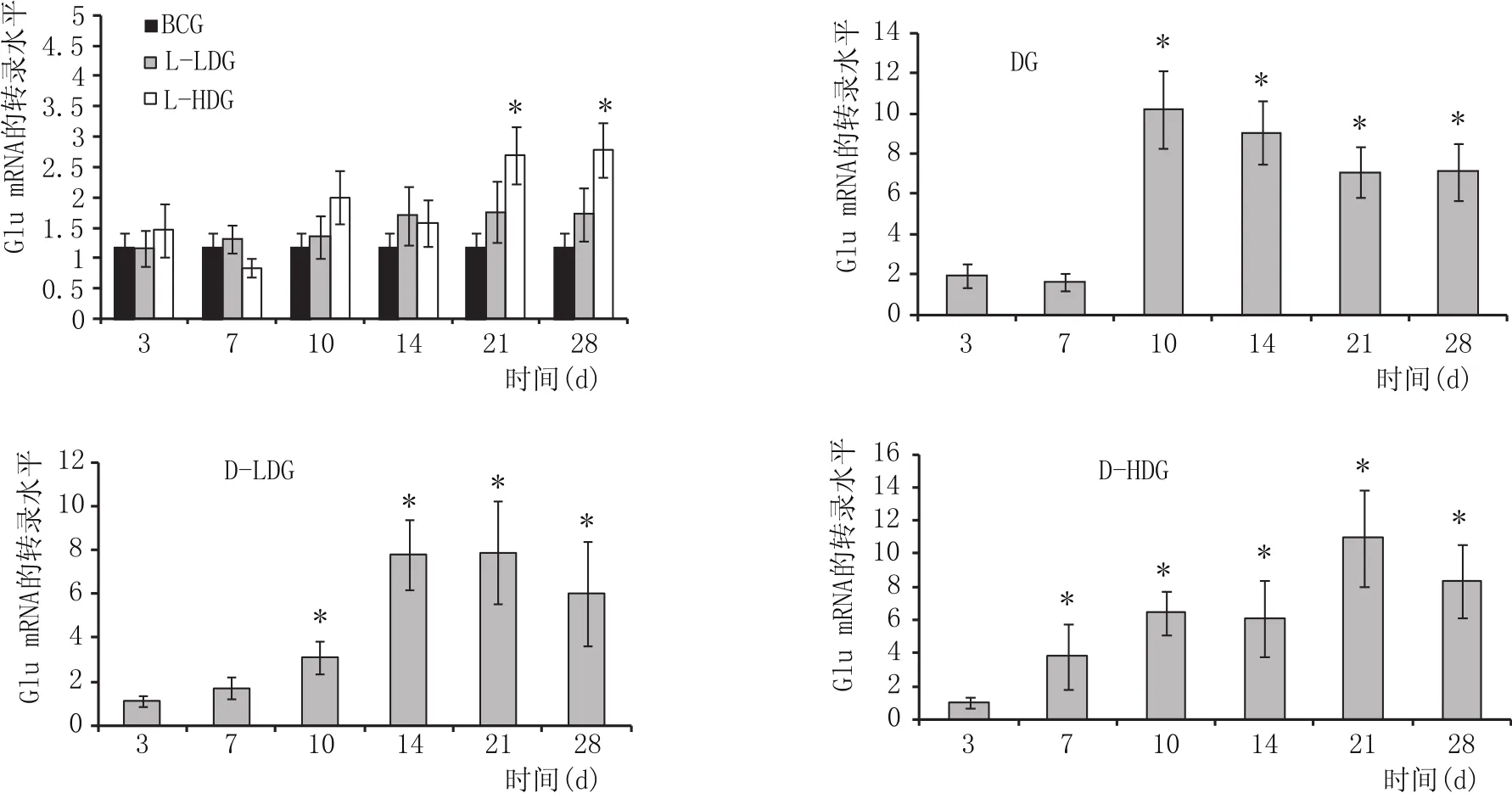
图5 胰组织中Glu mRNA的转录水平(x±s)
DG、D-HDG空腹血糖值自14 d时明显升高,胰岛Glu NA增多、Glu mRNA表达增加,考虑T1DM发病过程中随胰岛β细胞逐渐被破坏,α细胞数量增多填充胰岛,胰岛稳态被打破。而D-LDG空腹血糖值升高较DG及D-HDG时间晚,可能与以下机制有关:适量饮酒抑制肝脏糖异生而降低空腹血糖水平[12],增加脂联素及高密度脂蛋白分泌等方式提高组织对Ins的敏感性[13-14]。
饮酒量的差异对糖尿病进程有不同程度的影响[15],急性过量饮酒可导致Ins分泌减少而血糖升高[16],Shai[12]的研究则表明适量饮酒能够降低糖尿病患者的空腹血糖值。同时饮酒的种类的差别也对糖尿病有不同程度影响[16]。中国白酒酿造所采用的固态多微酿造工艺,使其与其他种类的酒相比具有更独特的风味和多样生物活性成分,如萜烯类化合物、脂肽类化合物、吡嗪类化合物、亚麻酸等[17-18],在本实验中这些生物活性成分也可能对T1DM的进程有一定影响。
综上所述,在本实验设定的剂量及时间内,单纯饮用该白酒小鼠Glu表达改变不明显;适量饮酒对糖尿病小鼠Glu表达亦未见明显影响。
参考文献:
[1]GOSMAIN Y,MASSON M H,PHILIPPE J.Glucagon:the renewal of an old hormone in the pathophysiology of diabetes[J].J diabetes,2013,5(2):102-109.
[2]COOPERBERG B A,CRYER P E.Insulin reciprocally regulates glucagon secretion in humans[J].Diabetes,2010,59(11):2936-2940.
[3]LEE Y,WANG M Y,DU X Q,et al.Glucagon receptor knockout prevents insulin-deficient type 1 diabetes in mice[J].Diabetes,2011,60(2):391-397.
[4]SØRENSEN H,WINZELL M S,BRAND C L,et al.Glucagon receptor knockout mice display increased insulin sensitivity and impaired beta-cell function[J].Diabetes,2006,55(12):3463-3469.
[5]BONNET F,DISSE E,LAVILLE M,et al.Moderate alcohol consumption is associated with improved insulin sensitivity,reduced basal insulin secretion rate and lower fasting glucagon concentration in healthy women[J].Diabetologia,2012,55(12):3228-3237.
[6]AAGAARD N K,THØGERSEN T,GRØFTE T,et al.Alcohol increases glucagon secretion in normal man[J].Alcohol clin exp res,2004,28(11):1643-1637.
[7]LI Z,KARLSSON F A,SANDLER S.Islet loss and alpha cell expansion in type 1 diabetes induced by multiple low-dose streptozotocin administration in mice[J].J endocrinol,2000,165(1):93-99.
[8]CRYER P E.Minireview:glucagon in the pathogenesis of hypoglycemia and hyperglycemia in diabetes[J].Endocrinology,2012,153(3):1039-1048.
[9]SHERR J,XING D,RUEDY K J,et al.Lack of association between residual insulin production and glucagon response to hypoglycemia in youth with short duration of type 1 diabetes[J].Diabetes care,2013,36(6):1470-1476.
[10]CHUNG S T,HAYMOND M W.Minimizing morbidity of hypoglycemia in diabetes:a review of mini-dose glucagon[J].J diabetes sci technol,2015,9:44-51.
[11]李容瑢,李一欣,夏白娟,等.适量饮用贵州某食用白酒对1型糖尿病小鼠胰岛β细胞的影响[J].解剖学杂志,2017,40(2):141-144.
[12]SHAI I,WAINSTEIN J,HARMAN-BOEHM I,et al.Glycemic effects of moderate alcohol intake among patients with type 2 diabetes:a multicenter,randomized,clinical intervention trial[J].Diabetes care,2007,30(12):3011-3016.
[13]IMHOF A,PLAMPER I,MAIER S,et al.Effect of drinking on adiponectin in healthy men and women:a randomized intervention study of water,ethanol,red wine,and beer with or without alcohol[J].Diabetes care,2009,32(6):1101-1103.
[14]WIELA V D.Alcohol and insulin sensitivity[J].Netherlands journal of medicine,1998,52(3):91-94.
[15]HO J Y,JU L S,JI J K,et al.Alcohol intake and serum glucose levels from the perspective of a mendelian randomization design:The KCPS-II biobank[J].Plos one,2016,11(9):e0162930.
[16]KIDO M,ASAKAWAA,KOYAMA K I K,et al.Acute effects of traditional Japanese alcohol beverages on blood glucose and polysomnography levels in healthy subjects[J].Peerj,2016,4:e1853.
[17]徐岩,范文来,葛向阳,等.科学认识中国白酒中的生物活性成分[J].酿酒科技,2013(9):1-6.
[18]郅岩,吴群,徐岩.传统白酒中生物活性物质脂肽类化合物及其产生机制[J].酿酒科技,2017(10):17-23.

